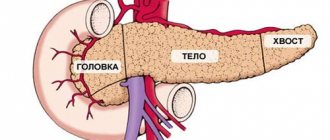
Доброкачественные новообразования поджелудочной железы — это группа опухолевых заболеваний, в основе которых лежит патологический процесс бесконтрольного деления клеток тканей поджелудочной железы и ее протоков, характеризующийся доброкачественным течением.
Основными заболеваниями данной группы являются инсуломы (опухоли, происходящие из железистой ткани, продуцирующей гормон инсулин), фибромы (из соединительной ткани), гемангиомы (доброкачественные новообразования, прорастающие из кровеносных сосудов), кистозные образования.
Доброкачественные опухоли поджелудочной железы встречаются достаточно редко. В целом в общей статистике всех видов новообразований поджелудочной железы доброкачественные опухоли составляют примерно от 0,01 до 0,1%. Мужчины и женщины болеют данным заболеванием с одинаковой частотой.
Причины
Причины развития заболеваний данной группы весьма разнообразны. Среди основных можно выделить следующие:
- Курение.
- Злоупотребление алкоголем.
- Заболевания обмена веществ (ожирение, диабет 2 типа).
- Неправильное питание (потребление фастфуда, жирной и жареной пищи, недостаток в рационе растительных волокон).
- Хронические воспалительные заболевания поджелудочной железы (панкреатиты) в анамнезе.
- Проживание в неблагоприятной экологической обстановке, в условиях повышенного содержания в атмосфере асбеста, кадмия, бензола, нефтепродуктов, сажи, фенольных смол; вредные условия труда (сильная запыленность, повышенная температура).
Симптомы и признаки
Доброкачественные опухоли поджелудочной железы не проявляют себя до тех пор, пока не достигают больших размеров. Диагноз зачастую устанавливается случайно, во время планового УЗИ органов брюшной полости.
Исключением является инсулома: даже при небольших ее размерах она вызывает нарушения в секреции инсулина, и у больных значительно снижается уровень сахара в крови, что сопровождается:
- повышенным аппетитом и стремительным набором веса;
- слабостью;
- беспричинным чувством страха;
- повышенным потоотделением;
- учащенным сердцебиением;
- эпизодами головокружения, двоения в глазах, иногда – потерей сознания.
В процессе роста опухоли и в результате воздействия на прилежащие структуры могут наблюдаться следующие симптомы:
- Боли с локализацией в правом или левом подреберье, эпигастрии (область под грудиной), возле пупка. Часто имеют опоясывающий характер, могут отдавать в спину. Возникают вне зависимости от приема пищи.
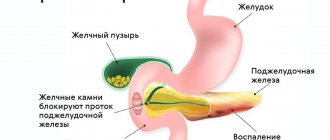
- Желтуха. Опухоль нарушает проходимость желчных путей, нарушается отток желчи, что сопровождается пожелтением кожных покровов и склер глаз, кожным зудом, обесцвечиванием кала, моча приобретает цвет «крепко заваренного чая».
- Кишечная непроходимость. В результате воздействия на двенадцатиперстную кишку развивается ее непроходимость. Состояние может сопровождаться тошнотой, рвотой, ощущением тяжести после приема пищи.
Диагностика
- С помощью методов визуализации: УЗИ (ультразвуковая диагностика), МРТ (магнитно-резонансная томография), ПЭТ-КТ — устанавливают размер опухолевого образования, его локализацию.
- Чрескожная биопсия опухоли поджелудочной железы под контролем УЗИ является важным методом определения характера опухолевого процесса. Через кожу в область патологического образования вводится тонкая игла, и производится забор фрагмента ткани патологического образования. В дальнейшем пробный образец отправляется на гистологическое исследование с целью обнаружения/исключения раковых клеток и определения типа опухоли.
- Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ). Метод диагностики состояния слизистой желудка, двенадцатиперстной кишки, поджелудочной железы путем введения в полость пищевода тонкого эндоскопа, снабженного ультразвуковым датчиком. Метод позволяет также оценить состояние желчных протоков (билиарной системы). В просвет общего желчного и главного панкреатического протока (которые открываются в полость двенадцатиперстной кишки) вводится рентгеноконтрастное вещество. По изображению, транслируемому на монитор, можно определить общую проходимость и состояние желчных путей, участки сужений, непроходимости, наличие опухолевых разрастаний.
- Диагностическая лапароскопия. Эндоскоп, снабженный оптическим прибором, вводится непосредственно в брюшную полость. Данный метод визуализации также позволяет зафиксировать опухолевые образования органов брюшной полости, определить их размеры, локализацию, распространенность процесса (метастатическое поражение соседних органов) и произвести забор биопсии.
Что может означать обнаружение гиподенсного образования?
Если после диагностической процедуры в заключении вам написали, что обнаружено гиподенсное образование, то это указывает на наличие патологического процесса. Но гиподенсное образование – это не окончательный диагноз.
Пониженная плотность ткани может указывать на наличие:
- кист, наполненных жидкостью;
- гемангиом;
- других доброкачественных образований;
- первичных раковых опухолей;
- гиподенсного образования почки,
- гиподенсного образования печени,
- гиподенсивного образования щитовидной железы,
- метастаз.
Для того чтобы выяснить, какая именно патология имеет место, необходимо провести дополнительное обследование. Это могут быть лабораторные исследования, биопсия и другие более специфические методы, которые позволят точно диагностировать болезнь.
Специализированная клиника
Врач: Клаус Тиманн, диагностика сердца
Лечение сердца в Германии
9.9/10
Германия, Мюнхен
Немецкий кардиоцентр (Osypka Herzzentrum Muenchen)
Лечение сердца в Германии ежегодно дает надежду на выздоровление тысячам пациентов немецких клиник.
Подать запросПрофиль врача
Специализированная клиника
Врач: Альберт Аймиллер. Гастроэнтеролог
Гастроэнтерологическая клиника Аймиллера
9.8/10
Германия, Мюнхен
в Мюнхене при Медицинском Центре ИЗАР
Гастроэнтерологическая клиника Аймиллера — это отделение гастроэнтерологии, которым заведует доктор Альберт Аймиллер, в ультрасовременном медицинском центре ИЗАР Клиникум, Мюнхен.
Подать запросПрофиль врача
Лечение доброкачественных новообразований поджелудочной железы
- В некоторых случаях выбирается тактика наблюдения. Если опухоль характеризуется очень медленным ростом, является доброкачественной по своей структуре, не приводит к сдавливанию сосудов и не воздействует на соседние органы, терапевтические мероприятия не проводятся, но пациент находится под постоянным наблюдения со стороны специалистов.
- Хирургическое удаление опухоли. Объем предстоящей операции зависит от размера и локализации опухоли, предусматривает как частичную, так и расширенную (иногда с иссечением прилежащих структур) резекцию поджелудочной железы.
- Кибер-Нож — современный метод лучевой терапии, в некоторых случаях являющийся альтернативой хирургическому лечению. Основным преимуществом данной методики является максимально точная подача высоких доз радиации непосредственно в опухолевый очаг. Метод уникален тем, что имеет минимальный набор побочных эффектов (по сравнению с традиционной лучевой терапией или хирургическим лечением). Курс лечения на аппарате Кибер-Нож составляет всего 1-5 сеансов, каждый из которых длится не более часа.
как записаться на лечение кибер-ножом или пэт-кт исследование: — по телефону горячей линии — с помощью формы обратной связи на сайте.
позвоните прямо сейчас!
Наши консультанты ответят на все Ваши вопросы, а опытные онкологи определят необходимость в лечении Кибер-Ножом.
Смотрите также: Лечение Кибер-Ножом
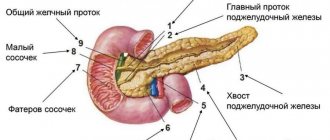
Введение
Высокая разрешающая способность современных методов лучевой диагностики позволяет обнаруживать опухоли поджелудочной железы (ПЖ) даже небольшого размера и с высокой степенью вероятности предполагать их морфологическую принадлежность. Дифференциальная диагностика опухолей ПЖ на дооперационном этапе, в частности идентификация нейроэндокринных неоплазий (НЭН) ПЖ, имеет принципиальное значение. Это обусловлено различной тактикой лечения протоковых аденокарцином (ПАК), кистозных опухолей, солидно-псевдопапиллярных опухолей (СППО) и НЭН ПЖ. Комплексное лечение новообразований нейроэндокринной природы претерпело существенные изменения за последние годы, что связано с расширением показаний к хирургическому лечению, в том числе и к миниинвазивному, а также с появлением эффективных препаратов биотерапии и таргетной терапии. Прогноз течения заболевания у больных НЭН благоприятнее, что позволяет выполнять органосохраняющие операции при небольших размерах опухолей и не отказывать в хирургической помощи при распространенном процессе, а также при наличии отдаленных метастазов [6, 20, 31, 33].
Институт хирургии им. А.В. Вишневского является одним из ведущих центров диагностики и лечения опухолей ПЖ в РФ, и в настоящей работе изложен наш взгляд на основополагающие дифференциально-диагностические признаки НЭН ПЖ.
Материал и методы
В Институте хирургии им. А.В. Вишневского в 1998-2011 гг. находились на лечении 140 больных с морфологически верифицированными НЭН ПЖ. Дифференциально-диагностические критерии строились с учетом результатов обследования 211 больных с верифицированным диагнозом ПАК ПЖ, 18 — СППО, 4 — с метастазами почечно-клеточного рака в ПЖ. Всего в исследование включены 373 пациента.
Солитарные НЭН ПЖ диагностированы у 129 пациентов. Они локализовались в головке у 58 (45%), в теле у 48 (37%) и в хвосте ПЖ у 23 (18%) больных. Множественные синхронные опухоли железы выявлены у 10 больных, у 1 больного обнаружено тотальное поражение мультицентрической НЭН. Нефункционирующие НЭН были у 117 (83,6%) больных, функционирующие — у 23. Среди последних инсулиномы диагностированы у 15, гастриномы — у 8 больных. Спорадический характер заболевания определен у 115 (82,1%) больных, наследственно предрасположенный, в структуре множественных эндокринных неоплазий (МЭН-1), — у 25 пациентов. Распределение больных НЭН ПЖ в соответствии с синдромами гормональной гиперпродукции и наследственной предрасположенности к развитию НЭН представлено в табл. 1
.
Средний возраст больных солитарными НЭН ПЖ составил 50,6±14,5 года. Больные с множественными НЭН ПЖ были моложе, их средний возраст составил 33,8±11,6 года. Распределение больных в зависимости от пола было с незначительным преобладанием женщин (54,1%).
Лабораторная диагностика основывалась на определении уровня хромогранина А, канцер-эмбрионального антигена (СЕА) и карбогидратного антигена (СА19-9) крови. У больных с инсулинпродуцирующей НЭН ПЖ контролировали углеводный обмен.
Лучевые методы обследования больных включали ультразвуковое исследование (УЗИ) в комплексе с эндосонографией (эндо-УЗИ), спиральную и мультиспиральную компьютерную томографию (КТ) с болюсным внутривенным усилением, магнитно-резонансную томографию (МРТ) с контрастным усилением и без него.
В топической диагностике органического гиперинсулинизма при опухолях малого размера (до 2 см) применяли ангиографию с артериально-стимулированным забором крови (АСЗК). В соответствии с методикой забор крови производили из правой печеночной вены после артериальной стимуляции 10% раствором глюконата кальция.
Результаты и обсуждение
Клиническая картина заболевания при НЭН ПЖ зависела от функционального состояния опухоли. Функционирующие опухоли (инсулиномы и гастриномы) имели яркую клиническую симптоматику, соответствующую избыточному синтезу гормона, продуцируемого опухолью, аналогичную описанной во многих публикациях.
При поступлении в Институт хирургии им. А.В. Вишневского 47,8% больных с нефункционирующими НЭН ПЖ жалоб не предъявляли. Впервые опухоль ПЖ у этих больных выявлена при профилактическом обследовании. У 8 из 14 больных с синдромом МЭН-1 нефункционирующие НЭН ПЖ были обнаружены во время целенаправленного обследования после выявления гиперплазии/аденомы паращитовидных желез и/или аденомы гипофиза. Клинические симптомы заболевания отсутствовали при нефункционирующих НЭН малого размера (24,5±12,8 мм). НЭН большого размера (64,1±35,3 мм) сопровождались симптомами, характерными для сдавления прилежащих органов (механическая желтуха и др.), чувством тяжести в животе, тупыми ноющими болями в эпигастральной области.
Средняя концентрация хромогранина А в крови у больных НЭН составила 39,6±34,8 ед/л и колебалась от 3,5 до 107,5 ед/л. Максимальное значение показателя отмечено у больной с метастатическим поражением печени. Для большинства больных НЭН ПЖ (G1 и G2 по классификации ВОЗ 2010 г.) характерен нормальный уровень СЕА и СА 19-9. Напротив, у 80,5% больных ПАК ПЖ отмечалось значимое повышение уровня СА 19-9 и у 42,6% — повышение СЕА. У 36,1% больных выявлено синхронное повышение обоих маркеров. Статистически достоверной зависимости концентрации СЕА и СА 19-9 от степени дифференцировки ПАК ПЖ не выявлено. Однако уровень СА 19-9 достоверно отражал распространенность опухолевого процесса. Средняя концентрация СА 19-9 в крови у больных ПАК поджелудочной железы с метастазами в печень и без них составила 2183,3±644,8 и 52,4±48,9 ед/мл. Различий концентрации СЕА в крови у этих же больных не выявлено.
Средняя концентрация глюкозы у больных с инсулинпродуцирующей НЭН ПЖ на момент поступления составляла 3,13±1,72 ммоль/л. У больных с нефункционирующими НЭН и ПАК ПЖ этот показатель составил 6,1±2,6 и 7,4±3,1 ммоль/л соответственно.
При УЗИ брюшной полости НЭН ПЖ выглядели как солидные (82,9%) очаговые образования округлой формы (64,1%) с неровным и нечетким контуром (65,8%). В 7,7% наблюдений образования имели мультицентрический рост. Структура НЭН чаще являлась гипоэхогенной (89,5%) и неоднородной (78,9%). В 55,3% наблюдений НЭН ПЖ были аваскулярными, в 31,6% — гиповаскулярными, в 10,5% — умеренно васкуляризованными и в 2,6% — гиперваскулярными. ПАК визуализировались как гипоэхогенные структуры, СППО — как гипоэхогенные гомогенные или гипоэхогенные с кистозно-солидной структурой. При эндосонографии НЭН ПЖ выглядели как образования округлой либо овальной формы (77,8%) с четкими (88,9%) неровными (55,6%) контурами, солидной (72,7%) или кистозно-солидной (27,3%) структуры, визуализируемой в виде чередования в структуре опухоли гипер-, гипо- и анэхогенных участков. У 22% больных НЭН ПЖ имели мультицентрический рост.
КТ-характеристика НЭН ПЖ зависела от размеров опухоли и ее функционального состояния. Интрапаренхиматозные (73,8%) новообразования округлой (66,7%) или неправильной (28,6%) формы с четкими контурами (71,4%) были типичны для функционирующих, активных НЭН ПЖ (рис. 1)
.
В то же время отсроченная фаза может быть эффективной при диагностике низкодифференцированных ПАК, в которых поля склероза интенсивно накапливают контрастное вещество именно в отсроченную фазу исследования.
В 83,3% наблюдений структура образования определялась как мягкотканная, в 16,7% — как кистозно-солидная. В отдельных наблюдениях в паренхиме опухоли визуализированы кальцинаты. ПАК ПЖ отличались гиподенсной структурой в артериальную фазу. Редко (10-15%) ПАК имеет изоденсную структуру, но отсроченная фаза может помочь в дифференциальной диагностике. Нефункционирующие НЭН ПЖ в артериальную фазу могут быть гиподенсны, и это затрудняет их дифференциальную диагностику с ПАК и особенно с СППО гомогенной структуры. СППО можно разделить на три группы: 1) гомогенная структура СППО затрудняет дифференциальную диагностику с ПАК и нефункционирующими НЭН ПЖ; 2) кистозно-солидная структура СППО обусловлена некрозом и кровоизлияниями в опухоли, такая структура СППО требует дифференциальной диагностики с муцинозными опухолями; 3) при третьей форме СППО характерны увеличение ее размеров, массивные кальцинаты, распространение за пределы органа, наличие отдаленных метастазов, в том числе в печени. Эта форма СППО требует дифференциальной диагностики с муцинозной опухолью и НЭН с выраженной кистозной трансформацией.
Для определения критериев дифференциальной диагностики различных морфологических вариантов опухолевого поражения ПЖ проведен анализ динамики различий накопления контрастного препарата в фазы исследования опухолевой тканью и паренхимой железы. Различия показателей относительной плотности ткани опухоли и ПЖ в фазы исследования рассчитывали по формуле: x(t)
—
y(t)
, при
t
=
t
1,
t
2,
t
3,
t
4 , где
х
— абсолютное значение показателя относительной плотности ткани опухоли,
y
— абсолютное значение показателя относительной плотности ткани ПЖ,
t
1 — нативная,
t
2 — артериальная,
t
3 — венозная и
t
4 — отсроченная фазы исследования. Абсолютные значения среднего и стандартного отклонения различий накопления контрастного препарата в фазы исследования опухолевой тканью и паренхимой ПЖ представлены в
табл. 2
, из которой видно, что в нативную фазу исследования НЭН ПЖ практически изоденсны или слабо гиподенсны паренхиме железы.
Напротив, ПАК, СППО и метастазы почечно-клеточного рака в ПЖ визуализировались как гиподенсные новообразования. Статистически достоверных различий в показателе относительной плотности этих опухолей железы не выявлено. После болюсного внутривенного контрастирования функционирующие НЭН ПЖ становились гиперденсными по отношению к паренхиме железы в артериальную и венозную фазы исследования. Выраженная гиперденсность метастазов почечно-клеточного рака в артериальной фазе нивелировалась в венозной и отсроченной фазах исследования. ПАК ПЖ были выражено гиподенсными в артериальную и венозную фазы исследования. Оптическая плотность ПАК достигала плотности паренхимы ПЖ в отсроченную фазу или даже превышала ее. СППО солидной структуры во все фазы выглядели как гиподенсные или умеренно гиперденсные новообразования. Выявленные различия показателя относительной плотности опухолей ткани при НЭН, ПАК и СППО статистически достоверны в артериальную и венозную фазы контрастирования (рис. 2)
.
Рисунок 2. Динамика средней плотности опухолевой ткани в зависимости от морфологического варианта новообразования. а — при нейроэндокринных неоплазиях (НЭН) ПЖ, протоковой аденокарциноме (ПАК) ПЖ, солидно-псевдопапиллярной опухоли (СППО); б — при нейроэндокринных неоплазиях ПЖ в зависимости от критерия Grade (G1 и G2, G3). Динамика накопления контрастного препарата тканью НЭН ПЖ различалась в зависимости от степени злокачественности неоплазии. G1 и G2 НЭН ПЖ гиперденсны по отношению к паренхиме во все фазы исследования. Динамика контрастирования нейроэндокринных карцином (G3) в большей степени соответствовала таковой ПАК ПЖ
(см. рис. 2)
.
При МРТ большинство НЭН ПЖ определялись как интрапаренхиматозные новообразования с четкими контурами (83,3% наблюдений). В 11,1 и 5,3% наблюдений неоплазии располагались экстрапаренхиматозно или имели смешанный вариант роста. 77,8% новообразований имели округлую форму. В 68,4% наблюдений НЭН ПЖ имели солидную и в 31,6% — кистозно-солидную структуру. По отношению к окружающей паренхиме в Т1-режиме НЭН были гипоинтенсивными в 56,3% и практически изоинтенсивными в 43,8% наблюдений, на Т2-ВИ НЭН, как правило, гиперинтенсивны. При динамическом сканировании с внутривенным болюсным контрастным усилением эти образования были гиперваскулярными по отношению к паренхиме железы. По сравнению с ПАК отличительными признаками НЭН являлись гиперинтенсивность сигнала в артериальную и венозную фазы.
В нашем исследовании чувствительность комплексного УЗИ составила 82,8%, КТ — 94,8%, МРТ — 96,1% и эндосонографии — 92,3%. Сводные данные литературы по информативности различных инструментальных методов в выявлении опухолевых новообразований ПЖ и метастазов печени при НЭН ПЖ представлены в табл. 3
[3-5, 7, 8, 10, 11, 14-17, 19, 21-25, 27-30, 35].
Ангиография (целиакография и верхняя мезентерикография, возвратная портография), дополненная АСЗК, оказалась информативной у всех больных, которым выполнено исследование. В качестве примера приводим клиническое наблюдение.
Больная Г.
, 25 лет, госпитализирована в Институт хирургии им. А.В. Вишневского с жалобами на приступы потливости, чувства голода, слабости, потери сознания. Больной себя считает с августа 2011 г., когда внезапно появились эти жалобы. Доставлена в ЦРБ по месту жительства в гипогликемической коме. После выписки отмечалась повторная потеря сознания, доставлена в отделение эндокринологии ЦРБ по месту жительства с уровнем глюкозы 1,3 ммоль/л. При инструментальном обследовании образований ПЖ и органов брюшной полости не выявлено. За время нахождения в стационаре уровень глюкозы крови колебался от 1,3 до 2,5 ммоль/л.
При обследовании в Институте хирургии им. А.В. Вишневского МРТ и КТ органов брюшной полости убедительных данных о наличии образований в ПЖ не выявлено. При эндо-УЗИ обнаружено очаговое образование в теле ПЖ, вероятнее всего, НЭН. Признаков интимного прилежания опухоли к крупным сосудам верхнего отдела брюшной полости не выявлено. На рис. 3
представлены график изменения концентрации инсулина и С-белка в крови при АСЗК из правой печеночной вены и стимуляции различных отделов ПЖ.
Рисунок 3. Ангиограмма с АСЗК у пациентки с органическим гиперинсулинизмом (а) и интраоперационная ультрасонограмма (б). а — график изменения концентрации инсулина и С-белка в крови, забранной из правой печеночной вены, при стимуляции различных отделов ПЖ. Максимальный выброс отмечен при стимуляции тела ПЖ; б — опухоль ПЖ указана стрелкой. Отмечен достоверный рост концентрации инсулина при стимуляции тела ПЖ. Больная оперирована. При осмотре и пальпации ПЖ опухоль не определялась, и была обнаружена при интраоперационном УЗИ. Из традиционного доступа выполнена дистальная резекция ПЖ с сохранением селезенки. Данные гистологического исследования: НЭН G1 ПЖ. Клетки неоплазии экспрессируют инсулин.
Обсуждая вопрос рационального объема обследования больных с подозрением на НЭН ПЖ, надо отметить, что каких-либо стандартов или российских консенсусов по данному вопросу нет, а экстраполировать опыт других стран на российскую действительность невозможно. Мы ограничены недоступностью рутинного использования функциональных методов визуализации нейроэндокринных неоплазий. Рекомендации Европейской ассоциации по изучению нейроэндокринных опухолей (ENETS) заключаются в использовании УЗИ и КТ для первичной диагностики НЭН ПЖ, после чего рекомендуется выполнение сцинтиграфии соматостатиновых рецепторов и позитронной эмиссионной томографии, совмещенной с КТ со специфическими трейсерами. Только после этого решается вопрос о выполнении МРТ, эндосонографии и других методов инструментальной диагностики [9, 18]. В проспективных исследованиях показано, что сцинтиграфия соматостатиновых рецепторов обладает информативностью 60-70% при выявлении локализованных НЭН, а при наличии метастазов в печень — 92% [12, 13]. Чувствительность сцинтиграфии соматостатиновых рецепторов сравнима с суммарной чувствительностью всех традиционных методов лучевой диагностики.
При всех лучевых методах исследования, включая сцинтиграфию соматостатиновых рецепторов, важным критерием является размер опухоли. Образования менее 1 см не определяются в 50% наблюдений [2]. Наибольшие надежды возлагаются на позитрон-эмиссионную томографию со специфическими трейсерами, такими как 68Ga-DOTA,1-Nal(3)-octreotide, 68Ga-DOTANOC, 68Ga-DOTA, Tyr(3)-octreotate и 68Ga-DOTATATE [5, 15, 19, 23, 26, 34, 36]. Чувствительность этого метода в визуализации НЭН достигает 97% [32].
В условиях нашей страны для определения тактики лечения и последующего контроля течения заболевания считаем целесообразным выполнять комплексное УЗИ и мультиспиральную КТ как основные методы скрининга и дифференциальной диагностики опухолевых заболеваний ПЖ. В качестве дополнительных методов следует использовать эндосонографию, а также МРТ с болюсным контрастированием. Большим преимуществом эндосонографии является возможность выполнения пункции с аспирационной биопсией во время исследования. МРТ — метод, обеспечивающий возможность последующей многолетней оценки опухолевого ответа на проводимую терапию при отсутствии лучевой нагрузки на больного. Для топической диагностики органического гиперинсулинизма необходимо проведение АСЗК. Сочетанная рентгенологическая диагностика (ангиография и артериально-стимулированный забор крови) позволяет локализовать опухоль или зону гиперплазии β-клеток в 96,8% наблюдений. В комплексном обследовании больных необходимо проведение и лабораторной диагностики, которая должна включать оценку уровня хромогранина А, гормонов и пептидов в соответствии с гиперфункциональным синдромом (при наличии такового), а также определение уровня СЕА и СА 19-9 крови для дифференциальной диагностики с ПАК ПЖ [1].
Таким образом, в основе дифференциальной диагностики и верификации диагноза при НЭН ПЖ лежит настороженность и информированность лечащих врачей о НЭН ПЖ. Лучевые методы обследования позволяют с высокой степенью вероятности диагностировать НЭН ПЖ в большинстве наблюдений. Проведение КТ или МРТ с болюсным внутривенным контрастированием должно быть обязательным при подозрении на опухолевое заболевание ПЖ. Дифференциальная диагностика между НЭН, ПАК, СППО и метастазами почечно-клеточного рака в ПЖ на основании нативной фазы КТ, а также по «усредненной фазе», когда контрастное вещество внутривенно вводится «от руки», невозможно. Больные НЭН ПЖ должны находиться под наблюдением мультидисциплинарной команды врачей, включающей хирурга, онколога-химиотерапевта, эндокринолога, специалистов лучевой диагностики и патолога.