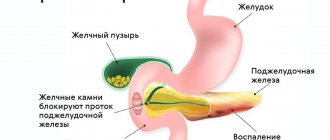
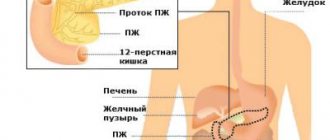
Стресс эндоплазматического ретикулума; роль митохондрий
- Производство энергии митохондриями связано с работой 2 механизмов: дыхательной цепи переноса электронов (ЭТЦ);
- окислительного фосфорилирования.
- свободные радикалы: супероксид-ион (O−2);
- пероксид водорода (H2O2);
- перекисного окисления липидов;
окисления белков;
- повреждения структур, обеспечивающих синтез инсулина;
- значительное уменьшение запасов АТФ;
- супероксиддисмутазы (СОД);
Диабет и онкологические заболевания других органов — какие органы поражаются и что повышает риски?
Диабет и онкологические заболевания других органов
Онкологические заболевания других органов при диабете развиваются как в результате системного, так и местного канцерогенеза. Ученые проводили исследования не столько в случаях рака печени и поджелудочной железы, но опухолей других органов.
Почки один из органов-мишеней, поражаемых при CD-специфической гипергликемии. Было показано, что рак почек развивается из-за общих факторов — гиперинсулинемия, ожирение, и специфических факторов, в основном гипертонии и диабетической нефропатии.
Диабетики имеют несколько более высокую заболеваемость раком мочевого пузыря. Гиперинсулинемия — не единственный частый фактор канцерогенеза в этом случае. Также могут способствовать развитию рака частые инфекции мочевыводящих путей.
Рак женской репродуктивной системы также чаще встречается у женщин с диабетом. Доказано, что у диабетиков больше шансов заболеть раком груди и слизистой оболочки матки, независимо от того, страдают они ожирением или нет. Как известно, ожирение — одна из основных причин рака груди. Но развитие этих видов рака определяют несколько механизмов, среди которых важное значение имеет действие половых гормонов.
- Гиперинсулинемия увеличивает уровень биоактивных эстрогенов в крови женщины, потому что снижается концентрация гормон-связывающего белка.
- Избыточная концентрация инсулина также стимулирует синтез андрогенов в строме яичника.
- Также является одним из механизмов развития рака репродуктивных органов женщины задержка первой менструации, особенно у девочек с диабетом типа 1. Такие женщины более склонны к бесплодию, нерегулярным менструациям и другим проблемам с фертильностью.
Результаты большинства исследований предполагают, что диабет 2-го типа связан с повышенной частотой карцином и аденом толстой кишки. Риск развития рака толстой и прямой кишки повышен и у женщин, и у мужчин.
При описании механизмов патогенеза упоминаются ряд причин:
- гиперинсулинемия;
- более медленный транзит содержимого в кишечнике;
- повышенная концентрация желчной кислоты в кале, что характерно для диабета.
Основываясь на результатах опубликованных крупных проспективных когортных исследований и исследований случай-контроль, было обнаружено, что диабетики имеют несколько более высокую вероятность развития неходжкинской лимфомы. Это объясняется нарушением работы иммунной системы из-за дисфункции нейтрофилов и изменением клеточного и гуморального иммунитета у больных диабетом.
Аутофагия
- Клеточное повреждение и апоптоз ассоциированы с аутофагией — процессом удаления из клетки повреждённых органелл путём лизосомальной деградациии и образования новых на их месте.
- Считается, что некоторые болезни, в том числе и диабет, имеют множественную этиологию. В частности, среди причин называют аутофагию.
- В ходе исследований, изучающих взаимосвязь между диабетом и аутофагией у людей установлено, что, если β—клетки и клетки островков Лангерганса подвергаются воздействию гипергликемии или гиперлипидемии, аутофагия прекращается.
- Это приводит к накоплению в клетках окисленных, повреждённых или неправильно «свёрнутых» белков.
- Впоследствии также отмечается гибель β—клеток в результате оксидативного стресса.
- Процесс аутофагии регулируется различными сигналами.
- Особое значение в работе механизма имеют белки mTOR сигнальных комплексов 1 и 2 (mTORC1 и mTORC2).
- Эти белки представляют собой киназы, участвующие в нескольких клеточных процессах, например, в: формировании инсулинрезистентности (ИР);
- адипогенезе;
- ангиогенезе;
- аутофагии.
- неправильным «сворачиванием» белка;
Связь диабета и рака простаты — есть ли она?
Хотя диабет является одним из факторов риска многих онкологических заболеваний органов, эпидемиологические исследования показывают, что рак простаты менее распространен среди диабетиков.
Метаанализ 14 исследований, где уровни ПСА не использовались в качестве инструмента ранней диагностики, и 5 исследований, где уровни ПСА использовались, подтвердили статистически значимое снижение риска рака простаты у мужчин, больных диабетом.
Риск снижается в среднем на 16%. Это скорее всего связано со снижением уровня тестостерона при диабете. Было высказано предположение, что на эту взаимосвязь могут влиять другие метаболические и гормональные факторы — измененные уровни инсулина и лептина, употребление статинов и метформина.
Дефектный фолдинг
- В последние годы дефектный фолдинг в ЭПР рассматривается как причина нескольких хронических заболеваний, в том числе: сахарного диабета;
- неалкогольной жировой болезни печени (НАЖБП);
- рака;
- болезни Альцгеймера.
- депонирование Ca;
- В ходе них установлено, что при наличии предиабета проинсулиновый синтез в β—клетках протекает более активно, и за счёт этого нарушается фолдинг белков. Неправильно свёрнутые белки накапливаются в ЭР, вызывая стресс.
- инсулинрезистентность (ИР);
- вызывает в β—клетках стресс ЭР;
- CCAAT/ гена-усилителя, связывающего гомологичный протеин;
Риски развития онкологии у больных с сахарным диабетом
Содержание статьи
Риски развития онкологии
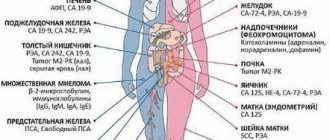
Согласно данным, предоставляемых онкологами, диабет увеличивает риск поражения печени, поджелудочной железы, толстой кишки, почек, мочевого пузыря, слизистой оболочки матки, груди и развития неходжкинской лимфомы.
Есть два типа механизмов, которые способствуют развитию злокачественных новообразований при диабете.
- Первый тип
— это общие механизмы, которые способствуют онкологическим процессам во многих органах. Например, гипергликемия, гиперинсулинемия, активность препаратов, используемых при лечении сахарного диабета, поскольку они влияют на все ткани. - Второй тип
— определенные механизмы, влияющие на канцерогенез только в одном из органов.
Из-за хронического течения без выраженных симптомов диабет часто длительное время не диагностируют. Согласно эпидемиологическому исследованию, проведенному в США, у 3-5% взрослых диабет не выявлен. Доказано, что диабет является одним из факторов, повышающих риск развития злокачественных новообразований — онкологические заболевания однозначно чаще встречаются среди людей с CD