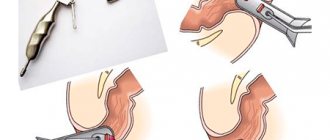
Сучасні рекомендації
Володимир Нікішаєв, Ігор Тумак, Андрій Патій Львівський національний медичний університет Український науково-практичний центр екстреної медичної допомоги та медицини катастроф
Досі у всьому світі захворювання печінки посідають одне з чільних місць серед причин інвалідності та смерті. Зокрема у США цироз печінки посідає п’яте місце серед причин смерті осіб віком до 60 років. Середній вік таких хворих — 50 років, що підкреслює соціоекономічну важливість проблеми.
Лікування хворих із цирозом і пов’язаними з портальною гіпертензією шлунково-кишковими кровотечами (ШКК) залежить від стадії портальної гіпертензії, на якій перебуває пацієнт, починаючи від хворих з цирозом і портальною гіпертензією, у яких ще не розвинувся варвикоз, і закінчуючи хворими з гострими варикозними кровотечами, в яких основною метою лікування є зупинка кровотечі і запобігання її рецидиву. З 1997 року, коли було опубліковано рекомендації AASLD, ACG, AGA і ASGE для діагностики і лікування варикозних шлунково-стравохідних кровотеч, було проведено три міжнародні консенсусні конференції (Бавено III у 2000 р., Бавено IV у 2005 р. і конференція на одну тему AASLD/EASL у 2007 р.), на яких експерти оцінили зміни, які стались у розумінні патофізіології та лікуванні варикозних шлунково-стравохідних кровотеч.
ПАТОФІЗІОЛОГІЯ ПОРТАЛЬНОЇ ГІПЕРТЕНЗІЇ ПРИ ЦИРОЗІ
Ворітна вена починається при злитті верхньої брижової і селезінкової вен, нижня брижейкова і ліва шлункова вени варіабельно впадають у них або безпосередньо у ворітну вену. Її назва віддзеркалює той факт, що вона є “воротами” для відпливу крові від органів травлення у печінку, довжина ворітної вени сягає 6–8 см, а діаметр 1–1,2 см. Крім неї, у печінку надходить кров через печінкову артерію, однак головним джерелом притоку крові є саме ворітна вена і загальний потік (“приплив-відплив”) визначається саме тиском у портальній системі. Цироз — остання стадія будь-якого хронічного захворювання печінки, він може призводити до портальної гіпертензії. Її визначають як підвищення портального венозного тиску понад 5–10 мм рт. ст. Відповідно до основних принципів гідродинаміки, як збільшення потоку крові, так і підвищення опору (згідно з законом Ома — градієнт тиску ΔP = Q × R, де Q — потік рідини, а R — опір потоку) можуть призводити до підвищення тиску в портальній системі.
Портальний тиск при цирозі підвищується насамперед як наслідок збільшеного опору кровоплину, що зумовлено, в основному, спотворенням архітектоніки печінки після розростання фіброзної тканини і утворення регенераційних вузлів. За формулою Пуазейля опір R = 8nl/πr4, де n — в’язкість рідини, у даному разі крові, l — довжина гідродинамічної системи (величини фактично постійні), а r — радіус судини. За таких умов невелике зменшення діаметра судин призводить до різкого збільшення опору. У нормі печінка — циркуляторна система з низьким опором. Збільшення опору може локалізуватися на підпечінковому, печінковому і надпечінковому рівнях (табл. 1). Внутрішньопечінкова портальна гіпертензія (ПГ), своєю чергою, може поділятися на пресинусоїдальну, синусоїдальну і постсинусоїдальну, однак у клінічній ситуації чітко розмежувати їх важко: при хронічному гепатиті підвищується пресинусоїдальний та синусоїдальний опір, а при алкогольній хворобі печінки — синусоїдальний (відкладення колагену у просторі Діссе, його секретують зірчасті клітини) і постсинусоїдальний (фіброз термінальних печінкових вен). При шистосомозі печінки спочатку підвищується пресинусоїдальний опір, а пізніше — уражається синусоїдальна зона.
На додаток до структурного опору кровоплину, наявне активне внутрішньопечінкове звуження судин, яке відповідає за 20–30% зростання внутрішньопечінкового опору, пов’язане, в основному, із зменшенням ендогенної продукції монооксиду азоту. Як при хронічних, так і при гострих захворюваннях печінки зірчасті клітини печінки набувають скоротливих властивостей, такі активовані клітини містять актиноподібні філаменти й експримують ген актину гладких м’язів альфа. Вони реагують на вазоактивні речовини, що виділяються ендотелієм судин, зокрема зменшення продукції вазодилятатора NO і збільшення продукції вазоконстриктора ендотеліну.
Гіпертензію пов’язують також із розладом гомеостазу натрію і гіпердинамічним циркуляторним станом. У хворих з портальною гіпертензією виявляють підвищений серцевий індекс, знижений системний судинний опір і підвищений спланхнічний артеріальний кровоплин (і, відповідно, надходження крові у портальну систему). Вважають, що є три основні причини периферичної вазодилятації при портальній гіпертензії. Першою вважають підвищений вміст циркулюючих вазодилятаторів унаслідок їх підвищеної продукції та зниженого катаболізму (через порушення функції печінки і портосистемне шунтування крові мимо неї). Другим є збільшення продукції ендотелієм локальних вазодилятаторів і третій — знижена відповідь на вазоконстриктори. Однак докази важливості усіх цих трьох механізмів досі недостатні і контраверсійні.
Крім системної вазодилятації гіпердинамічний циркуляторний стан зумовлений збільшенням об’єму плазми. Вважають, що спланхічна і системна вазодилятація призводять до зниження центрального артеріального об’єму через збільшення ємності венозного басейну. Наслідком є компенсаторна активація ренін-ангіотензин-альдостеронової системи та симпатичної системи, збільшується також продукція вазопресину. Відбувається ретенція натрію та води і, відповідно, збільшення об’єму плазми.
Наслідками ПГ є застій крові у селезінці, гіперспленізм та тромбоцитопенія. Іншим драматичним наслідком портальної гіпертензії є асцит. Портальна гіпертензія зумовлює формування порто-системних колатералей. Однак, незважаючи на їх розвиток, гіпертензія утримується з двох причин: 1) збільшення притоку до портальної вени в результаті розширення вісцеральних артеріол, що стається одночасно з формуванням колатералей, і 2) недостатньої портальної декомпресії через колатералі, оскільки вони чинять більший опір, ніж судини здорової печінки.
Сполучення між портальною і загальною (кавальною) венозними системами є і в нормі, однак при ПГ кровоплин по них різко зростає. Виділяють 4 основні групи портосистемних колатералей.
Перша група поділяється, своєю чергою, на дві підгрупи. Підгрупа Іа включає ліву шлункову вену і короткі шлункові вени, які в ділянці кардії шлунка утворюють анастомози з міжреберними венами, діафрагмальною веною, венами стравоходу та іншими дрібнішими венами кавальної системи (наприклад люмбарними венами). Саме інтенсивний потік крові цим шляхом призводить до утворення стравохідних і шлункових вариксів. До підгрупи Іb належить верхня прямокишкова вена, яка утворює анастомози з середньою і нижньою прямокишковими венами кавальної системи.
Друга група — це параумбілікальні вени, які йдуть у товщі круглої зв’язки печінки, анастомозують з v v. epigastricae sup. et inf. Параумбілікальні вени — рудимент плідного кровообігу, у дорослих вони облітеровані і при ПГ реканалізуються.
Третю групу становлять колатералі між венами органів черевної порожнини і кавальними венами прилеглих тканин заочеревинного простору та черевної стінки. Сюди входять анастомози між венами печінки та діафрагми, вени селезінково-ниркової зв’язки, між венами заочервинних відділів товстої кишки і люмбарними венами. Сюди належать також вени, що утворилися у спайках після попередніх абдомінальних операцій.
Четверта група — це анастомози між селезінковою та лівою нирковою, нижньою діафрагмальною і лівою наднирниковою венами (поділу на третю і четверту групи дотримуються не всі автори). Наявність портосистемних анастомозів вказує на ПГ, однак при інтенсивному колатеральному кровотоку тиск у ворітній вені може падати. Натомість короткотривала ПГ може не супроводжуватися явною колатеральною циркуляцією.
Як за об’ємом потоку крові, так і за клінічним значенням (кровотечі) найважливішими є портокавальні анастомози в ділянці шлунково-стравохідного з’єднання. Через них кров надходить у непарну і напівнепарну вени. Через їх клінічну важливість доцільно докладніше розглянути анатомію венозних судин цієї ділянки.
У стравоході виділяють чотири шари розташування венозних судин. Поверхнево розташовуються інтраепітеліальні вени, що дренуються в поверхневе венозне сплетення підслизового шару. Вени цього сплетення сполучені з глибокими венами підслизового шару. Перфорантні вени, що проникають крізь м’язовий шар стравоходу, сполучають їх з адвентиціальним венозним сплетенням.
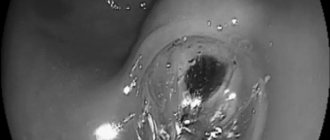
Vianna A. et al. (1987) виділили 4 зони вен кардіоезофагальної ділянки: одну зону у шлунку і 3 зони у стравоході. Найдистальніше розміщена шлункова зона, в якій є численні, невеликого діаметра, поздовжньо розміщені вени, що проходять у власній пластинці (lamina propria) і підслизовому шарі, утворюючи анастомози. Дистальніше вени шлункової зони зливаються, утворюючи судини великого діаметра, які сполучаються з портальною і селезінковою венами відповідно через ліву шлункову вену і короткі шлункові вени. Проксимальніше, вище кардії, починається палісадна зона завдовжки 2–3 см, в якій вени, що йдуть із кардії шлунка, проходять через м’язову пластинку слизової оболонки і далі йдуть усередині власної пластинки. Цей перехід відбувається на рівні стравохідно-шлункового з’єднання. Венозні судини в цій зоні орієнтовані поздовжньо, вони паралельні, однакові за розміром. Вище розміщена перфорантна зона завдовжки близько 2 см, в якій вени зливаються, утворюючи 4–5 великих стовбурів, що проникають крізь м’язову пластинку слизової оболонки і розташовуються в підслизовому шарі; також є численні комунікантні вени, які сполучають вени різних рівнів. У стовбуровій зоні, проксимальніше перфорантної, містяться поздовжні підслизові вени, діаметр яких зменшується в оральному напрямку (припускають, що у стовбуровій зоні кров у венах тече в каудальному напрямку). При підвищенні портального тиску і розвитку гіпертензії у венозних басейнах відбувається збільшення глибоких вен підслизового шару стравоходу, особливо в перфорантній зоні. Саме ці вени і визначаються ендоскопічно як варикозно розширені. Інтраепітеліальні вени і вени поверхневого сплетення також дилятовані і трансформуються. Ендоскопічно вони виглядають як “червоні знаки”, що містяться на самих варикозно розширених венах.
1.Что такое варикоз вен пищевода?
Варикоз вен пищевода
– это расширение кровеносных сосудов в пищеводе. Иногда вены расширяются и в желудке. Это заболевание не вызывает никаких неприятных симптомов, если не происходит разрыва и кровотечения из сосудов. В этом случае может наступить
портальная гипертензия
– опасное для жизни состояние.
Портальная гипертензия
– это увеличение давления в системе воротной вены (вены, по которой кров поступает от органов пищеварения в печень), что часто бывает связано с блокадой всего кровотока к печени. Повышение давления в воротной вене приводит к развитию крупных, опухших вен (варикоза) в пищеводе, желудке, прямой кишке и пупочной области. Варикозные вены хрупкие и легко разрываются. А при разрыве вены может произойти большая кровопотеря. Чаще всего причиной портальной гипертензии становится цирроз печени. Цирроз – это рубцевание печени при заживании повреждений печени, вызванных гепатитом, алкоголем и другими менее распространенными причинами. При циррозе рубцовая ткань может блокировать поток крови через печень и замедлить ее работу.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
КЛІНІЧНИЙ ДІАГНОЗ ПОРТАЛЬНОЇ ГІПЕРТЕНЗІЇ
При фізикальному дослідженні найпростіше виявити асцит, жовтяницю, павукоподібні ангіоми на шкірі, еритему долонь, атрофію яєчок, гінекомастію, контрактури Дюпюїтрена і атрофію м’язів. Можуть бути також прояви портосистемної енцефалопатії — у важких випадках астериксиз (ляпаючий або “пурхаючий” тремор кистей) і летаргія, у легких — дратівливість, порушення сну. У більшості хворих з ПГ виявляють також спленомегалію, хоча розмір селезінки погано корелює з портальним венозним тиском і її збільшення може бути викликане іншими захворюваннями. На гіпердинамічний стан можуть вказувати високий (скачучий) пульс, теплі, добре перфузовані кінцівки в поєднанні з артеріальною гіпотензією.
Ознаками портосистемних колатералей є дилятовані вени на передній поверхні живота (умбілікально-епігастральні шунти), “голова медузи” становить собою звивисті колатеральні вени навколо пупка. Внутрішні гемороїдальні вузли не є специфічною знахідкою, але також можуть бути проявом колатералізації. Натомість видимі колатеральні судини на спині вказують не на власне портальну гіпертензію, а на обструкцію на рівні нижньої порожнистої вени. Її рідкісною причиною може бути компресія нижньої порожнистої вени регенеративними вузлами при цирозі печінки.
Асцит легко виявити при великій кількості рідини — у таких випадках живіт тугий, можна виявити балотування рідини. Однак невеликий асцит діагностують інструментально, наприклад, з допомогою ультрасонографії. Парацентез допомагає встановити етіологію асциту: на його портальну (неперитонеальну) етіологію вказує сироватково-асцитичний градієнт альбуміну (SAAG) понад 1,1 г/дл (11 г/л). Однак цим методом не можна розрізнити печінкову і надпечінкову ПГ, наприклад, при застійній серцевій недостатності. Недавні дослідження вказують на зниження SAAG після встановлення трансюгулярних портосистемних шунтів (TIPS).
Лабораторні дослідження загалом не є специфічними щодо виявлення ПГ. Відзначають збільшення протромбінового часу і тромбоцитопенію. У хворих з цирозом печінки ці показники вважають предикторами наявності стравохідних вариксів (див. нижче). Гіпоальбумінемія вказує на важкість ураження печінки і непрямо — на ПГ. Подібно гіпонатріємія і низька концентрація натрію в сечі можуть бути наслідком ретенції води і натрію при портальному гіпертензивному синдромі.
ОЦІНКА ПОРТАЛЬНОЇ ГІПЕРТЕНЗІЇ
Найкращим, хоч і непрямим, методом оцінки портального тиску вважається вимірювання тиску заклинювання в печінкових венах — ТЗПВ (wedged hepatic venous pressure — WHVP), який вимірюється шляхом заведення балонного катетера (з яремного, плечового або стегнового доступу) під флюороскопічним наведенням у печінкову вену і “заклинення” його в малій гілці (введення до упору) або (що вважають ще ліпшим) — шляхом роздування балона і оклюзії більшої гілки печінкової вени. Завжди виконується корекція WHVP з урахуванням підвищення внутрішньочеревного тиску (наприклад при асциті) шляхом віднімання вільного тиску в печінковій вені — ВТПВ (free hepatic vein pressure — FHVP) або внутрішньочеревного тиску в порожнистій вені, які вважають внутрішнім нульовим рівнем. Його вимірюють при спущеному балоні. Отримане значення є градієнтом тиску в печінковій вені — ГТПВ (the hepatic venous pressure gradient — HVPG). Показник, як звичайно, вимірюється тричі; якщо він визначений технічно правильно, то є добре відтворюваним і дуже надійним. Оскільки вимірюється градієнт тиску між синусоїдами (а не гілками ворітної вени) і печінковою веною, ГПВТ буде підвищеним при внутрішньопечінкових причинах портальної гіпертензії, таких як цироз, однак нормальним при передпечінкових причинах, таких як тромбоз портальної вени. Нормальні показники ГПВТ — 3–5 мм рт. ст. Було доведено, що WHVP дуже тісно корелює з портальним тиском як при алкогольних, так і неалкогольних цирозах. ГПВТ і зміни його показників, які відбуваються протягом певного часу, мають передбачувальну цінність щодо розвитку варикозного розширення вен стравоходу, ризику варикозної кровотечі, розвитку неварикозних ускладнень портальної гіпертензії і смерті. Одиночні вимірювання корисні для прогнозу як компенсованого, так і декомпенсованого цирозу, тоді як повторні вимірювання застосовують для моніторингу ефективності медикаментозної терапії і перебігу захворювання печінки. Обмеженнями для широкого використання вимірювань ГПВТ є відсутність відповідного досвіду у практикуючих лікарів і недотримання ними рекомендацій, які дають змогу отримувати надійні і відтворювані показники, а також інвазійність процедури.
Дуплексна допплерівська ультрасонографія
Ультрасонографія є безпечним, недорогим і ефективним методом скринінгу ПГ. Вузлувата структура печінки, спленомегалія і наявність колатеральної циркуляції дають підстави підозрювати цироз печінки і ПГ. Вивчають також діаметр спланхнічних судин, напрям і швидкість кровоплину, зміни діаметра судин при диханні, індекс портального венозного застою, індекс пульсативності та індекс резистентності печінкової, верхньої брижової і селезінкової артерій та печінковий судинний індекс. У нормі діаметр ворітної вени не перевищує 13 мм при спокійному диханні, при глибокому він може збільшуватися на 50%. Розширеною вважають вену з діаметром >15 мм при спокійному диханні. При підвищенні тиску кровоплин у ворітній вені уповільнюється і стає монотонним (без дихальних коливань) і врешті-решт повністю зворотним, спрямованим у бік функціонуючих портокавальних шунтів.
Однак відтворюваність кількісних ультразвукових параметрів, їх точність недостатня, вони залежать як від техніки дослідження, так і від добових ритмів, стану симпатичної нервової системи, медикації тощо. Так, наприклад, діаметр ворітної вени може збільшуватися при тривалій застійній серцевій недостатності (водночас із нижньою порожнистою веною). Тому саму по собі дуплексну допплерівську ультрасонографію не рекомендують застосовувати для встановлення точного діагнозу ПГ, неясним залишається її діагностичне значення саме для ранніх стадій ПГ (у більшості таких досліджень обстежувалися пацієнти з важким цирозом і вираженою ПГ). І все ж таки цей метод цінний для первинного обстеження, він також допомагає виявити етіологію ПГ, наприклад, обструкцію судин на різному рівні, високочутливий щодо виявлення функціонуючих портокавальних анастомозів. Після накладання TIPS або портокавальних анастомозів допплерівська ультрасонографія відіграє велике значення у контролі прохідності шунта.
Комп’ютерна томографія є тестом з якісним (не кількісним) значенням, якщо ультрасонографія не дала чітких результатів. На відміну від ультрасонографії, на результати КТ не впливає наявність газу в кишківнику. Реконструкція будови судинного дерева з допомогою 3-D технології дає змогу точно відтворити будову портальної венозної системи і колатералей. Частою знахідкою при портальній гіпертензії під час КТ є дилятація нижньої порожнистої вени. Однак КТ не дає змоги оцінити потік крові по венозних і артеріальних судинах. МЯР дає змогу, крім якісної, також отримати певну кількісну інформацію, наприклад, оцінити венозний потік по ворітній і непарній венах. Однак вона не виключає необхідності інвазивних досліджень.
У випадках сумніву в генезі ураження печінки доцільною може бути її пункційна біопсія: некроз третьої зони, наприклад, свідчить про портальну гіпертензію, вторинну до серцевої недостатності, а нормальна паренхіма печінки — про підпечінкову причину ПГ. Протипоказанням для біопсії печінки є коагулопатія і виражений асцит.
Таблиця 1. Причини портальної гіпертензії та градієнт тиску в печінковій вені
| ГТПВ | |||
| Рівень оклюзії | Нормальний | Нормальний або підвищений | Підвищений |
| Підпечінкові синдроми ПГ | Тромбоз ворітної вени Тромбоз селезінкової вени Спланхнічна артеріовенозна фістула | ||
| Внутрішньопечінкові синдроми ПГ Переважне ураження на пресинусоїдальному рівні | Шистосомоз, первинний біліарний цироз, ідіопатична ПГ (рання стадія)* Вузлова регенеративна гіперплазія* | Мієлопроліферативні захворювання*† Полікістозна хвороба*† Метастази в печінку*† Гранульоматозні захворювання † (саркоїдоз, туберкульоз)*† | |
| Переважне ураження на синусоїдальному або постсинусоїдальному рівні | Синдром Бадда-Кіарі‡ | Цироз печінки Шистосомоз, первинний біліарний цироз, ідіопатична ПГ (пізня стадія) Гострий і фульмінантний гепатит Гострий алкогольний гепатит Хвороба Вільсона Венооклюзійна хвороба Синдром Бадда-Кіарі‡ | |
| Постпечінкові синдроми ПГ | Обструкція нижньої порожнистої вени Правошлуночкова серцева недостатність Стискаючий перикардит Недостатність тристулкового клапана | ||
* Рідкісні причини ПГ. † За умови ураження синусоїдів. ‡ Ураження синусоїдів слабке.
Особенности лечения
Лечебные мероприятия можно разделить на две группы. Первая группа направлена на устранение причины, которая привела к варикозному расширению вен пищевода и желудка. Кроме цирроза печени, это может быть хронический гепатит, эхинококкоз, опухоли, которые сдавливают воротную вену и другие заболевания, которые были обнаружены в ходе диагностики.
Вторая группа методов направлена на устранение непосредственно варикозного расширения вен. С этой целью назначают консервативное лечение (препараты, которые способствуют сужению сосудов и укрепляют их стенку) и эндоскопические операции, которые направлены на устранение патологически расширенных вен (склеротерапия, перевязка и др.).
Если данные мероприятия оказываются неэффективными, то прибегают к более радикальному лечению, которое заключается в создании «обходных путей» (шунтов) для крови с целью разгрузки кровотока в воротной вене.
Специалисты нашей клиники могут предложить несколько современных методик лечения варикозного расширения вен пищевода и желудка. Точный план составляется индивидуально, после консультации врача и необходимой диагностики. Хирургические вмешательства проводятся в хорошо оснащенной малой операционной.
ПЕРЕБІГ ЗАХВОРЮВАННЯ
Шлунково-стравохідні варикозно розширені вени (ВРВ) є найбільш вагомими у клінічному плані порто-системними колатералями, тому що їх розрив призводить до варикозної кровотечі, найчастішого летального ускладнення цирозу — вже перший її епізод супроводжується смертністю 30–50%. Варикоз та варикозні кровотечі — ускладнення цирозу, які безпосередньо спричинені портальною гіпертензією. Пацієнти з цирозом та гастроезофагеальними вариксами мають показники ГПВТ щонайменше 10–12 мм рт. ст.
Шлунково-стравохідні ВРВ наявні у близько 50% хворих з цирозом. Їх наявність корелює з важкістю захворювання печінки (таблиця 2): якщо при класі А за Child-Pugh лише 40% пацієнтів мають варикоз, то при класі С він є у 85% хворих. У пацієнтів з первинним біліарним цирозом варикоз та варикозні кровотечі можуть розвиватись на ранньому етапі захворювання, навіть за відсутності встановленого діагнозу цирозу. Встановлено також, що 16% пацієнтів з гепатитом C і мостоподібним фіброзом мають варикозне поширення вен стравоходу.
У пацієнтів без варикозу останній розвивається з частотою 8% на рік, найсуттєвішим предиктором розвитку варикозу в пацієнтів, які його не мають при первинному ендоскопічному огляді, є показник ГПВТ >10 мм рт. ст. У пацієнтів з малими ВРВ великі варикси розвиваються з частотою 8% на рік. Декомпенсований цироз (Child B/C), алкогольний цироз і наявність “червоних знаків” при первинній ендоскопії є головними ознаками, пов’язаними з переходом від малих вариксів до великих (Merli M. et al., 2003). Японські автори у своїй класифікації надають суттєвого значення синюватому забарвленню ВРВ.
Варикозні кровотечі трапляються з частотою 5–15% на рік, а найважливішим предиктором кровотечі є розмір ВРВ, з найвищим ризиком першої кровотечі (15% на рік) у пацієнтів з великими ВРВ (The North Italian Endoscopic Club for the Study and Treatment of Esophageal Varices, 1988). Іншими предикторами кровотечі є декомпенсований цироз (Child B/C), синюшний колір вени, наявність під час ендоскопії червоних знаків. Хоча кровотечі з варикозно розширених вен стравоходу зупиняються самостійно у майже 40% хворих, та, незважаючи на досягнення в лікуванні за останні 10 років, вони асоціюються із смертністю щонайменше 20% в межах 6 тижнів. Пацієнтів з ГПВТ >20 мм рт. ст. (виміряним протягом 24 год. після варикозної кровотечі) було визнано такими, що мають вищий ризик раннього рецидиву кровотечі (повторна кровотеча упродовж першого тижня після надходження) або невдалої зупинки кровотечі (83% на противагу 29%) і вищу однорічну смертність (64% на противагу 20%) порівняно з пацієнтами з нижчим тиском. Пізні рецидиви кровотеч стаються у близько 60% нелікованих хворих, в основному упродовж 1–2 років після первинної кровотечі.
Портальний тиск, розмір ВРВ і товщина його стінки пов’язані між собою законом Лапласа — напруження стінки вени (Т) прямо пропорційне тиску всередині судини (Р) і його радіусу (R) та обернено пропорційне товщині судинної стінки (W): Т = Р × R/W. Відповідно, дилятація вузла з витонченням його стінки є основним чинником, який спричиняє напруження стінки і розрив варикса. При однаковому тиску судина більшого діаметра розірветься, тоді як судина меншого діаметра — ні. Окрім діаметра судини, іншим чинником розтягнення варикозної стінки є тиск усередині ВРВ, який безпосередньо пов’язаний з ГПВТ. Таким чином, зниження ГПВТ повинно зумовлювати зменшення розтягнення стінки варикозної судини і, відповідно, зменшення ризику розриву. Справді, варикозна кровотеча не настає, коли ГПВТ знижується до <12 мм рт. ст. Також доведено, що ризик повторної кровотечі значно зменшується при зниженні ГПВТ більш ніж на 20% від початкового рівня. Хворі, у яких ГПВТ знижується до <12 мм рт. ст або хоча б на 20% від початкового рівня (“HVPG responders”), не тільки мають меншу ймовірність розвитку повторних варикозних кровотеч, але й менший ризик виникнення асциту, спонтанного бактеріального перитоніту і смерті.
Таблиця 2. Класифікація важкості цирозу за Child-Pugh
| Пункти* | |||
| 1 | 2 | 3 | |
| Енцефалопатія | Немає | Рівень 1–2 (індукована) | Рівень 3–4 (хронічна) |
| Асцит | Немає | Незначний/помірний (реагує на діуретики) | Напружений (резистентний до діуретиків) |
| Білірубін (мг/дл) | <2 | 2–3 | >3 |
| Альбумін (г/дл) | >3,5 | 2,3–3,5 | <2,8 |
| Протромбіновий час (PT), подовження (с) або міжнародне нормалізоване відношення (INR) | <4 <1,7 | 4–6 1,7–2,3 | >6 >2,3 |
*5–6 пунктів: Child A. 7–9 пунктів: Child В. 10–15 пунктів: Child С.
Кровотечение желудочно-кишечное — симптомы и лечение
В первую очередь на возникшее кровотечение реагируют надпочечники. Они начинают «выбрасывать» в кровеносное русло специальные вещества — катехоламины. Такая реакция возникает в первые сутки после кровотечения. Она приводит к спазму периферических сосудов и компенсации гемодинамики — нормализации давления и скорости кровотока в системе кровообращения. Благодаря этому сохраняется достаточное кровоснабжение жизненно важных органов — сердца, мозга и печени.
На 2-3 сутки после кровотечения в сосудистое русло «выходит» тканевая жидкость. Она делает кровь менее вязкой, способствует выведению эритроцитов из «депо», в частности из селезёнки, и попаданию их в кровяное русло. Таким образом организм при небольшом кратковременном кровотечении создаёт условия для быстрого восстановления изначального объёма и качества циркулирующей крови. Но при этом на тканевом уровне постепенно развиваются обменные нарушения, так как тканевая жидкость — это жидкая питательная среда, благодаря которой происходит обмен веществ между клетками и тканями с одной стороны и кровью — с другой.
На 4-5 день после кровотечения костный мозг начинает активно восполнять недостающее количество потерянных элементов крови, в частности эритроциты и тромбоциты. Если кровотечение больше не возникало, уровень эритроцитов нормализуется через 2-3 недели.
На самочувствие пациента и клиническую картину желудочно-кишечного кровотечения влияют объём и скорость кровопотери. От них зависит, насколько полноценно и быстро механизмы компенсации и приспособления организма восстановят объём циркулирующей крови.
В случае самостоятельной остановки кровотечения и потери не больше 10 % от исходного объёма крови состояние организма, как правило, легко стабилизируется за счёт вышеописанных процессов.
В первые часы после значительной кровопотери концентрация гемоглобина и число эритроцитов также остаются в пределах нормы. Их снижение начинается только к концу первых суток, что при определённых минимальных пороговых показателях требует переливания донорской крови. Помимо этого, в крови увеличивается концентрация продуктов обмена — мочевины и креатинина, из-за чего ко всему прочему добавляется интоксикация. В совокупности эти состояния приводят к нарастающей полиорганной недостаточности. При отсутствии квалифицированной медицинской помощи человек в таком состоянии, как правило, погибает.
Отдельно нужно отметить незначительные часто повторяющиеся кровотечения, которые отличаются крайне незначительными кровопотерями (20-50 мл). Такое возможно при хроническом геморрое, тех же язвах (если они повреждают мелкий сосуд) и иных патологиях, в том числе онкологических. Опасность кроется в том, что на фоне небольших повторяющихся кровопотерь наш организм не успевает восполнять прогрессирующую нехватку железа и/или витамина B12, необходимых для продукции гемоглобина. Таким образом, при частых малых кровопотерях у человека постепенно формируется лёгкая степень анемии, которая со временем может перерасти в более тяжёлую форму. Риск развития такого сценария высок у людей, которые не уделяют своему здоровью должного внимания, боятся медицинского обследования или, зная о своих болезнях, по разным причинам отказываются их лечить [2][4][7].
ВАРИКОЗНЕ РОЗШИРЕННЯ ВЕН ШЛУНКА
Варикозне розширення вен шлунка менш поширене, ніж стравохідний варикоз, і наявне у 5–33% хворих з портальною гіпертензією, з частотою кровотеч близько 25% протягом 2-х років та з більшою кількістю кровотеч з вен дна шлунка (Sarin S. K. et al., 1992). Фактори ризику шлункових варикозних кровотеч включають розмір вузлів у дні шлунка (великі > середні > малі, визначені як >10 мм, 5–10 мм і <� 5 мм відповідно), клас цирозу за Child (C > B > A) і наявність червоних знаків на поверхні варикса під час ендоскопії (Kim T. et al., 1999). Шлункові ВРВ, як правило, поділяють на основі їх співвідношення зі стравохідними венами, а також за їх локалізацією у шлунку. Гастроезофагеальні варикси (ГЕВ) є продовженням варикозних вен стравоходу і поділяються на 2 типи. Найчастіше трапляються варикси типу 1 (ГЕВ 1 – GOV1), які поширюються вздовж малої кривини. Вони вважаються продовженням ВРВ стравоходу і повинні лікуватися так само. Шлункові ВРВ типу 2 (ГЕВ 2) поширюються вздовж дна і мають тенденцію бути довшими і звивистішими. Ізольовані шлункові ВРВ (ІШВ) виявляються за відсутності варикозу у стравоході і також поділяються на 2 типи. ВРВ типу 1 (ІШВ 1 – IGV1) локалізовані у дні і частіше бувають звивистими і комплексними, а ВРВ типу 2 (ІШВ 2) містяться у тілі, антрумі та навколо воротаря. Наявність ВРВ дна шлунка потребує виключення діагнозу тромбозу селезінкової вени.
ПОРТАЛЬНА ГАСТРОПАТІЯ
Портальна гіпертензивна гастропатія є наслідком портальної гіпертензії з дилятацією капілярів і розкриттям внутрішньослизових судинних шунтів. Вона вказує на важкість ураження печінки, але може бути й у хворих з підпечінковим портальним блоком. При морфологічному дослідженні відзначають дилятацію судин як слизової, так і підслизового шару. Крововиливам у слизову сприяє тромбоцитопенія, яка розвивається при цирозі печінки. При портальній гастропатії збільшується чутливість слизової оболонки до різних ушкоджуючих чинників: аспірину, алкоголю тощо. Відзначають регрес портальної гастропатії після транспечінкового портосистемного шунтування і погіршення — після склеротерапії або лігування варикозно розширених вен стравоходу.
New Italian Endoscopic Club (1997) рекомендує встановлювати діагноз портальної гастропатії на підставі чотирьох ознак: мозаїчний вигляд слизової, ураження у вигляді червоних крапок (легкий ступінь), вишнево-червоні плями, чорно-коричневі плями (важкий ступінь). Уражене насамперед тіло шлунка.
Вважають, що портальна гастропатія може траплятися і в пацієнтів з артеріальною гіпертензією без ПГ, а також в осіб без інших захворювань, її прояви можуть прогресувати, а також повністю зникати. Кровотечі, зумовлені портальною гастропатією, рідко бувають масивними, частіше вона призводить до хронічної крововтрати.