Анатомия и физиология
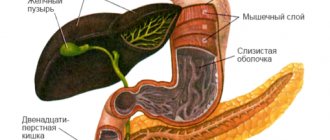
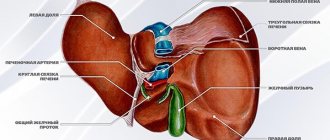
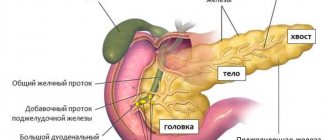
Орган с серовато-розовой поверхностью имеет продолговатую трехгранно-призматическую форму. Поджелудочная железа является одной из самых крупных, уступая размерами лишь печени. Ее вес составляет 70-80 г, длина равна 16-22 см, ширина 3-9 см, толщина 2-3 см. В железе различают 3 части. Самая широкая – головка. Подобно подкове она охватывается 12-перстной кишкой.
Далее, суживаясь, головка переходит в тело железы, а тело в еще более узкий хвост. Все эти части плавно сменяют друг друга справа налево: головка, тело, хвост. Четких анатомических ориентиров между ними нет, если не считать шейки поджелудочной железы, небольшого сужения между головкой и телом.
Поджелудочная железа прилежит к задней поверхности брюшной стенки на уровне JX-XII грудных и I-II поясничных позвонков. На переднюю брюшную стенку она проецируется на 5-10 см выше пупка. 1/3 ее располагается справа от срединной вертикальной линии позвоночника, а остальные 2/3 слева от этой линии. При этом железа расположена экстраперитонеально, за пределами брюшной полости.
Подобно другим железистым органам панкреас представлена стромой и паренхимой. Строма – это соединительнотканный каркас. В основном его функцию выполняет брюшина, покрывающая переднюю и нижнюю поверхность железы. Вся железа покрыта тонкой, едва различимой, капсулой. От нее в толщу железы отходят перегородки или трабекулы, которые делят паренхиму на дольки.
Паренхима – это функциональная ткань железы. Паренхиматозные дольки состоят из ацинусов, мельчайших округлых скоплений клеток-панкреатоцитов. Эти клетки секретируют сок поджелудочной железы или панкреатический сок. Каждый ацинус снабжен мелким выводным протоком, по которому оттекает сок.
Мелкие протоки объединяются в более крупные. А самый крупный – главный или вирсунгов проток, тянется через хвост, тело, и головку железы, и отрывается на 12-перстной кишке отверстием на возвышении, большом дуоденальном или фатеровом сосочке.
Предварительно он сливается с холедохом, общим желчным протоком. Выходное отверстие на фатеровом сосочке снабжено мышечным клапаном или сфинкетером Одди, регулирующим выброс желчи и панкреатического сока в 12-перстную кишку. Хотя у некоторых лиц холедох и вирсунгов проток на фатеровом соске имеют разные отверстия.
Кроме главного протока в головке железы имеется еще добавочный или санториниев проток. И здесь тоже возможны варианты. У большинства главный и добавочный протоки сливаются в толще головки. Но у некоторых санториниев проток открывается в 12-перстную кишку самостоятельно отверстием на малом дуоденальном сосочке. А бывает так, что санториниев проток отсутствует, и это является нормой.
Поджелудочная железа в течение суток выделяет 1,5-2 л сока. Кроме воды он содержит соли натрия и калия, а также бикарбонаты для ощелачивания кислого содержимого 12-перстной кишки, поступившего из желудка.
Но основными компонентами панкреатического сока являются ферменты – трипсин и химотрипсин, амилаза, липаза, нуклеаза, и многие другие. Эти ферменты осуществляют расщепление белков (протеолиз), жиров (липолиз), сахаров (гликолиз). Под действием этих ферментов крупномолекулярные пищевые соединения распадаются на промежуточные продукты.
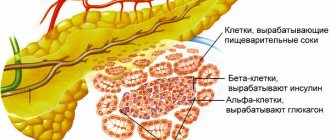
Секретирующие сок ацинусы с протоками – это внешнесекреторный или экзокринный аппарат железы. На его долю приходится основная часть паренхимы. В железе есть и внутрисекреторный или эндокринный аппарат. Это островки Лангерганса, мелкие скопления клеток преимущественно в хвосте железы.
Островки состоят из разных типов клеток: альфа, бета, дельта. Эти клетки секретируют гормоны: инсулин, глюкагон, грелин, соматостатин. Гормоны регулируют обмен углеводов, секрецию других пищеварительных желез, возбуждают аппетит. В отличие от экзокринной части железы ее островковый эндокринный аппарат не имеет выводных протоков. Гормоны выделяются непосредственно в кровь.
Пищеварение.
Также по теме:
ИНСУЛИН
Часть железы, участвующая в пищеварении, через главный проток секретирует панкреатический сок прямо в двенадцатиперстную кишку. Он содержит 4 необходимых для пищеварения фермента: амилазу, превращающую крахмал в сахар; трипсин и химотрипсин – протеолитические (расщепляющие белок) ферменты; липазу, которая расщепляет жиры; и реннин, створаживающий молоко. Таким образом, сок поджелудочной железы играет важную роль в переваривании основных питательных веществ.
Заболевания и симптомы
Воспаление поджелудочной железы, панкреатит, в основном развивается на фоне других заболеваний пищеварительной системы – холециститов, гастродуоденитов. Заболевание протекает остро и хронически. В основе воспалительного процесса лежит механизм самопереваривания железы. В норме протеолитические ферменты (трипсин, химотрипсин) секретируются в неактивном состоянии, и активируются в просвете 12-перстнй кишки.
При заболеваниях ЖКТ (желудочно-кишечного тракта) часто происходит рефлюкс, заброс содержимого 12-перстной кишки в панкреатические протоки. Активированные в 12-перстной кишке протеолитические ферменты переваривают собственную железу.
Специфический признак панкреатита – опоясывающая боль в верхней части живота. При хронических панкреатитах она ноющая, распирающая. Пациенты жалуются на ухудшение аппетита, тошноту после приема пищи. Недостаточное поступление панкреатического сока приводит к брожению в кишечнике.
Это проявляется метеоризмом, схваткообразными разлитыми болями в животе, частым зловонным жидким стулом (панкреатогенные поносы). Из-за болей и пищеварительных расстройств пациенты сами ограничивают прием пищи. И это усугубляет имеющееся исхудание.
Боль при остром панкреатите жгучая, интенсивная. Характерная связь боли с обильным приемом жирной, жареной пищи, алкоголя. Поэтому панкреатиты часто заявляют о себе после праздничных застолий. Голод в сочетании с воздействием холода на верхнюю часть живота в проекции поджелудочной железы приводит к улучшению самочувствия. При наклоне туловища вперед боль тоже уменьшается.
Боль сопровождается интоксикацией, повышением температуры до 38° С, обезвоживанием из-за многократной рвоты и диареи. Из железистой паренхимы в кровь поступают в большом количестве ферменты. Это может привести к шоковому состоянию из-за угнетения сердечной деятельности (ферментативный шок).
Рак поджелудочной железы тоже протекает тяжело с интенсивными болями, снижением массы тела и прогрессирующим ухудшением состояния при вторичном поражении других органов.
Что касается эндокринного аппарата, то здесь самыми уязвимыми являются бета-клетки, секретирующие инсулин. Дефицит этого гормона приводит к сахарному диабету с гипергликемией (высоким уровнем глюкозы в крови) и другими видами обменных нарушений.
Симптоматика заболевания
В начале формирования камней присутствует симптоматика панкреатита. О наличии камней говорят следующие признаки:
- опоясывающая живот и отдающая в спину либо под лопатку жгучая боль, возникающая после приема алкоголя или употребления очень жирной пищи;
- тошнота, рвота желчью;
- эпизодически – присутствие большого объема жира в каловых массах.
По мере прогрессирования заболевания ухудшается секреторная и ферментативная функция железы, появляется некроз ее тканей. При пальпации эпигастрия больной ощущает сильную боль, у него присутствует слюнотечение. При попадании камня в общий проток возможно развитие желтухи. У большинства пациентов на этом этапе обнаруживается сахарный диабет.
Работа поджелудочной железы и ее регуляция
Поджелудочная железа — жизневажный орган
Как и любой другой орган в организме человека, поджелудочная железа, вернее ее работа, контролируется центральной нервной системой. Из проведенных учеными исследований можно отметить, что при любом появлении привлекательного запаха пищи, особенно если человек голоден, работа железы сразу же активизируется. Отдельно стоит сказать, что за активизацию работы этой железы отвечает блуждающий нерв, а за снижение активности – симпатический.
Аберрантная поджелудочная железа: диагностика и терапевтическая тактика. Клиническое наблюдение
Аберрантная поджелудочная железа – результат нарушения эмбриогенеза. Клиническая картина может быть разнообразной и маскироваться под видом различных заболеваний. Сложность диагностики заставляет специалистов более тщательно подходить к обследованию пациентов. Одним из факторов риска рака поджелудочной железы считается хронический рецидивирующий панкреатит. Табакокурение и алкоголь существенно увеличивают риск проявления аберрантной поджелудочной железы. В статье приведен клинический пример диагностики аберрантной поджелудочной железы у мужчины 37 лет спустя десять лет от начала проявлений хронического панкреатита. Заболевание началось с эпизода острого панкреатита, панкреонекроза, который был купирован в стационаре. Спустя четыре года были диагностированы псевдокисты поджелудочной железы. Однако только через шесть лет диагностировали кистозную дегенерацию стенок желудка и дуоденальную дегенерацию. Благодаря верно установленному диагнозу удалось назначить консервативное лечение и избежать операции.
Рис. 1. Компьютерная томография с внутривенным болюсным контрастированием. Панкреатическая фаза. А – утолщенные стенки желудка. Б – увеличенные размеры желудка, обильное содержимое внутри – признаки гастростаза
Рис. 2. Эндоскопическая ультрасонография. А – кистозная дегенерация стенки тела желудка
Рис. 3. Компьютерная томография с контрастированием в 2022 г. Панкреатическая фаза. А – уменьшение толщины стенок желудка. Б – уменьшение размеров желудка по сравнению с исследованием 2022 г., формирование складок слизистой оболочки желудка
Введение
Аберрантная поджелудочная железа (ПЖ) является одним из редких пороков развития, выражается гетеротопией ткани ПЖ в другие органы, такие как желудок, двенадцатиперстная кишка (ДПК), тонкая и толстая кишка, печень, желчный пузырь [1].
ПЖ начинает формироваться на пятой неделе внутриутробного периода развития из дорсального и вентрального первичных выпячиваний, происходящих соответственно из ДПК и закладки печени [2]. К седьмой неделе оба зачатка сливаются. Из вентрального зачатка формируются нижняя часть головки ПЖ и ее крючковидный отросток, из дорсального – тело и верхняя часть головки железы [3]. Аберрантная железа не имеет анатомической или сосудистой связи с основной. В стенке желудка эктопия ПЖ встречается в 25–60% случаев, в стенке ДПК – в 25–35% случаев [4].
В 1970 г. французские ученые F. Potet и N. Duclert впервые описали аберрантную ПЖ [5]. Среди западного населения распространенность аберрантной ПЖ достигает 10%, у азиатов и африканцев частота меньше – 1–2% [6].
Клинически заболевание может проявиться при воспалительных и некротических изменениях в добавочной ПЖ и окружающих тканях. Аберрантная ПЖ может стать причиной кишечной непроходимости, панкреатита и панкреонекроза, язвы желудка, механической желтухи, развившейся вследствие сдавления желчных протоков.
Более 95% пациентов с аберрантной ПЖ не имеют симптомов. Выявление заболевания – случайная находка при проведении эзофагогастродуоденоскопии (ЭГДС), компьютерной томографии (КТ), магнитно-резонансной холангиопанкреатографии, эндоскопической ультрасонографии (ЭУС).
Патогенез до конца не ясен, однако считается, что из-за наличия дополнительного протока ПЖ с меньшим диаметром, чем обусловлено неадекватное дренирование сока ПЖ, вызывается обструкция потока. Повышенное внутрипротоковое давление и растяжение панкреатического протока способны привести к панкреатиту эктопированной ПЖ [6].
Дифференциальный диагноз сложен и является ключевым звеном, направленным на разработку адекватной тактики лечения пациентов. Проводится дифференциальная диагностика с новообразованиями органов гепатобилиарного тракта, врожденными аномалиями, воспалительными заболеваниями. К основным симптомам относятся боли в верхних отделах живота, тошнота, рвота, снижение массы тела, анемия, нарушение электролитного обмена [7]. Известно, что в эктопированной железе может развиться и рак, и нейроэндокринные опухоли [8, 9]. С помощью рентгенологических, ультразвуковых и эндоскопических методов исследования с высокой долей вероятности можно установить правильный диагноз.
Одним из важнейших методов диагностики является ЭУС, при необходимости используются эластография и контрастное усиление. Оценивается коэффициент эластичности, среднее значение которого может дифференцировать воспалительные и опухолевые поражения ПЖ. Использование ЭУС-контрастного усиления позволяет оценить стенку, перегородки и нодулярный компонент кистозных образований, что расширяет возможности дифференциальной диагностики кистозных образований ПЖ [10].
В отсутствие клинических проявлений данная патология требует только динамического наблюдения [3].
При наличии клинических проявлений рассматривают терапевтический и хирургический методы лечения. Терапевтическое лечение основано на отказе от алкоголя, табакокурения, а также на принципах, аналогичных принципам лечения хронического панкреатита. Применяется медикаментозная терапия анальгетиками, ингибиторами протонной помпы, нестероидными противовоспалительными препаратами, синтетическими аналогами соматостатина. При необходимости проводится нутритивная поддержка в виде парентерального и (или) зондового питания [11].
Если терапевтическое лечение не представляется возможным, основным методом является хирургический [12]. Однако вопрос выбора хирургического лечения сложен. В зависимости от болевого синдрома, степени сужения просвета ДПК и поражения ПЖ применяется определенный способ хирургического лечения: панкреатодуоденальная резекция, циркулярная резекция нисходящей части ДПК и резекция головки ПЖ, резекция нисходящей части ДПК с дуоденопластикой и реимплантацией большого сосочка ДПК, панкреассохраняющая субтотальная резекция двенадцатиперстной кишки, резекция головки ПЖ (операции Бегера, Фрея, бернский вариант резекции) и паллиативные операции [13]. Чаще методом выбора становится панкреатодуоденальная резекция. При эктопии в желудок и другие органы может также накладываться панкреато- или цистоэнтероанастомоз, выполняться резекция желудка [11]. Тем не менее в отсутствие клинических проявлений эктопии ПЖ в желудок рекомендуется динамическое наблюдение [3].
Клиническое наблюдение
В декабре 2022 г. в Московский клинический научно-практический центр (МКНЦ) им. А.С. Логинова был госпитализирован пациент Р. в возрасте 37 лет с жалобами на боли ноющего характера в эпигастрии и левом подреберье, усиливающиеся после приема пищи, чувство переполнения желудка, периодически – тошноту, рвоту съеденной пищей, постоянный кислый привкус во рту, общую слабость, шум в ушах, снижение массы тела на 10 кг за шесть месяцев.
Злоупотреблял легким алкоголем ежедневно в течение десяти лет. Последние шесть месяцев алкоголь не употреблял. Выкуривал пачку сигарет в день.
Из анамнеза известно, что в феврале 2010 г. на фоне погрешности в диете впервые появились интенсивные боли в верхних отделах живота, тошнота, рвота съеденной пищей. По СМП госпитализирован в стационар, где диагностирован острый флегмонозный калькулезный холецистит, панкреонекроз. Выполнена лапаротомия: холецистэктомия, дренирование брюшной полости. Проведена комплексная терапия, направленная на подавление патологических процессов и предупреждение осложнений.
Впоследствии отмечалось хорошее самочувствие. В октябре 2014 г. – закрытая травма живота с разрывом селезенки. Выполнены спленэктомия, дренирование поддиафрагмального абсцесса слева. Тогда же, по данным мультиспиральной компьютерной томографии (МСКТ) с контрастированием, выявлена постнекротическая киста тела – хвоста ПЖ размером 70 × 35 × 47 мм. В дальнейшем пациент отмечал периодические интенсивные боли в верхних отделах живота, в связи с чем неоднократно проходил стационарное лечение с диагнозом обострения хронического панкреатита. МСКТ с контрастированием от 2016 г. показала признаки псевдотуморозного панкреатита. Расширение вирсунгова протока до 6 мм, уменьшение размера кисты до 60 × 10 мм. С сентября 2022 г. беспокоили интенсивные боли в верхних отделах живота, тошнота, рвота. Дважды был госпитализирован в стационар по месту жительства. Последняя госпитализация – в октябре 2022 г.
В клиническом анализе крови отмечалась анемия – эритроциты – 3,54 × 106/мкл, гемоглобин – 101 г/л, лейкоцитоз – 13,6 × 109/л, тромбоцитоз – 636 × 103/мкл, гиперамилаземия – 452 ЕД/л, повышение креатинина до 127 мкмоль/л. По данным ультразвукового исследования (УЗИ), КТ без контрастирования, признаки острого панкреатита. После проведенного консервативного лечения пациент выписан с незначительной положительной динамикой: болевой синдром купирован, сохранялась тошнота. Однако в декабре 2022 г. вновь появились указанные выше симптомы, в связи с чем пациент был направлен на лечение в МКНЦ им. А.С. Логинова.
При объективном осмотре: состояние удовлетворительное, питание пониженное – индекс массы тела (ИМТ) – 16,7 кг/м2. При физикальном обследовании не выявлено значимых нарушений со стороны сердечно-сосудистой, дыхательной и мочевыделительной систем. Пульс 68 в минуту, удовлетворительного наполнения, ритм правильный, артериальное давление 110/70 мм рт. ст.
В клиническом анализе крови – признаки анемии (гемоглобин – 9,4 г/дл), тромбоцитоз (716 × 103 мкл).
Результаты биохимического анализа крови: гиперамилаземия (331 ЕД/л), гипоальбуминемия (27,3 г/л), электролитные нарушения (калий – 3,47 ммоль/л, хлор – 95,2 ммоль/л), железо – 2,7 мкмоль/л.
Кроме того, выявлены маркеры воспаления (С-реактивный белок – 78,7 мг/л, скорость оседания эритроцитов – 94 мм/ч, лейкоциты – 14,52 × 109/л, палочкоядерные нейтрофилы – 11%).
Диастаза мочи – 2701,1 ЕД/л.
Результаты УЗИ: гастростаз (объем примерно 200–300 мл), стенки желудка инфильтрированы, утолщены до 10 мм. Контуры ПЖ нечеткие, неровные, границы плохо дифференцируются от окружающих тканей. Выявлены внутри- и парапанкреатические жидкостные скопления размерами от 10 до 62 × 12 мм. Парапанкреатическая клетчатка инфильтрирована. Селезеночная вена тромбирована, кровоток не лоцирован. Тонкие прослойки жидкости в брюшной полости. Заключение: УЗ-признаки тромбоза селезеночной вены, реканализованного тромбоза воротной вены, выраженных изменений поджелудочной железы с формированием внутри- и парапанкреатических жидкостных скоплений, инфильтрации парапанкреатической клетчатки, незначительного выпота в брюшной полости, гастростаза, с утолщением стенок желудка.
Для визуальной оценки органов верхних отделов пищеварительного тракта, подтверждения гастростаза, оценки проходимости выполнена ЭГДС, по данным которой выявлены признаки эрозивного эзофагита, инфильтративного поражения желудка, деформация выходного отдела желудка, гастростаз, хронический дуоденит с выраженной лимфоидной инфильтрацией, в области бульбодуоденального перехода слизистая резко отечна с формированием циркулярного сужения, не препятствующего проведению эндоскопа диаметром 0,9 см, – признаки дуоденальной дистрофии.
Заключение на основании морфологического исследования: хронический неактивный гастрит с фовеолярной гиперплазией поверхностного эпителия.
С учетом тошноты, периодической рвоты съеденной пищей пациенту была выполнена установка назоинтестинального зонда для питания.
В результате проведенных исследований выявлены признаки перенесенного панкреонекроза, кист в проекции ПЖ, гастростаза с возможным инфильтративным поражением желудка, также косвенные признаки нарушения эвакуации из желудка.
В сложившейся ситуации возникла необходимость проведения дифференциального диагноза между воспалительным и опухолевым поражением гастропанкреатодуоденальной зоны.
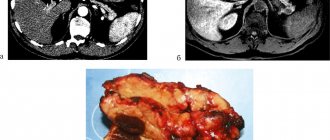
При проведении МСКТ с внутривенным болюсным контрастированием обращало на себя внимание наличие минимального количества жидкости поддиафрагмально слева и вдоль левой доли печени. Желудок заполнен жидкостью и содержимым, полностью не расправлен. От средней трети тела желудка с переходом на антральный и пилорический отделы отмечается неравномерное циркулярное утолщение стенки желудка до 42 мм. На этом фоне в стенках желудка и луковицы ДПК визуализируются жидкостные включения размерами до 18 × 62 мм и до 6 мм соответственно. Контуры желудка неровные, слабое накопление контрастного вещества, дифференцировка слоев нарушена. Образование инфильтрирует перешеек ПЖ, на этом уровне ее паренхима не прослеживается. Парагастральная клетчатка инфильтрирована на всем протяжении, инфильтрация прилежит к левой доле печени, распространяется на гепатодуоденальную связку и брыжейку тонкой кишки. Вдоль левой желудочной артерии и общей печеночной артерии – цепочка вторично измененных лимфоузлов до 20 мм, в гепатодуоденальной связке и воротах печени до 9 мм, мезентериальные до 9 мм. Воротная вена, верхняя брыжеечная вена и селезеночная вена компримированы на уровне конфлюенса. В большом сальнике визуализируются венозные коллатерали до 5 мм. Внутри- и внепеченочные желчные протоки расширены: долевые до 11 мм, секторальные до 9 мм, сегментарные до 7 мм, холедох до 13 мм, в интрапанкреатическом отделе компримирован инфильтратом. Поджелудочная железа дольчатого строения, правильно расположена. Размеры: головка – 30 мм, тело – 16 мм, хвост – 15 мм, плотность не изменена. Контуры железы четкие, неровные, на уровне инфильтрата перешейка железы контуры не прослеживаются. В головке ПЖ визуализируется кистозная структура размером 14 × 7 мм. Создается впечатление о наличии связи с главным панкреатическим протоком (ГПП). ГПП расширен до 7 мм с блоком на уровне перешейка ПЖ. Парапанкреатическая и парадуоденальная клетчатка отечна.
Заключение: утолщение стенок средней трети тела желудка с переходом на антральный и пилорический отделы (дифференцировать лимфому желудка и рак/новообразование, воспалительные изменения менее вероятны, рекомендовано дообследование), с выраженной инфильтрацией окружающей клетчатки и вовлечением перешейка ПЖ, развитием панкреатической и билиарной гипертензии, вторичной внутрибрюшной лимфаденопатии. Признаки перенесенного деструктивного панкреатита (кистозную структуру в головке ПЖ дифференцировать между псевдокистой и внутрипротоковой муцинозной неоплазией ПЖ бокового типа), дуоденальной дегенерации (рис. 1).
Для оценки слоев стенок пищевода, желудка, ДПК и получения цитологического материала проведена ЭУС.
Результаты исследования показали, что стенка кардиального отдела желудка структурная, пятислойная, дифференциация слоев не нарушена. От средней трети тела желудка по малой кривизне, задней стенке, в антральном отделе циркулярно стенка желудка утолщена, максимально до 2,5 см. В антральном отделе отсутствует дифференциация слизистого и подслизистого слоев, внутренний контур ровный, мышечный слой прослеживается. В теле в структуре стенки определяются множественные кистозные новообразования с эхогенным содержимым, разделенные гиперэхогенными перегородками (рис. 2). Для исключения атипии проведена тонкоигольная пункция стенки, получено жидкое содержимое. Заключение: деформация просвета желудка за счет циркулярного утолщения стенки антрального отдела желудка, кистозной дегенерации стенки тела желудка.
Исследование содержимого кистозного образования стенки желудка: в препарате все поля зрения покрывают нейтрофилы, небольшое количество гистиоцитов и лимфоидных клеток, аморфный и клеточный детрит. Другого клеточного состава нет. Заключение: цитологическая картина воспалительных изменений. Элементов злокачественного новообразования в предоставленном материале не обнаружено.
В результате проведенных исследований был установлен диагноз:
- основной: хронический панкреатит первой стадии, средней степени тяжести по классификации M-ANNHEIM: C (13 баллов). Панкреонекроз в 2010 г.;
- осложнения: формирующиеся постнекротические кисты поджелудочной железы. Кистозная дегенерация стенок желудка. Дуоденальная дегенерация. Белково-энергетическая недостаточность 2-й степени. Дефицит циркулирующего белка 1-й степени. Гипохромная анемия среднетяжелой степени. Дефицит массы тела;
- сопутствующий: желчнокаменная болезнь. Холецистэктомия в 2010 г. Гастроэзофагеальная рефлюксная болезнь в стадии эрозивного эзофагита. Спленэктомия по поводу травмы в 2014 г.
В отделении пациенту проводилась противовоспалительная, ферментозаместительная, антисекреторная, инфузионная, антибактериальная терапия, нутритивная поддержка (Нутрикомп Пептид ликвид, альбумин, раствор Рингера, Аминостерил H-Гепа, липофундин) с положительным эффектом, зонд был удален на седьмые сутки от начала лечения. Пациент смог питаться самостоятельно, не испытывая тошноты и рвоты.
На фоне проведенного лечения вес пациента стабилизировался, боли уменьшились.
При контроле лабораторных показателей отмечалось повышение уровня гемоглобина до 11,1 г/дл, постепенное снижение уровня тромбоцитов (687 × 103 мкл). В биохимическом анализе крови – нормализация показателей электролитов (калий – 3,7 ммоль/л, хлор – 99,4 ммоль/л, железо – 16,4 мкмоль/л), сохранялась гиперамилаземия (497 ЕД/л).
Снизились маркеры воспаления (С-реактивный белок – 35,7 мг/л, скорость оседания эритроцитов – 84 мм/ч, лейкоциты – 10 × 109/л, палочкоядерные нейтрофилы – 6%).
Диастаза мочи уменьшилась до 1888,6 ЕД/л.
Пациент выписан на девятые сутки от начала консервативного лечения.
Больному рекомендовано продолжить лечение в амбулаторных условиях: прием полиферментных препаратов в минимикросферах или минитаблетках, пробиотиков (водорастворимые формы), ингибиторов протонной помпы, нестероидных противовоспалительных препаратов, препаратов, содержащих калий, препаратов железа. Диета с повышенным содержанием белка.
При контрольном обследовании в 2022 г. (через год) пациент предъявлял жалобы на ноющие боли в верхних отделах живота, тяжесть, усиливающуюся после приема пищи. Больной прибавил в весе, ИМТ нормализовался и составил 21,6 кг/м2.
Данные лабораторных исследований: гиперамилаземия (201 ЕД/л), диастаза мочи – 768 ЕД/мл. Остальные показатели в пределах нормы.
По данным УЗИ, отмечалось отсутствие жидкостных скоплений в проекции ПЖ и свободной жидкости в брюшной полости.
При проведении ЭГДС отсутствовали признаки инфильтративного поражения желудка, гастростаза не выявлено. Однако сохранялись косвенные эндоскопические признаки желудочной и дуоденальной дегенерации: начиная с нижней трети тела желудка и дистальнее циркулярно утолщенные складки, при инсуффляции воздухом расправляются не полностью. Просвет сужен, но свободно проходим для эндоскопа диаметром 9 мм. В области бульбодуоденального перехода также циркулярно утолщенные складки, суживающие просвет.
Данные МСКТ: отсутствие выпота в брюшной полости, плевральных полостях и полости перикарда, утолщенные стенки желудка, уменьшение в размерах кист ПЖ, уменьшение лимфаденопатии, частичное восстановление структуры ПЖ. Кистозные структуры в головке ПЖ, вероятно, связаны с постнекротическими изменениями. Признаки дуоденальной дегенерации (рис. 3).
Таким образом, зафиксирована положительная динамика в виде уменьшения выраженности воспаления, что свидетельствует об эффективности проведенного лечения.
В течение последующего года на фоне соблюдения диеты и консервативного лечения самочувствие пациента улучшилось, наладилось питание, повысилось качество жизни.
Больной продолжает динамическое наблюдение в консультативно-диагностическом отделении МКНЦ им. А.С. Логинова и проходит регулярные обследования в условиях отделения патологии поджелудочной железы и желчевыводящих путей МКНЦ им. А.С. Логинова.
Обсуждение
Описанная клиническая ситуация показывает сложности в постановке диагноза и определении лечебной тактики.
Пациент длительное время злоупотреблял алкоголем. Перенес острый панкреатит, панкреонекроз. Через четыре года выявлена постнекротическая киста ПЖ, впоследствии – регулярные обострения хронического панкреатита. Регулярные обострения привели к нарушению дуоденальной проходимости и, как следствие, нарушению пассажа пищи, тошноте, рвоте, снижению массы тела и электролитным расстройствам. Клиническая картина схожа с таковой при наличии злокачественного новообразования, которое могло развиться на фоне хронического панкреатита [14, 15]. Однако результаты проведенного обследования не подтвердили диагноз злокачественного новообразования. Выявленная патология компенсирована благодаря терапевтическому лечению, что позволило избежать операции. В данном случае пациенту требуются регулярное обследование, при необходимости – коррекция терапии.
Для рассмотренного случая характерна двойная локализация эктопированной ПЖ: в желудок и ДПК. Несмотря на достаточно большое количество описаний дуоденальной локализации эктопированной ПЖ [4, 11] и аберрантной ПЖ в желудке [1], нам не удалось найти в литературе описания двойной локализации.
Способы лечения
Лечение на основе данных обследования назначает гастроэнтеролог. Сначала обычно показана консервативная терапия. С ее помощью снимают воспаление, справляются с отеком поджелудочной и протоков, нормализуют фосфорно-кальциевый обмен. Обязательно прописывается строгая диета, а также заместительная терапия ферментами. Если камни небольшие, они могут перейти в кишечник, а затем выйти из организма естественным путем.
На ранних стадиях консервативная терапия эффективна, но на поздних уже требуется операция по удалению камней. Она проводится эндоскопически, отличается легким послеоперационным периодом и быстрым восстановлением. Если же камней много и они крупные, то нужна классическая полостная операция. Она сложнее и тяжелее для пациента, но очень эффективна.
Если во время операции хирург видит, что в тканях железы присутствует диффузный кальциноз, то оперативно принимается решение об удалении органа.
Показания к операции:
- на протяжении нескольких лет в поджелудочной железе и/или ее протоке находятся камни, которые увеличиваются в размерах;
- у больного появились признаки истощения;
- прогрессирует воспалительный процесс;
- учащаются приступы мучительной резкой боли.
Самая популярная операция сегодня – ЭРХПГ, то есть эндоскопическая ретроградная холангиопанкреатография. Эндоскопом хирург извлекает мелкие камни. Если обнаруживаются камни большего размера, то проток немного надрезают, а образования проталкивают в кишечник.
Самая маленькая травматичность – у ДУВЛ – дистанционной ударно-волновой литотрипсии. Камни при этом превращают в порошок и извлекают эндоскопом либо позволяют им выйти естественным образом. Манипуляция проходит под общим наркозом. Пациента укладывают животом вниз, на излучатель, который измельчает камни.
Возможности профилактики
Сегодня наука не знает точных способов профилактики именно камнеобразования в протоке поджелудочной железы. Однако есть достаточно действенные меры. Главная из них – это диета. Нужно исключить жареную пищу, супы на крепких мясных бульонах, сложные овощные, мясные и фруктовые салаты, жирное. Все эти продукты провоцируют усиленную выработку желчи и одновременно задерживают ее отток, то есть образуют застой.
- Мясо можно есть только за обедом, в один прием. Вечером – овощи или рыба. Два раза в неделю полезно выпивать по бутылке минеральной воды – «Нарзан», «Боржоми» или др. Периодически вместо обычно чая пейте желчегонный и/или мочегонный отвар, настой фенхеля, алтея, отвар шиповника. Все это улучшает функцию выделительной системы.
- Есть нужно 4-5 раз в день малыми порциями. Это снижает вязкость желчи и предупреждает тем самым ее застой. Употребляйте больше воды – до 2 л в сутки.
- Эвакуацию желчи улучшает растительное масло, которое также стимулирует работу кишечника. Сливочное масло можно есть только в качестве добавки к гарниру или каше.
- Полностью нужно исключить тугоплавкие жиры – жирную рыбу и мясо, баранину, сало. Курицу и индейку надо готовить без кожи.
- Помимо диеты, надо отказаться от вредных привычек и больше двигаться. Особенно полезно плавать в бассейне. Если это невозможно, то хотя бы делайте небольшую 15-минутную гимнастику дома, разминая спину, шею, нижнюю часть торса, выполняя наклоны.