Удаление желудка — это не приговор
Рак желудка занимает пятое место в мире по числу диагностированных случаев онкологических заболеваний, второе — в структуре смертности от опухолей. Самым действенным методом лечения выступает полное либо частичное удаление органа. Операция сложная, требует тщательной подготовки, соблюдения правил длительного реабилитационного периода. Люди, которые придерживаются всех рекомендации врачей, имеют большой шанс на долгую, полноценную жизнь.
Правильная подготовка
Лапароскопическая операция по поводу рака желудка в Москве в Юсуповской больнице проводится после предварительного обследования пациента на возможные противопоказания к хирургическому вмешательству.
Подготовка включает:
- заключение лечащего врача;
- история болезни с указанием результатов проведенной ранее диагностики и лечения;
- электрокардиографии;
- гастроскопия;
- УЗИ;
- компьютерная томография;
- анализ крови (коагулограмма, клинический, биохимический и др.);
- рентген;
- заключения врача-анестезиолога.
Перед операцией проводится консультация с хирургом-онкологом. Врач может рекомендовать прекратить прием некоторых препаратов. Пациенту обязательно нужно будет отказаться от медикаментов, влияющих на свертываемость крови.
Хирургическое лечение рака
Основным методом терапии желудочных опухолей является их резекция. На начальных стадиях рака органа возможно эндоскопическое вмешательство, при котором удаляется только пораженный измененными клетками участок слизистой оболочки. Метод относится к малоинвазивным. Жизнь после удаления желудка таким способом быстро возвращается в привычное русло. Однако, показания к эндоскопическому вмешательству часто отсутствуют.
Диагноз рак желудка крайне редко подтверждают на ранних стадиях развития заболевания, большинству людей проводят радикальную операцию с частичным либо полным удалением органа.
Количество отсекаемых тканей зависит от размера опухоли, наличия метастаз. Во время вмешательства врачи выполняют реконструкцию пищеварительной системы. Например, замещают удаленную часть органа петлями тонкой кишки. Длится операция в среднем от двух до пяти часов. За ней следует продолжительный период реабилитации больного раком, направленный на восстановление полноценной работы пищеварительного тракта.
Дистальная резекция
Дистальная резекция подразумевает удаление ⅔ или ¾ части органа. Выполняется при поражении антрального отдела.
Дистальная резекция длится в 3 этапа:
- Ревизия органов брюшной полости, перевязка желудочных артерий, отсечение сальника, определение границ резекции.
- Непосредственно удаление части желудка: отграничение удаляемой и интактной зоны, отсечение пораженной части с использованием зажимов и электрокоагуляторов.
- Создание анастомоза, формирование культи, дренирование брюшной полости, ушивание раны.
В качестве обезболивания при дистальной резекции используют общий наркоз.
Особенности пищеварения после резекции
Вне зависимости от того, полностью либо частично удален орган, процесс пищеварения пациента кардинально меняется. Важно скорректировать рацион, работу ЖКТ таким образом, чтобы организм продолжал получать все необходимые вещества. Больной может не испытывать чувства голода. Питаться придется по времени, четко рассчитывая калории.
Распространенное постоперационное отклонение — демпинг-синдром. Под этим понятием врачи подразумевают ускоренный выброс содержимого культи органа в кишечник на фоне нарушений синтеза ферментов, нервной регуляции работы пищеварительных органов. Приступы, как правило, начинаются после еды, богатой углеводами.
Среди признаков демпинг-синдрома:
- резкая слабость;
- тошнота;
- избыточное потоотделение;
- рвота;
- срыгивание;
- учащенное сердцебиение;
- диарея;
- сонливость;
- головокружение.
У больных раком с удаленным желудком часто развивается непереносимость определенных веществ. Чаще:
- витамина B12;
- сахара;
- жиров;
- лактозы.
Недостаток витаминов в организме врачи компенсируют с помощью их введения. Пищевые нарушения корректируют соблюдением специального рациона питания.
Проксимальная резекция
Проксимальная резекция желудка при опухоли рекомендована при поражении области кардии, дна, или малой кривизны. Хирург рассекает кожу от мечевидного отростка до пупка, отсекает часть органа, при необходимости удаляет селезенку и хвост поджелудочной железы, затем перевязывает артерии с левой стороны.
При дальнейшем формировании культи ее проксимальный конец должен соответствовать дистальной части пищевода. Эзофагогастральный анастамоз погружают в желудок с формированием клапана, в культю устанавливают назогастральный зонд.
Две трети пациентов после проксимальной резекции сталкиваются с возникновением гастроэзофагеального рефлюкса. Затекание содержимого культи в пищевод приводит к язвенным изъязвлениям.
Еда в ранний послеоперационный период
Первые два дня после операции пациенту запрещен пероральный прием пищи. Больного кормят белковыми, аминокислотными растворами внутривенно. Состав коктейлей питательных веществ определяют, основываясь на результатах анализов крови. Задача послеоперационного питания — восполнить потребность организма в тех или иных веществах.
Затем рацион больного раком постепенно пополняется новыми продуктами. С третьего дня к еде добавляют:
- слизистый суп;
- пюре из рыбы, мяса, творога;
- суфле;
- яйца, сваренное всмятку;
- отвар шиповника;
- слабозаваренный чай;
- процеженный, чуть подслащенный компот.
На 5-6 день (если организм пациента хорошо переносит еду) питание дополняют омлетами, приготовленными на пару, перетертыми кашами, овощными пюре. Белковую составляющую рациона включают в каждый прием пищи. Продукты питания вводят только с разрешения лечащего врача, постоянно отслеживающего состояние больного раком, реакцию его организма на еду.
Объем порций наращивают постепенно. Начинают с 50 мл за один прием пищи (включая жидкость), доводят до 300-400 мл к десятому дню после операции.
Примерно через две недели пациента переводят на специальную диету, предполагающую полноценный высокобелковый рацион с добавлением нормального количества сложных углеводов, жиров.
Врачи-диетологи минимизируют потребление больным раком:
- «быстрых» углеводов;
- продуктов питания, раздражающих пищеварительный тракт;
- азотистых веществ;
- тугоплавких жиров, а также компонентов их расщепления (например, при жарке).
Полностью исключают из рациона продукты, вещества, стимулирующие отведение желчи, секрецию поджелудочной железы, кишечника. Пищу тщательно перетирают. Придерживаться такого режима питания надо 2-4 месяца.
Затем, если отсутствуют признаки оперированного желудка, допустимо отказаться от измельченной еды. Готовить твердую пищу. Определенные правила питания больному раком придется соблюдать минимум пять лет.
Реабилитация после операций на желудке
Оперативное вмешательство при лечении заболеваний желудка и 12-ти перстной кишки остается доминирующим методом лечения на данный момент. Чаще всего операция требуется при осложнениях язвенной болезни. Например таких как внутреннее кровотечение, прободение язвы. Так же хирургическое вмешательство необходимо при неэффективном консервативном лечении длительное время. А самое важное в этом то, что реабилитация после операций на желудке часто необходима для восстановления не только непосредственно желудку, но и многим сопутствующим органам и системам.
Но к сожалению, подобные вмешательства нередко не приносят облегчения больным. Более того, иногда последствия вмешательств могут быть более тяжелые, чем непосредственно само заболевание. Поэтому вопрос профилактики постоперационных осложнений становится ключевым.
Особенности восстановительного периода
Заживление после операции может длиться дольше чем при других заболеваниях…
После проведенной операции пациенты могут ощущать слабость и другие болезненные симптомы на протяжении 2 — 3 недель. Наблюдается тяжесть и распирание в подложечной области после еды. Так же могут быть затруднения с приемом пищи. После глубокой резекции человек редко может принять за один раз более 200 — 300 мл жидкой пищи. Так же после любого вида операций на ЖКТ у больного могут появиться сопутствующие функциональные нарушения. Например, такие как эзофагит, гастрит, нарушение моторики желудка. Изменяется функциональное состояние печени. В связи с большим количеством осложнений пациент может оставаться нетрудоспособным еще долгое время после операции.
Целями медицинской реабилитации после операций на желудке становятся два ключевых аспекта. Первый аспект — предупреждение послеоперационных расстройств. Второй — максимальное восстановление трудоспособности пациента.
Физические и природные факторы реабилитации
Реабилитация после операций на желудке должна проходить комплексно и иметь последовательный характер. Так как терапевтическое воздействие дает результат только в совокупности и сочетаемости факторов, как физических, так и природных. Ключевыми компонентами восстановительного лечения являются минеральные воды, грязевые аппликации, лечебная физкультура и массаж.
- Минеральные воды — позволяют снизить секреторную функцию желудка, а именно кислотность. Так же они улучшают моторную функцию, способствуют нормализации работы печени и поджелудочной железы. Рекомендуются углекислые, гидрокарбонатные натриево-калиевые воды. Например такие как «Ессентуки 4», «Московская», «Смирновская».
- Грязевые аппликации — так же способствуют нормализации моторной функции желудка. Наилучший эффект лечебные грязи оказывают на 3 — 4 неделе после оперативного вмешательства.
- Лечебная физкультура — целое медицинское направление, которое заслуживает того чтобы быть рассмотренным отдельно. Тем не менее, укажем ключевые положительные моменты, которые нам дает ЛФК. Лечебная физкультура оказывает общетонизирующее воздействие, способствует укреплению мышц брюшного пресса. Что в свою очередь приводит к ликвидации запоров, ускорению заживления послеоперационного рубца.
Общие принципы питания
Люди с удаленным желудком должны постоянно следить за тем, чтобы потреблять достаточно пищи для поддержания полноценной жизнедеятельности. Размер органа после операции существенно уменьшается (либо он полностью отсутствует), культя не может вмещать прежнее количество еды.
Чтобы избежать критической потери веса при лечении рака, нужно придерживаться следующих рекомендаций:
- есть 6-8 раз в день небольшими порциями с интервалом между едой 2-3 часа;
- тщательно прожевывать продукты;
- за столом во время еды сидеть, выпрямив спину;
- ужинать максимум за два часа до сна;
- отказаться от запивания пищи;
- растительные масла не подвергать термической обработке, использовать в питании как заправку;
- продукты добавлять в рацион по одному. Следить за реакцией на еду пищеварительного тракта. Если возникает тошнота, рвота, другая неприятная симптоматика — исключить новое блюдо из рациона;
- наполнить меню растительными, животными белками;
- пищу варить, запекать, готовить на пару;
- свести к минимуму количество острой, жирной, сладкой еды в рационе;
- выпивать не менее восьми стаканов жидкости в сутки за час до и после приема пищи.
Внимание: нельзя полностью отказываться от жиров, углеводов. Они снабжают организм больного раком необходимой энергией, поддерживают здоровье кожи, волос, ногтей.
Люди после операции по удалению желудка должны потреблять около 3000 ккал в день. Примерный баланс веществ врачами рекомендован следующий:
- 138 г белков;
- 115 г жиров;
- 390 г углеводов.
Врачи советуют пациентам с удаленным органом вести дневник потребления еды. В нем надо указывать съеденные продукты питания, их количество, время приема пищи, реакцию организма на компоненты рациона, калорийность. Это помогает контролировать массу тела, исключить вещества, провоцирующие признаки оперированного органа.
Внимание: после хирургического лечения рака надо взвешиваться каждые 3-5 суток. Если наблюдается снижение веса, следует обратиться к врачу-диетологу, скорректировать рацион.
После операции при раке важно полностью отказаться от вредных привычек, правильно выбирать продукты питания для пациента.
Рекомендованные продукты питания
В рацион больного раком после резекции части желудка врачи разрешают включать:
- супы на овощном, крупяном бульоне;
- подсушенный, цельнозерновой хлеб;
- постное мясо;
- несладкое бездрожжевое печенье;
- крупы (гречневую, рис, овсянку);
- яйца всмятку, омлет из белков;
- макароны, запеканки из них;
- рыбу нежирных сортов;
- овощи — свежие либо термически обработанные;
- растительные масла;
- сладкие фрукты, ягоды;
- орехи;
- кисломолочные продукты;
- свежую зелень измельчать, добавлять к любым блюдам.
Пить пациентам, которым удалили орган пищеварения, врачи разрешается пить:
- некрепкий чай;
- кофе с молоком;
- несладкие морсы, компоты;
- натуральные фруктовые, овощные, ягодные соки.
Если отсутствует выраженная симптоматика оперированного желудка, допустимо изредка есть закуски в виде нежирной сельди, домашнего мясного паштета, заливного из рыбы либо мяса.
Запрещенные продукты
Исключить из рациона пациента после полного или частичного удаления органа во время реабилитационного периода, свести к минимуму в долгосрочной перспективе (через несколько лет после операции) врачи рекомендуют следующие продукты питания:
- мясные, рыбные консервы;
- копчености;
- фаст-фуд;
- соленья;
- колбасы;
- острые приправы;
- полуфабрикаты;
- мясо, рыбу жирных сортов;
- наваристые бульоны;
- свежий хлеб;
- грибы;
- кондитерские изделия;
- животные жиры;
- сдобу;
- бобовые;
- ячневую, перловую, кукурузную, пшенную, манную крупы;
- сырую капусту, редьку;
- виноград, сок из него;
- пряную пищу;
- мороженое;
- молочные продукты с высоким процентом жирности;
- шоколад;
- цитрусовые;
- кетчуп; майонез;
- сваренные вкрутую яйца.
Запрещено при раке пить газированные, алкогольные напитки, крепко заваренные кофе, чай, пакетированные соки.
Как сгладить основные негативные моменты в еде
Часто больные раком боятся, что каждый прием пищи будет причинять мучения, уменьшают количество еды. Чтобы не допустить критической потери веса, нужно научиться купировать основные негативные моменты питания, характерные для оперированного желудка без изменения рекомендованного рациона.
Справиться с тошнотой, перееданием помогают следующие методы:
- есть надо медленно;
- исключить тяжелые, острые продукты из рациона;
- принимать горизонтальное положение не раньше чем спустя 2-3 часа после приема пищи;
- уменьшить размер порции, сократив интервал между трапезами;
- не употреблять газированные напитки, продукты, вещества, провоцирующие усиленное газообразование в организме.
Для предотвращения диареи врачи рекомендуют:
- снизить потребление сахара, жиров;
- повысить количество клетчатки в еде;
- соблюдать правила хранения продуктов;
- есть пищу теплой (но не горячей).
При непереносимости жиров, лактозы, сахара, вводить в рацион содержащие их ингредиенты постепенно, небольшими порциями. Когда негативные проявления сохраняются, проконсультироваться с врачом. Возможно потребуется прием ферментных веществ, обезболивающих препаратов, витаминных комплексов.
Прогноз при раке желудка
Прогноз и выживаемость зависят от многих факторов. Врач должен хорошо знать анамнез пациента, конкретику заболевания (вид, стадию, признаки), проведенные лечебные процедуры, реакцию организма на терапию, чтобы собрать всю информацию воедино и дать прогноз развития недуга.
По сути, это оценка специалиста, как болезнь далее будет воздействовать на человека, и как организм отреагирует на лечение. При составлении прогноза берутся во внимание прогностический и предсказательный факторы. Первый представляет собой характеристики рака или пациента, которые учитываются при прогнозировании. Предсказательный фактор определяет, как болезнь отреагирует на конкретную терапию.
Стадия
Это наиболее важный прогностический фактор рака желудка. Основные показатели или индикаторы – опухоль и лимфатические узлы.
- Злокачественное образование, которое не вышло за границы желудка, имеет лучший прогноз.
- Количество лимфоузлов, пораженных раком, влияет на прогноз: 4 и более лимфатических узла ухудшают ситуацию, 7 и выше еще более осложняют.
Расположение злокачественной опухоли
Новообразования, которые находятся в нижнем отделе органа (дистальном), имеют более благоприятный прогноз при раке желудка, чем в верхнем (проксимальном).
Тип опухоли
Кишечный тип рака желудка обладает лучшим прогнозом, по сравнению с диффузным.
Опухолевые клетки в перитонеальном смыве
Если раковые клетки находят перитонеальном смыве, прогноз менее благоприятный.
Хирургическое удаление
Когда в ходе операции полностью удаляют опухолевый процесс, прогноз будет лучше.
Физкультура в лечении рака
Важной частью реабилитации больных раком после удаления органа выступает ЛФК. Среди основных задач гимнастики:
- стимуляция синтеза секрета пищеварительного тракта организма;
- активация кишечной моторики;
- укрепление мускулатуры живота;
- нормализация работы органов дыхательной, сердечно-сосудистой систем;
- выработка правильной осанки;
- восстановление у пациента толерантности к бытовым нагрузкам.
Внимание: занятия должны проходить под контролем врача-физиотерапевта.
Помимо упражнений, больным раком показаны прогулки на свежем воздухе минимум полчаса в день. Дозированные физнагрузки улучшают работу органов пищеварительной системы, стимулирую обмен веществ, усваивание пищи, повышают настроение пациента.
Подъем тяжестей больным противопоказан. В первый год после удаления нельзя поднимать суммарно более 3 кг, затем — более 5 кг.
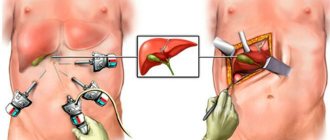
Гастрэктомия
Гастрэктомия – это тотальное удаление желудка. Целостность пищеварительного тракта восстанавливается путем создания анастомоза между пищеводом и тонкой кишкой. На связки желудка хирург накладывает зажимы, что позволяет отсечь его от пищевода и двенадцатиперстной кишки, затем формируется анастомоз. Вмешательство может быть проведено открытым, лапароскопическим или комбинированным доступом. В среднем, операция длится не более четырех часов, минимальная продолжительность составляет 2 часа.
Как проводится операция
Обычно операция выполняется через большой разрез на животе (лапаротомия). Изредка используется лапароскопия. Хотя операция через короткие разрезы менее травматичная, пока что нет убедительных доказательств, что она способна обеспечить аналогичные показатели выживаемости пациентов.
Врач удаляет желудок, пересекая его на расстоянии около 5 см от опухоли. При агрессивных типах рака отступ увеличивают до 7 см. Желудок удаляют вместе с большим и малым сальником, клетчаткой и лимфоузлами. Сразу после вмешательства выполняется гистологическое исследование материала, чтобы убедиться в отсутствии раковых клеток на границе удаленной ткани.
Наш эксперт в этой сфере:
Моисеев Алексей Андреевич
Врач-онколог, химиотерапевт, к.м.н.
Кандидат медицинских наук
Опыт работы: Более 19 лет
Позвонить врачу
Позвонить врачу
Отправьте документы на почту Возможность проведения лечения рассмотрит главный врач клиники.
Операция всегда дополняется лимфодиссекцией. Количество удаляемых лимфоузлов зависит от стадии патологии, величины и расположения опухоли. Обычно чем больше узлов удаляет врач, тем лучше показатели выживаемости пациентов. Но хирург удаляет только лимфоузлы первого и второго порядка. Узлы третьего порядка считаются отдаленными. Их удаление повышает риск осложнений, но не увеличивает выживаемость пациентов.
Введение
Рак желудка — одно из наиболее распространенных онкологических заболеваний во всем мире [7, 14, 18, 28, 30], занимающее лидирующие позиции в структуре смертности (803 тыс. умерших ежегодно) [60]. Заболеваемость раком желудка значительно варьирует в разных частях света. Наибольшая частота этого заболевания выявлена в Южной Корее — 66,5-72,5 на 100 000 мужчин и 19,5-30,4 на 100 000 женщин [51]. Аналогичные показатели в США в 10 раз меньше [49].
Рак желудка занял второе место после рака легкого в структуре онкологической заболеваемости в России в 2007 г. Количество зарегистрированных случаев 41 941, что составило 17,5% общего числа онкологических заболеваний. В структуре смертности от злокачественных заболеваний на рак желудка приходится 13,8% [27].
В настоящее время единственным радикальным методом лечения больных раком желудка является хирургический. Радио- и химиотерапия дополняют хирургическую операцию и не играют решающей роли в длительности безрецидивного периода и продолжительности жизни больных [9, 10, 19, 24, 25]. Наиболее частая операция при раке желудка — гастрэктомия (ГЭ). В зависимости от локализации и стадии опухолевого процесса оперативные вмешательства могут быть расширенными, комбинированными, а также сопровождаться лимфаденэктомией (ЛАЭ) в том или ином объеме [16, 29, 31, 33].
Выбор оптимального объема оперативного вмешательства при раке желудка в настоящее время вызывает много противоречий. Это обусловлено тем, что улучшение результатов лечения резектабельного рака желудка не всегда непосредственно связано с расширением объема радикальной операции. Основным предметом дискуссии являются показания к ЛАЭ, ее объем и отдаленные результаты [3, 36, 43]. Традиционно радикальные операции по поводу рака различной локализации включают обязательное удаление единым блоком регионарных лимфатических узлов.
В конце 70-х годов в Японии «расширенная» ЛАЭ была возведена в «ранг» общенациональной рекомендации (Japanese Research Society for Gastric Cancer — JRSGC, 1981 г.).
В настоящее время применение операций в сочетании с расширенной ЛАЭ рассматривается как наиболее перспективное направление, способное повлиять на повышение эффективности лечения резектабельного рака желудка [2, 4, 7, 9, 11, 15, 23, 31-33, 42, 50, 52, 53].
В литературе продолжает дискутироваться вопрос о показаниях к спленэктомии (СЭ) при радикальных операциях по поводу рака желудка. Целесообразность рутинной СЭ как компонента расширенной гастрэктомии при раке желудка должна определяться взаимодействием двух факторов: с одной стороны, частотой поражения метастазами лимфатических узлов ворот селезенки, с другой — предпосылкой к улучшению отдаленных результатов за счет сохранения селезенки как иммунокомпетентного органа. Немаловажное значение имеет факт повышенной опасности развития поддиафрагмальных абсцессов и панкреонекроза дистальных отделов поджелудочной железы (ПЖ) после СЭ [10, 26, 42].
Клинические последствия СЭ изучались многими авторами. Считается, что ранний послеоперационный период может осложниться поддиафрагмальным абсцессом [45], панкреатитом [21, 44, 56], сепсисом [5], нагноением послеоперационной раны, эвентрацией, спаечной кишечной непроходимостью [21], кровотечением, образованием кишечного свища [13, 20], тромбозом верхней брыжеечной и воротной вен [47]. Другие авторы указывают на возможность развития экстраабдоминальных осложнений, таких как пневмония, плеврит, тромбоэмболия легочной артерии и ее ветвей [14, 38, 45].
Опухоли верхней и средней трети желудка могут метастазировать в лимфатические узлы, расположенные в области селезеночной артерии и ворот селезенки (группы №10, 11). По мнению ряда авторов, ЛАЭ в объеме D2 включала СЭ и дистальную резекцию ПЖ, что отражено в многочисленных японских исследованиях 80-х годов [9]. Считалось, что СЭ и дистальная резекция хвоста ПЖ позволяют наиболее полно выполнить ЛАЭ узлов групп №10 и 11 [6, 9, 11, 35].
В дальнейшем некоторые авторы настаивали на СЭ и резекции ПЖ при распространении опухоли за пределы серозной оболочки желудка или при наличии видимых метастазов в области селезеночных сосудов/ворот селезенки [6, 9-12].
Несомненно, наиболее важным прогностическим фактором в оценке радикальности хирургической операции является патоморфологическое исследование границ резекции [9, 23]. Соответственно в случае прямого врастания опухоли в селезенку или ПЖ при отсутствии явного поражения лимфатических узлов необходимость комбинированной операции бесспорна [8, 9, 12, 23, 24].
По данным K. Okajima и соавт. [54], частота метастазирования в лимфатические узлы ворот селезенки и селезеночной артерии при опухолях, занимающих верхнюю и среднюю треть желудка, достигает 26,7%, при дистальных локализациях она близка к нулю.
А.Ф. Черноусов и соавт. [31] считают СЭ показанной только при опухолях верхней и средней трети органа, прорастающих серозную оболочку, и низкодифференцированной форме рака.
В последнее десятилетие в хирургическом сообществе прослеживается тенденция к органосохраняющим операциям. Если речь идет о сохранении селезенки это, безусловно, обосновано.
В 2012 г. опубликован систематический обзор исследований, сравнивающих результаты хирургического лечения рака желудка в зависимости от проведения СЭ и дистальной резекции ПЖ как компонентов расширенной ЛАЭ [58]. Были проанализированы данные Medline, Embase, Cochrane Central Register of Controlled Trials с января 1998 г. по 31 декабря 2009 г. Критериям систематического обзора литературы соответствовало 42 исследования с общим числом больных 6354. В 4 рандомизированных исследованиях статистически значимых различий в общем количестве осложнений и летальности выявлено не было. Из 6 проспективных исследований, сравнивающих различные методики ЛАЭ, сохранение селезенки и ПЖ ассоциировалось с меньшим количеством осложнений в 2, меньшим количеством послеоперационных осложнений и летальных исходов в 1, не отмечено статистически значимых различий в оставшихся. В ретроспективных исследованиях сохранение селезенки ассоциировалось с меньшим количеством осложнений в 3, сохранением ПЖ — в 5 и снижением летальности в 1. Из 33 оставшихся ретроспективных исследований в 10 работах по сохранению селезенки и в 13 — без резекции ПЖ статистически значимых различий показателей летальности и количества осложнений не было. В рандомизированных исследованиях различий в уровне выживаемости выявлено не было.
По результатам двух больших рандомизированных европейских исследований была выявлена связь высокого уровня осложнений и летальности с выполнением СЭ и дистальной резекцией ПЖ.
С учетом того, что эти выводы были сделаны на основании статистического метода post hok subgroup, они должны интерпретироваться предельно аккуратно. Некоторые исследователи считают, что столь низкие показатели 5-летней выживаемости могли быть связаны с чрезвычайно высокими показателями периоперационной летальности [37, 39].
В рандомизированных исследованиях [40, 41] сравнивали результаты ЛАЭ в объеме D2 и D1. Разница между спленосохранными операциями и СЭ не была выявлена, однако исследование сопровождалось специфическим отбором больных, исключительным внутрибольничным уходом и участием хирургов с большим опытом.
A. Csendes и соавт. [39] и W. Yu и соавт. [61] отметили тенденцию к увеличению 5-летней выживаемости в группе больных после СЭ.
Исследование K. Okinaga и соавт. [55] было относительно небольшим (43 больных) и тоже не продемонстрировало значительных преимуществ сохранения селезенки. Наряду с этим авторы постулировали, что лимфоциты селезенки обладают повышенной цитотоксической активностью на ранних стадиях опухолевого процесса и значительной супрессивной активностью на поздних стадиях рака желудка. Также авторы отметили увеличение уровня выживаемости при сохранении селезенки и проведении иммунотерапии.
H. Furukawa и соавт. [46] сравнили результаты ЛАЭ в объеме D2 с резекцией хвоста ПЖ и стандартной ЛАЭ в объеме D2 и также не выявили статистически значимого увеличения количества осложнений и уровня выживаемости. Одним из возможных объяснений отсутствия статистических различий в результатах является недостаточное число больных.
Интересны результаты метаанализа трех рандомизированных когортных исследований [59] влияния СЭ как комбинированного этапа ЛАЭ при раке желудка. Локализация и стадия опухоли играли решающую роль в показаниях к СЭ. Послеоперационная летальность и количество осложнений достоверно не различались в обеих группах. Количество удаленных лимфатических узлов было больше в группе СЭ. Длительность операции и периода госпитализации была одинаковой. Также не было различий в количестве повторных операций. Полученные данные свидетельствуют, что выполнение «рутинной» СЭ не влияет на 5-летнюю выживаемость больных и ее не следует рекомендовать как стандартную операцию.
Несмотря на многочисленные приведенные исследования в последних клинических рекомендациях JGCA [48] ЛАЭ в объеме D2 дополняют СЭ при опухолях Т2-Т4, локализующихся по большой кривизне в верхней трети желудка.
В 2002 г. в Японии начато мультицентровое рандомизированное исследование целесообразности СЭ при раке проксимального отдела желудка, призванное окончательно решить этот вопрос [57]. Изучались данные обследования и лечения 505 больных, разделенных на две группы. Критериями включения в исследование были Т2-Т4, N0-2, М0, локализация опухоли не по большой кривизне, гистологически подтвержденная аденокарцинома. В 2010 г. JCOG обнародованы промежуточные результаты этого исследования. В раннем послеоперационном периоде умерли 3 больных (2 в группе с сохранением селезенки, 1 в группе СЭ). Количество больных с послеоперационными осложнениями оказалось существенно выше (30,3%) в группе СЭ, чем в группе с сохраненной селезенкой (16,7%; р
<0,0001). Кровопотеря достоверно больше в группе СЭ: 390,5 мл против 315 мл при сохранении селезенки (
р
=0,002). Статистически значимых различий в продолжительности операций не выявлено (в среднем соответственно 231 и 224 мин). Набор больных был закончен в 2009 г., окончательные результаты будут опубликованы в 2014 г.
С 2005 г. аналогичное рандомизированное исследование проводится в РОНЦ им. Н.Н. Блохина РАМН. Российские онкологи разрабатывают и применяют методику ЛАЭ в объеме D2 с сохранением селезенки и выполнением полной ЛАЭ в ее воротах, называя только такие операции спленосохранными в отличие от гастрэктомий с оставлением селезенки [28].
Таким образом, данные литературы свидетельствуют, что до сих пор не решен вопрос о целесообразности симультанного удаления селезенки при выполнении ГЭ и ЛАЭ больным раком желудка при различной локализации опухоли. Неоднозначны данные о состоянии иммунитета онкологических больных до и в разные сроки после операции. Кроме того, учитывая многообразные функции селезенки, не до конца изучено влияние СЭ на течение ближайшего послеоперационного периода и состояние здоровья больных в отдаленные сроки после операции.
Материал и методы
В исследование вошли 118 больных раком желудка, оперированных с 2006 по 2011 г. в клинике факультетской хирургии им. Н.Н. Бурденко ПМГМУ им. И.М. Сеченова.
В зависимости от характера вмешательства все больные разделены на 2 группы: в 1-ю группу (ГЭ и СЭ) был включен 61 пациент, во 2-ю (ГЭ с сохранением селезенки) — 57 пациентов. Среди оперированных было 72 мужчины и 46 женщин.
Обе группы были однородны по полу и возрасту. В исследовании преобладали больные старше 60 лет мужского пола. У 79 (67%) больных диагностированы сопутствующие, конкурирующие заболевания.
В обеих группах выявлено однородное распределение сопутствующих заболеваний. Наиболее часто встречались заболевания сердечно-сосудистой системы.
У 62 (52,5%) больных отмечены сопутствующие терапевтические заболевания, у 42,7% — два и более заболеваний, что потребовало предоперационной подготовки. Самыми частыми среди них были заболевания сердечно-сосудистой системы и органов дыхания: ИБС — у 55 больных, артериальная гипертензия — у 70, хроническая обструктивная болезнь легких — у 36. По результатам расчета индекса массы тела 22 больных страдали ожирением.
Обследование включало стандартные лабораторные и инструментальные методы (общий анализ крови и мочи, биохимический анализ крови, коагулограмма, электрокардиография, исследование функции внешнего дыхания).
Также выполняли комплексное исследование иммунного статуса. Забор крови производили до операции для определения исходных параметров, на 7-е сутки после операции и в период от 14-х до 20-х суток после операции. Больным, поступавшим на контрольное обследование, проводили аналогичное исследование через 3 мес, 6 мес и 1 год после операции, далее каждый год на протяжении 5 лет.
Всем наблюдавшимся нами больным с учетом наличия вторичного иммунодефицита в периоперационном периоде и до выписки из стационара проводили иммуномодулирующую терапию препаратом галавит — производное фталгидрозида [1, 17, 24]. Особенностью этого препарата является наличие, помимо иммуномодулирующих, выраженных противовоспалительных свойств. Его главные фармакологические эффекты связаны с воздействием на функциональную активность макрофагов. При гиперактивации этих клеток галавит обратимо ингибирует продукцию фактора некроза опухоли и интерлейкина (ИЛ)-1, а также активных форм кислорода. Происходит нормализация функционального состояния макрофагов, восстанавливается нормальная продукция цитокинов и антиген-презентирующая функция. Галавит стимулирует функциональную активность нейтрофилов, повышая поглощение и внутриклеточный киллинг бактерий. Следствием этого является повышение неспецифической устойчивости организма к инфекциям. Галавит не влияет на нормальный уровень цитотоксичности естественных киллеров, но при исходно низких значениях он восстанавливает цитотоксичность до нормальных значений.
По локализации онкологического процесса, стадиям и характеру выполненных операций обе группы больных были однородны.
В работе мы использовали классификацию TNM (UICC, 2002 г.), согласно которой больных c заболеванием I и II стадий в обеих группах было соответственно 22 и 46, III стадии — 35 (16 в 1-й и 19 во 2-й), IV стадии — 15. Больных с заболеванием III и IV стадий было 50. У 7 больных опухоль прорастала в соседние анатомические структуры (T4), что потребовало выполнения комбинированных оперативных вмешательств. Очевидно, что выявление рака на ранней стадии и своевременное радикальное оперативное лечение улучшают как непосредственные, так и отдаленные результаты хирургического лечения больных раком желудка.
В обеих группах преобладали инфильтративно-язвенные формы рака (94%), с локализацией в теле желудка (64%), и низкой степенью дифференцировки опухоли (54%). Распространение рака желудка на пищевод отмечено у 28 больных. Вовлечение большой кривизны желудка в опухоль имело место у 61 (52%) больного.
Результаты и обсуждение
Из 118 гастрэктомий 88 (75%) были комбинированными. Гастрэктомию комбинировали с резекцией толстой кишки у 3 больных, с резекцией ПЖ у 9, с резекцией пищевода у 81. Желчнокаменная болезнь послужила основанием для удаления желчного пузыря у 5 больных, в то же время принципиальную холецистэктомию произвели 49 больным во время ЛАЭ в объеме D 2,5 с циркулярной диссекцией печеночно-двенадцатиперстной связки.
В большинстве наблюдений была выполнена радикальная операция с ЛАЭ (90%) в объеме D2, D 2,5, D3 — соответственно 73, 23 и 14 больным.
Во время большинства операций на область анастомоза наносили один из вариантов фибринового клея для улучшения местных процессов регенерации.
В зависимости от стадии рака желудка и варианта гистологической структуры опухоли проводили стандартное химиотерапевтическое лечение: чаще системную адъювантную химиотерапию, а 8 больным после циторедуктивных операций — лечебную. Циторедуктивные операции выполняли в случае наличия отдаленных метастазов в верхнем средостении, печени, легких, забрюшинном пространстве, а также при наличии асцита, канцероматоза брюшины, метастазов Крукенберга, Шницлера, Вирхова, сестры Мери Джозеф.
Оценка физиологических возможностей организма больных, страдающих раком желудка, большинство которых составляют люди пожилого и старческого возраста, трудна и противоречива, но только хирургическое вмешательство является единственным радикальным методом, дающим какую-либо надежду на выздоровление.
Ряд авторов признают вынужденным снижение хирургической активности ввиду возраста больного и наличий сопутствующих заболеваний сердца и легких [17, 22, 29, 34]. Велико число больных, которым производят пробные лапаротомии, торакотомии и паллиативные вмешательства [32]. Мы также сталкивались с подобными фактами и в большинстве наблюдений нам удалось выполнить радикальные или циторедуктивные хирургические вмешательства при повторных операциях у подобных больных.
Травматичные (комбинированные) оперативные вмешательства противопоказаны больным с тяжелыми сердечно-сосудистыми и легочными заболеваниями в стадии декомпенсации, при выраженном нарушении функции печени и почек, декомпенсированном сахарном диабете.
Одновременно с предоперационным обследованием больным проводили коррекцию выявленных нарушений со стороны сердца и легких, электролитных и нутритивных изменений, обусловленных неадекватным питанием.
Назначение высококалорийного питания через зонд, проведенный за опухолевое сужение, одновременно с внутривенными инфузиями аминокислот, белков, витаминов и микроэлементов (в суточной суммарной дозе 2500-3000 ккал) позволяло восполнить нутритивный дефицит. Для оценки эффективности проводимой терапии у всех больных измеряли толщину кожной складки на уровне средней трети плеча, определяли содержание общего белка и уровень трансферрина, белковых фракций, показатели иммунного статуса, альбумин-глобулиновый коэффициент, контролировали уровень электролитов, измеряли потери суточного азота и азотистый баланс.
Все больные, находившиеся на энтеральном питании, получали специальные питательные жидкие смеси. Наряду с возмещением выделяемого азота больным проводили коррекцию уровня общего белка и альбуминов путем введения 10 и 20% растворов альбумина, плазмалита и плазмы.
Критериями адекватности проводимого курса предоперационной терапии считали нормализацию уровня электролитов крови, увеличение показателей общего белка и альбуминов крови, увеличение альбумин-глобулинового индекса, положительный или нулевой азотистый баланс, поддержание умеренной гемодилюции (35-37%) с тенденцией к нормализации показателей иммунного статуса: уменьшение общего количества лейкоцитов и лимфоцитов, увеличение количества Т-лимфоцитов, снижение активных Т-лимфоцитов, снижение в количественном и процентном отношении Т-супрессоров и В-лимфоцитов.
В зависимости от различных факторов вопросы предоперационной подготовки в каждой конкретной ситуации решали индивидуально.
Показаниями к сохранению селезенки считали отсутствие прямого прорастания опухоли в ее капсулу или сосуды.
В ходе операции при сохранении селезенки перевязывали и пересекали короткие желудочные сосуды максимально близко к капсуле селезенки, при этом клетчатку и лимфатические узлы из ворот селезенки смещали в удаляемый комплекс.
Всего из 61 оперированного больного 1-й группы осложнения развились у 22 (36,1%). При этом 41 больному резецировали пищевод: 32 — абдоминальный отдел, 9 — абдоминальный и нижнегрудной отделы. В 9 наблюдениях операцию дополнили резекцией ножек диафрагмы, в 9 — дистальной резекцией ПЖ.
Среди больных 1-й группы основным интраабдоминальным осложнением был абсцесс брюшной полости, локализовавшийся в левом поддиафрагмальном пространстве. Это осложнение наблюдали у 6 (9,8%) больных. Своевременная диагностика этого осложнения, антибактериальная терапия, миниинвазивные вмешательства под контролем УЗИ позволили добиться излечения всех больных.
Острый отечный панкреатит диагностировали у 4 (6,6%) больных после ГЭ с резекцией нижней трети грудного отдела пищевода из трансхиатального доступа. Основными проявлениями отечного панкреатита были повышение уровня амилазы в отделяемом из дренажей и в крови, а также увеличение размеров ПЖ по данным УЗИ. У одного больного диагностировали некроз хвоста ПЖ.
Развитие послеоперационного панкреатита в 1-й группе больных являлось характерным осложнением и только в 2 наблюдениях было связано с дистальной резекцией ПЖ.
С целью профилактики послеоперационного панкреатита при расширенных ЛАЭ мы применяли синтетический аналог соматостатина (октреотид).
У 7 (11,5%) больных осложнения потребовали дополнительных оперативных вмешательств в послеоперационном периоде. Пункции и дренирование абсцессов брюшной полости под контролем УЗИ были сделаны 5 (8,2%) больным. Одному больному пришлось выполнить люмботомию в связи с панкреонекрозом и флегмоной забрюшинной клетчатки.
Наибольшее количество экстраабдоминальных осложнений наблюдали со стороны органов грудной клетки; в общей сложности они развились у 10 (16,4%) больных. Экссудативный плеврит был у 4 (6,6%) больных.
В двух наблюдениях левосторонний плеврит был осложнением острого послеоперационного панкреатита. Еще у одного больного плеврит сочетался с абсцессом левого поддиафрагмального пространства.
Пневмонию диагностировали у 5 (8,2%) больных, у 1 из них развилась молниеносная форма герпес-вирусной пневмонии, которая стала причиной смерти на 2-е сутки после операции.
Относительно высокая частота осложнений со стороны легких и плевральной полости обусловлена имевшимися у больных исходными хроническими заболеваниями дыхательной системы (бронхиальная астма, хронический бронхит, эмфизема легких), а также вмешательством в заднем средостении при проксимальных локализациях раковой опухоли.
Осложнения со стороны сердечно-сосудистой системы отмечены у 1 (1,6%) больного. У него возникла тромбоэмболия мелких ветвей легочной артерии с развитием инфарктной пневмонии. Диагноз тромбоэмболии был установлен по результатам МСКТ-ангиопульмонографии. На фоне антикоагулянтной, антибактериальной и кардиотропной терапии наступило выздоровление.
Из 57 больных 2-й группы 53 произведена радикальная операция. Следует отметить, что выполнение СЭ при заведомо циторедуктивной операции считали нецелесообразным. Радикальные операции дополняли резекцией пищевода у 41 больного: абдоминального отдела — у 31, нижнегрудного — у 10. Резекция ножек диафрагмы сделана в 13 наблюдениях. По объему и количеству комбинированных вмешательств обе группы больных достоверно не различались. Осложнения диагностировали у 10 (17,5%) больных.
Представляется важным, что при сохранении селезенки не развивались абсцессы поддиафрагмального пространства, а также прослеживалась тенденция к снижению частоты нагноения послеоперационной раны. У больных 2-й группы преобладали экстраабдоминальные осложнения, связанные с сопутствующими заболеваниями сердечно-сосудистой и дыхательной систем.
При циторедуктивных операциях мы стремились сохранить селезенку, во всех ситуациях, кроме прямой инвазии опухоли в сосуды селезеночной ножки или капсулу селезенки.
У больных наблюдали осложнения со стороны сердечно-сосудистой системы: у 1 — острый инфаркт миокарда на 12-е сутки после операции, еще у 1 — острую левожелудочковую недостаточность, возникшую на 3-и сутки после операции на фоне предшествующей сопутствующей пароксизмальной мерцательной аритмии и купированную в результате интенсивной кардиальной терапии. У 5 (8,8%) больных диагностировали пневмонию, у 4 (7%) выявили нагноение послеоперационной раны. Летальных исходов в этой группе не было.
Таким образом, использование дифференцированного подхода в зависимости от локализации опухоли и степени вовлеченности пищевода у отягощенных сердечно-легочными заболеваниями больных позволило значительно улучшить непосредственные результаты лечения, в том числе расширить показания к радикальным операциям у больных с высоким анестезиологическим риском, уменьшить количество ранних послеоперационных осложнений.
Для больных обеих групп до операции были характерны лимфопения, снижение содержания антигена CD8+ и в связи с этим дисбаланс субпопуляции? Т-клеточного звена на фоне снижения показателей противоинфекционного иммунитета и увеличения содержания активационных маркеров CD25+, помимо этого, происходило увеличение концентрации иммуноглобулинов классов М и G. Статистически достоверных различий показателей до операции в обеих группах не выявлено.
Отсутствие разницы в показателях иммунного статуса до операции свидетельствует об однородности обеих групп наблюдавшихся нами больных, а вторичный иммунодефицит, выраженный в той или иной степени и установленный у всех пациентов, является следствием влияния злокачественной опухоли.
При исследовании иммунного статуса на 7-10-е сутки после операции установлено, что уровень IgM, Т-активных лимфоцитов достоверно выше в 1-й группе, что свидетельствует о ранней реакции иммунной системы в ответ на травматическое воздействие операции. Уровень B-лимфоцитов, циркулирующих иммунных комплексов (ЦИК), ИЛ-1В и ИЛ-10 на фоне продолжающегося снижения количества провоспалительных цитокинов достоверно меньше, чем во 2-й группе.
Усугубление предшествующего иммунодефицита у больных после СЭ отражается также в снижении показателя спонтанного и стимулированного НСТ-теста.
На 14-20-е сутки после операции достоверных различий показателей иммунного статуса не выявлено, так как у больных обеих групп на фоне иммуномодулирующей терапии они зависят в большей степени от наличия гнойно-септических осложнений, чем от варианта операции.
Через 3 мес достоверных различий также не выявлено вследствие активации компенсаторных механизмов иммунной системы и продолжающегося лечения галавитом.
К 6 мес после операции в 1-й группе больных уровень Т-общих лимфоцитов достоверно больше, чем во 2-й группе. Это связано с окончанием применения иммуномодулирующих препаратов и угнетением фагоцитарного звена иммунитета в группе СЭ, в которой также наблюдали снижение уровня Т-лимфоцитов ранних и показателя стимулированного НСТ-теста, IL-8.
Через 1 год после операции в 1-й группе уровень Т-активных лимфоцитов, ЦИК, фактора некроза опухоли достоверно больше, а уровень лимфоцитов, Т-общих, Т-хелперов достоверно меньше, чем во 2-й группе.
Об онкологическом радикализме судили на основании оценки выживаемости в обеих группах больных. В 1-й группе больных средняя выживаемость составила 26 мес (16,0; 40,0), во 2-й группе — 23,5 (13,0; 36,0).
Среди 57 радикально оперированных больных 1-й группы отдаленные результаты прослежены у 50 (82%). Показатель 2-летней выживаемости составил 55,2±0,2%, 3-летней — 34,6±0,2%. Среди 53 радикально оперированных больных 2-й группы отдаленные результаты прослежены у 45 (79%). Показатель 2-летней выживаемости составил 54,8±0,3%, 3-летней — 36,4±0,3%.
При анализе 2- и 3-летней выживаемости оперированных больных в зависимости от стадии заболевания видна отчетливая корреляция: чем выше стадия, тем меньше продолжительность жизни. Из 50 больных 1-й группы, прослеженных в отдаленные сроки, после операции 2 года и более, при I стадии заболевания прожили 12 (80±1,5%), при II стадии — 8 (72,7±1,3%), при IIIА стадии — 11 (57,8±0,9%), при IIIВ стадии — 3 (37,5±0,4%), при IV стадии — 3 (25±0,09%). Общая 2-летняя выживаемость составила 56,92±0,2%. Три года и более прожили 22 (33,8±0,2%) больных. Показатель 3-летней выживаемости при I стадии заболевания составил 60±1,0%, при II стадии — 36,36±0,9%, при IIIА стадии — 36,84±0,9%, при IIIВ стадии — 12,5±0,1%, при IV стадии — 8,3±0,08%.
Во 2-й группе 2- и 3-летняя выживаемость зависела от стадии заболевания такая же, как в 1-й группе: чем выше стадия, тем меньше продолжительность жизни. Из 45 прослеженных в отдаленные сроки после операции 2 года и более при I стадии заболевания прожили 10 (80±1,5%) больных, при II стадии — 7 (72,7±1,3%), при IIIА стадии — 10 (57,8±0,9%), при IIIВ стадии — 4 (37,5±0,4%), при IV стадии — 3 (25±0,09%). Общая 2-летняя выживаемость составила 55,66±0,2%. Три года и более прожили 23 (33,8±0,2%) больных. Показатели 3-летней выживаемости в зависимости от стадии заболевания составили: при I стадии — 60±1,0%, при II стадии — 36,36±0,9%, при IIIА стадии — 36,84±0,9%, при IIIВ стадии — 12,5±0,1%, при IV стадии — 8,3±0,08%.
Таким образом, чем меньше стадия заболевания, тем благоприятнее прогноз и выше показатели 2- и 3-летней выживаемости.
Фактор поражения лимфатических узлов оказывает существенное негативное влияние на отдаленные результаты. Больных без метастазов, переживших 2- и 3-летний срок наблюдения, оказалось соответственно в 1,5 и 2,6 раза больше, чем больных с метастазами в лимфатических узлах. Больные без метастазов в регионарные лимфатические узлы имеют в 2 раза больше шансов выжить, чем больные с лимфогенными метастазами. С увеличением срока наблюдения шансы на выживание повышаются.
На выживаемость больных после радикальных операций по поводу рака желудка влияет ряд факторов. Основными из них являются стадия заболевания, анатомическая форма опухоли, метастазы в лимфатические узлы, глубина опухолевой инвазии, локализация опухоли, протяженность поражения пищевода и объем выполненного оперативного вмешательства.
Общая 2-летняя выживаемость в обеих группах больных составила 56,92±0,2%. Из 95 прослеженных больных 3 года и более прожили 22 (33,8±0,2%). Показатели 3-летней выживаемости при I стадии заболевания составили 60±1,0%, при II стадии — 36,36±0,9%, при IIIА стадии — 36,84±0,9%, при IIIВ стадии — 12,5±0,1%, при IV стадии — 8,3±0,08%.
Из 118 оперированных у 14 не было метастатического поражения лимфатических узлов. Среди них 2 года прожили 9 (66,6%) человек, 3 года — 5 (33,4%). У остальных 104 пациентов имело место поражение регионарных лимфатических узлов, 2 года пережили 59 (57%) и 3-летний срок — 45 (34%) больных.
По данным современной литературы, показатели 2-летней выживаемости больных раком желудка варьируют от 36 до 58%, показатели 3-летней выживаемости — от 25 до 52%. Полученные нами результаты 2- и 3-летней выживаемости у заведомо тяжело больных оказались сопоставимы, достоверно (p
<0,005) не различались и составили соответственно 57 и 34%.
Таким образом, можно говорить о правомерности выбранной лечебной тактики с точки зрения онкологического радикализма, так как сохранение селезенки позволяет снизить количество послеоперационных осложнений и не влияет на отдаленные результаты лечения.
Сравнение выживаемости в зависимости от вида оперативного вмешательства (со спленэктомией или сохранением селезенки) свидетельствует о том, что показатели 2- и 3-летней выживаемости достоверно не различаются в обеих группах больных.
Независимо от локализации и распространенности ракового процесса в случае отсутствия прямой инвазии опухоли в селезеночные сосуды, капсулу селезенки или поджелудочную железу сохранение селезенки при проведении лимфаденэктомии с полным удалением лимфатических узлов в области ворот селезенки позволяет снизить количество ранних послеоперационных осложнений и достоверно не влияет на отдаленную выживаемость больных раком желудка.