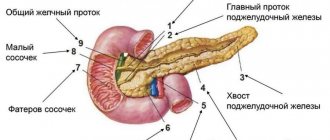
Панкреонекроз – деструктивное заболевание поджелудочной железы, являющееся осложнением острого панкреатита и приводящее к развитию полиорганной недостаточности. К проявлениям панкреонекроза относят острую опоясывающую боль в животе, упорную рвоту, тахикардию и энцефалопатию. Лабораторная диагностика предполагает определение уровня альфа-амилазы; инструментальная – проведение обзорной рентгенографии брюшной полости, УЗИ, КТ и МРТ поджелудочной железы, РХПГ, диагностической лапароскопии. Лечение включает в себя консервативные мероприятия (угнетение протеолитических ферментов, восстановление оттока соков поджелудочной железы, дезинтоксикацию и обезболивание) и оперативное вмешательство.
МКБ-10
K85 Острый панкреатит
- Причины панкреонекроза
- Патогенез
- Классификация
- Симптомы панкреонекроза
- Осложнения
- Диагностика
- Лечение панкреонекроза Консервативная терапия
- Хирургическое лечение
Общие сведения
Панкреонекроз является наиболее тяжелым осложнением панкреатита, поражает в основном молодых трудоспособных людей, составляет 1% всех случаев острого живота. В основе патогенеза панкреонекроза лежит сбой механизмов внутренней защиты поджелудочной железы от разрушающего действия панкреатических ферментов.
В последнее время в России увеличивается количество острых панкреатитов – данная патология выходит на второе место после острого аппендицита в хирургических стационарах. Также растет и число деструктивных форм панкреатита, в частности панкреонекроза — до 20-25%. В разных клиниках летальность при деструкции поджелудочной железы достигает 30-80%. Ведущий способ снижения летальности при некрозе поджелудочной железы – своевременная диагностика, госпитализация и раннее начало патогенетического лечения.
Панкреонекроз
Причины панкреонекроза
Причинами развития, как панкреатита, так и панкреонекроза, обычно являются нарушения диеты и эпизодический прием алкоголя. Исследования в области гастроэнтерологии показали, что панкреонекрозами обычно страдают люди, не склонные к постоянному употреблению алкоголя. Тем не менее, в подавляющем большинстве случаев началу панкреонекроза предшествует эпизод употребления спиртного в больших количествах. У пациентов, страдающих хроническим алкоголизмом, практически всегда развивается хронический панкреатит, редко осложняющийся панкреонекрозом. Первые признаки заболевания могут появиться спустя часы или сутки после действия провоцирующих факторов.
Патогенез
В основе патогенеза панкреонекроза лежит нарушение местных защитных механизмов поджелудочной железы. Обильный прием пищи и алкоголя приводит к значительному усилению внешней секреции, перерастяжению протоков поджелудочной железы, нарушению оттока панкреатических соков. Повышение внутрипротокового давления провоцирует отек паренхимы, разрушение ацинусов поджелудочной железы, преждевременную активацию протеолитических ферментов, которые и приводят к массивному некрозу ткани железы (самоперевариванию).
Активация липазы вызывает некроз жировых клеток, эластазы – разрушение сосудистой стенки. Активированные ферменты и продукты распада тканей, благодаря воздействию эластазы, попадают в кровоток, оказывая токсическое действие на все органы и ткани. В первую очередь страдают печень, почки, сердце, головной мозг.
Причины развития некроза
Панкреонекроз
Перед тем, как начинать лечение по той или иной схеме, надо установить причину данной патологии. Ведь если вылечить только последствия, не устранив причину, заболевание повториться вновь.
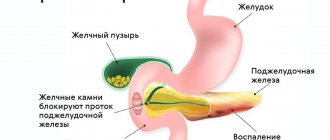
К некрозу приводят некоторые заболевания. Например, холецистит, ДЖВП или холангит, проявляющийся в нарушении оттока ферментов, часто становится такой причиной. К изменениям в тканях поджелудочной приводят инфекционные заболевания.
Самой распространенной причиной такой патологии считается злоупотребление спиртным, питание, основанное на вредной пище.
Проблемы с поджелудочной начинаются и тогда, когда люди занимаются самолечением и бесконтрольно употребляют лекарственные препараты. Как поведет себя организм при употреблении определенных препаратов, может знать только специалист. Ведь воздействие лекарственных компонентов на организм – это очень сложный процесс. Стрессы, эмоциональные перегрузки также ведут к некрозу тканей поджелудочной.
Классификация
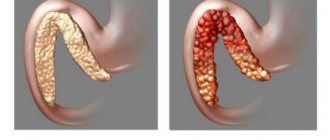
В зависимости от того, какие повреждающие механизмы лидируют в патогенезе, выделяют жировую, геморрагическую и смешанную формы панкреонекроза.
- Жировая форма. Если преобладает повышение активности липазы, происходит разрушение жировой ткани поджелудочной железы. Липаза попадает за пределы панкреатической капсулы, вызывая появление очагов некроза в большом и малом сальнике, листках брюшины, брыжейке, внутренних органах. Жировая форма панкреонекроза обычно оканчивается развитием тяжелейшего химического асептического перитонита, полиорганной недостаточности.
- Геморрагическая форма. В случае же преобладания микроциркуляторных нарушений развивается спазм сосудов поджелудочной железы, приводящий к быстрому нарастанию отека паренхимы. В течение нескольких часов или дней токсемия постепенно приводит к парезу сосудистой стенки, расширению сосудов и замедлению кровотока в тканях железы. Все это способствует повышенному тромбообразованию, а в дальнейшем – развитию ишемического некроза. Активация эластазы вызывает разрушение сосудистой стенки сначала в толще поджелудочной железы, затем и в других органах. В конечном итоге это ведет к геморрагическому пропитыванию панкреас, кровоизлияниям во внутренние органы и забрюшинную клетчатку. Признаком геморрагического панкреонекроза является выпот в брюшную полость с примесью крови.
- Смешанная форма. Если активность эластазы и липазы находятся примерно на одном уровне, развивается смешанная форма панкреонекроза. В этом случае явления жирового некроза и геморрагической имбибиции выражены одинаковы. При панкреонекрозе также значительно повышается уровень альфа-амилазы, однако в патогенезе этот факт не играет никакой роли. Измерение уровня амилазы имеет только клиническое значение.
2.Причины стеатопанкреатита
Потенциально опасные факторы, угрожающие липоматозом поджелудочной железы, условно делятся на две группы: токсические и метаболистические.
Токсическое воздействие, особенно длительное, приводит к разрушению здоровых клеток поджелудочной железы. Для сохранения объема и поддержания геометрии органа включается механизм замещения их на жировую ткань. Разрастание жировых прослоек в толще способных нормально функционировать клеток отражается на деятельности всего органа, который постепенно утрачивает функциональную состоятельность.
Наиболее распространённые факторы токсического воздействия на панкреас:
- длительная никотиновая интоксикация;
- систематическое употребление алкоголя;
- приём некоторых медикаментов, нагружающих поджелудочную железу.
Метаболистические факторы в своём большинстве могут быть контролируемы и корректируемы. Это избыточный вес, диета, режим приёма пищи, сбалансированность питания, физическая активность. К разряду не зависящих от человека факторов, связанных с метаболизмом, можно отнести хронические заболевания ЖКТ и печени, сахарный диабет. Стеатопанкреатит может развиться вторично на их фоне.
В последнее время к факторам риска также стали относить увлечение голоданием и экстремальными диетами. Резкие перепады объёмов поступающей пищи стимулируют процессы жиронакопления в органах и тканях при наступлении благоприятных для этого условий.
Некоторые типы медицинской помощи также могут спровоцировать стеатоз (например, перентеральное питание), однако в большинстве случаев, когда назначается внутривенное питание, альтернативы ему не существует.
Посетите нашу страницу Гастроэнтерология
Симптомы панкреонекроза
Развитие клиники панкреонекроза происходит в три этапа. Этому состоянию может предшествовать гнойный панкреатит, острый алкогольный панкреатит, билиарный панкреатит, геморрагический панкреатит. На первом этапе активное размножение бактерий в поджелудочной железе вызывает выраженную токсинемию и усиление панкреатической ферментативной активности. Пациента беспокоят лихорадка, рвота, неустойчивость стула. На втором этапе заболевания происходит гнойное и ферментативное расплавление тканей железы с формированием одной или нескольких каверн. На последней стадии воспалительный процесс распространяется на окружающие ткани, приводя к полиорганной недостаточности и смерти больного.
Заболевание имеет острое начало, обычно пациенты четко связывают появление первых симптомов с погрешностями в диете и приемом алкоголя. Около 70% больных поступают в стационар в состоянии сильного алкогольного опьянения, что говорит об очень быстром развитии патологических изменений в поджелудочной железе.
Первым симптомом обычно выступает острая опоясывающая боль, иррадиирующая в левую половину живота и поясницы, левое плечо. Безболевых форм панкреонекроза не бывает. Между выраженностью болевого синдрома и тяжестью некроза поджелудочной железы существует прямая зависимость. Распространение деструктивных изменений на нервные окончания приводит к постепенному уменьшению болевого синдрома, в сочетании с сохраняющейся интоксикацией это является плохим прогностическим признаком.
Через некоторое время после появления боли развивается неукротимая рвота, не связанная с приемом пищи и не приносящая облегчения. В рвотных массах содержится желчь, сгустки крови. Из-за рвоты развивается дегидратация, проявляющаяся сухостью кожи и слизистых, язык обложен, постепенно снижается темп диуреза. Развивается метеоризм кишечника, перистальтика ослаблена, отмечается задержка газов и стула. Интоксикация и дегидратация сопровождаются лихорадкой.
Токсемия, колебания уровня глюкозы в крови, гиперферментемия приводят к поражению головного мозга и развитию энцефалопатии, которая выражается спутанностью сознания, возбуждением, дезориентацией, вплоть до развития комы (примерно у трети пациентов).
Прогрессирование воспалительного процесса приводит к значительному увеличению поджелудочной железы в размерах, формированию инфильтрата в брюшной полости. Уже к пятым суткам от начала заболевания инфильтрат можно не только пропальпировать, но и увидеть невооруженным глазом. В проекции поджелудочной железы появляется гиперестезия кожи.
Материал и методы
В настоящее сравнительное проспективное исследование были включены 152 пациента в возрасте от 23 до 59 лет, проходивших лечение в отделении хирургии ФНКЦ ФМБА России в период с 2001 по 2012 г. с клиническим диагнозом ПН.
Основную группу составили 92 больных. На ранних сроках заболевания основной целью вмешательств являлись санация и дренирование брюшной полости и (или) ограниченных жидкостных скоплений забрюшинного пространства как метод хирургической детоксикации при неэффективности консервативной терапии (использовались эндовидеохирургическая или чрескожная пункционно-дренирующая методики). Выявление инфицированного ПН, парапанкреатических абсцессов служило абсолютным показанием к их дренированию, которое выполняли чрескожно или люмбоскопически (мини-доступ). При неэффективности малоинвазивных методик проводили традиционные открытые вмешательства.
В зависимости от стадии ПН и видов осложнений пациентам выполняли различные варианты и сочетания хирургических вмешательств. Малоинвазивные операции законченным видом хирургического лечения явились у 39 (42,4%) больных, этим пациентам всего проведено 128 малоинвазивных хирургических вмешательств, включающих диагностические операции (диагностическая видеолапароскопия, диагностические пункции под лучевым контролем). У 47 (51,1%) больных проведено комбинированное хирургическое лечение, а именно: сочетание малоинвазивных методик и открытых операций. Открытые операции, без применения малоинвазивных методик, выполнены 6 (6,5%) больным. Показаниями в этих случаях были распространенный гнойный перитонит и забрюшинная флегмона.
В фазу панкреатогенной токсемии и стерильного ПН малоинвазивные хирургические вмешательства проведены 79 (91,9%) больным. Показаниями к операции считали прогрессирование или сохранение симптомов интоксикации и ПОН в соответствии со шкалой SAPS. В фазу инфицированного панкреонекроза малоинвазивные вмешательства проведены 7 (8,1%) пациентам, остальные больные в этой стадии панкреатита прооперированы открытым способом.
В комплексном лечении больных основной группы, помимо малоинвазивных хирургических методов, использовали устройство для пролонгированной регионарной анестезии Smartinfuser Pain Pump, ультразвуковой кавитатор Sonoca-190, аппарат Prizma Flex для проведения низкопоточной гемофильтрации, аппарат Рематерп для проведения сеансов структурно-резонансной терапии (СРТ).
В группу сравнения включены 60 больных. Из них у 42 выполняли видеолапароскопию и традиционные открытые операции, а у 18 — только лапаротомные вмешательства. Обе исследуемые группы были сопоставимы по полу, возрасту, сроку заболевания и основным клинико-лабораторным показателям.
В основной группе было 69 мужчин (75%) и 23 женщины (25%), средний возраст — 47,3±3,8 года. Группу сравнения составили 41 (68,3%) мужчина и 19 (31,7%) женщин, средний возраст — 52,4±4,7 года. В основной группе (92 больных) 31 пациент поступил в стационар в течение первых 3 сут от начала заболевания, 48 — в сроки от 3 до 7 сут, 9 — от 7 до 14 сут и 4 — позже 14 сут. В группе сравнения больные по указанным выше периодам времени распределились следующим образом: 22, 29, 6 и 3 соответственно. Этиологическими факторами, вызвавшими ПН у больных основной группы, были алиментарный (погрешность в диете, употребление алкоголя) — 64 (69,6%) и билиарный (патология желчных путей) — 28 (30,4%). В группе сравнения — 39 (65%) и 21 (35%) соответственно.
Клинический диагноз устанавливали на основании анамнеза, клинической картины заболевания, данных инструментальных и лабораторных обследований, а также при видеолапароскопии или лапаротомии.
Из инструментальных методов диагностики у всех больных обеих групп использовали рентгенографию органов грудной клетки и обзорную рентгенографию органов брюшной полости, УЗИ органов брюшной полости и забрюшинного пространства, компьютерную томографию (КТ) с болюсным контрастным усилением, электрокардиографию. По показаниям выполняли эзофагогастродуоденоскопию (ЭГДС) и эндоскопические вмешательства на большом сосочке двенадцатиперстной кишки и общем желчном протоке (папиллосфинктеротомия, эндоскопическая литэкстракция, назобилиарное дренирование), видеолапароскопию. Лучевая диагностика и малоинвазивные операции проводились с помощью аппарата IU 5000 «Fhilips» и 64-срезового компьютерного томографа High Speed «General Electric». Видеолапароскопические вмешательства выполняли с использованием видеокомплекса и инструментария . Во всех наблюдениях помимо общих лабораторных методов исследования в динамике определяли уровень С-реактивного белка и прокальцитонина.
Как первый этап хирургического лечения видеолапароскопия выполнена 73 (79,3%) пациентам основной группы и 42 (70%) больным из группы сравнения. Помимо диагностического фактора лапароскопия носила лечебный характер, включая санацию и удаление токсичнго выпота из брюшной полости и сальниковой сумки, установку дренажей в брюшную полость, катетеризацию круглой связки печени и последующим введением анальгетических растворов. Кроме того, у 16 больных во время лапароскопии произведено чрескожное чреспеченочное дренирование желчного пузыря с целью ликвидации билиарной гипертензии.
Оценку тяжести ПН при поступлении в стационар проводили с помощью интегральных шкал Ranson, Apache-II, а также по данным компьютерной томографии, в системе Balhtasar. Тяжелый П.Н. в основной группе был установлен у 34 (37%) больных, средней тяжести — у 58 (63%). В группе сравнения — соответственно у 23 (38,3%) и 37 (61,7%) пациентов.
Комплексное консервативное лечение в обеих группах включало индивидуальную тактику лечения заболевания в зависимости от его этиологии (автономный или билиарный), купирование болевого синдрома (эпидуральная анестезия), зондирование и аспирацию желудочного содержимого, нутритивную поддержку, интенсивную терапию (направленная на восстановление гемодинамики, регидратацию, коррекцию нарушений кислотно-основного состояния, поддержание оптимального уровня доставки кислорода), блокаду секреторной функции ПЖ (октреотид), антибактериальную и противоязвенную терапию, методы экстракорпоральной детоксикации (рис. 1).
Рис. 1. Схема лечебной тактики при панкреонекрозе в зависимости от этиологии заболевания. ОП — острый панкреатит; УЗИ — ультразвуковое исследование; ЭГДС — эзофагогастродуоденоскопия; КТ — компьютерная томография; МРПХГ — магнитно-резонансная панкреатохолангиография; БСДПК — большой сосочек двенадцатиперстной кишки.
Оценку эффективности лечения пациентов ПН в основной группе проводили путем сравнения длительности клинических проявлений, динамики лабораторных и инструментальных показателей, количества осложнений и летальных исходов, сроков пребывания больного в стационаре относительно таковых в группе сравнения.
Весь цифровой материал обработан статистически с использованием пакета программ Statistica 6.0 («Stat-Soft», 2001). Результаты считали достоверными при p
<0,05.
Осложнения
Указанные патологические сдвиги в организме приводят к формированию полиорганной недостаточности на фоне тяжелого токсического гепатита, нефрита, кардита, дыхательных нарушений. Панкреонекроз может осложняться шоком, перитонитом, абсцессом брюшной полости, желудочно-кишечными кровотечениями.
Из местных осложнений часто встречаются абсцесс, киста или ложная киста поджелудочной железы, ферментная недостаточность, фиброз поджелудочной железы, флегмона забрюшинной клетчатки, язвы ЖКТ, тромбоз воротной и мезентериальных вен.
Диагностика
Осмотр пациента должен осуществляться совместно гастроэнтерологом, хирургом, реаниматологом. Наличие панкреонекроза предполагает крайнюю тяжесть состояния пациента, поэтому во всех случаях рекомендуется госпитализация в отделение интенсивной терапии. В отделении производится постоянное определение ферментов поджелудочной железы в крови и моче. Плохим прогностическим признаком является прогрессирующий рост уровня амилазы либо резкий скачок данного показателя.
При физикальном осмотре отмечается вздутие живота, на боковых поверхностях передней брюшной стенки и пояснице появляются синюшные пятна (проявление внутренних гематом, кровоизлияний в мягкие ткани). Кожные покровы землисто-бледные или желтушные, мраморные, холодные. Тахикардия, артериальная гипотония, учащенное поверхностное дыхание являются признаком тяжелой интоксикации. Диагноз подтверждается с помощью:
Дифференциальный диагноз проводят с кишечной непроходимостью, острыми воспалительными заболеваниями аппендикса, желчного пузыря, желчной коликой, перфорацией полого органа, тромбозом мезентериальных сосудов, инфарктом миокарда, разрывом аневризмы брюшной аорты.
КТ ОБП. Панкреонекроз. Диффузный отек и нарушение структуры поджелудочной железы, отсутствие накопления контраста в ее паренхиме.
Обсуждение
Наш опыт хирургического лечения ПН подтверждает данные других авторов [2, 4, 6, 12], что, определяя показания к операции, необходимо руководствоваться всем комплексом клинических, лабораторных и особенно инструментальных визуализационных (УЗИ, РКТ, лапароскопия) данных в динамике заболевания и консервативного лечения. Стерильные формы ПН, осложненные развитием ферментативного перитонита, служат абсолютным показанием к лапароскопической санации и дренированию брюшной полости. Лапаротомное хирургическое вмешательство, предпринятое в экстренном порядке по поводу ферментативного перитонита в доинфекционную фазу заболевания, следует считать ошибочным и необоснованным лечебным мероприятием [1, 5, 16].
При формировании инфицированного ПН в сочетании с абсцессом, когда область деструкции в забрюшинном пространстве соизмерима с жидкостным компонентом гнойно-некротического очага, на первом этапе хирургического лечения могут быть использованы малоинвазивные технологии в виде чрескожного дренирования гнойно-некротического очага под контролем УЗИ или РКТ (рис. 7). Подобная тактика позволяет выполнить лапаротомное вмешательство в отсроченном порядке (на 2—3-й неделе заболевания и даже позже), когда создаются оптимальные условия для разграничения зон некроза, секвестрации и жизнеспособных тканей [10, 17].
Рис. 7. Фистулограмма парапанкреатического абсцесса после чрескожного дренирования под ультразвуковым наведением.
Чрескожное дренирование панкреатогенных абсцессов различной локализации в забрюшинном пространстве представляется оптимальным способом их хирургического лечения в тех ситуациях, когда объем некроза минимален или он отсутствует, полость абсцесса не содержит замазкообразного детрита, провоцирующего постоянную обтурацию дренажей. Методы малоинвазивных хирургических вмешательств имеют несомненные преимущества также в тех случаях, когда формируются ограниченные жидкостные образования в различные сроки после лапаротомных операций, особенно после неоднократных санационных вмешательств [6, 10, 18].
В то же время считаем необходимым отметить опасность преувеличения значимости чрескожных дренирующих вмешательств в качестве основного метода лечения тех форм инфицированного ПН, при которых имеется длительная и обширная секвестрация. В подобных ситуациях для достижения лечебного эффекта, на наш взгляд, следует склоняться в пользу традиционного лапаротомного вмешательства.
В последние годы активно используют методы лапароскопической панкреатооментобурсоскопии и санации сальниковой сумки [7, 19]. С помощью эндоскопической техники выполняют лапароскопию, декомпрессию ЖП, санацию и дренирование брюшной полости и затем с использованием специально разработанного инструментария из минилапаротомного доступа осуществляют осмотр ПЖ, ее абдоминизацию, некр- и секвестрэктомию и формируют панкреатооментобурсостому и/или люмбостому. В последующем выполняют этапные санации, а между операциями через дренажи проводят проточный или фракционный лаваж полости сальниковой сумки (рис. 8). Полученные результаты лечения больных в основной группе доказывают эффективность ультразвуковой кавитации гнойных полостей (рис. 9). В качестве акустической среды предпочтительно использовать 0,02% раствор хлоргексидина, 0,9% раствор хлорида натрия, 0,25—0,5% раствор новокаина и их смеси. Бактерицидный эффект метода обусловлен повреждающим действием ультразвуковой волны на микробную клетку, образованием гибельно действующих на микроорганизмы химических соединений, снижением антибиотикорезистентности возбудителей раневой инфекции. Ультразвук стимулирует внутриклеточный биосинтез и регенераторные процессы, вызывает расширение кровеносных сосудов и увеличение регионарного кровотока в 2—3 раза, инициирует благоприятные изменения в микроциркуляторном русле и адвентиции сосудов, развитие коллатералей, что очень важно при воспалительных и гнойно-деструктивных процессах [5, 15].
Рис. 8. Области ретроперитонеального пространства, дренируемые через различные мини-доступы. 1 — бурсостома (парапанкреатическая, мезоколон), 2 — люмбостома (парапанкреатическая, мезоколон, ретроколитическая), 3 — ретроперитонеостома (ретроколитическая).
Рис. 9. Ультразвуковой кавитатор Sonoca-190 для обработки гнойных полостей.
Адекватная санация, дренирование патологических очагов в совокупности с низкой хирургической агрессией доступа при указанных вмешательствах обеспечивают преимущества по сравнению с лечением традиционными способами.
Другим фактором, определяющим более благоприятное течение послеоперационного периода, являлось минимальное разрушение анатомо-физиологических барьеров вокруг патологических очагов, что влечет за собой меньшее усиление эндогенной интоксикации по сравнению с таковым при открытых операциях.
Важная роль в адекватном обезболивании, стимуляции перистальтики кишечника, более ранней активизации пациентов принадлежит инфузионному устройству Smartinfuser Pain Pump, обеспечивающему пролонгированное замедленное введение раствора местного анестетика через ирригационный катетер непосредственно в рану (рис. 10). Из многочисленных методов экстракорпоральной детоксикации, по нашему мнению, наиболее эффективной оказалась низкопоточная гемофильтрация с помощью аппарата Prizma Flex (рис. 11).
Рис. 10. Устройство для пролонгированной регионарной анестезии Smartinfuser Pain Pump с ирригационным катетером, помещаемым в забрюшинное пространство.
Рис. 11. Общий вид аппарата Prizma Flex для проведения низкопоточной гемофильтрации.
Пропагандируя широкое применение малоинвазивных операций при лечении больных деструктивным панкреатитом, мы считаем, что при их неэффективности открытые вмешательства являются операциями резерва. Вместе с тем использование малоинвазивных технологий в комплексе с консервативной терапией у пациентов данной категории позволяет усилить эффект детоксикации, стабилизировать состояние больных и выполнить открытые операции в более благоприятных условиях, что еще раз подчеркивает необходимость применения рассмотренных методов, особенно на начальном этапе лечения заболевания.
Мы согласны с мнением E. Bradley (США, 1992), что «не много можно найти иных заболеваний, требующих от врача такой же гибкости в диагностике и лечении, какая необходима клиницисту, оказывающему помощь больному острым панкреатитом». Поэтому его лечение должно быть комплексным и опережающим, а эффективные хирургические методики обязательно сочетаться с адекватной консервативной терапией и реабилитацией.
Учитывая основные звенья патогенеза и фазы течения ПН, а также принимая во внимание доказанные возможности метода СРТ в купировании отека, улучшении микроциркуляции, нормализации тонуса и работы кишечника, восстановлении нормального (генетически обусловленного) функционирования вегетативной нервной системы, позволяет рекомендовать использование метода СРТ в комплексном лечении больных ПН [20].
Методика СРТ при данном заболевании патогенетически обоснована (способствует более раннему разрешению пареза кишечника и уменьшает патологическое воздействие микрофлоры кишечника на ПЖ) при остром панкреатите, проста в исполнении, безопасна и не требует больших финансовых затрат (рис. 12).
Рис. 12. Аппарат Рематерп для проведения сеансов структурно-резонансной терапии.
В настоящее время продолжается процесс пересмотра диагностических и лечебных программ при ПН, что обусловлено появлением современных высокоинформативных диагностических методов, новых медикаментозных средств и эффективных малоинвазивных хирургических методик.
Лечение панкреонекроза
Консервативная терапия
Лечение панкреонекроза начинают с обеспечения полного покоя воспаленной поджелудочной железе. Исключаются физические нагрузки, энтеральное питание, может назначаться промывание желудка прохладными растворами. Основными направлениями лечения являются обезболивание, обезвреживание протеолитических ферментов, дезинтоксикационная терапия.
- Аналгезия. Адекватное обезболивание включает в себя введение анальгетиков (при необходимости — наркотических), спазмолитиков, рассечение капсулы поджелудочной железы, новокаиновые блокады. Уменьшение отека железы под влиянием диуретиков приводит к угасанию болевого синдрома (так как ведет к ослаблению натяжения панкреатической капсулы).
- Инфузионная терапия. Дезинтоксикация проводится большим количеством инфузионных растворов под контролем диуреза. В инфузионный раствор добавляют апротинин. Обязательно назначаются антигистаминные препараты.
- Антибиотикотерапия. С целью профилактики гнойных осложнений проводится антибактериальная терапия антибиотиками широкого спектра действия. Симптоматическое лечение включает в себя противошоковые мероприятия, восстановление функции других органов и систем.
Хирургическое лечение
Практически во всех случаях развития панкреонекроза требуется проведение хирургического лечения для восстановления оттока панкреатических соков, удаления некротических масс (некрэктомия поджелудочной железы). В первые пять суток от начала патологического процесса проводить оперативное вмешательство не рекомендуется, так как в эти сроки еще невозможно оценить уровень некроза, зато повышается риск вторичного инфицирования и послеоперационных осложнений.
На этапе гнойного воспаления в брюшной полости могут использоваться разнообразные методики (пункционные, лапароскопические, лапаротомные) восстановления оттока из протоков поджелудочной железы; устранения некротических масс, воспалительного и геморрагического экссудата; остановки внутрибрюшного кровотечения. Для улучшения состояния внутренних органов может потребоваться дренирование брюшной полости.
Результаты
Из 92 пациентов с ПН в основной группе комплексное лечение с применением малоинвазивных методик оказалось эффективным и достаточным у 39 (42,4%); 47 (51,1%) пациентам после малоинвазивных вмешательств выполнены открытые операции. В группе сравнения только видеолапароскопические вмешательства выполнены у 11 (26,2%) больных из 42, а 31 (73,8%) перенес комбинированное хирургическое лечение (видеолапароскопию + лапаро- или люмботомию).
При поступлении больных с клинической картиной ПН лечебно-диагностический алгоритм в зависимости от характера течения заболевания заключался в следующих этапах: 1) определение распространенности деструктивного процесса в ПЖ, наличие или отсутствие перитонита; 2) выявление степени вовлечения в воспалительный процесс парапанкреатической клетчатки и забрюшинного пространства; 3) определение тяжести синдрома ПОН; 4) выявление инфицирования.
Основными показаниями к видеолапароскопическим вмешательствам являлись ферментативный перитонит, наличие свободной жидкости в брюшной полости и по данным лучевых методов диагностики; стерильный панкреонекроз с прогрессирующей ПОН на фоне адекватной интенсивной терапии.
В обеих группах лапароскопическая санация с дренированием брюшной полости выполнена у 115 (75,7%) из 152 больных (рис. 2). Основными областями дренирования являлись правое подреберье и полость малого таза. В 42 (36,5%) случаях наличие патологического экссудата в полости малого сальника обусловило необходимость его вскрытия с последующей аспирацией выпота и дренированием. В связи с распространением патологического процесса на забрюшинную клетчатку у 22 (19,1%) больных возникла необходимость вскрытия, дренирования забрюшинного пространства с мобилизацией ободочной кишки.
Рис. 2. Лапароскопическая чреспеченочная холецистостомия, санация и дренирование брюшной полости при панкреонекрозе (эндофото).
При наличии билиарной гипертензии, напряженном и увеличенном желчном пузыре, без признаков холедохолитиаза во время операции выполняли лапароскопическую холецистостомию — у 26 (22,6%) больных (рис. 3). В других случаях при необходимости осуществляли чрескожно-чреспеченочную холецисто- или холангиостомию под ультразвуковым наведением. Осложнений, связанных непосредственно с видеолапароскопическими операциями, не было.
Рис. 3. Интраоперационный вид выполненной при лапароскопии чрескожной чреспеченочной холецистостомии.
В основной группе малоинвазивные технологии с применением лучевой навигации проводили на всех этапах лечения ПН и во всех фазах заболевания с целью снижения фактора операционный травмы. Диагностическое чрескожное пункционное вмешательство давало возможность определить наличие бактериальной контаминации, оценить распространенность процесса деструкции и не усугубляло имеющийся у пациентов эндотоксиновый шок.
Показаниями к пункционным и дренирующим лечебным чрескожным вмешательствам при ПН считали: 1) жидкостные отграниченные скопления в брюшной полости, сальниковой сумке, в забрюшинном пространстве; 2) формирующиеся постнекротические псевдокисты диаметром более 5 см; 3) абсцессы брюшной полости и забрюшинного пространства; 4) признаки билиарной гипертензии.
Полученный опыт показывает, что сочетание управляемого чрескожного дренирования некротических очагов множественными дренажами большого диаметра с регулярной заменой дренажей с увеличением их диаметра, агрессивная ирригация очагов и некрэктомия через просвет ретроперитонеостом дает возможность в большинстве случаев избежать открытых операций (рис. 4). Применение малоинвазивных процедур позволяет устранить септические проявления и в дальнейшем выбрать более подходящее время для открытого хирургического вмешательства в условиях наступившей демаркации некротизированных тканей ПЖ и забрюшинного пространства.
Рис. 4. Санация и дренирование забрюшинной клетчатки через бурсо- и люмбостомы. а — компьютерная томограмма в сагиттальной плоскости, распространенное поражение забрюшинной клетчатки (стрелки); б — общий вид того же больного после формирования бурсо- (1) и люмбостомы (2).
При обнаружении жидкости в полости малого сальника, парапанкреатической, паракольной клетчатке, в брюшной полости выполняли диагностическую пункцию, задачей которой является определение контаминации и удаления токсичного экссудата. Для оценки степени инфицирования экссудата проводили бактериоскопическое и бактериологическое исследование с оценкой чувствительности к антибактериальным препаратам.
В случае отграниченных жидкостных скоплений в полости малого сальника или забрюшинном пространстве более 5 см применяли кратковременное дренирование сроком от 2 до 3 сут, с просветом дренажей 12—15 Fr (4—5 мм). Контроль за состоянием брюшной полости и забрюшинного пространства осуществляли ежедневно с помощью УЗИ, при затрудненной визуализации — рентгеновской компьютерной томографией (РКТ) или магнитно-резонансной томографией.
При проведении дренирующих чрескожных операций были использованы следующие методы: стилет-катетер (одноэтапный), двухэтапный, троакарный. Выбор методики дренирования осуществляли в зависимости от топографии, размеров и характера патологического очага. Первичное дренирование выполняли дренажами 12—15 Fr. На 3—4-е сутки проводили замену дренажей с просветом 16—18 Fr и затем до 30 Fr.
Для дренирования забрюшинного пространства без контакта с брюшной полостью предпочитали троакарный способ, позволяющий одномоментно установить дренажи большого диаметра и «гильзы» ретроперитонеостомы. Через ретроперитонеостомические отверстия осуществляли лапароскопический осмотр, санацию забрюшинного пространства и удаление секвестров. Данный вид хирургического вмешательства проведен 27 (29,3%) пациентам из основной группы, при этом 9 больным вмешательство выполняли от 2 до 4 раз.
В абсцессы объемом более 100 мл обычно устанавливали 2 дренажа и более. Большинству пациентов дренирование проводили сразу из различных точек, которые выбираем с учетом возможно большего охвата дренируемого объема и адекватности дренирования (рис. 5). Последующая замена дренажей на более крупный диаметр позволяла сохранять адекватность дренирования. При наличии секвестров проводили замену на дренажи с просветом до 30 Fr, что позволяло удалять крупные фрагменты некротических тканей.
Рис. 5. Внешний вид пациента К., 48 лет, после пункционно-дренирующих вмешательств при левостороннем типе гнойного парапанкреатита.
Несмотря на преимущества метода (отсутствие необходимости общего обезболивания, минимальная хирургическая агрессия, возможность проведения вмешательства через полые органы), осуществление таких операций в случаях преобладания тканевого (или солидного) компонента над жидкостной частью полости было ограниченным. Осложнения в данной группе больных возникли у 6 (4,8%) пациентов: наружный и внутренние кишечные свищи — у 3, дислокация холецистостомы — у 1 и внутрибрюшинное кровотечение — у 2 (рис. 6).
Рис. 6. Фистулограммы. а — сообщение парапанкреатической гнойной полости с нисходящим отделом толстой кишки; б — сообщение парапанкреатической гнойной полости с двенадцатиперстной кишкой.
Главной проблемой, ограничивающей применение малоинвазивных методик, являлись массивное вовлечение в инфильтративный процесс забрюшинной клетчатки, секвестры в полостях деструкции, формирование полостей по типу песочных часов, что не позволяло в ряде случаев выполнить адекватное дренирование или замену дренажей по проводнику под рентгенологическим контролем. В такой ситуации применяли методику гибковолоконной фистулоскопии дренированных полостей. Под визуальным и рентгенологическим контролем у 14 больных (после чрескожного и люмбоскопического дренирования) с помощью эндоскопа осуществляли фрагментацию и удаление секвестров, бужирование наружных и внутренних свищевых ходов с более адекватной установкой дренажей. Операцию выполняли под местной анестезией, используя фистулоскоп диаметром 7 мм. Во всех случаях методика оказалась эффективной и дополнительной дренирующей операции не потребовалось.
У 13 (16,8%) больных со сформировавшимися очагами деструкции применяли оригинальную малоинвазивную методику — люмбоскопическое вскрытие, санация и дренирование широкопросветными дренажами под ультразвуковым контролем и с использованием лапароскопии. Указанная операция позволила в полной мере ревизовать забрюшинное пространство, под инструментальным и визуальным контролем вскрыть, санировать и адекватно дренировать патологические очаги. У 4 больных полости локализовались в области головки ПЖ — соответственно операция выполнена через правую поясничную область, у остальных 9 пациентов деструктивные очаги находились в области хвоста и тела железы — доступ через левую поясничную область. Во всех случаях вскрытия полостей получено гнойное содержимое, у 5 пациентов очагом деструкции являлся инфицированный панкреонекроз с большим количеством детрита, крупных секвестров, у 8 операция выполнена по поводу парапанкреатических абсцессов.
После дренирования проводилось активное местное и общее лечение. Сохранение целостности париетальной брюшины исключало распространение гнойного процесса в брюшную полость, что положительно сказалось на течении послеоперационного периода в виде меньшей интоксикации, быстрого очищения полостей деструкции, отсутствия специфических осложнений (спаечная непроходимость кишечника, тонкокишечные свищи, абсцессы брюшной полости). Контроль над динамикой состояния дренированных полостей, их размерами осуществляли при помощи УЗИ, динамической фистулографии с заменой и более адекватной установкой дренажей по требованию. В послеоперационном периоде у 2 пациентов сформировались неполные наружные толстокишечные свищи, не потребовавшие повторных хирургических вмешательств.
Общие результаты лечения пациентов ПН представлены в таблице.
Основные результаты комплексного лечения больных панкреонекрозом
Анализ результатов показал, что основной причиной неэффективности малоинвазивного лечения являлось тотальное распространение в забрюшинном пространстве инфицированного ПН с преобладанием плотного тканевого компонента, и это затрудняло выполнение адекватной санации путем малоинвазивных методик. Во всех случаях основной причиной летального исхода в обеих группах было прогрессирование ПОН на фоне гнойно-септических осложнений.
Прогноз и профилактика
Составление прогноза для пациентов с панкреонекрозом является очень сложной задачей, так как зависит от многих обстоятельств. Значительно ухудшается прогноз при наличии одного или нескольких из следующих факторов: возраст более пятидесяти пяти лет, лейкоцитоз более 16х109/л, гипергликемия, гипокальциемия, метаболический ацидоз, артериальная гипотензия, повышение уровня мочевины, ЛДГ и АСТ, значительные потери жидкости из кровеносного русла в ткани. Наличие семи из указанных критериев обеспечивает 100% летальность пациента. Профилактика панкреонекроза заключается в своевременном обращении за медицинской помощью, раннем начале лечения, в том числе и хирургического.