Печень – орган, который выполняет в организме человека много разных функций. В частности, она является биологическим «фильтром», который собирает кровь от кишечника через воротную вену и очищает её от токсичных веществ.
При циррозе и раке печени давление в воротной вене повышается – развивается состояние, которое врачи называют портальной гипертензией. Оно способствует тому, что в брюшной полости начинает скапливаться жидкость, развивается асцит. [1,15]
- Причины асцита при циррозе и раке печени
- Асцит при раке поджелудочной железы
- Симптомы асцита при циррозе и раке печени
- Лечение асцита при циррозе и раке печени
- Цены
Об органе и заболевании
Печень – орган многофункциональный. Один из аспектов ее работы – очищение организма. Будучи своеобразным фильтром, печень собирает кровь от кишечника через воротную вену и очищает ее от токсинов.
Серьезнейшее заболевание органа – это цирроз. Он представляет собой патологический процесс, при котором гибнут здоровые ткани и замещаются фиброзными. Такие повреждения столь серьезны, что имеют необратимый характер и приводят к полному прекращению работы органа.
Что же качается асцита, то эта патология характеризуется избыточным накоплением жидких масс в брюшной полости. Она вторична по своей природе, и осложняет цирроз печени и некоторые иные заболевания.
Если вовремя не оказать необходимую медицинскую помощь, заболевание будет сопровождаться электролитными нарушениями и потерей белка. Это влечет за собой ухудшение функционирования внутренних органов, чем весьма усугубляет прогноз заболевания основного.
Асцит при циррозе печени начинает развиваться вследствие значительного повышения давления в воротной вене.
В нормальном состоянии брюшины в ней постоянно присутствует незначительное количество жидкости, брюшина без проблем всасывает ее обратно.
Чрезмерное повышение давления в воротной вене дает импульс целому каскаду патологических реакций. Они и приводят к дисбалансу работы брюшины: та просто уже не в состоянии всасывать жидкость. Таким образом, жидкие массы скапливаются в брюшной полости.
Патогенетические подходы к диуретической терапии асцита у больных циррозом печени
Асцит — одно из самых значимых осложнений цирроза печени, которое возникает примерно у 40–50% пациентов за 10-летний период от постановки диагноза. Развитие асцита считают важным неблагоприятным прогностическим признаком прогрессии заболевания, так как он связан с50% смертностью втечение двух ближайших лет [23, 26].
До настоящего времени механизмы формирования асцита при циррозе печени остаются недостаточно ясными. Каким образом накапливается жидкость в брюшной полости, в чем физиологическая сущность данного процесса, какова его связь с центральной гемодинамикой, состоянием почек и брюшины? Почему именно данный синдром является поворотным в жизни пациентов с циррозом и независимо от этиологии заболевания определяет дальнейшую выживаемость и качество жизни этих больных?
Кроме того, прогрессивный рост фармакологического рынка почти не заметен в гепатологии. Тогда как в других областях медицины, например в кардиологии, ежегодно принимаются согласительные документы по лечению пациентов с сердечной недостаточностью (СН), куда включаются новые мочегонные препараты, оптимизируются схемы и подходы к терапии. Лечение отечно-асцитического синдрома у кардиологического больного четко отработано, тогда как обсуждение принципов курации гепатологического пациента влечет за собой целый ряд споров и разногласий.
Эти и многие другие вопросы уже сегодня требуют своего разрешения, прежде всего для врачей-специалистов, ежедневно участвующих в лечении больных хроническими заболеваниями печени.
Механизмы возникновения асцита у больных циррозом печени
Развитие асцита обусловлено повышенной лимфопродукцией в печени в связи с блокадой оттока из нее венозной крови, однако его возникновение начинается с момента повреждения гепатоцитов, т. е. с этапа гепатита.
Основными механизмами развития отечно-асцитического синдрома являются (
):
- нарушение функции печени (гепатопривный синдром);
- выброс вазодилятаторов и цитокинов поврежденными гепатоцитами;
- активация симпато-адреналовой (САС) и ренин-ангиотензин-альдестероновой системы (РААС) с последующим нарушением функции сердечно-сосудистой системы (ССС) и почек;
- формирование портальной гипертензии (ПГ): • вследствие активации клеток синусоидального компартмента с развитием функциональной ПГ; • активации процессов фиброгенеза в печени с нарушением ее сосудистого русла и развитием органической ПГ;
- блокада венозного и лимфатического оттока от печени.
Остановимся на более детальном рассмотрении данных положений.
Развитие синдрома печеночно-клеточной недостаточности (ПКН) у больных циррозом печени. Характеризуется:
- нарушением синтеза белков и развитием гипоальбуминемии, которая приводит к снижению онкотического давления плазмы крови, при этом усиливается выход жидкости из сосудистого русла, уменьшается объем внутрисосудистой жидкости, снижается наполнение центрального артериального русла (эффективный объем циркулирующей крови (ОЦК)), что компенсаторно повышает активность РААС и увеличивает уровень альдостерона, вызывающего задержку жидкости. Однако в условиях сохраняющейся патологии печени компенсаторный механизм (активация РААС) становится патологическим, способствуя дальнейшей задержке жидкости в организме, формированию асцита и отеков;
- нарушением детоксицирующей функции печени, что сопровождается расстройством катаболизма гормонов, увеличением содержания в крови эстрогенов, обладающих антидиуретическим действием и стимулирующих задержку жидкости и активацию РААС.
Выброс вазодилятаторов и цитокинов поврежденными гепатоцитами. Нарушение детоксицирующей функции печени, развитие ПКН и порто-кавального шунтирования способствуют проникновению в кровь из поврежденных гепатоцитов вазодилятаторов, таких как глюкагон, оксид азота, простагландин E2α, предсердный натрий-уретический гормон, вазоинтестинальный пептид, простациклин, что приводит к генерализованной вазодилятации и снижению общего периферического сопротивления сосудов (ОПС). При этом в эндотелии сосудов печени, под влиянием эндотоксинов и цитокинов, синтезируются мощные вазоконстрикторы, в частности эндотелин-1, что вызывает спазм сосудов. То есть происходит разобщение местного и общего кровотока, связанное с дисбалансом вазодилятирующих и вазоконстриктивных веществ, что приводит:
- к активации и трансформации синусоидальных клеток Ито в миофибробласты, которые сокращаются, сужают просвет синусоидов, формируя функциональную ПГ, вместе с клетками Купфера синтезируют коллаген и вазоактивные вещества, стимулирующие САС и РААС;
- к неадекватной периферической вазодилятации, вызывая компенсаторную активацию САС и РААС, повышение уровня антидиуретического гормона (АДГ).
Активация САС и РААС. Активированные САС и РААС воздействуют на основные мишени:
- ССС: следствием периферической вазодилятации является увеличение ОЦК, ударного объема (УО), минутного объема кровотока (МОК) и формирование гиперкинетического типа кровообращения. Гиперкинетическое состояние центральной гемодинамики первоначально имеет компенсаторный характер, направленный на увеличение центрального эффективного объема циркулирующей крови и внутрипеченочного кровотока, что препятствует снижению портального давления при развитии порто-системных коллатералей. Однако уже на ранних этапах такой тип гемодинамики приводит к функциональной перегрузке миокарда, способствуя развитию диастолической, а впоследствии и систолической его дисфункции, реализуя системные проявления заболевания в виде СН и асцита [20, 22, 24, 37];
Основными факторами поражения ССС при циррозе печени являются шунтирование крови с прямым токсическим воздействием на миокард биологически активных веществ (адреналина, гистамина, серотонина), дисметаболические расстройства, связанные с нарушением печеночных функций, вегетативные нарушения, длительная гиперактивация САС и РААС [7, 35, 38]. Совокупность нарушений обмена биологически активных веществ приводит к развитию так называемой метаболической кардиомиопатии с дилятацией полостей сердца и СН. Данное состояние усугубляется хронической функциональной перегрузкой сердца на фоне гиперкинетического типа кровообращения [2, 4, 6]. То есть при развитии заболевания печени развивается системная реакция, которая реализуется через вовлечение в процесс ССС, формируя аналогичные СН способы компенсации и декомпенсации с возникновением отечно-асцитического синдрома [11, 12, 34].
- Почки: снижением кровотока в корковом слое на фоне гипердинамического типа кровообращения, что приводит к сужению сосудов, высвобождению ренина и повышению уровня альдостерона. Компенсаторно для восстановления ОЦК эти системы стимулируют увеличение реабсорбции натрия и воды, вызывая переход жидкости в межклеточное пространство, что приводит к формированию асцита и отеков [5, 8].
Основными факторами поражения почек при циррозе печени являются:
- • снижение почечного кровотока и перфузии коркового вещества почек в результате шунтирования крови по анастомозам в субкортикальном слое;
- • уменьшение эффективного ОЦК;
- • повышение уровня вазоконстрикторов (эндотелина-1, тромбоксана и др.);
- • снижение синтеза простагландинов и калликреина почками, оказывающих сосудорасширяющее действие.
Поражение почек развивается вследствие нарушения баланса между системной вазодилятацией и почечной вазоконстрикцией. Несмотря на характерную для цирроза печени системную вазодилятацию, в почках, как и в печени, происходит вазоконстрикция, что приводит к снижению скорости клубочковой фильтрации, уровень ренина в плазме при этом возрастает. Натрий компенсаторно усиленно реабсорбируется в почечных канальцах, что вызывает повышение осмолярности мочи. Происходит накопление жидкости в организме, несмотря на нормальный объем мочи, малосолевую диету и диуретическую терапию. Во внепочечных сосудах преобладает расширение артерий, и в результате снижается ОПС с развитием артериальной гипотензии. Сердечный выброс не изменяется или даже повышен, однако эффективный почечный кровоток уменьшается в результате перераспределения кровотока в селезенку, кожу и другие органы, таким образом происходит шунтирование коркового слоя почек. Наиболее ранним признаком включения почечного механизма при развитии асцита у больных циррозом печени является задержка натрия в организме, что проявляется снижением суточной экскреции натрия с мочой менее 78 ммоль/сут [8, 16].
Задержка натрия почками — это одна из вероятных причин асцита, предшествующая накоплению асцитической жидкости. На ранних этапах она является результатом блокады венозного оттока из печени и первичной вазодилятации.
Формирование ПГ. Развитие мощного дисбаланса вазоактивных веществ, вызывающего спазм синусоидов, а также способствующего активному фиброгенезу в печени, с формированием цирротических узлов, приводят к нарушению венозного русла печени и развитию ПГ.
Обратимость асцита определяется стадией ПГ. Асцит потенциально обратим, если имеется функциональная ПГ, и необратим, если произошли изменения сосудистого русла печени и сформировалась органическая ПГ [1, 11].
Функциональная (синусоидальная) ПГ определяется [19, 23, 38]:
- вегетативным тонусом;
- сокращением клеток Ито и, как следствие, сужением просвета синусоидов и выделением ими вазоактивных веществ, стимулирующих САС и РААС;
- тонусом печеночных сосудов, регулируемым вазоактивными субстанциями;
- реологическими свойствами крови всосудах портальной системы.
Органическая ПГ формируется на фоне нарушения цитоархитектоники печени, она определяется [23]:
- сдавлением и деструкцией синусоидов;
- портопеченочными шунтами;
- разрастанием соединительной ткани в центролобулярных зонах долек.
При этом важно отметить, что даже на этапе органической ПГ сохраняется ее функциональный компонент, который можно уменьшить, используя медикаментозную терапию, направленную на коррекцию состояния САС, РААС, реологию крови и другие патогенетические звенья.
Блокада венозного и лимфатического оттока от печени. Повышенное давление в портальной системе приводит к нарушению венозного оттока из печени и непарных органов брюшной полости, что сопровождается переполнением синусоидов, усилением продукции лимфы в печени.
У больных циррозом печени объем суточного лимфооттока через грудной лимфатический проток может увеличиваться до 20 литров. Лимфа из сосудов печени и непарных органов пропотевает в брюшную полость, формирует асцит, устанавливая динамическое равновесие с процессом всасывания ее в кишечные капилляры.
Таким образом, условно можно выделить несколько уровней формирования асцита, тесно взаимосвязанных между собой:
- гуморальный-метаболический, определяемый дисбалансом вазоактивных субстанций (вазодилятаторов и вазоконстрикторов), гипоальбуминемией, дисэлектролитными нарушениями, гиперэстогенемией, ростом АДГ;
- клеточный, определяемый специфическим реагированием клеток печени (гепатоцитов, эндотелиоцитов, клеток Купфера, Ито) и брюшины (мезотелиоцитов);
- органный, определяемый исходным состоянием, вовлечением в процесс и специфическим реагированием органов-мишеней (собственно печени, ССС, почек);
- системный, определяемый характером нейроэндокринного реагирования САС, РААС и системной реализацией ПГ.
При этом обратимость указанных изменений зависит от стадии ПГ (функциональной или органической).
Классификация асцита
В зависимости от количества асцитической жидкости и эффективности терапии выделяют:
- начальный или транзиторный (до 400 мл, выявляется при ультразвуковом исследовании);
- умеренный (когда асцит не напряжен и хорошо поддается терапии);
- выраженный или напряженный асцит;
- резистентный асцит (вариант напряженного асцита, резистентного клечению).
Критериями резистентного (рефрактерного) асцита являются отсутствие снижения или снижение массы тела менее 200 г/сут у больного в течение 7 дней на фоне низкосолевой диеты (5,2 г поваренной соли в сутки) и интенсивной диуретической терапии (спиронолактон по 400 мг/сут и фуросемид по 160 мг/сут), а также уменьшение экскреции натрия с мочой менее 78 ммоль в сутки [16, 25]. О резистентном асците говорят также в тех случаях, когда он не уменьшается или быстро рецидивирует после парацентеза или осложнения диуретической терапии не позволяют назначать диуретики в эффективных дозах. В практике критерии резистентного асцита выявляются менее чем у 10% пациентов с циррозом печени.
Причинами резистентного асцита, как правило, являются:
- избыточный прием натрия и жидкости;
- неадекватная мочегонная терапия;
- гипотония;
- алкалоз;
- гипокалиемия, гипонатриемия, гипоальбуминемия;
- прием нестероидных противовоспалительных средств;
- прогрессирование заболевания печени;
- синдром Бадда–Киари;
- канцероматоз брюшины;
- спонтанный бактериальный перитонит (СБП).
Многие причины рефрактерности асцита являются потенциально обратимыми, поэтому своевременное их устранение может значительно повысить эффективность проводимой терапии.
Лечение асцита у больных циррозом печени
Следует отметить, что сама по себе задача терапии асцита у больных циррозом печени труднее, чем лечение других форм накопления жидкости в организме, потому что формирование отечно-асцитического синдрома является проявлением значительной декомпенсации заболевания. По результатам контролируемых исследований появление асцита значительно ухудшает качество жизни и увеличивает риск развития фатальных осложнений цирроза печени [27, 39], поэтому его терапия представляет собой одну из важнейших составляющих успешного лечения этих больных. Однако, с учетом того, что в развитии асцита задействованы сложные нейрогормональные механизмы, бездумная дегидратация может вызвать лишь побочные эффекты и «рикошетную» задержку жидкости.
Режим, диета и потребление жидкости больными циррозом печени и асцитом. У пациентов с асцитом, не ограничивающих потребление соли с пищей, суточная экскреция натрия с мочой снижена до 78 ммоль и менее, при этом внепочечные потери натрия могут достигать 10 ммоль/сут.
Употребление больными циррозом печени натрия более 90 ммоль/сут ведет к развитию асцита, так как каждый грамм натрия задерживает до 200 мл жидкости. Поэтому с пищей в течение суток рекомендуется употреблять не более 90 ммоль натрия (5,2 г поваренной соли), в сочетании с ограничением до 1 литра в сутки количества жидкости. При этом важно учитывать, что ограничение жидкости не показано больным с низким содержанием Nа в сыворотке крови (менее 120 ммоль/л) [16].
На сегодняшний день не опубликовано исследований, которые демонстрировали бы положительное или отрицательное влияние ограничения воды на разрешение асцита. Большинство экспертов считают, что у больных с неосложненным асцитом роль ограничения воды отсутствует. Несмотря на это во многих центрах диета с ограничением воды у пациентов с асцитом и гипонатриемией стала стандартом клинической практики. В этом вопросе существует много противоречий, и лучший подход пока не найден. Как правило, гепатологи лечат таких больных со строгим ограничением воды. С точки зрения патогенеза гипонатриемии, такое лечение является алогичным и может ухудшить тяжесть центральной гиповолемии, которая запускает неосмотическую секрецию АДГ. Еще большее повышение концентрации циркулирующего АДГ ведет к дальнейшему снижению почечной функции. Нарушенный клиренс свободной воды имеют 25–60% пациентов с цирротическим асцитом, при этом у них часто развивается спонтанная гипонатриемия.
Погрешности в диете часто служат причиной плохо поддающегося лечению (резистентного, рефрактерного) асцита. При употреблении большого количества соли применение современных мочегонных препаратов даже в высоких дозах окажется неэффективным.
Диета должна быть по существу вегетарианской, так как большинство продуктов с высоким содержанием белка (мясо, яйца и молочные продукты) содержат много натрия, поэтому в связи с этим рацион нужно дополнять белковой пищей с низким содержанием натрия. Рекомендуется употреблять бессолевой хлеб, масло и все блюда готовить без добавления соли. Показаны также продукты, богатые калием и микроэлементами. Энергетическая ценность диеты должна составлять ~1500–2000 ккал с содержанием 70 г белка и 90 ммоль натрия в сутки.
Пациенту с асцитом рекомендуется ограничение физической активности, что способствует уменьшению количества метаболитов, образующихся в печени. Также в положении лежа несколько усиливается портальный венозный и почечный кровоток.
Общие подходы к терапии асцита у больных циррозом печени. Стратегические направления терапии асцита включают ограничение соли в пище и медикаментозное выведение избыточной жидкости из организма. Кроме этого, исходя из рассмотренных позиций патогенеза асцита у больных циррозом печени, важно решить терапевтические задачи по коррекции ПГ, ПКН, блокированию периферических вазодилятаторов, подавлению активности САС и РААС, нормализации функции ССС, почек и т. д.
Для безопасного медикаментозного выведения жидкости из организма необходимо соблюдение трех этапов:
- Избыточная жидкость должна быть переведена из внеклеточного пространства в сосудистое русло.
- Избыточная жидкость должна быть доставлена к почкам, где обеспечится ее фильтрация.
- При попадании первичной мочи в почечные канальцы должна быть блокирована реабсорбция, это обеспечит выведение избыточной жидкости из организма [13].
Для перевода избыточной жидкости из внеклеточного пространства в сосудистое русло используются:
- активные мочегонные средства (диуретики), которые за счет снижения ОЦК и гидростатического давления облегчают переход жидкости из внеклеточного пространства в сосудистое русло;
- гемодинамически активные нейрогормональные модуляторы: бета-блокаторы, ингибиторы ангиотензин-превращающего фермента (ИАПФ), антагонисты рецепторов ангиотензина (АРА) [4, 16];
- средства, повышающие в крови онкотическое (препараты плазмы крови и альбумина) и осмотическое давление (антагонисты альдостерона, усиливающие ионообмен и уменьшающие выраженность гипонатриемии разведения).
Наиболее оптимальными бета-блокаторами у пациентов с заболеваниями печени, эффективность которых подтверждена результатами метаанализа, являются неселективные производные группы пропранолола — Анаприлин в индивидуально подобранной дозе — 40–80 мг/сут или карведилол в индивидуальной дозе — 25–50 мг/сут [3, 14, 28, 31].
Среди ИАПФ у больных циррозом печени препаратами выбора является группа лизиноприла в индивидуально подобранной (2,5–20 мг/сут) дозе или препарат с двойным путем выведения спираприл по 6 мг/сут.
В отличие от других представителей этого класса они являются готовой лекарственной формой, а их эффективность подтверждена результатами сравнительных исследований [11, 17].
Из АРА у данной категории пациентов может использоваться эпросартан в индивидуально подобранной дозе — 300–600 мг/сут. В открытых исследованиях продемонстрирована эффективность препаратов данной группы у больных циррозом печени [32, 40].
Для доставки избыточной жидкости к почкам применяют положительные инотропные средства:
- сердечные гликозиды, критерием назначения которых у больных циррозом печени является наличие нормальной или пониженной фракции выброса (ФВ) (ввиду изначального гиперкинетического состояния центральной гемодинамики у этих пациентов с повышенным сердечным выбросом) при ЭХО-КГ, а также мерцательная аритмия;
- Неотон (с целью метаболической поддержки миокарда).
Для улучшения почечной фильтрации рекомендованы:
- допамин (лучше при артериальной гипотензии, за счет влияния на допаминергические рецепторы этот препарат увеличивает долю почечного кровотока);
- Эуфиллин (при уровне систолического артериального давления (САД) выше 100 мм рт. ст.).
Для блокады реабсорбции первичной мочи в почечных канальцах применяются собственно диуретики (преимущественно петлевые диуретики и антагонисты альдостерона).
Диуретическая терапия больных циррозом печени с асцитом. Принимая во внимание сложный патогенез развития отечно-асцитического синдрома, при его терапии используют диуретики различных фармакологических групп: антагонисты рецепторов альдостерона, калийсберегающие, петлевые, тиазидные диуретики и ингибиторы карбоангидразы. Алгоритм назначения диуретиков больным циррозом печени представлен на схеме 1.
Действие диуретиков при циррозе печени и асците носит многогранный характер и состоит в их влиянии на почечные структуры и внепочечные механизмы регуляции водно-электролитного баланса [9, 10], включая воздействие на уровне:
- клеточных мембран — диуретики регулируют их проницаемость, функции внутриклеточных белков-переносчиков и электрохимические процессы ионного транспорта;
- отдельного нефрона — влияние на фильтрационную загрузку нефрона, транспортную функцию различных его сегментов;
- почек — влияние на внутрипочечную гемодинамику, межнефронные взаимоотношения, активность тканевых составляющих нейрогуморальных систем;
- системной гемодинамики и водно-электролитного баланса.
Основным принципом разгрузочной терапии отечно-асцитического синдрома у больных циррозом печени является получение постепенно развивающегося и стабильного диуретического эффекта, при этом препаратом выбора является спиронолактон [15, 23].
В случаях рефрактерности к терапии антагонистами альдостерона перед назначением других диуретиков, действующих на иных участках нефрона, целесообразно оценить показания для использования дополнительных терапевтических мероприятий, в частности для введения альбумина и кровезамещающих коллоидных растворов.
При выраженном отечно-асцитическом синдроме объем диуретической терапии может быть расширен за счет петлевых или тиазидных диретиков, подавляющих реабсорбцию натрия и воды.
Рекомендуется комбинированное назначение калийвыводящих и калийсберегающих диуретиков, что способствует снижению риска возникновения электролитных нарушений [18, 21, 29].
Дозировку и частоту приема препарата подбирают индивидуально каждому больному. При поступлении пациента в стационар рекомендуется определить суточную экскрецию натрия, что облегчает подбор диуретика и контроль за эффектом лечения [16].
При начальных признаках асцита терапия начинается одним из препаратов группы калийсберегающих диуретиков, обычно спиронолактоном. В случае неэффективности добавляют петлевой диуретик.
Наличие признаков выраженного асцита требует изначального применения комбинированной терапии, при этом спиронолактон назначается в качестве надежного партнера петлевых диуретиков.
У больных циррозом печени с умеренной и выраженной ПГ возможно начало лечения курсами антагонистов альдостерона еще до формирования асцита в минимальных (25–50 мг/сут), не изменяющих диурез, дозировках в качестве нейрогуморального модулятора, однако данная точка зрения является авторской и не подтверждена широкими клиническими испытаниями.
При декомпенсации цирроза печени (в виде развития асцита) применение спиронолактона абсолютно необходимо и можно не бояться его сочетания с ИАПФ или АРА, если параллельно правильно использовать активные диуретики в достижении положительного диуреза. Препарат принимают в высоких дозах (100–300 мг, назначаемых однократно утром или в два приема утром и в обед) на период 1–3 недели до достижения компенсации. После этого доза спиронолактона должна быть уменьшена.
Нужно помнить, что концентрация спиронолактона в плазме крови выходит на плато к третьему дню лечения и после отмены (или уменьшения дозы препарата) его концентрация и действие пропадает (снижается) через трое суток. После достижения компенсации применение высоких доз спироналактона прекращается и рассматривается вопрос о назначении малых доз препарата в качестве дополнительного нейрогормонального модулятора.
Для длительной поддерживающей терапии больных циррозом печени рекомендуется использование малых (25–50 мг) доз спиронолактона дополнительно к ИАПФ и бета-адрено-блокаторам (БАБ), позволяющее более полно блокировать РААС и САС.
В случаях, когда необходима замена спиронолактона, препаратом выбора является амилорид по 10–15 мг/сут.
Оптимальное соотношение спиронолактона и фуросемида 5:2, например 100 мг спиронолактона и 40 мг фуросемида и т. д. Максимальные суточные дозы этих препаратов составляют 400 и 160 мг соответственно.
Фуросемид, в свою очередь, может быть неэффективен при выраженном гиперальдостеронизме, когда натрий, не реабсорбированный в петле Генле, всасывается в дистальном отделе нефрона. Вторая причина — гипокалиемия и алкалоз.
Альтернативными, в случаях неэффективности, фуросемиду петлевыми диуретиками для лечения асцита у больных циррозом печени могут рассматриваться: Урегит (этакриновая кислота) 25–50 мг/сут и буметанид, который не слабее фуросемида и применяется в дозах от 0,5 до 10 мг, что позволяет достичь оптимального диуреза.
Этакриновая кислота и тиазиды, как диуретики длительного действия, менее показаны больным циррозом печени, поскольку они способны усугублять развившиеся электролитные нарушения, и даже после их отмены могут продолжаться потеря калия с мочой и нарастание алкалоза.
Поэтому, в частности, тиазиды применяются преимущественно на этапе поддерживающей терапии и/или невозможности использовать спиронолактон. Принимая во внимания возможные побочные эффекты, тиазидные диуретики у больных циррозом печени назначают курсом не более 7–14 дней с перерывом на 3–4 дня.
Кроме вышеперечисленных, в 2006 году в России был зарегистрирован один из самых эффективных и безопасных петлевых диуретиков — торасемид (Диувер). Его стартовая доза составляет 5–10 мг, а при необходимости она может быть увеличена до 20 мг в сутки. Торасемид обладает не только более выраженным, чем фуросемид, мочегонным эффектом, но и имеет собственную активность в отношении рецепторов к альдостерону, что обеспечивает ему калийсберегающий эффект. Преимуществом является отсутствие нежелательных эффектов антагонистов альдостерона (гиперкалиемия, гирсутизм и другие), препарат обладает высокой биодоступностью (80% против 50% у фуросемида), пролонгированным эффектом (период полувыведения 3–5 часов против 1 часа у фуросемида) и мягким гипотензивным действием. Фармакокинетика торасемида мало зависит от функции почек и состояния кишечника, что обеспечивает низкий риск кумуляции препарата и меньшую, по сравнению с фуросемидом, экскрецию калия, кальция, неорганических фосфатов и магния.
При лечении отечно-асцитического синдрома у больных циррозом печени возможно использовать торасемид как в качестве монотерапии, так и в сочетании с Верошпироном. Терапия торасемидом показана при декомпенсации асцита, а также в целях профилактики его возникновения в дозировках 5–20 мг, не вызывающих гипокалиемии даже при длительном приеме. Рекомендуется использовать ступенчатый подход, начиная с 5 мг/сут, увеличивать дозу на 5 мг каждые 2–3 дня до достижения эффекта. На амбулаторном этапе не рекомендуется превышать суточную дозу 20 мг, так как большее количество препарата требует частого контроля уровня калия.
Для оценки эффективности мочегонной терапии у пациентов с циррозом печени и асцитом был проведен ряд сравнительных исследований торасемида и фуросемида. Так, в двойном слепом перекрестном исследовании были сопоставлены результаты однократного приема фуросемида (80 мг) и торасемида (20 мг) внутрь у 14 больных. Торасемид превосходил фуросемид по диуретической и натрийуретической активности. У 5 пациентов наблюдался слабый ответ на прием фуросемида, при этом торасемид вызвал значительное увеличение натрийуреза и диуреза [30, 33, 36].
Аналогично в двойном слепом рандомизированном исследовании у 28 пациентов с асцитом, получавших спиронолактон (200 мг/сут), были сопоставлены результаты 6-недельной терапии торасемидом (20 мг/сут) и фуросемидом (50 мг/сут). Оба препарата оказывали сопоставимое влияние на массу тела, диурез и экскрецию мочевой кислоты, натрия и хлоридов, однако в группе торасемида экскреция калия, кальция, неорганических фосфатов и магния была ниже [30, 33, 36].
В группе из 46 больных циррозом печени, осложнившимся асцитом (рандомизированное исследование), проводили лечение торасемидом 20 мг/сут или фуросемидом 40 мг/сут в сочетании со спиронолактоном 200 мг/сут. Если не удавалось добиться снижения массы тела на 300 г/сут, дозы диуретиков каждые 3 дня увеличивали до 40, 120 и 400 мг/сут соответственно. Торасемид вызывал более выраженное увеличение диуреза, чем фуросемид, хотя в целом результаты лечения в 2 группах оказались сопоставимыми. Увеличение доз диуретиков потребовалось у 2 больных группы торасемида и у 9 пациентов группы фуросемида [33, 36].
То есть по результатам исследований торасемид может рассматриваться как альтернатива комбинированной терапии Фуросемид + Верошпирон у больных циррозом печени и асцитом.
Ингибиторы карбоангидразы не нашли широкого применения у пациентов с асцитом, так как подавление ими реабсорбции натрия и воды в проксимальном канальце компенсируется усилением ее в дистально расположенных сегментах канальцев.
Препараты этой группы могут использоваться в качестве вспомогательного средства на фоне приема активных мочегонных (петлевых и/или тиазидных). Ингибиторы карбоангидразы блокируют фермент в области проксимальных почечных канальцев, что сопровождается незначительным диурезом (прирост до 10–15%), однако при этом усиливается «загрузка» натрием нижележащих отделов канальцев, что повышает эффективность более сильных диуретиков. При истощении фермента карбоангидразы через 3–4 дня непрерывного применения активность ацетазоламида падает, что требует перерыва в лечении.
Поэтому ацетазоламид (Диакарб) рекомендуется в дозе по 0,25 г трижды в день в течение 3–4 дней с двухнедельным перерывом. Данная терапевтическая тактика способствует подкислению среды, восстанавливает диуретическую активность тиазидных и петлевых диуретиков, при длительном применении которых развивается алкалоз. При сочетании с Эуфиллином мочегонный эффект Диакарба увеличивается.
Для избежания развития рефрактерности и побочного действия диуретиков на пациентов с асцитом важно оценивать эффективность лечения и проводить клинико-лабораторный скрининг с определением показаний для последующей коррекции режима дозирования или отмены препаратов.
Продолжение статьи читайте в следующем номере.
С. Н. Мехтиев, доктор медицинских наук, профессор Ю. А. Кравчук, кандидат медицинских наук И. В. Субботина О. А. Мехтиева * М. В. Шаповалов ВМА им. С. М. Кирова, *СПб ГМА им. И. И. Мечникова, Санкт-Петербург
Симптоматика
Симптоматика заболевания может проявится очень быстро. Речь идет, как правило, о нескольких сутках.
При осмотре у врача или на ультразвуковом исследовании возможно определить начало процесса по ряду признаков:
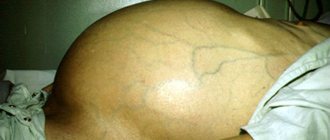
- Окружность живота увеличивается;
- Кожа натягивается;
- Пупок (особенно у людей худых) выпячивается вперед;
- Образуются стрии;
- Венозная сеть просматривается без труда;
- Если человек стоит, живот отвисает книзу;
- Если находится в лежачем положении, растекается в стороны, по бокам свисает.
В случае, если скопления жидкостной массы значительные, возникают симптомы дополнительные:
- Кашель с мокротой мокроты;
- Одышка, которая усиливается в положении лежа;
- Тяжесть в верхней центральной области живота при употреблении пищи;
- Отрыжка, тошнота, рвота;
- Нарушения стула;
- Мочеиспускание учащается;
- Возникают отеки ног.
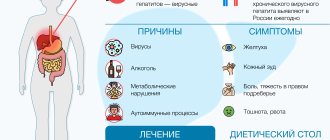
Развитие перечисленных симптомов наблюдается на фоне признаков, которые указывают на цирроз печени:
- Тошнота;
- Горечь во рту;
- Боль тупого характера в зоне правого подреберья;
- Зуд;
- Желтуха;
- Носовые кровотечения и т.д.
Запор
Средняя продолжительность жизни
Сколько живут люди с брюшной водянкой? Определить среднюю продолжительность жизни пациента возможно только на основании полученных результатов биохимического анализа крови и инструментального обследования печени. Как утверждают специалисты, многое зависит и от самого больного, который должен строго соблюдать питьевой режим и диету.
В зависимости от формы печеночного цирроза и наличия сопутствующих осложнений, определяется такая продолжительность жизни:
- компенсированный цирроз с начальным асцитом (не более 1.5 л жидкости) — более 10 лет;
- субкомпенсированный цирроз с умеренным асцитом (не более 4.5 л) — не более 5-6 лет;
- декомпенсированный цирроз с массивным асцитом (более 5 л) — не более 1 года.
Важно понимать, что определить среднюю продолжительность жизни по количеству скопившейся в брюшине жидкости невозможно. Прогноз зависит от целого ряда факторов — стадии развития цирроза, возраста больного, эффективности лечения, соблюдения предписаний специалиста и т.д.
Причины
Чрезмерное повышение давления в воротной вене есть не что иное, как портальная гипертензия. При ее развитии появляются следующие патологические изменения:
- Нагрузка на сосуды венозные, лимфатические увеличивается, что приводит к пропотеванию жидкой массы через сосудистые стенки в полость брюшины;
- Уровень белка в крови снижается, создается онкотическое давление, способствующее удержанию жидкой массы в сосудах;
- Объем циркулирующей крови снижается, кровоток ухудшается, это касается всех соседних органов.
Испытывая указанные сбои, организм как система вынужден работать на то, чтобы сосуды сузились, а натрий и вода задержались. Но получается, что вследствие этого жидкости скапливается еще больше.
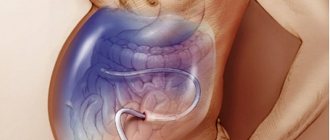
Техника выполнения лапароцентеза
Такое мини-вмешательство, как лапароцентез, осуществляется под местной анестезией, при этом пациент чаще находится в положении сидя, иногда его кладут на спину. Область, где будет производиться прокол, очищается и стерилизуется. После введения анестетика специальной иглой производится прокол внизу живота (примерно посредине между пупком и лобком), куда вводят небольшую трубку. С ее помощью будет удаляться жидкость. Количество выведенной жидкости за одну процедуру в среднем колеблется от 3 до 5 л, но в более тяжелых случаях доктор может принять решение и об извлечении 10 л.
Обычно лапароцентез занимает около получаса, но может длиться больше. Время будет зависеть от объема удаляемой жидкости и состояния пациента.
После завершения процедуры место прокола туго перевязывают. У пациента всегда измеряют температуру, пульс, давление. Перед лапароцентезом и после него измеряют вес.
После лапароцентеза образцы полученной жидкости исследуют для определения ее происхождения (цитологическое исследование). Пациенту не придется искать учреждение, где смогут исследовать полученную жидкость, ведь на базе Юсуповской больницы есть собственная лаборатория.
Если жидкость имеет отечную природу, то это может «говорить» о сердечной недостаточности, циррозе печени или нефротическом синдроме. При получении жидкости воспалительной природы следует говорить о наличии опухолей или метастазов в органах брюшной полости.
Стадии
Классифицируют 4 стадии цирроза, 3-я и 4-я из которых, как правило, отягощены асцитом:
- Стадия компенсации. Ткань органа подверглась изменению, фиброз локализуется преимущественно по периферии, портальная гипертензия и асцит отсутствуют.
- Стадия субкомпенсации. Фиброз распространяется от периферии к центру печени, развивается портальная гипертензия. Асцит пока незначителен, начинают проявляться симптомы заболевания.
- Стадия декомпенсации. Количество фиброза увеличивается и достигает от половины до двух третей объема печени. Асцит стремительно прогрессирует.
- Стадия терминальная. Добавляются новые симптомы, прогноз для выживаемости очень низкий, состояние больного тяжёлое, асцит чрезмерный.
Какие печёночные болезни приводят к водянке живота
И цирроз, и асцит являются следствием длительного заболевания печени. Тогда как причины могут быть разными. Поражения печени могут вызываться различными агентами:
- вирусы,
- токсины,
- механические препятствия,
- объёмные процессы в самом органе и в непосредственной близи от него,
- лекарственные вещества,
- врождённые состояния,
- аутоиммунные процессы,
- нарушение обмена веществ.
Существуют заболевания других органов, которые тоже вызывают выпот жидкости в брюшину: например, опухолевые процессы брюшной полости и малого таза. Очень редко причины цирроза невозможно установить, тогда его называют криптогенным.
Лечение асцита при циррозе
Согласно медицинской статистике, подавляющее большинство (до 90%) пациентов с диагностируемым асцитом принимают препараты мочегонные и находятся на специальной диете, способствующей восстановлению водно-соляного баланса.
Среди используемых лекарственных препаратов:
- Гепатопротекторы;
- Диуретики;
- Альбумин и некоторые иные.
Оперативное вмешательство проводят в случае неэффективности терапии. Такое часто случается в отношении больных с онкологией. Отдельную группу составляют пациенты с онкологией на поздних его стадиях, у которых в животе скопилось большое количество жидкостной массы.
В этом случае для устранения асцита используют лапароцентез, который представляет собой пунктирование стенки брюшины с последующим выведением жидкости. Часть этих пациентов нуждается в установке дренажа. Посредством его скопившаяся жидкость эвакуируется еще в течение нескольких дней.
Применима для борьбы с асцитом на фоне цирроза и внутриполостная химиотерапия, при которой препарат вводится непосредственно в брюшинную полость.
Завершая рассказ об оперативных вмешательствах при циррозе, отягощенном асцитом, назовем их разновидности:
- Если терапия неэффективна, в этом случае применяют лапароцентез;
- Шунтирование, выполняется для снижения давления в воротной вене.
- Пересадка органа.
Прогноз
Асцит при онкологическом заболевании в разы ухудшает общее самочувствие больного. Как правило, такое осложнение возникает на поздних стадиях онкологии, при которых прогноз выживаемости зависит от характера самой опухоли и ее распространенности по организму.
Продолжительность жизни при асците зависит от следующих факторов:
- Функционирования почек и печени;
- Деятельности сердечно-сосудистой системы;
- Эффективности проводимой терапии основного заболевания.
Развитие асцита может предотвратить опытный врач, наблюдающий пациента. Врачи Юсуповской больницы имеют огромный опыт борьбы с различного рода онкологическими заболеваниями. Квалификация медицинского персонала и новейшее оборудование позволяют провести точную диагностику и качественное, эффективное лечение согласно европейским стандартам.
Прогноз выживаемости
Чтобы прогнозировать продолжительность жизни пациента с циррозом отягощенным асцитом, необходимо учитывать запущенность болезни.
При продолжении воздействия на орган факторов неблагоприятных цирроз усугубляется, что негативно сказывается на выживаемости.
Мировая статистика показывает, что больные с компенсированным циррозом печени могут жить более десяти лет. Если речь идет о декомпенсированном циррозе, то до 40% больных уходит из жизни в течение первых трех лет три года с того момента, когда болезнь диагностирована.
Клиника интегративной онкологии Onco.Rehab предлагает современные методы лечения заболеваний по международным протоколам.
Подготовка к процедуре лапароцентеза
Перед лапароцентезом доктор назначает ряд необходимых анализов и диагностических процедур, среди которых:
- физический осмотр;
- анализ на свертываемость крови;
- рентгеновское обследование;
- УЗИ;
Все диагностические процедуры можно пройти на месте, ведь оснащение Юсуповской больницы находится на высоте. Здесь есть все необходимое оборудование новейших образцов, которое позволяет быстро и точно установить диагноз с минимальным негативным воздействием на организм пациента.
Также пациент должен сообщить врачу об аллергии на препараты, беременности или если он уже принимает медикаменты. Непосредственно перед процедурой нужно опорожнить мочевой пузырь и кишечник, а за 12 часов до операции не есть и не пить.
Возможные осложнения
После лапароцентеза могут оставаться гематомы на брюшной стенке и наблюдаться выделения из места прокола. В теории возможны
- повреждения кишечника;
- инфекция;
- кровотечение из-за повреждения крупного кровеносного сосуда;
- снижение артериального давления, головокружение, обморок (при единовременной эвакуации слишком большого объема жидкости);
- нарушение функционирования печени и почек.
Однако, если процедура производится опытными специалистами при должной подготовке, осложнения при лапароцентезе возникают крайне редко.
+7
Позвоните или оставьте заявку
Заказать звонок!
На какие симптомы стоит обратить внимание
- При первой стадии болезни жалобы практически отсутствуют. Возможно наличие горечи во рту или неприятного привкуса, снижение аппетита. Печень может быть увеличенной из-за жировой дистрофии, но может быть уменьшенной или нормальной (врач может это определить при осмотре, по данным УЗИ).
- Вторая стадия характеризуется усилением симптоматики. Это вздутие живота, усиление кишечной перистальтики или урчание, иногда отмечается жидкий стул. Часто становится заметен «печёночный» язык: лаковый, с отсутствием налёта. А также «печёночные» ладони красно-бордового цвета.
- При декомпенсации болезни присоединяется желтизна кожных покровов, обесцвечивание кала и потемнение мочи, появление «синяков». Повсеместно на теле возникают сосудистые элементы по типу звёздочек или мелкоточечных кровоизлияний. У мужчин возникает импотенция, возможна гинекомастия (увеличение грудных желез), у женщин — нарушение цикла. Если присоединяется инфекция, то возможно повышение температуры тела.
- Четвёртая стадия болезни, при которой формируется клиническая картина тяжёлого состояния. Это все вышеперечисленные симптомы плюс нарушение свёртываемости крови, проявляющаяся повышенной кровоточивостью. Кровотечения могут быть довольно массивными: например, желудочное или кровотечение из варикозного расширенных вен пищевода. Больной худеет, у него возникают расстройства пищеварения. Появляется выраженная слабость. За несколько дней возможно значительное увеличение живота. На поверхности живота возникает картина из варикозно-расширенных вен, называемая «головой медузы».
Если больного положить, то форма его живота изменится. В положении стоя — живот круглый, свисающий вниз, а когда больной ложится на спину — его живот «растекается» в стороны, становится похожим на «лягушачий» (плоский).
Является положительным симптом флюктуации. Если резко нажать на живот сбоку — то с другой стороны ощущается удар «волны».
Характерно то, что больной, визуально очень сильно похудевший, тем не менее сохраняет прежний вес или даже набирает ещё больше. Это происходит из-за того, что несколько литров скопившейся жидкости увеличивают вес больного.
На 4 стадии цирротического перерождения органа возникают проблемы с лёгкими из-за венозного застоя, который продолжает прогрессировать. Возникает одышка, кашель. Они усиливаются в положении лёжа, когда жидкость, разливаясь в животе, начинает давить на диафрагму.
При накоплении большого объёма выпота могут возникнуть такие проблемы:
- При сильном давлении на брюшную стенку возможно формирование различных грыж: пупочной, паховой, белой линии живота.
- Кровотечение из расширенных вен пищевода, кровотечение из расширенных вен желудка.
- Выход жидкости в плевральную полость (гидроторакс).