Слабость сфинктера, то есть частичное или полное недержание каловых масс — это проблема для человека, страдающего данным недугом. Сильные переживания и волнения по поводу своих деликатных симптомов могут привести пациента к нервным расстройствам. Однако, при своевременном обращении к врачу, слабость сфинктера, в целом, успешно поддаётся лечению. Существует множество различных методик, которые способны значительно улучшить состояние больного. Кроме слабости анального сфинктера у пациентов, могут присутствовать такие патологии, как недостаточность сфинктера мочевого пузыря, которая является причиной недержания мочи и слабость кардиального жома (разграничивает полость желудка от пищевода), проявляется болями в области груди, изжогой и другими симптомами.
Слабость анального сфинктера
Недостаточность анального жома (фото: tutknow.ru)
Сфинктер (жом) — это анатомическая структура, состоящая из круговой мышцы, которая способна сокращаться, то есть быть в расслабленном или напряжённом состоянии. Его главная функция – продвижение содержимого из одного полого органа в другой. Например, нижний сфинктер пищевода (кардиальный) даёт возможность пищи перейти из пищевода в полость желудка, сфинктеры мочевого пузыря обеспечивают мочеиспускание, контролируют удержание мочи. Недостаточная работа жомов – патология, требующая лечения.
Прямая кишка человека – окончание пищеварительного тракта, заканчивающееся анальным отверстием, вокруг которого расположены наружный и внутренний сфинктеры. В норме они способны удерживать каловые массы, газы при любой нагрузке (чихание, физические упражнения, кашель, диарея). Однако, из-за действия различных негативных факторов, может возникнуть атрофия мышечных волокон и нарушение их моторной функции. Наиболее частыми причинами, которые вызывают слабость сфинктера заднего прохода, являются такие патологические состояния, как:
- Травмы.
- Врождённые аномалии (патологии в крестцовом отделе позвоночника, недоразвитие анального прохода).
- Оперативные вмешательства.
- Разрыв промежности во время родов.
- Хронические патологии толстой кишки (геморрой, проктит).
- Органические изменения в головном мозге (опухоли мозга, черепно-мозговые травмы, нарушения мозгового кровообращения).
- Грыжи в поясничном, крестцовом отделе позвоночного столба.
- Возрастные изменения (климакс у женщин).
Проявляется слабость анального сфинктера в зависимости от тяжести патологического процесса следующими симптомами:
- Неконтролируемое выделение жидкого кала при диарее, не возможность сдерживать газы (начальные стадии заболевания).
- Не произвольное выделение твёрдого кала (третья степень слабости анального сфинктера).
- Зуд в области ануса.
- Метеоризм.
- Отсутствие позывов к опорожнению кишечника. Данный симптом, нередко является признаком органических повреждений головного мозга, грыжами в поясничном, крестцовом отделах позвоночника. А также может быть связан с различными повреждениями рецепторов нижних отделов толстой кишки.
Лечение и диагностика недостаточности анального сфинктера
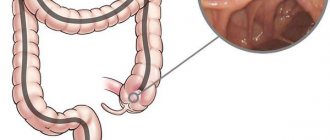
Диагностический метод – ректороманоскопия (фото: seolite.ru)
Диагностирует и проводит лечение слабости сфинктера прямой кишки врач проктолог. После пальцевого обследования, для дифференциации диагноза, доктор может назначить такие виды функциональной диагностики, как:
- Сфинктерометрия (для изучения силы сокращений сфинктера прямой кишки на разных участках, помогает определить локализацию проблемной зоны).
- Электромиография (для определения тонуса и состояния тканей мышц).
- Аноскопия (зрительная оценка анального канала).
- Ректороманоскопия (исследование прямой кишки с помощью ректоскопа).
- Рентгенография с контрастным веществом (помогает понять степень тяжести патологического процесса).
Лечение слабости анального сфинктера заключается в следующих методах:
- Пересмотреть рацион питания. Добавить продукты богатые клетчаткой – бобовые, пшеничные отруби, ржаной хлеб, орехи. А также свежие фрукты, овощи, зелень. Исключить алкоголь, кофе.
- Если слабость анального жома вызвана систематической диареей, её можно устранить такими препаратами как Лоперамид, Белладонна, Активированный уголь, Каопектат (после консультации врача).
- Специальные упражнения, направленные на ритмичное сокращение тазовых мышц способны укрепить не только анальный жом, но и сфинктер мочевого пузыря.
- Электростимуляция мышц с помощью ректального зонда (электрода), который вводится в анальное отверстие. Может проводиться пациентом самостоятельно в домашних условиях при наличии портативного прибора (электростимулятора).
- Бифидбэк-терапия. С помощью специального аппарата проводится обучение пациента управлению мышцами тазового дна.
- Медикаментозная терапия, направленная на устранение воспалительных процессов в толстом кишечнике.
- Лечение хирургическим способом (сфинктеропластика, имплантация искусственного сфинктера).
Все вышеперечисленные методы и препараты должны применяться только после согласования с врачом проктологом.
Важно! Слабость сфинктера является очень серьёзной проблемой и может привести пациента к инвалидности. Не стоит заниматься самолечением и откладывать посещение врача. При любых проявлениях недержания каловых масс необходимо обращаться к специалисту
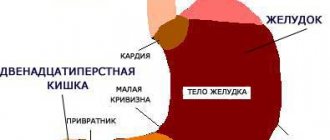
Недостаточность кардиального сфинктера (кардия желудка)
Боль в области груди и изжога при слабости кардиального сфинктера (фото: mojzheludok.com)
Желудок человека через кардиальный сфинктер имеет соединение с пищеводом, а через пилорический соединяется с двенадцатипёрстной кишкой. Главная функция сфинктера пищевода это удержание пищи в полости желудка, препятствие попаданию в пищевод желудочного сока, частичек не переваренной еды и желчи. При систематическом переедании, ожирении, хронических воспалительных процессах (гастрит, язва), малоподвижном образе жизни, привычке принимать большое количество пищи перед сном, может возникнуть слабость кардиального сфинктера, которая проявляется следующими симптомами:
- Изжога.
- Отрыжка.
- Тошнота, рвота.
- Общее недомогание, повышенная утомляемость.
- Жгучая боль в груди.
- Грыжа в области диафрагмы.
Лечит и диагностирует заболевание врач гастроэнтеролог. В первую очередь необходимо определить причину, из-за, которой возникла кардия желудка. После назначения основного лечения, нужно организовать правильный режим питания пациента – принимать пищу в одно и то же время, маленькими порциями, 5-6 раз в день, не ложиться в течение двух часов после еды. Запрещено употребление алкоголя, кофе, крепкого чая, острых и жирных блюд.
Слабость сфинктера мочевого пузыря
Недержание мочи (фото: medweb.ru)
Недостаточность сфинктера мочевого пузыря в основном возникает из-за слабости мышц тазового дна (после родов, недостаточная физическая активность, ожирение). Хронические воспалительные процессы в самом мочевом пузыре (цистит), могут провоцировать слабость его сфинктеров. Страдают данным недугом чаще всего женщины. Проявляется заболевание следующими симптомами:
- Бесконтрольное выделение мочи при физической нагрузке.
- Произвольное частое выделение мочи в состоянии покоя.
- Постоянное чувство переполнения мочевого пузыря.
- Выделение небольших порций мочи при кашле, чихании, беге, прыжках.
Лечение и диагностику заболевания проводит врач уролог.
Профилактика
Упражнения Кегеля при беременности, для укрепления мышц тазового дна (фото: woman365.ru)
Любая посильная физическая активность очень полезна при всех выше перечисленных патологиях, в том числе при кардии желудка. Слабость мышц тазового дна и недостаточность анальных сфинктеров поможет устранить гимнастика Кегеля. Общий принцип выполнения упражнений, для начинающих, заключается в следующих действиях:
- Принять любое удобное положение.
- Сжать и подтянуть вверх все мышцы тазового дна на 5-10 секунд.
- На счет десять расслабить.
- Повторять упражнение следует по десять раз 3-4 раза в день. Успех данного метода заключается в регулярности выполнения. Нерегулярные хаотичные движения могут привести к обратному эффекту – дисбалансу мышц тазового дна.
Также, следует избегать переохлаждения, неадекватных физических нагрузок, систематического переедания. Нужно своевременно пролечивать все воспалительные процессы в организме и при любом дискомфорте обращаться к врачу.
Дисфункция сфинктера Одди и синдром избыточного бактериального роста в кишечнике
У значительной части больных после холецистэктомии развивается дисфункция сфинктера Одди (ДСО) [1, 3].
Согласно Римскому консенсусу III (2006 г.) под дисфункцией сфинктера Одди понимают нарушение его сократительной функции, препятствующее нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку [10].
Синдром абдоминальной боли
Считают, что в первый месяц после холецистэктомии более чем у 80% больных преобладает гипертонус сфинктера Одди, что связано с выключением регулирующей роли сфинктера Люткенса [1, 3]. Болевой синдром при наличии дисфункции сфинктеров в большинстве случаев обусловлен спазмом сфинктера Одди.
Диагностические критерии дисфункции сфинктера Одди [10]:
1) эпизоды выраженной боли, локализованной в эпигастрии или правом подреберье, в сочетании со всеми следующими признаками; 2) продолжительность 30 мин и более; 3) частота развития симптомов: 1 раз и более за последние 12 мес; 4) интенсивность боли значительная: нарушает ежедневную активность и требует обращения за медицинской помощью; 5) отсутствуют структурные изменения, которые объясняли боль.
Следует помнить, что клинические симптомы (в первую очередь абдоминальные боли) после удаления желчного пузыря наблюдаются в 70–80% случаев и могут быть обусловлены целой группой причин, среди которых наиболее значимыми являются: диагностические ошибки, допущенные на дооперационном этапе во время обследования больного и/или во время операции; обострение или прогрессирование существовавших до операции заболеваний гепатопанкреатобилиарной зоны, технические погрешности и тактические ошибки, допущенные при проведении операции [3]. Клинические симптомы могут быть обусловлены недиагностированными и некорректированными заболеваниями, существовавшими еще в предоперационный период (хронические заболевания печени, стриктуры, стенозы желчных путей, как врожденного, так и приобретенного характера, камни желчных протоков, холангит, панкреатиты, доброкачественные и злокачественные опухоли поджелудочной железы, особенно с локализацией процесса в области головки, заболевания желудка и двенадцатиперстной кишки, включая эрозивно-язвенные изменения, а также пара- и перипапиллярные дивертикулы двенадцатиперстной кишки. Ошибки, допущенные во время холецистэктомии: невыявленные камни в общем желчном протоке, повреждение протоков, оставление длинной культи пузырного протока и др. [3].
В силу указанных причин постановка диагноза «дисфункция сфинктера Одди» требует тщательного обследования больного. В качестве скрининговых диагностических методов используют лабораторные тесты (общий анализ крови, определение уровней гамма-глютамилтранспептидазы, щелочной фосфатазы, билирубина, аспартатаминотрансферазы, аланинаминотрансферазы, амилазы) и инструментальные методы диагностики (ультразвуковое исследование, эзофагогастродуоденоскопия, дуоденография). Применение высокоинформативных методов диагностики (эндоскопическая ретроградная холангиопанкреатография, магнитно-резонансная холангиография, эндоскопическая ультрасонография и др.) позволяет проводить своевременную и адекватную коррекцию анатомо-функциональных нарушений, развившихся после холецистэктомии или усугубленных ею. Для подтверждения дисфункции сфинктера Одди применяют эндоскопическую манометрию сфинктера [1, 3, 6].
В 2006 г. рабочей группой экспертов по функциональным расстройствам желудочно-кишечного тракта (ЖКТ) подготовлен Римский консенсус III, в соответствии с которым в рубрику Е «Функциональные расстройства сфинктера Одди» включены разделы: Е2 «Функциональное расстройство билиарного и панкреатического типов» [10].
Больные с билиарным типом дисфункции сфинктера Одди распределяются на три группы, представленные в таблице, тактика ведения которых существенно различается.
Аналогичная классификация используется у больных с панкреатическим типом дисфункции сфинктера Одди. В этих случаях большое значение придается не менее чем двукратному повышению уровня панкреатических ферментов в крови в период двух последовательных приступов болей, а также расширению панкреатического протока более 5 мм.
Больным 1-й группы, имеющим стеноз сфинктера Одди и высокую вероятность дисфункции сфинктера Одди (> 70%), проводится эндоскопическая сфинктеротомия без предварительного манометрического исследования, что уменьшает частоту осложнений.
У больных 2-й группы только в 50% случаев при манометрическом исследовании выявляется дисфункция сфинктера Одди. Большинство исследователей полагают, что этой группе больных необходимо провести предварительное медикаментозное лечение и лишь при его неэффективности проводить манометрию сфинктера Одди.
В 3-й группе больных причины болей в большинстве случаев обусловлены дискинезией сфинктера Одди, и, следовательно, манометрия последнего не показана.
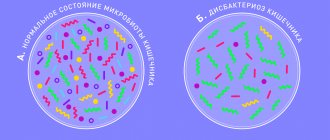
Синдром избыточного бактериального роста и метаболизм желчных кислот в кишечнике
При наличии спазма сфинктера Одди в пищеварительный период нарушается пассаж желчи по кишечнику, сопровождающийся разнообразными проявлениями нарушения пищеварения. Нерегулярное поступление желчных кислот нарушает энтерогепатическую циркуляцию желчных кислот, переваривание и всасывание жиров, уменьшает бактерицидные свойства дуоденального содержимого, способствуя нарушению микробиоценоза тонкой кишки. В случае недостаточности сфинктера Одди, который при отсутствии резервуарной функции желчного пузыря не способен выдержать повышенное давление (более 300–350 мм вод. ст.) в общем желчном протоке, отмечается постоянное поступление желчных кислот в кишечник, что может быть причиной развития холагенной диареи [3, 12].
Следует отметить, что при обоих типах дисфункции (спазм, недостаточность) наблюдается ряд симптомов, свидетельствующих о нарушении метаболизма желчных кислот в кишечнике (диспепсический симптомокомплекс). Основная роль в развитии указанных нарушений принадлежит изменению состава кишечной микрофлоры.
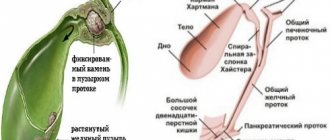
У здорового человека при наличии желчного пузыря синтезированные в гепатоцитах первичные желчные кислоты экскретируются в желчь конъюгированными с глицином или таурином и по желчевыводящим путям поступают в желчный пузырь, где и накапливаются [4]. В стенках желчного пузыря происходит всасывание незначительного количества желчных кислот — около 1,3%. У здорового человека при наличии желчного пузыря основной пул желчных кислот находится в желчном пузыре и только после стимуляции пищей рефлекторно происходит сокращение желчного пузыря и желчные кислоты поступают в двенадцатиперстную кишку. Вторичные желчные кислоты — дезоксихолевая и литохолевая — образуются из первичных (холе- и хенодезоксихолевой соответственно) под воздействием анаэробных бактерий толстой кишки (рис. 1).
После реабсорбции вторичных желчных кислот происходит их конъюгация с глицином или таурином, и они также становятся компонентами желчи. Урсодезоксихолевая кислота (УДХК) — третичная желчная кислота не превышает 5% от всех желчных кислот организма человека и также образуется под действием ферментов микроорганизмов [13].
Из кишечника желчные кислоты с током портальной крови вновь попадают в печень, которая абсорбирует практически все желчные кислоты (примерно 99%) из портальной крови; совсем небольшое количество (около 1%) попадает в периферическую кровь (рис. 2).
Активное всасывание желчных кислот происходит в подвздошном отделе тонкой кишки, тогда как пассивная абсорбция идет за счет концентрации желчных кислот в кишечнике, поскольку она всегда выше, чем в портальной крови. В гепатоцитах токсичные свободные желчные кислоты, составляющие примерно 15% от всего количества желчных кислот, всосавшихся в кровь, превращаются в конъюгированные. Из печени желчные кислоты вновь поступают в желчь в виде конъюгатов. Подобная энтерогепатическая циркуляция в организме здорового человека совершается 2–6 раз в сутки в зависимости от режима питания; 10–15% от всех поступивших в кишечник желчных кислот после деконъюгации подвергаются более глубокой деградации в нижних отделах тонкой кишки. В результате процессов окисления и восстановления, вызываемых ферментами микрофлоры толстой кишки, происходит разрыв кольцевой структуры желчных кислот, что приводит к образованию ряда веществ, выделяемых во внешнюю среду. Учитывая, что желчные кислоты в норме предотвращают развитие избыточного микробного роста в кишечнике, у пациентов после холецистэктомии они рассматриваются также в качестве одной из причин развития данного синдрома, а также в качестве классических повреждающих факторов по отношению к слизистой оболочке желудка, пищевода, кишечника. Повреждающий эффект желчных кислот зависит не только от их концентрации, но и от конъюгации и рН окружающей среды, два последних процесса обеспечиваются микрофлорой кишечника. Желчные кислоты, обладающие детергентными свойствами, способствуют солюбилизации липидов мембран клеток поверхностного эпителия. Растворимые желчные кислоты проникают в эпителиальные клетки. Внутриклеточные концентрации желчных кислот могут в 8 раз превосходить их внеклеточные концентрации. Такое избыточное накопление приводит к повышению проницаемости мембран клеток, их разрушению, повреждению межклеточных контактов и в итоге к гибели клетки [4, 14]. Этот повреждающий эффект зависит не только от концентрации желчных кислот в рефлюксате, но и от продолжительности времени, в течение которого слизистая оболочка подвержена действию желчи. Под действием желчных кислот снижается количество фосфолипидов, теряется гидрофобность слизи [4, 9]. Конъюгированные желчные кислоты оказывают негативное влияние при кислых значениях рН, а неконъюгированные — при рН, равном 5–8. В силу указанных причин при нарушении микробиоценоза кишечника неконъюгированные желчные кислоты оказывают выраженное повреждающее действие на эпителиоциты. Зрелые и незрелые бокаловидные клетки из ткани толстой кишки здорового человека под действием желчных кислот подвергаются апоптозу.
Исследование биологических свойств бифидо- и лактобактерий показало, что популяция человеческой микробиоты оказывает многогранный спектр физиологически полезных воздействий. Применительно к обсуждаемой проблеме следует остановиться на некоторых из них.
Микрофлора кишечника принимает непосредственное участие в метаболизме и элиминации токсичных желчных кислот, в частности, холевой кислоты. В норме невсосавшаяся в дистальных отделах подвздошной кишки конъюгированная холевая кислота в толстой кишке подвергается деконъюнгации микробной холеглицингидролазой и дегидроксилированию при участии 7-альфа-дегидроксилазы [11, 12]. Образовавшаяся дезоксихолевая кислота связывается с пищевыми волокнами и выводится из организма. Большое значение имеет рН в просвете кишечника. При повышении значений рН дезоксихолевая кислота ионизируется и хорошо всасывается в толстой кишке, а при снижении — выводится. Повышение значений рН в толстой кишке приводит к повышению активности ферментов, приводящих к синтезу дезоксихолевой кислоты, ее растворимости и всасыванию и, как следствие, повышению в крови уровня желчных кислот, холестерина и триглицеридов. Одной из причин повышения рН может быть недостаток пребиотических компонентов в питании, нарушающих рост нормальной микрофлоры, в т. ч. бифидо- и лактобактерий.
Не менее важны эффекты, связанные с синтезом короткоцепочечных жирных кислот (КЦЖК) в результате анаэробного брожения доступных для бактерий ди-, олиго- и полисахаридов [11, 12]. Локально КЦЖК определяют снижение рН, обеспечивая колонизационную резистентность кишечника, принимают участие в регуляции кишечной моторики. Помимо этого КЦЖК важны для эпителия толстой кишки, т. к. именно бутират колоноциты используют для обеспечения своих энергетических потребностей. Кроме того, снижение рН, связанное с образованием КЦЖК, приводит к образованию ионов аммония из аммиака, образовавшегося в толстой кишке в процессе микробного метаболизма белков и аминокислот, который уже не может свободно диффундировать через кишечную стенку в кровь, а выводится с калом в виде аммонийных солей.
Результатом совместной симбиотической деятельности клеток эпителия кишечника и физиологической микрофлоры является формирование сложной специфической преэпителиальной структуры — слизистого барьера (биопленки, микробиологического барьера), состоящего из слизи, молекул секреторного IgA, индигенной флоры и ее метаболитов и защищающего слизистую оболочку кишечника от действия бактериальных и других токсинов физической и химической природы, включая желчные кислоты [11, 12].
Лечение пациентов с дисфункцией сфинктера Одди
Основной целью лечения больных с дисфункцией сфинктера Одди является восстановление нормального тока желчи и поджелудочного сока из билиарных и панкреатических протоков в двенадцатиперстную кишку с использованием оперативного или консервативного лечения [1–3, 5–8].
В связи с этим в задачи лечения входят:
- восстановление, а при невозможности — восполнение продукции желчи;
- восстановление тонуса сфинктерной системы;
- восстановление давления в двенадцатиперстной кишке (от этого зависит адекватный градиент давления в билиарном тракте).
Диетотерапия занимает существенное место в лечении данной категории больных. Общим принципом диеты является режим питания с частыми приемами пищи в небольшом количестве (5–6-разовое питание) с достаточным потреблением пищевых волокон, необходимых для восстановления моторно-эвакуаторной функции кишечника и коррекции микробиологических нарушений.
Для купирования болевого синдрома используют релаксанты гладкой мускулатуры, включающие несколько групп препаратов: антихолинергические средства — М-холиноблокаторы (препараты красавки, платифиллин, Метацин и т. п., в связи с выраженными побочными системными эффектами сфера применения ограничена), Бускопан (в отличие от предыдущих не проникает через гематоэнцефалический барьер и имеет низкую — 8–10% — системную биодоступность); миотропные спазмолитики: неселективные (дротаверин, отилония бромид и др.) и селективные — Мебеверина гидрохлорид [2, 5, 8].
Препаратами выбора для патогенетической терапии больных с функциональными заболеваниями билиарного тракта, безусловно, являются средства, селективно релаксирующие гладкую мускулатуру органов пищеварения, в частности мебеверин [2, 5, 8]. Преимуществом препарата является релаксирующая селективность в отношении сфинктера Одди, в 20–40 раз превышающая эффект папаверина. Мебеверин оказывает нормализующее воздействие на мускулатуру кишечника, устраняя функциональный дуоденостаз, гиперкинез, спазм, не вызывая развитие нежелательной гипотонии. Препарат у данной категории пациентов может применяться длительно, курсами в дозе 200 мг 2 раза в день.
Для лечения синдромов мальдигестии и мальабсорбции назначают препараты панкреатина (Микразим, Креон, Панзинорм форте-Н, Панцитрат и другие).
Лечение синдрома избыточного бактериального роста в кишечнике
При наличии микробной контаминации тонкой кишки необходимо проведение деконтаминирующей терапии (невсасывающиеся кишечные антибиотики — рифаксимин, или кишечные антисептики (нитрофуранового ряда — Энтерофурил, Эрсефурил, фторхинолоны и др.) с одномоментным и/или последовательным применением пробиотиков и пребиотиков (Хилак форте, Лактулоза), лекарственных препаратов на основе пищевых волокон — Псиллиум и др.). Применение про- и пребиотических препаратов улучшает метаболизм желчных кислот, стимулирует регенерацию поврежденных деконъюгированными желчными кислотами эпителиоцитов кишечной стенки [3, 11].
При наличии билиарной недостаточности назначают препараты УДХК (Урсосан). Применение препаратов в суточной дозе 10–15 мг/кг массы тела уменьшает степень билиарной недостаточности и выраженность дисхолии.
Фармакологические эффекты УДХК (Урсосана) разносторонни. Относительно рассматриваемой проблемы особое значение имеют следующие ее свойства. В первую очередь, это гидрофильность и отсутствие токсических свойств. УДХК вытесняет желчные кислоты, обладающие повреждающим действием на слизистые оболочки. При систематическом приеме УДХК становится основной желчной кислотой в сыворотке крови и составляет около 48% общего количества желчных кислот в крови, происходит дозозависимое увеличение ее доли в пуле желчных кислот до 50–75%. Это происходит, например, вследствие конкурентного захвата рецепторами желчных кислот в подвздошной кишке или за счет индукции холереза, богатого бикарбонатами, что приводит к увеличению пассажа желчи и повышенному выведению токсичных желчных кислот через кишечник. УДХК не оказывает негативного влияния на клетки (мицеллы УДХК практически не растворяют мембраны). Цитопротективные свойства УДХК имеют большое значение также с точки зрения защиты слизистой оболочки желудочно-кишечного тракта. В экспериментальных условиях УДХК продемонстрировала антиоксидантный эффект [4, 13]. Помимо этого, применение УДХК позволяет профилактировать развитие избыточного бактериального роста в кишечнике. Своевременная и правильная оценка клинической симптоматики с применением современных методов диагностики дисфункции сфинктера Одди, назначение адекватной комплексной терапии позволяют значительно улучшить самочувствие и качество жизни данной категории пациентов.
Литература
- Ардатская М. Д. Функциональные расстройства билиарного тракта (определение, классификация, диагностические и лечебные подходы) // Справочник поликлинического врача. 2010. № 7.
- Ильченко А. А. Эффективность мебеверина гидрохлорида при билиарной патологии // РМЖ. 2003. № 4.
- Ильченко А. А. Желчнокаменная болезнь. М.: Анахарсис, 2004. 200 с.
- Лапина Т. Л., Картавенко И. М. Урсодезоксихолевая кислота: влияние на слизистую оболочку верхних отделов желудочно-кишечного тракта // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2007. № 6.
- Косюра С. Д., Федоров И. Г., Ильченко Л. Ю. Применение дюспаталина в комплексной терапии функциональных расстройств билиарного тракта и дисфункции сфинктера Одди // Consilium Medicum. Гастроэнтерология. 2010. № 2.
- Лоранская И. Д., Вишневская В. В., Малахова Е. В. Билиарные дисфункции — принципы диагностики и лечения // РМЖ. 2009. № 4.
- Минушкин О. Н. Функциональные расстройства кишечника и желчевыводящих путей. Лечебные подходы, выбор спазмолитика // Лечащий Врач. 2012. № 2.
- Топорков А. С. Эффективность селективных миотропных спазмолитиков для купирования абдоминальной боли // РМЖ. 2011. № 28.
- Allen A., Flemstrom G. Gastroduodenal mucus bicarbonate barrier: protection against acid and pepsin // Am. J. Physiol. Cell Physiol. 2005. Vol. 288. P. 1–19.
- Drossman D. A. The Functional Gastrointestinal Disorders and the Rome III Process // Gastroenterology. 2006; 130 (5): 1377–1390.
- Jenkins D. J. A., Kendall C. W. C., Vuksan V. Inulin, Oligofructose and Intestinal Function // J. Nutr. 1999. Vol. 129. 1431 S–1433 S.
- Edwards C. A., Parrett A. M. Intestinal flora during the first months of life: new perspectives // British Journal of Nutrition. 2002. 88, Suppl.1. S11–S18.
- Kawamura T., Koizimi F., Ishimori A. Effect of ursodeoxycholic acid on water immersion resistant stress ulcer of rats // Nippon Shokakibyo Gakkai Zasshi. 1989. Vol. 86. P. 2378–2388.
- Stein H. J., Kauler W. K., Feussner H., Siewert J. R. Bile acids as component of the duodenogastric refluate: detection, relationship to bilirubin, mechanism of injury, and clinical relevance // Hepatogastroenterology. 1999. Vol. 46. P. 66–73.
Е. А. Лялюкова, кандидат медицинских наук, доцент М. А. Ливзан, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМА МЗ РФ, Омск
Контактная информация об авторах для переписки
Недостаточность анального сфинктера (анальное недержание, анальная инконтиненция)
Недостаточность анального сфинктера (НАС) – состояние, при котором человек полностью или частично не может удерживать содержимое прямой кишки.
Причины:
- травмы запирательного аппарата прямой кишки;
- роды;
- нервно-рефлекторные расстройства;
- ункциональная недостаточность анального сфинктера, обусловленная выраженными изменениями мышечных структур (при выпадении прямой кишки, геморрое с выпадением внутренних геморроидальных узлов, воспалительных заболеваниях толстой кишки, пороках развития прямой кишки и анального канала).
Классификация НАС
- По форме: – органическая; – неорганическая (функциональная); – смешанная.
- По локализации дефекта мышц по окружности заднепроходного канала: – на передней стенке; – задней стенке; – боковой стенке; – нескольких стенках (сочетание дефектов); – по всей окружности.
- По степени недержания кишечного содержимого (нарушения функции держания): – 1-я степень — недержание газов; – 2-я степень — недержание газов и жидкого кала; – 3-я степень — недержание газов, жидкого и твердого кала.
- По протяженности мышечного дефекта по окружности заднепроходного канала: – до 1/4 окружности; – 1/4 окружности; – до 1/2 окружности; – 1/2 окружности; – 3/4 окружности; – отсутствие сфинктера.
Диагностика
- Сбор анамнеза. В ходе беседы с пациентом врач выявляет возможные причины недержания.
- Осмотр пациента проводят на гинекологическом кресле. При осмотре промежности и заднего прохода выявляют сопутствующие заболевания в этой области — анальную трещину, геморрой, свищи или выпадение прямой кишки.
- Оценка анального рефлекса. Используют для изучения сократительной способности мышц сфинктера.
- Пальцевое обследование прямой кишки.
- Ректороманоскопия.
- Проктография с ирригоскопией.
- Функциональные исследования запирательного аппарата прямой кишки.
– Аноректальная профилометрия. – Электромиография наружного сфинктера и мышц тазового дна — метод, позволяющий оценить жизнеспособность и функциональную активность мышечных волокон и определить состояние нервных путей мышц запирательного аппарата прямой кишки. Результат исследования играет важную роль в прогнозировании эффекта от пластических операций. - Эндоректальное УЗИ.
- Подробнее с описанием диагностических методов Вы можете ознакомиться в разделе Диагностика.
Лечение
Консервативное — направлено на улучшение нервно-рефлекторной деятельности запирательного аппарата прямой кишки и включает электростимуляцию, медикаментозную терапию и лечебную физкультуру;
Хирургическое лечение. Показания:
- Невозможность радикального излечения пациентов с недостаточностью анального сфинктера консервативными методами;
- недостаточность анального сфинктера 2-й и 3-й степени, с дефектом сфинктера размером 1/4 окружности и более, при наличии рубцовой деформации стенок анального канала;
- нарушении анатомических взаимоотношений мышц запирательного аппарата.
Противопоказания: поражение отделов центральной и периферической нервной системы, участвующих в иннервации органов малого таза и мышечных структур промежности
Какие операции применяют при НАС?
- Сфинктеропластика
- Сфинктеролеваторопластика
- Сфинктероглютеопластика (замещение дефекта коротким лоскутом большой ягодичной мышцы)
- Глютеопластика (формирование сфинктера длинными лоскутами большой ягодичной мышцы)
- Грацилопластика (формирование сфинктера нежной мышцей бедра)
- Имплантация искусственного сфинктера
- Инъекционный метод – инъекции силиконовых биоматериалов в область дефекта сфинктера под УЗ-контролем.
Выбор метода лечения осуществляется врачом колопроктологом с учетом клинической ситуации и индивидуальных особенностей пациента.
Перейти к
Гастроэзофагеальная рефлюксная болезнь. От патологии к клинике и лечению
- Гастроэзофагеальной рефлюксной болезни;
- о причинах и механизмах развития пищеводного рефлюкса;
- о дифференциальном диагнозе загрудинной боли;
- о современных принципах лечения гастроэзофагельной рефлюксной болезни и поймете, когда направить пациента к хирургу.
Определение
Определение понятия «гастроэзофагеальная рефлюксная болезнь» ( ГЭРБ) затруднено, поскольку:
- у практически здоровых людей наблюдаются забросы желудочного содержимого в пищевод;
- достаточно продолжительное закисление дистального отдела пищевода может не сопровождаться клиническими симптомами и морфологическими признаками эзофагита;
- нередко при выраженных симптомах ГЭРБ отсутствуют воспалительные изменения в пищеводе.
Под ГЭРБ большинство исследователей понимают спонтанное, регулярно повторяющееся забрасывание в пищевод желудочного или дуоденального содержимого, что приводит к повреждению дистального отдела пищевода и появлению характерных симптомов (изжога, ретростернальные боли, дисфагия).
Эпидемиология
Истинная распространенность заболевания мало изучена, что связано с большой вариабельностью клинических проявлений — от эпизодически возникающих изжог до ярких признаков осложненного рефлюкс-эзофагита. Это наглядно показал D. Castell (1985 г.), предложивший схему «айсберга» ГЭРБ. V большинства больных симптомы бывают слабовыраженными и спорадическими, они не обращаются к врачам, а самостоятельно принимают антацидные препараты или пользуются советами знакомых («телефонные» рефлюксы) — это подводная часть «айсберга». Среднюю, надводную, часть айсберга составляют больные рефлюкс-эзофагитом с выраженными или постоянными симптомами, но без осложнений, которым необходимо проводить регулярное лечение — «амбулаторные» рефлюксы. Наконец, вершина айсберга — это больные, у которых развились осложнения (Пептические язвы, кровотечения, стриктуры) — «госпитальные» рефлюксы. Среди взрослого населения США частота изжоги, основного симптома ГЭРБ, составляет 20 — 40%, однако только 2% получают лечение по поводу рефлюксэзофагита (Spechler S., 1992). P. Jones (Великобритания, 1990 г.), обследовав 7428 пациентов, выбранных наугад, отметил наличие изжоги у 40%, причем 24% страдали от изжоги более 10 лет и только четверть из них консультировались по этому поводу с врачами.
Патофизиология
Поскольку давление в желудке выше, чем в грудной полости, рефлюкс желудочного содержимого в пищевод должен быть явлением постоянным. Однако благодаря запирательным механизмам кардии он возникает редко, на короткое время (менее 5 мин) и вследствие этого не рассматривается как патология. Пищеводный рефлюкс следует считать патологическим, если время, за которое рН достигает 4,0 и ниже, превышает 4,2% всего времени записи (Fisher R„ Ogorek С., 1994). ГЭРБ — многофакторное заболевание. J. Ferston и соавт. (1995 г.) выделяют следующие предрасполагающие факторы:
- стресс;
- поза;
- ожирение;
- беременность;
- курение;
- хиатальная грыжа;
- лекарства (антагонисты кальция, антихолинергические препараты, бетаблокаторы и др.).
Развитие заболевания связывают с рядом причин:
- с недостаточностью нижнего эзофагеального сфинктера;
- с рефлюксом желудочного и дуоденального содержимого в пищевод;
- со снижением пищеводного клиренса;
- с уменьшением резистентности слизистой пищевода.
Непосредственной причиной рефлюкс-эзофагита является длительный контакт желудочного (соляная кислота, пепсин) или дуоденального содержимого (желчные кислоты, трипсин) со слизистой оболочкой пищевода.
1. Недостаточность нижнего пищеводного сфинктера (НПС).
Желудочно-пищеводный заброс является результатом относительной или абсолютной недостаточности запирательного механизма кардии. К относительной недостаточности кардии приводит значительный рост интрагастрального давления. Так, например, интенсивное сокращение антрального отдела желудка способно порождать гастроэзофагеальный рефлюкс даже у людей с нормальной функцией НПС. Относительная недостаточность кардиального сфинктера встречается у 9-13% больных с ГЭРБ (Гребенев А. А., Нечаев В. М., 1995). Гораздо чаще имеет место абсолютная недостаточность кардии. К механизмам, поддерживающим состоятельность функции области пищеводно-желудочного перехода, относятся (Maher J., Woodward Е„ 1985):
- НПС;
- диафрагмально-пищеводная связка;
- слизистая «розетка»;
- острый угол Гиса;
- внутрибрюшное расположение НПС;
- круговые мышечные волокна желудка.
Главная роль в «запирательном» механизме кардии отводится состоянию НПС. У здоровых людей давление в данной зоне составляет 20,810,3 мм рт. ст. V больных ГЭРБ этот показатель снижается до 8,9±2,3 мм рт. ст. (Dodds W. и соавт., 1982). На тонус НПС влияет значительное число экзогенных и эндогенных факторов. Давление в НПС снижается под влиянием ряда гастроинтестинальных гормонов: глюкагона, соматостатина, холецистокинина, секретина, вазоактивного интестинального гормона, энкефалинов. Некоторые из широко применяемых лекарственных препаратов также оказывают депрессивное воздействие на запирательную функцию кардии: холинергические вещества, седативные и снотворные средства, бета-блокаторы, нитраты, теофиллин и др. Тонус НПС снижается при употреблении некоторых продуктов питания: жирной пищи, шоколада, цитрусовых, томатов, а также алкоголя и при курении. Прямое поражение мышечной ткани кардиального сфинктера (хирургические вмешательства, длительное назначение назогастрального зонда, бужирование пищевода, склеродермия) может вызвать гастроэзофагеальный рефлюкс. Часто ретроградное попадание желудочного или дуоденального содержимого в пищевод наблюдается у больных с хиатальной грыжей. Рефлюкс при грыже пищеводного отверстия диафрагмы объясняется рядом причин:
- дистопия желудка в грудную полость приводит к исчезновению угла Гиса и нарушению клапанного механизма кардии (клапан Губарева);
- наличие грыжи нивелирует запирающее действие диафрагмальных ножек в отношении кардии;
- локализация нижнего пищеводного сфинктера в брюшной полости предполагает воздействие на него положительного внутрибрюшного давления, которое в значительной степени потенцирует запирательный механизм кардии. Грыжа пищеводного отверстия диафрагмы является достаточно частой причиной развития ГЭРБ, По данным W. Wienbeck и j. Bamert (1989), хиатальная грыжа обнаруживается у 50% обследуемых в возрасте старше 50 лет и у 63- 84% из них эндоскопически определяются признаки рефлюкс-эзофагита.
II. Роль рефлюкса желудочного и дуоденального содержимого в ГЭРБ.
Прослеживается положительная связь между вероятностью рефлюкс-эзофагита и уровнем закисления пищевода (Stanciu С., 1975; Gotley D. и соавт., 1991). Исследования на животных ясно показали повреждающее воздействие ионов водорода и пепсина, а также желчных кислот и трипсина на защитный слизистый барьер пищевода. В то же время практически все исследователи признают роль не абсолютных показателей агрессивных компонентов желудочного и дуоденального содержимого, попадающих в пищевод, а длительности задержки (снижение клиренса) и резистентности слизистой оболочки пищевода.
III. Клиренс и резистентность слизистой пищевода.
Пищевод снабжен весьма эффективным механизмом, позволяющим устранять сдвиги интраэзофагеального рН в сторону кислой среды. Данный защитный механизм называют пищеводным клиренсом, который определяют как скорость выхода химического раздражителя из полости пищевода. Эзофагеальный клиренс обеспечивается за счет активной перистальтики органа, а также ощелачивающего компонента слюны и слизи. При ГЭРБ происходи”замедление пищеводного клиренса, связанного прежде всего с ослаблением перистальтики пищевода и дисфункцией антирефлюксного барьера (De Мео М„ Sontag S„ 1992). Резистентность слизистой оболочки пищевода обусловлена преэпителиальным, эпителиальным и постэпителиальными факторами. Повреждение эпителия начинается, когда ионы водорода и пепсин или желчные кислоты преодолевают водный слой, омывающий слизистую, преэпителиальный защитный слой слизи и активную бикарбонатную секрецию. Клеточная резистентность к ионам водорода зависит от нормального уровня внутриклеточного рН (7,3 — 7,4). Некроз возникает, когда этот механизм себя исчерпывает. Увеличение клеточного оборота за счет усиленного размножения базальных клеток слизистой оболочки пищевода противостоит образованию небольших поверхностных изъязвлений. Постэпителиальным эффективным защитным механизмом от кислотной агрессии является кровоснабжение слизистой.
Клиника и диагностика
Первый этап диагностики — опрос больного. Среди симптомов ГЭРБ основное значение имеют изжога, кислая отрыжка, ощущение жжения в эпигастрии и за грудиной, которые чаще возникают после еды, при наклоне туловища вперед или в ночное время. Вторым по частоте симптомом данного заболевания является ретростернальная боль. Боль иррадиирует в межлопаточную область, шею, нижнюю челюсть, левую половину грудной клетки и может имитировать стенокардию. Для дифференциальной диагностики генеза болей важно, что провоцирует и купирует боли. Для эзофагеальных болей характерны их связь с едой, положением тела и купирование приемом щелочных минеральных вод и соды. К внепищеводным проявлениям заболевания относятся легочные (кашель, одышка, чаще возникающие в положении лежа), отоларингологические (охриплость голоса, слюнотечение) и желудочные (быстрое насыщение, вздутие, тошнота, рвота) симптомы. Для выявления желудочно-пищеводного рефлюкса используются различные методы. При рентгенографии пищевода удается зафиксировать попадание контраста из желудка в пищевод, обнаружить грыжу пищеводного отверстия диафрагмы. Более надежным методом выявления гастроэзофагеального заброса является длительная рН-метрия пищевода, позволяющая оценить частоту, продолжительность и выраженность рефлюкса. В последние годы для оценки эзофагеального клиренса применяется сцинтиграфия пищевода с радиоактивным изотопом технеция. Задержка принятого изотопа в пищеводе более чем на 10 мин указывает на замедление эзофагеального клиренса. Исследование суточной рН и пищеводного клиренса позволяет выявить случаи рефлюкса до развития эзофагита. Основным методом диагностики ГЭРБ является эндоскопический. С помощью эндоскопии можно получить подтверждение наличия рефлюкс-эзофагита и оценить степень его тяжести. В соответствии с эндоскопической классификацией Савари и Миллера различают 4 степени эзофагита:
I степень — отдельные несливающиеся эрозии и/или эритема дистального отдела пищевода;
II степень — сливающиеся, но не захватывающие всю поверхность слизистой эрозивные поражения;
III степень — язвенные поражения нижней трети пищевода, сливающиеся и охватывающие всю поверхность слизистой;
IV степень — хроническая язва пищевода, стеноз, пищевод Баррета (цилиндрическая метаплазия слизистой пищевода).
Осложнения рефлюкс-эзофагита.
Пептические язвы пищевода наблюдаются у 2-7% больных ГЭРБ, у 15% из них они осложняются перфорацией, чаще всего в средостение. Острые и хронические кровопотери различной степени отмечаются практически у всех пациентов с пептическими язвами пищевода, причем у половины из них — сильные. Стенозирование пищевода придает заболеванию более стойкий характер: прогрессирует дисфагия, ухудшается самочувствие, снижается масса тела. Стриктуры пищевода встречаются примерно у 10% больных ГЭРБ. Клинические симптомы стеноза (дисфагия) появляются при сужении просвета пищевода до 2 см. К серьезному осложнению ГЭРБ относится пищевод Баррета, поскольку при этом резко повышается (в 30-40 раз) риск развития рака. На фоне цилиндрической метаплазии эпителия часто образуются пептические язвы и развиваются стриктуры пищевода. Пищевод Баррета обнаруживается при эндоскопии у 8 — 20% больных ГЭРБ (Levin D., 1992). Клинически пищевод Баррета проявляется общими симптомами рефлюксэзофагита и его осложнениями. Диагноз пищевода Баррета должен подтверждаться гистологически (обнаружение в биоптатах цилиндрического, а не многослойного плоского эпителия).
Лечение
Цель лечения — купирование симптомов, улучшение качества жизни, лечение эзофагита, предотвращение или устранение осложнений. Лечение ГЭРБ может быть консервативным и хирургическим.
Консервативное лечение
Консервативное лечение включает в себя:
- рекомендация больному определенного образа жизни и диеты;
- прием антацидов и производных альгиновой кислоты;
- антисекреторные препараты (блокаторы H2-рецепторов гистамина и ингибиторы протонной помпы);
- прокинетики, нормализующие моторику (активизация перистальтики, усиление активности НПС, ускорение эвакуации из желудка).
1 . Общие рекомендации по режиму и диете.
Основные правила, которые должен соблюдать больной:
- после принятия пищи избегать наклонов вперед и не ложиться; спать с приподнятой головой;
- не носить тесную одежду и тугие пояса;
- избегать обильных приемов пищи;
- не есть на ночь;
- ограничить потребление продуктов, вызывающих снижение давления НПС и оказывающих раздражающее воздействием (жиры, алкоголь, кофе, шоколад, цитрусовые);
- отказаться от курения; избегать накопления избыточной массы тела; избегать приема лекарств, вызывающих рефлюкс (антихолинергические, седативные препараты и транквилизаторы, ингибиторы кальциевых каналов, бетаблокаторы, теофиллин, простогландины, нитраты).
2. Антациды и альгинаты.
Антацидная терапия преследует цель снижения кислотно-протеолитической агрессии желудочного сока. Повышая интрагастральный рН, эти препараты устраняют патогенное воздействие соляной кислоты и пепсина на слизистую оболочку пищевода. В настоящее время ощелачивающие средства выпускаются, как правило, в виде комплексных препаратов, их основу составляют гидроксид алюминия, гидроксид или гидрокарбонат магния, т. е. невсасывающиеся антациды (фосфалюгель, маалокс, магалфил и др.). Наиболее удобной фармацевтической формой при ГЭРБ являются гели. Обычно препараты принимают 3 раза в день через 40 — 60 мин после еды, когда чаще всего возникают изжога и ретростернальные боли, и на ночь. Рекомендуют также придерживаться следующего правила: каждый приступ боли и изжоги следует купировать, поскольку эти симптомы указывают на прогрессирующее повреждение слизистой пищевода. В лечении рефлюкс-эзофагитов хорошо зарекомендовали себя препараты, содержащие альгиновую кислоту. К таким препаратам относится топалкан (топаал), выпускаемый (Франция), который наряду с гидроксидом алюминия и углекислым магнием содержит альгиновую кислоту. Альгиновая кислота образует пенную антацидную взвесь, которая плавает на поверхности желудочного содержимого и попадает в пищевод в случае желудочно-пищеводного рефлюкса, оказывая лечебное воздействие. По нашим данным, при рефлюкс-эзофагите 1 степени топалкан можно применять в качестве монотерапии, при рефлюкс-эзефагите II — III степени к топалкану следует добавлять антисекреторные препараты.
3. Антисекреторные препараты.
Цель антисекреторной терапии ГЭРБ — уменьшить повреждающее действие кислого желудочного содержимого на слизистую оболочку пищевода при гастроэзофагеальном рефлюксе. Наиболее широкое применение при рефлюкс-эзофагите нашли блокаторы Н2-рецепторов гистамина (ранитидин, фамотидин). Многочисленные клинические испытания блокаторов Н2-рецепторов показали, что после 8-недельного лечения заживление дефектов слизистой пищевода происходит у 65 — 75% больных. Мы использовали квамател (фамотидин), выпускаемый (Венгрия), у 27 больных рефлюкс-эзофагитом I-II степени, ассоциированным с язвенной болезнью двенадцатиперстной кишки, во всех случаях получили хороший результат при 4 — 6-недельном лечении. В последние годы появились принципиально новые антисекреторные препараты — блокаторы Н+, К+ — АТФазы (омепразол, лансопразол, пантопразол). Ингибируя протонную помпу, они обеспечивают выраженное и продолжительное подавление кислой желудочной секреции. Ингибиторы протонной помпы особенно эффективны при пептическом эрозивно-язвенном эзофагите, обеспечивая после 4-5 нед лечения рубцевание пораженных участков в 90 96% случаев. Однако антисекреторные препараты, способствуя заживлению эрозивно-язвенного поражения пищевода, не устраняют рефлюкс как таковой.
4. Прокинетики.
Антирефлюксное действие оказывают прокинетики. Одним из первых препаратов этой группы был блокатор центральных дофаминовых рецепторов метоклопрамид (церукал, реглан). Метоклопрамид усиливает высвобождение ацетилхолина в желудочно-кишечном тракте (стимулирует моторику желудка, тонкой кишки и пищевода), блокирует центральные дофаминовые рецепторы (воздействие на рвотный центр и центр регулирования желудочно-кишечной моторики). Метоклопрамид повышает тонус НПС, ускоряет эвакуацию из желудка, оказывает положительное влияние на пищеводный клиренс и уменьшает гастроэзофагеальный рефлюкс. К недостаткам метоклопрамида следует отнести его нежелательное центральное действие (головная боль, бессонница, слабость, импотенция, гинекомастия, усиление экстрапирамидальных расстройств). В последнее время вместо метоклопрамида при рефлюкс-эзофагите с успехом используется мотилиум (домперидон), который является антагонистом периферических дофаминовых рецепторов. Эффективность мотилиума как прокинетического агента не превышает таковую метоклопрамида, но препарат не проходит через гематоэнцефалический барьер и практически не оказывает побочных действий. Мотилиум выпускается , его назначают по 1 таблетке (10 мг) 3 раза в день за 15 — 20 мин до еды, Нами получен положительный результат монотерапии мотилиумом у больных с 1 — II степенью эзофагита. При рефлюкс-эзофагите III степени возникает необходимость в назначении антисекреторных препаратов (фамотидин, омепразол). Перспективным препаратом для лечения рефлюкс-эзофагита является препульсид (цизаприд) — гастроинтестинальный прокинетик. Он лишен антидопаминергических свойств, в основе его действия лежит непрямое холинергическое воздействие на нейромышечный аппарат желудочно кишечного тракта. Препульсид повышает тонус НПС, увеличивает амплитуду сокращений пищевода и ускоряет эвакуацию содержимого желудка. В то же время препарат не влияет на желудочную секрецию, поэтому препульсид при рефлюкс-эзофагите лучше комбинировать с антисекреторными препаратами. При рефлюкс-эзофагите, обусловленном забросами в пищевод дуоденального содержимого (в первую очередь, желчных кислот), что обычно наблюдается при желчнокаменной болезни, хороший эффект достигается при приеме нетоксической урсодезоксихолиевой желчной кислоты (урсофальк), которую в этом случае целесообразно комбинировать с препульсидом.
Хирургическое лечение
Целью операций, направленных на устранение рефлюкса, является восстановление нормальной функции кардии. Показания к оперативному лечению: 1) безуспешность консервативного лечения; 2) осложнения ГЭРБ (стриктуры, повторные кровотечения); 3) частые аспирационные пневмонии; 4) пищевод Баррета (из-за опасности малигнезации). Особенно часто показания к операции возникают при сочетании ГЭРБ с грыжей пищеводного отверстия диафрагмы. Основным типом операции при рефлюкс-эзофагите является фундопликация по Ниссену. В настоящее время разрабатываются и внедряются методы лапароскопической фундопликации.
Выбор метода лечения
Выбор метода лечения связан с особенностью течения и причиной ГЭРБ. G. Tytgat, проводя дискуссии за круглым столом «Гастродуоденальная рефлюксная болезнь» на I Объединенной гастроэнтерологической неделе в Афинах (1992 г.), рекомендовал придерживаться следующих правил:
- слабо выраженное заболевание (рефлюкс-эзофагит 0 — 1 степени) требует особого жизненного режима и, при необходимости, приема антацидов или блокаторов H2-рецепторов;
- при средней степени выраженности (рефлюкс-эзофагит II степени) наряду с постоянным соблюдением особого режима жизни и диеты необходим длительный прием блокаторов H2-рецепторов в сочетании с прокинетиками или ингибиторов протонной помпы;
- при тяжелом заболевании (рефлюкс-эзофагит III степени) назначают комбинацию блокаторов H2-рецепторов и ингибиторов протонной помпы или высокие дозы блокаторов H2-рецепторов и прокинетиков;
- отсутствие эффекта консервативного лечения или осложненные формы рефлюкс-эзофагита являются показанием к хирургическому лечению.