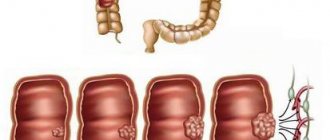
Аденокарцинома является злокачественным формированием, которое возникает из эпителиальных железистых клеток. Что касается такого подвида патологии как высокодифференцированная аденокарцинома, то она считается самой легкой формой, почти беспроблемно поддающейся лечению. Формируется патология из эпителиальных клеточных компонентов верхнего кожного слоя, самого эпителия, который застилает внутренние органические поверхности (желудка, матки, кишечника, некоторых других органов). Видимые отличия между болезнетворными и нормальными клетками почти отсутствуют. Наиболее явное изменение касается лишь клеточного ядра, которое удлиняется.
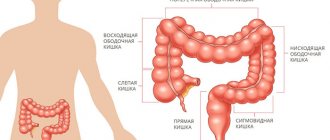
На основе степени клеточной дифференциации можно выделить несколько разновидностей таких онкопоражений. Также, при классификации болезни может учитываться местонахождение онкоочага (например, аденокарцинома толстой кишки, матки, желудка и пр.).
На что следует обращать внимание?
В онкологической практике учитывается критерий пятилетней выживаемости. Чтобы понять, доживет ли человек до этого срока, нужно учитывать:
• габариты опухоли (чем больше, тем меньше шанс на выживаемость); • глубина прорастания онкоформирования (здесь, соответственно, чем глубже, тем хуже прогноз); • наличие метастаз – при обнаружении этих компонентов прогнозы даются плохие, ведь это свидетельствует о поздних этапах протекания патологического процесса.
Следует отметить, что высокодифференцированная аденокарцинома сама считается фактором, воздействующим на выживаемость. Этот тип онкопоражения излечивается легче всего (в сравнении с дефектами умеренной или низкой дифференциации).
Основные методы терапии, позволяющие успешно бороться с аденокарциномой толстого отдела кишечника
Фортранс — средство для очистки ЖКТ.
Удаление опухоли оперативным путем. Этот метод является наиболее эффективным, так как в процессе хирургического вмешательства осуществляется удаление новообразования, которое по сути является очагом болезни.
Также производится удаление тканей, пораженных метастазами. Очень важно перед операцией придерживаться всех правил подготовки, а именно:
- соблюдать безшлаковую диету, о нюансах которой пациенту рассказывает врач;
- осуществлять (самостоятельно или помощью медицинского персонала) манипуляции, связанные с очищением кишечника от фекалий. Делается это, как правило, за 3-5 суток до операции посредством клизм и слабительных препаратов;
- делать (по назначению врача) промывания ЖКТ с помощью современных усовершенствованных средств. Оптимальными для этого являются «Фортранс» и «Лаваж».
Также эффективна терапия химиопрепаратами. В частности, применяют такие лекарственные средства, как: «Ралтитрексид», «Фторафур» и «Капецитабин», «Лейковорин», «Иринотеканом» и «5-фторурацил». При комбинировании этих препаратов лечение приобретает большую эффективность.
Причины появления аденокарциномы
Врачи до сих пор точно не знают, из-за чего появляется злокачественное поражение. Медицина выделяет лишь факторы риска. К таким провоцирующим предпосылкам зачастую относят: наследственность, преклонный возраст, влияние внешних факторов (плохая экология, вредные условия труда), злоупотребление алкогольными и табачными изделиями, частое употребление сильных медикаментов, систематические стрессы, ожирение, дефекты конкретного органа (например, язва желудка), повышенную концентрацию эстрогена, плохое питание (злоупотребление фаст-фудами, жирной пищей и т.д.).
Лечение
Аденокарциному кишечника лечат тремя методами:
- хирургическое удаление;
- химиотерапия;
- лучевая терапия.
Чаще всего приходится сочетать и комбинировать все доступные способы. Для выбора метода операции учитываются:
- локализация;
- размеры;
- характер дифференцированности клеток;
- классификацию по международной системе.
В период подготовки к операции применяют специальное питание смесями без шлаков, систему слабительных препаратов и очистительных клизм, средство Фортранс для выведения вредных веществ.
Фортранс принимают по схеме, указанной в инструкции
Оперативным путем проводят:
- резекцию (иссечение) пораженного ограниченного участка;
- экстирпацию (удаление) кишки, лимфоузлов и соседних органов при прорастании в них метастазов.
Обычно заканчивается операция формированием искусственного вывода кала на переднюю брюшную стенку (колостомы). Лучевая терапия проводится 5 дней до операции и спустя месяц после нее. Зона облучения определяется по локализации опухолевого роста.
Для химиотерапии используют комбинации лекарственных средств повторными курсами:
- 5-фторурацил;
- Фторафур;
- Адриамицин;
- Митомицин-C.
Препараты имеют выраженные негативные свойства, поэтому действие контролируют по анализам крови, мочи.
Особенности ухода за больными
В послеоперационном периоде пациенты сильно ослаблены. В связи с применением химиотерапии и облучения, иммунный статус резко падает. Им угрожает инфицирование любым возбудителем. Поэтому рекомендуется:
- чаще менять белье;
- ежедневно заниматься гигиеническими процедурами (чистить зубы, полоскать рот, протирать тело);
- проводить предупреждение образования пролежней (менять положение тела, разглаживать складки белья, смазывать кожу камфарным спиртом, делать массаж);
- в первые дни проводится кормление с помощью зонда и внутривенных смесей;
- нужно предусмотреть применение подгузников для недержания мочи;
- при замене калоприемника обрабатывать кожу вокруг колостомы теплой водой, вытирать насухо;
- возможно, врач порекомендует смазывание кремом.
Какое необходимо питание?
Еда должна поддерживать силы пациента, иметь достаточный калораж, не содержать раздражающих элементов, легко усваиваться. Категорически противопоказаны:
- жирные блюда;
- острые приправы;
- жареные и копченые мясные изделия;
- алкоголь;
- бобовые;
- свежие овощи в салатах.
Больного следует кормить 6 раз в сутки, малыми порциями. Полезны:
- приготовленные на пару котлеты, тефтели из нежирных сортов мяса, птицы;
- неострые морепродукты;
- кисломолочные изделия невысокой жирности;
- каши в жидком виде с чайной ложкой сливочного масла;
- супы из молока, овощей;
- вареные фрукты и овощи;
- ягодные кисели, компоты, чаи с травами.
За диетой пациенту придется следить всю жизнь.
Диагностирование
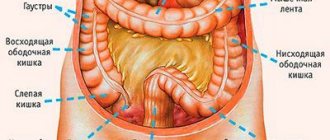
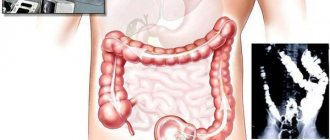
Процесс выявления высокодифференцированной карциномы включает сбор анамнеза и осуществление стандартных диагностических мероприятий: кровяной и мочевой анализ развернутого типа, анализ кала, ультразвуковое обследование области возможной локализации очага, изъятие биоматериала для последующего лабораторного изучения. Если имеются подозрения на онкологию кишечника, осуществляется пальцевое обследование прямой кишки. Кроме того, проделывается колоноскопия, позволяющая оценить состояние слизистой внутренней границы толстого кишечника. Еще одной важной процедурой является ирригоскопия (рентген толстого кишечника).
Виды опухоли в зависимости от изменений клеток
Опухолевый рост изменяет вид железистых клеток. Наименьшей опасностью обладают те клетки, которые мало отличаются от нормальных. Дифференцировать (различать) их по степени отклонений можно при цитологическом исследовании биопсийного материала. Чем сильнее выражены отличительные признаки, тем меньшей степенью дифференцировки обладают раковые клетки.
Среди новообразований типа аденокарциномы кишечника выделяются:
- Высокодифференцированная опухоль – под сильным увеличением микроскопа в отличие от нормальных видны увеличенные клеточные ядра, функциональных изменений нет, поэтому своевременное лечение бывает эффективно. Особенно результативна терапия пожилых больных. Удается достигнуть длительной ремиссии. У молодых пациентов не исчезает вероятность возникновения рецидивов в ближайшие 12 месяцев.
- Умеренно дифференцированная аденокарцинома – достигает большого размера, клетки сильно разрастаются, вызывают картину непроходимости кишечника, кровотечение, разрыв стенки. Клиническое течение осложняется перитонитом, образованием свищевых ходов. Высок риск перехода в низкодифференцированный вид. Однако, после хирургического удаления и последующего лечения, пятилетнее выживание наблюдается у 70–75% пациентов.
- Низкодифференцированная — опухоль отличается полиморфизмом (разнообразным составом клеток), растет очень активно, быстро распространяется на другие органы, поражает лимфатические узлы. Не имеет четких границ. Операция показана в ранней стадии, заранее предсказать длительность ремиссии сложно. При поздних сроках лечение неэффективно.
В зависимости от вида железистых клеток аденокарциному кишечника подразделяют на:
- Муцинозную опухоль (слизистую) – состоит из эпителия, слизи с муцином, нет четких границ, метастазируется в основном в соседние лимфатические узлы. Важно, что эта разновидность не чувствительна к действию лучевой терапии. Поэтому дает частые рецидивы.
- Перстневидноклеточную – отличается значительной злокачественностью, чаще выявляют с множественными метастазами. Особенно в печень и лимфоузлы. Больше поражает лиц молодого возраста и локализуется в слизистой толстой кишки.
- Плоскоклеточную – обладает высокой степенью злокачественности, наиболее распространенная локализация – прямая кишка. Прорастает в мочевой пузырь, влагалище, простату, мочеточники. Результаты лечения характеризуются частыми рецидивами, низкой выживаемостью (до пяти лет живут не более 1/3 пациентов, остальные умирают в первые 3 года).
- Тубулярную — опухоль с нечеткими очертаниями состоит из похожих на трубки образований в виде кубиков или цилиндров. Размеры могут быть небольшими, растет постепенно и отличается склонностью к массивным кровотечениям. Встречается у половины пациентов с раком кишечника.
Легочная аденокарцинома
Прогрессирует в легочных тканях. Ее компоненты слабо отличаются от здоровых компонентов легкого. Стимулировать появление такой болезни может чрезмерное курение, систематическое попадание в легкие вредных веществ (в большей степени это касается жителей промышленных городов), хронические легочные патологии. Метастазирование при таком онкопоражении крайне опасно: метастазы проникают в ближние и дальние органы, а также в костные ткани. Наиболее характерным признаком рассматриваемого онкодефекта считается кашель, сопровождающийся активным отделением слизистой мокроты. Онкоклетки выявляют при биообследовании мокроты и при помощи рентгена.
Классификация по стадиям
В целях создания единого подхода к оценке тяжести аденокарциномы принята международная классификация. Она подразделяет все аденокарциномы кишечника на 5 стадий. Для каждой определены:
- допустимые размеры опухолевого роста;
- наличие близких и отдаленных метастазов.
В стадии 0 – опухоль минимальна, никуда не прорастает и не имеет метастазов. В стадия I-II – размеры допустимы от 2 до 5 и более см, но метастазов нет. Третья стадия подразделяется на:
- IIIa – допускается прорастание в соседние органы и наличие метастазов в лимфоузлах;
- IIIв – сочетает большие размеры и наличие метастазирования только в соседних органах.
Стадия IV – ставится при отдаленных метастазах даже если размеры самой опухоли сравнительно небольшие.
Существует классификация рака кишечника, включающая такой признак, как дифференцировка клеточного состава. Она подразумевает, что:
- Gx – ставят в диагнозе, если клетки не могут быть дифференцированы;
- G1 – степень дифференцировки оценивается как высокая, клетки похожи на нормальные эпителиальные;
- рак толстой кишки степени G2 — показывает среднюю степень перерождения;
- G3 – клетки опухоли мало похожи на нормальные;
- G4 – тип клеток относится к низкодифференцированным, отличаются наибольшей злокачественностью.
Устаревшая, но очень яркая классификация
Устранение аденокарциномы высокодифференцированного типа
Лечебная тактика зависит от этапа онкопатологии, наличия метастаз. Местонахождение очага определяет специфические особенности осуществляемой терапии. Обычно задействуют лучевую обработку, химиотерапевтические процедуры, нейтронную терапию, хирургию. Лучи призваны замедлить прогрессирование онкоочага и его распад; кроме того, с их помощью разрушают метастазы. Что касается нейтронной терапии, то данная методика является новой. По принципу действия она схожа с лучевой терапией, правда вместо лучей задействуются нейтроны. Эти элементы проникают в глубинные слои онкоочага, которые поглотили конкретный микрокомпонент (к примеру, бор). Попав в глубинные слои, нейтроны начинают уничтожать онкоклетки. При этом здоровые ткани остаются нетронутыми.
Диагностика заболевания
Аденокарцинома толстой кишки – распространенное онкологическое заболевание. Оно довольно хорошо изучено и легко диагностируется. Для выявления данной патологии применяют следующие варианты скрининга:
- Исследование кала на фекальную ДНК. Проводится в момент обращения.
- Анализ каловых масс на скрытую кровь. Сдают раз в год.
- Виртуальная колоноскопия кишечника. Выполняется раз в пятилетку.
- Обычная колоноскопия. Делается раз в десять лет.
Скрининг проводится пациентам от 45 лет и старше. Частота и возраст завершения (80-85 лет) зависят от индивидуальных особенностей организма больного, состояния его здоровья, наследственности и ряда других факторов.
Если во время скрининга проктолог обнаружил у пациента опухоль, он берет ее образцы и отправляет их на биопсию (лабораторное исследование). Помимо этого для уточнения стадии развития аденокарцином используют следующие диагностические процедуры:
- Остеосцинтиграфия.
- УЗИ.
- Рентгенограмма грудной клетки.
- МРТ печени.
- Компьютерная томография брюшной полости.
Если пациенту помимо операции показано консервативное лечение (при помощи медикаментов), он дополнительно проходит молекулярно-генетический тест. Проводится забор образцов, которые впоследствии проверяют на микросателлитную нестабильность, наличие BRAF, RAS и других мутаций. По результатам проверки план лечения корректируются.
Вероятные осложнения
Осложнения способны проявляться при любой разновидности высокодифференцированного аденокарциномного поражения. Появление осложнений, прежде всего, обусловлено воздействием очага по мере его разрастания. Крупные габариты опухоли способны повреждать органы. Так, возможен разрыв кишечной стенки, ведущий, в свою очередь, к кишечному кровотечению. Помимо этого, отрицательно сказывается и конкретный этап онкопроцесса. Здесь все просто: чем дальше опухоль зашла в своем развитии, тем выше вероятность повреждения ближайших органов. Свою пагубную роль играет и рост онкокомпонентов. Например, увеличенные болезнетворные клетки при раке прямой кишки ведут к кишечной непроходимости. Также, стоит помнить о сопутствующих патологиях, которые могут осложнять течение рака.
Немного о нюансах операции
Хирургическое вмешательство — метод лечения данного заболевания.
При осуществлении хирургического вмешательства онкологи стараются не прикасаться к новообразованию, а зажимают кровеносные сосуды и отсекают пораженный участок кишечника.
Делается это для того, чтобы опухолевые клетки не перенеслись с током крови по всему организму. В ситуации, когда метастазы находятся на приличном расстоянии от злокачественного образования, проведение операции малоэффективно.
Однако, в части случаев вмешательство все таки проводится. Это позволяет избежать еще больших осложнений, болевого синдрома, идущего из очага, а также воспаления. Если болезнь находится на крайней стадии, то проведение операции необходимо для того, чтобы привести в норму работу кишечника и сформировать так называемую колостому (трубку с отверстием).
Наиболее распространенной формой рака ободочной кишки является аденокарцинома (75-80% наблюдений) [2, 4]. Значительно реже (10-12%) встречается муцинозная аденокарцинома, характеризующаяся гиперпродукцией слизи опухолевыми клетками [5]. Муцинозная аденокарцинома является одним из гистологических вариантов аденокарциномы желудочно-кишечного тракта. Прогноз при муцинозных аденокарциномах менее благоприятен, чем при обычных аденокарциномах, секретирующих небольшое количество слизи. Такие опухоли диагностируют в основном после возникновения осложнений: кишечных кровотечений, частичной или полной кишечной непроходимости. Установить диагноз обычно удается лишь при экстренной операции. Часто опухоли выявляют пальпаторно лишь тогда, когда они достигают большого размера и становятся неоперабельными.
В прогностическом отношении слизистый рак тонкой кишки намного хуже злокачественных опухолей толстой кишки. Причиной этого отчасти является позднее обращение больных за помощью, в результате чего операции производят на грани операбельности. Обширная резекция пораженного отдела толстой кишки является частью условно-радикального метода лечения этих пациентов. Редкий характер слизистой аденокарциномы толстой кишки служит причиной недостаточного исследования преимуществ адъювантной химиотерапии [1,6]. Нейроэндокринные раки толстой кишки чаще диагностируют в слепой и восходящей ободочной кишке, крупноклеточную морфологию новообразований — в толстой и прямой кишке, мелкоклеточные раки — в анальном канале [8].
Приводим клиническое наблюдение больной, дважды оперированной на протяжении 9 лет по поводу обширного (T4M0Nx) поражения злокачественной комбинированной опухолью — муцинозной аденокарциномой и нейроэндокринным раком толстой кишки.
Больная Л., 53 лет, в течение 3 лет лечилась по поводу железодефицитной анемии и поступила в ГНЦ в 2001 г. с жалобами на периодическую гипертермию, снижение массы тела, опухолевидное образование в левой подреберной области.
Считает себя больной с лета 1998 г., когда появились одышка, потливость, по ночам чувство удушья. Впервые глубокая железодефицитная анемия выявлена в 1998 г., ускорение РОЭ до 60 мм/ч. При проведенном тогда обследовании толстой кишки, желудка патологических изменений не обнаружено. Уровень гемоглобина вырос с 56 до 98 г/л. В сентябре 1999 г. при колоноскопии в городской клинической больнице выявлено и удалено три полипа. Терапия препаратами железа дала положительный эффект.
С апреля 2000 г. вновь появились признаки анемии и обнаружено опухолевидное образование в левом подреберье. Однако в отделение хирургической гематологии ГНЦ больная поступила лишь 28.05.01 с направительным диагнозом: хроническая постгеморрагическая железодефицитная анемия, недифференцированная опухоль брюшной полости. Предъявляет жалобы на тошноту, боли в животе, чувство дискомфорта. Состояние относительно удовлетворительное. Семейный анамнез отягощен: мать умерла от рака кишечника, отец — от рака легкого. После длительной подготовки 21.06 выполнена операция: при лапаротомии и ревизии выявлена плотная бугристая опухоль, представлявшая конгломерат с вовлечением петель тощей кишки, поперечной ободочной кишки, корня брыжейки тонкой кишки, мезоколон
(рис. 1, а).
Рисунок 1. Схема операции. а — штриховкой обозначены границы резекции органов.
Опухоль удалена единым блоком вместе с петлями тонкой и тощей кишки, большим сальником, частью поперечной ободочной и селезеночным углом толстой кишки, селезенкой. Кроме того, в связи с наличием конкрементов в желчном пузыре выполнена холецистэктомия. Наложены анастомозы: тонко-тонкокишечный конец в бок на уровне связки Трейтца и асцендо-десцендо конец в конец (см. рис. 1, б).
Рисунок 1. Схема операции. б — реконструкция кишечника.
При срочном гистологическом исследовании биоптата характер опухоли был неясен.
Макроскопически: опухоль располагалась в центре резецированного участка толстой кишки, граница между стенкой кишки и опухолью четкая как с проксимального, так и с дистального конца (рис. 2).
Рисунок 2. Препарат: удаленная опухоль с резецированными петлями тощей кишки (ТщК), толстой кишки (ТлсК) и большим сальником (Сал). На участке около 12 см стенка кишки резко утолщена (до 2 см), хрящевой плотности, на разрезе белого цвета, полупрозрачная. Дно опухоли неровное, выстлано свертками крови. Со стенкой кишки в области опухолевого перерождения были спаяны большой сальник и петля подвздошной кишки, на ограниченном участке — селезенка.
Микроскопически: опухоль имела комбинированное строение, низкодифференцированный нейроэндокринный рак G3 с инфильтрацией подслизистого слоя (рис. 3, а),
Рисунок 3. Микрофотографии опухоли. а — нейроэндокринный рак. Окраска гематоксилином и эозином. Ув. 100. опухолевыми эмболами в лимфатических сосудах подслизистого слоя, частично — муцинозной аденокарциномой с инфильтрацией мышечной оболочки
(см. рис. 3, б).
Рисунок 3. Микрофотографии опухоли. б — муцинозная аденокарцинома. Окраска гематоксилином и эозином. Ув. 200. Нейроэндокринный рак представлен крупными клетками с частыми митозами (2-3 в одном поле зрения, ув. 400), участками трабекулярного, органоидного строения, наличием псевдорозеток.
В удовлетворительном состоянии больная была выписана под амбулаторное наблюдение онколога. По месту жительства проведено три курса полихимиотерапии: лейковорин + 5-фторурацил, 6 пятидневных курсов с перерывом на 20 дней.
Спустя 2,5 года состояние удовлетворительное. Рецидива опухоли нет. Восстановлена нормальная масса тела (60 кг). 26.01.04 больная перенесла пластическую операцию по поводу послеоперационной грыжи.
В марте 2010 г. у больной появились жалобы на боли в эпигастральной области, признаки частичной кишечной непроходимости. Вновь госпитализирована в ГНЦ 01.04.10. При КТ в области ранее наложенного асцендо-десцендоанастомоза визуализируется опухоль размером 79×55×65 мм, суживающая просвет кишки, не дифференцирующаяся от левой поясничной мышцы и нижнего полюса левой почки (рис. 4).
Рисунок 4. Компьютерные томограммы. а — фронтальный срез.
Рисунок 4. Компьютерные томограммы. б — аксиальный срез.
13.03 произведена лапаротомия. В левой половине брюшной полости выявлен опухолевый конгломерат с вовлечением левой почки и селезеночного угла толстой кишки. При дальнейшей ревизии и в процессе выделения из сращений толстой кишки пальпаторно в ней обнаружено два опухолевых узла: в 5 см от баугиниевой заслонки в слепой кишке и в 3 см правее от ранее наложенного толсто-толстокишечного анастомоза. Произведено выделение опухолевого конгломерата единым блоком. Отсечена нисходящая толстая кишка в месте ее перехода в сигмовидную, на 12 см ниже опухоли. Пересечена подвздошная кишка в 15 см от илеоцекального угла. Опухоль вместе с левой почкой удалена единым блоком.
Прорастания опухоли в подвздошно-поясничную мышцу нет. Наложен анастомоз бок в бок между подвздошной и сигмовидной кишкой.
Макроскопически: в слепой кишке в 5 см от баугиниевой заслонки блюдцеобразная опухоль диаметром 3 см с язвой, в 6 см проксимальнее анастомоза опухоль диаметром 4 см, в 9 см от края резекции опухоль размером 8×7,5×7 см, прорастающая все слои стенки кишки, околопочечную клетчатку, капсулу почки. На разрезе большая часть опухоли представлена сообщающимися между собой полостями, максимально до 5 см в диаметре (рис. 5).
Рисунок 5. Препарат удаленной ободочной кишки (вскрыта продольно) единым блоком с левой почкой. Х — места рецидива опухоли, СА — старый анастомоз. Внутренняя поверхность полостей выстлана мягкими розоватыми слизистоподобными структурами. Микроскопически: во всех очагах опухоли картина слизистого рака с поражением всех слоев стенки кишки.
Течение послеоперационного периода осложнилось послеоперационным панкреатитом, перфорацией тонкой кишки с ограниченным перитонитом. 18.04 произведена релапаротомия, резекция петли тонкой кишки с формированием тонко-тонкокишечного анастомоза, санация брюшной полости. На фоне проводимой терапии перитонит регрессировал, уровень амилазы нормализовался. Однако в результате отека поджелудочной железы и спаечного процесса в брюшной полости длительно отмечался парез верхних отделов пищеварительного тракта (гастростаз). Ежедневно из желудка эвакуировали до 1500 мл застойного отделяемого. 31.05 наложена эндоскопическая гастростома, проведен энтеральный зонд. На фоне антибактериальной терапии и энтерального зондового питания состояние больной улучшилось. Частично восстановлен пассаж пищи естественным путем. 21.06 больная выписана под амбулаторное наблюдение. На фоне зондового питания состояние больной улучшилось, через 3 мес при контрольном обследовании отмечено восстановление пассажа пищи. Гастростомическая трубка удалена. Через 24 мес после операции состояние больной удовлетворительное, жалоб не предъявляет, питание не нарушено.
В данном наблюдении имело место сочетание двух форм злокачественных опухолей, имеющих эпителиальный и нейроэндокринный генез и получивших в новой классификации ВОЗ (2010) название комбинированного аденонейроэндокринного рака (MANEC) [9]. Он характеризуется сочетанием аденогенного и нейроэндокринного компонентов при условии выраженности каждого компонента не менее 30%. MANEC толстой кишки, в частности комбинированная муцинозная аденокарцинома и нейроэндокринный рак, — крайне редкая злокачественная опухоль, в связи с чем течение заболевания и прогноз мало изучены.
Вопреки распространенному мнению о том, что муцинозная аденокарцинома толстой кишки имеет склонность к более быстрому росту и более раннему метастазированию, в нашем наблюдении заболевание протекало относительно доброкачественно. Это, с одной стороны, препятствовало ранней диагностике, с другой — не помешало полному удалению опухоли. Своевременное радикальное хирургическое лечение и химиотерапия, проведенная впоследствии, позволяли надеяться на благоприятный прогноз [3].
По данным литературы, прогноз заболевания тесно связан с распространенностью процесса. При наличии только первичной опухоли (нейроэндокринная опухоль — NET) 5-летняя выживаемость составляет в среднем 94% (от 75% при нейроэндокринных опухолях тонкой кишки до 99% при поражении аппендикса). При вовлечении в процесс регионарных лимфоузлов 5-летняя выживаемость равна 64%, при нейроэндокринной опухоли желудка этот показатель значительно хуже — 23%. При наличии отдаленных метастазов выживаемость в среднем не превышает 18% [7]. При слизистом раке 5-летняя выживаемость после радикального хирургического лечения составляет 61,4%, при комбинированном лечении этот показатель достигает 78,4%. Основные причины неудач как хирургического, так и комбинированного методов лечения — локорегиональные рецидивы и метастазы в отдаленные органы, наиболее часто наблюдающиеся в первые 2 года после радикальной операции. После расширенных хирургических вмешательств 3- и 5-летняя выживаемость достигает 72,4±6,4 и 65,6±8,2% соответственно [4], что является несомненным доказательством целесообразности выполнения данных вмешательств.
Аденома
Аденома является факультативным предраком и может быть в виде полиповидного образования на ножке, образования на короткой ножке и образования на широком основании, связанного со слизистой оболочкой. Образование характеризуется гомогенным контрстным усилением и обычно не вызывает обструкции. Распространение за пределы серозного слоя указывает на злокачественное перерождение.
В данном примере представлен пациент с синдромом Пейтца—Егерса, с множественными полипами, в основном локализующимися в тощей кишке.