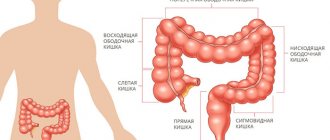
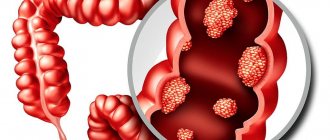
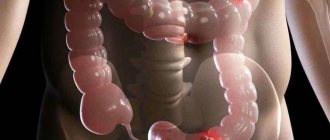
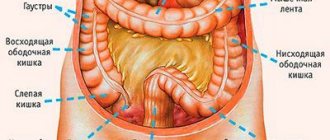
Колоректальный рак — объединённое название всех карцином толстого кишечника, начиная со слепой кишки и далее до анального отверстия. Злокачественные процессы в слепой, поперечно-ободочной и сигмовидной части кишечника принято относить к болезням ободочной кишки. Некоторые исследователи опухоли сигмовидной кишки считают отдельной группой — карциномы ректосигмоидного отдела.
- Колоректальный рак: что это такое?
- Причины возникновения болезни
- Симптомы колоректального рака
- Классификация колоректального рака
- Диагностика колоректального рака
- Метастазирование
- Лечение колоректального рака
- Хирургическое лечение
- Химиотерапия колоректального рака
- Лучевая терапия
- Прогноз и выживаемость колоректальной карциномы
- Профилактика колоректального рака
Колоректальный рак: что это такое?
Колоректальный рак (КРР) — это два разных заболевания, одно локализуется в ободочной, другое — в прямой кишке, их объединяет анатомия, схожесть причин развития и совпадение некоторых аспектов противоопухолевого лекарственного лечения.
При этих болезнях значимо различается диагностика, клинические проявления, подходы к хирургии и само оперативное лечение, отношение к использованию лучевой терапии и, конечно, прогноз.
Объединение в одну болезнь полезно для проведения профилактических мероприятий, но для утилитарных целей онкологии термин КРР не означает единства лечебно-диагностического подхода, потому что это два очень разных злокачественных процесса со своими клиническими особенностями и терапевтическими сложностями.
Карцинома прямой кишки в большинстве случаев течет агрессивно и, несмотря обязательность добавления к хирургическому лечению облучения, показатели выживаемости много хуже, чем при карциномах ободочной кишки.
Причины возникновения болезни
Предполагается развитие колоректальных аденокарцином из долго существующих ворсинчатых полипов, и доказано, что своевременное удаление полипов при колоноскопии снижает частоту карцином в популяции. Есть мнение, что злокачественный процесс может начинаться не в полипе, а с дисплазии слизистой оболочки.
Однозначное этиологическое мнение пока не сформировано, наоборот, совсем не исключается возникновение злокачественного процесса сразу в нескольких участках слизистой кишечника, причём часто морфологически не схожего.
Поскольку большинство новообразований локализуется в местах физиологической задержки содержимого, растет уверенность в активной канцерогенной роли особенностей и модели питания:
- заболеваемость африканского населения, сидящего на быстро эвакуирующейся по кишечной трубке растительной диете, незначительна;
- европейцы и американцы, предпочитающие высокобелковые продукты и фастфуд, болеют чаще.
Наследственные колоректальные раки большая редкость — едва ли у каждого 20-го больного можно проследить семейную заболеваемость, тем не менее, выведен целый список генетических синдромов с соучастием КРР. При наследственном заболевании карцинома возникает в десятки раз чаще и раньше по возрасту.
Предполагают негативное влияние алкоголя, причём не определенного напитка, а объемов употребления этилового спирта.
К факторам риска КРР причислено также:
- курение,
- низкая физическая активность,
- ожирение,
- сахарный диабет,
- хроническое воспаление слизистой кишечника при язвенном колите.
Знать точные причины злокачественных заболеваний важно для поиска путей профилактики, при выявлении заболевания у конкретного человека неважны вызвавшие его причины, необходимо подобрать адекватное лечение, но сначала провести полную диагностику.
Причины и механизмы развития заболевания
Колоректальный рак занимает лидирующие позиции по заболеваемости и смертности от злокачественных опухолей в России. Развитие молекулярной биологии привело к расшифровке механизмов образования и прогрессирования опухоли. Данные процессы требуют аккумуляции генетических и эпигенетических изменений в опухолевой клетке. Происходит накоплением мутаций в генах, которые контролируют рост и дифференцировку эпителиальных клеток. Это приводит к их генетической нестабильности.
Один из вариантов генетических изменений – микросателлитная нестабильность при колоректальном раке. Она характеризуется нарушением механизма репарации (особой функции клеток, заключающейся в способности исправлять химические повреждения и разрывы неспаренных оснований ДНК). Это приводит к тому, что мутации в геноме клетки накапливаются с большей скоростью, чем в нормальном состоянии.
При семейном аденоматозном полипозе возникают мутации генов, которые повреждают ДНК клеток с образованием микросателлитов. У больных с наследственными формами колоректального рака установлено наличие генных дефектов в различных хромосомах. При наследственных формах заболевания выявлены структурные изменения нуклеотидов. При спорадическом (ненаследственном) колоректальном раке наследственная предрасположенность является причиной заболевания у 18% пациентов.
Возможен непосредственный переход нормальной клетки к аденокарциноме. Чаще этот процесс развивается последовательно: сначала снижается дифференцировка колоноцитов, затем формируются доброкачественные новообразования (аденоматозные, аденопапилломатозные), потом они перерождаются в раковую опухоль.
В развитии колоректального рака определённую роль играют экзогенные и эндогенные факторы, в том числе нутритивные, функциональные нарушения толстого кишечника (хронический запор). К нутритивным факторам риска развития колоректального рака относят:
- Употребления большого количества красного мяса (говядины, свинины, баранины);
- Избыток в рационе пищевых жиров;
- Преобладание рафинированных продуктов, лишённых растительной клетчатки;
- Систематическое употребление алкоголя.
Важный фактор риска развития колоректального рака – хронические идиопатические воспалительные заболевания толстой кишки: гранулематозный и язвенный колит. Определённую роль играет дисбиоз толстого кишечника высоких степеней. Аденоматозные полипы почти неизбежно трансформируются в колоректальный рак. Малигнизация возникает в разное время в течение 13–15 лет. Причиной спорадического колоректального рака могут быть нарушения в клетках желудочно-кишечного тракта, способных к выработке и накоплению биогенных аминов и пептидных гормонов.
Симптомы колоректального рака
Клинические проявления заболевания зависят от:
- уровня локализации новообразования,
- размеров и степени обтурации просвета кишечной трубки,
- от агрессивности раковых клеток и связанной с нею скоростью развития метастазов.
Один и наиболее частых симптомов колоректального рака — боль, не относится к признакам раннего рака. Для инициации болевого синдрома необходимо существенное нарушение перистальтической функции или выход опухоли за пределы кишечника с вовлечением в раковый конгломерат богато иннервированной брюшины. Интенсивная прогрессивно нарастающая боль характерна для кишечной непроходимости, обусловленной частичным или полным перекрытием просвета трубки. В большинстве случаев КРР боли кратковременные и не стабильны по интенсивности, часто пациенты трактуют их как желудочный дискомфорт.
Задержка продвижения каловых масс проявляется ощущениями вздутия живота, негативно влияет на аппетит и может вызывать тошноту, но чаще беспокоит отрыжка. Рвота с каловым запахом характерна для кишечной непроходимости.
Изменения стула, как правило, в виде нестабильного чередования запоров и жидкого зловонного кала, и появление слизи при дефекации чаще возникает при поражении прямой кишки и левой половины ободочной. При новообразованиях правых отделов ободочной части отмечается склонность к запорам. При локализации опухоли в прямой кишке пациенты нередко не удовлетворены результатом дефекации — нет ощущения полного опорожнения.
Симптомы интоксикации — слабость и быстрая утомляемость обусловлены застоем кишечного содержимого с усилением процессов гниения и всасывания в кровь через стенку образующихся эндотоксинов. Разрушение раком сосудов может проявиться анемией вследствие хронического кровотечения.
Симптомы колоректального рака у женщин мало отличаются от мужских, но женщины внимательнее прислушиваются к голосу своего организма и много реже доводят себя до непроходимости.
В большинстве случаев симптоматика КРР настолько разнопланова и нестабильна, что не позволяет обнаружить процесс в ранней стадии, ярко манифестирует болезнь далеко не в начальной стадии.
Запись на консультацию круглосуточно
+7+7+78
Скрининговые тесты
Существует 4 основных скрининговых теста для выявления КРР:
- анализ кала на скрытую кровь,
- гибкая сигмоидоскопия,
- фиброколоноскопия (ФКС)
- ирригоскопия методом двойного контрастирования толстой кишки.
В последнее время к ним добавилась виртуальная колоноскопия. Ряд авторов настаивают на сочетании двух методов, как например: анализ кала на скрытую кровь с последующей сигмоидоскопией.
Самым дешевым и широко используемым методом скрининга является анализ кала на скрытую кровь, основанный на выявлении обладающего пероксидазной активностью гемоглобина с помощью гуаякового теста, бензидиновой или пирамидоновой пробы. Большинство тестов используемых в амбулаторной практике основаны на клее «гуаяк» который может окисляться в присутствии пероксидазы и перекиси водорода. Порядок проведения теста на скрытую кровь незначительно варьирует в зависимости от типа теста и описан во многих руководствах. Основными его недостатками являются большое количество ложноотрицательных, когда полипы или опухоль толстой кишки остаются не выявленными, и ложноположительных результатов, когда для исключения патологии пациенту приходиться проходить неприятную, дорогую и таящую в себе определенный риск процедуру — фиброколоноскопию. Обычно опухоли толстой кишки кровоточат незначительно и их трудно выявить с помощью теста на скрытую кровь. Чаще кровоточат образования более 2 см в диаметре [6]. Эффективность теста зависит от размера и локализации опухоли, большое влияние на него так же оказывает диета и ряд медикаментозных средств. Для уменьшения числа ложноположительных и ложноотрицательных результатов за несколько дней до исследования рекомендуется исключить употребление мяса, нестероидные противовоспалительные препараты, препараты железа и антиоксиданты типа витамина С. Тест желательно проводить с пробами, взятыми из нескольких порций кала (3 последовательных дефекации). С помощью данного теста невозможно определить количество крови в стуле, он так же неспецифичен, так как при доброкачественных заболеваниях: геморрое, язве желудка и двенадцатиперстной кишки, воспалительных заболеваниях кишечника он также может быть положительным. Разработаны несколько вариантов данного теста (Hemoc-cult, Hemoccult II), однако их чувствительность не превышает по самым оптимистичным данным 50%, а при ранних формах КРР составляет только около 5-10% [9]. Lieberman D et al. сообщает о низкой чувствительности этого теста (23,9%) даже в диагностики опухоли более 10 мм в диаметре. В этом же исследовании ложно положительные результаты встречались в 6,2 % случаев [14]. По данным Letsou G et al. у 59% пациентов с полипами и у 36% с раком толстой кишки тест на скрытую кровь был отрицательным [12]. Проведенное в Германии скрининговое обследование более 60 тысяч пациентов 47-75 лет с использованием теста на скрытую кровь показало снижение смертности от рака толстой кишки в течении 10 лет в группе скрининга на 18% [10]. Рекомендуется проводить тест на скрытую кровь по крайней мере один раз в год. При сравнении двух скрининговых методик, использующих тест на скрытую кровь — ежегодное прохождение теста или раз в два года, выживаемость в группе ежегодного скрининга была достоверно большей [15].
Следующим шагом в обследовании пациента с положительным результатом теста на скрытую кровь должна являться фиброколоноскопия, либо ирригография с двойным контрастированием (желательно в сочетании с сигмоидоскопией).
Использование комбинации теста на скрытую кровь и сигмоидоскопии повышает эффективность скрининга по сравнению с любым из этих методов, взятых отдельно. Однако даже сочетание однократного теста на скрытую кровь с сигмоидоскопией позволяет выявить злокачественную опухоль толстой кишки только у 75,8% пациентов [14].
Сигмоидоскопия позволяет успешно диагностировать КРР левой половины толстой кишки [19]. На основе обследования 2885 пациентов Lieberman D et al. сообщал, что гибкая сигмоидоскопия позволяет выявить неоплазму кишки в 70,3% случаев [14], по данным других авторов эта методика позволяет выявить до 95 % аденом и 80% случаев инвазивного КРР [18]. Однако проксимальные отделы ободочной кишки для обследования этим способом недоступны. Недостатком является и необходимость повторного исследования — ФКС, при выявлении патологии левой половины толстой кишки. На основе обследования 4411 пациентов Muller et al. сообщает о 60 % снижении риска смерти от колоректального рака при использовании скрининговой сигмоидоскопии [16]. Сигмоидоскопия проводится либо гибким сигмоидоскопом — аппаратом длиной около 35-60 см, либо ригидным ректороманоскопом длинной 25-30 см, хотя может выполняться и стандартным фиброколоноскопом. Необходимо подчеркнуть, что подготовка к сигмоидоскопии должна быть такой же, как и к ФКС. К сожалению 2-3 клизмы утром перед исследованием, иногда рекомендуемые для подготовки, часто не позволяют провести адекватную очистку исследуемого участка толстой кишки, приводя к сложностям при выполнении исследования и определенным сомнениям в его результатах. Участок толстой кишки, который может быть осмотрен при выполнении сигмоидоскопии, варьирует от места перехода сигмовидной в нисходящую ободочную кишки до селезеночного изгиба, а иногда и левой половины поперечно-ободочной кишки. Принципы выполнения сигмоидоскопии полностью соответствуют таковым при ФКС и приведены ниже. Рекомендуется проводить сигмоидоскопию по крайней мере 1 раз в 3-5 лет. Выбор такого промежутка времени между осмотрами обусловлено рядом факторов: существуют доказательства, что скрининговая эффективность сигмоидоскопии одинаковы при ежегодном осмотре и при осмотре раз в три года; развитие злокачественной опухоли из полипа редко происходит быстрее чем за 3 года [8, 21]. По данным ряда авторов «защитный эффект» сигмоидоскопии может длиться до 10 лет [20].
Пациенты с полипами или опухолями толстой кишки, выявленными при сигмоидоскопии должны в обязательном порядке пройти фиброколоноскопию или ирригографию.
Ирригография с двойным контрастированием является достаточно чувствительным методом выявления КРР и аденом больших размеров (более 90%). Ряд авторов сообщают о более высокой его эффективности при инфильтративном росте опухоли [4]. Недостатками ирригографии являются низкий процент диагностики раннего КРР, в особенности его поверхностно распространяющихся форм, значительное количество ложно положительных результатов и невозможность морфологической верификации диагноза. Данная методика позволяет выявить 50-80% полипов менее 1,0 см, 70-90% полипов более 1,0 см и 55-85% рака стадии A, B по Duke [5, 7]. В любом случае при обнаружении патологии проведение ФКС необходимо для подтверждения и морфологической верификации диагноза. Winawer S et al. на основе обследования 973 пациентов сравнил эффективность диагностики полипов толстой кишки у больных, ранее перенесших полипэктомию путём сравнения исследования кишечника с двойным контрастированием с барием и ФКС [23]. Ирригография выявила только 39% полипов, обнаруженных при ФКС, причем эта цифра варьировала от 32 до 52 % при образованиях менее 0,5 и более 0,6 см соответственно. Т.е. степень выявления полипов при ирригографии в значительной степени зависела от их размеров. Необходимо отметить, что не было выявлено 48% аденом размером больше 1,0 см — наиболее опасных в плане озлокачествления. При проведении ФКС не были выявлены 20% аденом (26% и 6% при образования менее 0,5 см и 0,6 — 1,0 см соответственно), диагностированных с помощью ирригографии, однако не одного образования более 1,0 см в диаметре пропущено не было. Подготовка и техника выполнения ирригографии прекрасно изложена Л.М. Портным в методическом пособии [4]. Он отмечает, что только хорошая подготовка кишечника к исследованию делает его высокоинформативным. Пероральная подготовка препаратом Фортранс является, по его мнению, методом выбора. Частота выполнения ирригографии с двойным контрастированием с целью скрининга КРР — 1 раз в 5 лет.
Фиброколоноскопия в настоящее время играет ведущую роль в установлении или исключении колоректальной патологии [2,13]. Однако не следует считать ФКС методом абсолютно и 100% исключающим патологию толстой кишки. Так, по данным П.А. Никифорова у 28 из 377 пациентов через год после выполнения колоноскопии был выявлен рак II или III стадии, а у 34 — рак I стадии, что косвенно свидетельствует о пропуске этой патологии при первичном осмотре [2]. Rex et al сообщает о пропуске 25% аденом размером менее 10 мм и 6% размером более 10 мм при стандартной ФКС [17]. В одном из исследований скрининговая ФКС позволила уменьшить встречаемость колоректального рака на 3570 случаев на 100000 населения в течении 10 лет [16]. Об успешно выполненной ФКС можно говорить только при условии достижении аппаратом купола слепой кишки. ФКС проводится пациентам после адекватной подготовки кишечника. Необходимо подчеркнуть, что под термином «адекватная подготовка» подразумевается полное удаление содержимого толстой кишки на всем ее протяжении (допускается только наличие небольшого количества прозрачной жидкости). Пероральная подготовка является способом выбора, так как приводит к адекватной очистке толстой кишки более чем в 95% случаев, легче переносится пациентом, связана с меньшим риском осложнений и побочных эффектов, чем очистительная клизма.
Важность полноценной очистки толстой кишки можно проиллюстрировать на следующем клиническом примере: Больная Р. 28 лет, была направлена на ФКС с подозрением на опухоль правой половины толстой кишки. Поскольку за 15 суток до обследования женщине было выполнено кесарево сечение, было принято решение о проведении исследования под общим обезболиванием. Подготовка к процедуре проводилась по принятой на тот момент методике — две клизмы по 1,5 литра вечером в день, предшествующий исследованию и две утром в день исследования. Клизмы выполнялись опытной медицинской сестрой. При осмотре уже на уровне сигмовидной кишки было обнаружено большое количество содержимого, которое с уровня селезеночного изгиба ободочной кишки полностью закрывала все стенки кишки, позволяя, однако, провести аппарат по просвету до купола слепой кишки. В связи со сложностями с повторным применением наркоза решено было продолжить процедуру. Патологии найдено не было. Однако клинические проявления, характерные для токсикоанемической формы опухоли толстой кишки позволили усомниться в результатах ФКС. При диагностической лапароскопии выявлена опухоль восходящего отдела ободочной кишки с преимущественно эндофитным ростом без стенозирования просвета кишки. Была произведена правосторонняя гемиколэктомия с анастомозом. Осмотр макропрепарата позволил сделать вывод о том, что при условии адекватной подготовки опухоль несомненно была бы выявлена во время эндоскопического осмотра (ФКС).
Наш опыт позволяет утверждать, что препарат для перорального очищения кишечника Фортранс является оптимальным средством подготовки к проведению ФКС, сигмоидоскопии и ирригографиии. Макроголь 4000, лежащий в основе препарата Фортранс не метаболизируется и не всасывается в кишечнике, обеспечивает эффективный лаваж без развития электролитных нарушений и побочных явлений. Для подготовки к исследованию принимают 3-4 пакетика препарата, растворив каждый в литре воды. Пациентам с запорами рекомендуется приём 4 пакетиков, при жидком стуле — трёх. Несмотря на необходимость выпить достаточно большое количество жидкости (3-4 литра), средний темп приёма препарата — 1 стакан каждые 15 минут, в подавляющем большинстве случаев делает это необременительным для пациента и легко им выполняется. Выделение промывных вод начинается в большинстве случаев через 60-80 минут после начала приёма препарата и продолжается до 45-60 минут после окончания его приема. При подготовке к амбулаторному обследованию мы не видим альтернативы пероральному методу подготовки, т.к. только очень небольшой процент населения может эффективно очистить кишечник с помощью клизм.
В данной работе не будем подробно останавливаться на технических аспектах выполнения ФКС, ограничившись лишь общими принципами:
- Кишку раздувать воздухом настолько мало, насколько это возможно для поддержания обзора, проводить аспирацию излишков воздуха при каждой возможности.
- Избегать формирования лишних петель.
- Отступать обратно и «присборивать» кишку при каждой возможности.
- Оценивать расстояние, на которое введён колоноскоп, ориентируясь на анатомические особенности кишки (селезёночный угол на 50 см от края ануса).
- Обращать внимание на ощущения дискомфорта пациентом, что говорит о чрезмерном образовании петель или чрезмерном раздувании кишки.
Применение кишечного спазмолитика — Дицитела в дозировке 50 мг 3 раза в день в течение 3 дней до исследования и 50 мг непосредственно пе-ред выполнением ФКС позволяет уменьшить неприятные ощущения во время и после процедуры. Частота проведения колоноскопии как скринингового метода в группе пациентов средней степени риска — 1 раз в 5-10 лет.
Новым методом диагностики патологии толстой кишки является виртуальная колоноскопия, впервые предложенная в 1994 году. Она позволяет на основе множества срезов, полученных с помощью компьютерного томографа и обработанных специальной программой получить изображение толстой кишки изнутри. Этот метод позволяет выявлять образования более 10 мм в 90% случаев, а менее 10 мм в 70-80% случаев [11]. Однако возможны и ложноположительные результаты, чаще всего обусловленные неадекватной подготовкой. Большим недостатком виртуальной колоноскопии является невозможность морфологической верификации диагноза. Данных о необходимой частоте выполнения виртуальной колоноскопии с целью скрининга в доступной литературе нами найдено не было.
Классификация колоректального рака
По типу роста колоректальной карциномы выделяют экзофитную — растущую подобно полипу и эндофитную форму, распространяющуюся внутри кишечной стенки и часто сужающую просвет трубки.
По клеточному строению у восьми из десяти пациентов находят аденокарциному толстой кишки, у одного — слизистую аденокарциному, ещё реже встречается перстневидно-клеточный и плоскоклеточный раки.
Вне зависимости от уровня локализации процесса предполагается следующее разделение по распространенности:
- 1 стадия — опухоль занимает только слизистую оболочку;
- 2 стадия — карцинома внутри кишечной стенки, но не вышла наружу — в брюшную полость;
- 3 стадия — любого размера раковый конгломерат с метастатическими лимфоузлами;
- 4 стадия — находят метастазы в других органах.
Стадия злокачественного процесса устанавливается до начала химиотерапии с облучением или после операции. Правильно установленная стадия — ключ к выбору оптимальной терапии, поэтому необходимо иметь в клинике высокоточное диагностическое оборудование, должны делаться все современные анализы, а врачи обязаны быть опытными. Пациентам «Евроонко» доступно все необходимое для этого.
Диагностика колоректального рака
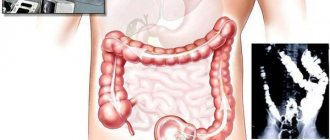
Диагностика колоректального рака не представляет особых сложностей — колоноскопия признана «золотым стандартом» выявления любой патологии кишечника и позволяет взятие материала для микроскопии. Осматривается вся кишечная трубка — тотально. Если колоноскопия невозможна, прибегают к ирригоскопии — рентгеноскопия с введением контраста в кишку, или к современной КТ-колонографии.
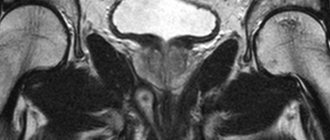
МРТ малого таза обязательно выполняется при прямокишечном раке, МРТ брюшной полости или аналогичного объема КТ выявит все внекишечные проявления болезни. Комплексное обследование — эндоскопия с одновременным УЗИ позволит понять степень поражения кишечной стенки.
При подозрении на метастазы в брюшной полости выполняется лапароскопия.
Опухолевые маркеры РЭА и СА 19.9. не помогают раннему обнаружению рака, потому что повышаются по множеству бытовых причин, но мониторинг их уровня позволяет понимать динамику процесса и оценивать эффективность лечения.
Для подбора оптимального лекарственного лечения в кусочке опухоли выявляют генетические мутации и микросателлитную нестабильность.
Табл.1 Чувствительность основных скрининговых тестов
| Скрининговые тесты | Чувствительность (%) | |
| Образование менее 10 мм | Образование более 10 мм | |
| 1. Тест на скрытую кровь | Около 17 | 23,9 |
| 2. Сигмоидоскопия | Около 65* | 70,3* |
| 3. Бариевая клизма | 32-52 | 48-90 |
| 4. Фиброколоноскопия | 75-85 | 94 |
| 5. Виртуальная колоноскопия | 70-80 | 90 |
*Чувствительность сигмоидоскопии в выявлении образований прямой и сигмовидной кишки аналогична таковой при ФКС.
У пациентов повышенной группы риска по колоректальному раку скрининговые методы и частота их проведения не отличаются от группы лиц со средней степенью риска, но начинаться скрининг должен с 40 лет, или на 10 лет раньше, чем самый ранний возраст возникновения рака толстой кишки у родственника.
Метастазирование
Колоректальные раки метастазируют в окружающие лимфатические узлы, по лимфатическим сосудам раковые клетки могут добраться до надключичной области. Степень вовлеченности лимфоколлектора коррелирует с агрессивностью карциномы и длительностью её существования. При высокодифференцированной аденокарциноме течение более благоприятно, а метастазы не столь обильны.
По кровеносным сосудам раковые отсевы заносятся в печень и чуть реже — в легкие. Костные метастазы совсем не характерны для КРР, но не исключаются при низкодифференцированной аденокарциноме.
Прорастание кишечной стенки может привести к разносу клеток по брюшной полости и, нередко, канцероматозу с асцитом.
Хирургическое лечение
Хирургия толстой кишки
При начальном процессе в ободочной кишке предпочтительно органосохраняющее вмешательство с использованием эндоскопического оборудования и удалением только поражённого участка слизистой оболочки — эндоскопическая резекция. Принципиально все злокачественные процессы в толстом кишечнике можно разделить на две группы: операбельные или резектабельные и, соответственно, не операбельные. Удаляется колоректальное образование несколькими способами, объем операции зависит от размера поражения: резекция части кишечника, удаление половины кишечника — гемиколэктомия, почти весь толстый кишечник — колэктомия и операция Гартмана. На объеме хирургии не сказывается каким образом пациент попал на операционный стол — экстренно по жизненным показаниям или в плановом порядке с качественной предоперационной подготовкой. Предпочтительная операция при небольшом числе метастазов в печени или легких, но только при технической возможности их одновременного удаления с пораженной кишкой. Если опухоль невозможно удалить, во избежание развития фатальной кишечной непроходимости, кишка выводится на живот — стома, а внутри брюшной полости мимо пораженного участка создается обходной путь.
Хирургия прямой кишки
Алгоритм хирургического лечения прямокишечной карциномы аналогичен оперативным подходам при раке ободочной кишки с той лишь разницей, что оперативное вмешательство дополняется локальной лучевой терапией и химиотерапией.
Основная операция — мезоректумэктомия только при ранней карциноме не дополняется облучением.
Пациент с неоперабельным процессом направляется в радиологию, если нет необходимости в паллиативном хирургическом вмешательстве, к примеру, установке стента в суженный участок. После облучения вновь рассматривается возможность операции на прямой кишке.
При невозможности выполнения операции на первом этапе, вопрос о ней должен ставиться после каждого последующего лечебного этапа — только хирургическое вмешательство существенно отражается на продолжительности жизни.
Лечение при разных стадиях
Начальные стадии рака кишечника хорошо поддаются лечению. Выживаемость составляет более 40%. Однако и при запущенной форме рака есть вероятность благополучного исхода. Всё зависит от тактики терапии, которую избрал врач и общей сопротивляемости организма к заболеванию.
- Стадия 0 — неинвазивный вид онкологии, который можно удалить без последствий для организма при помощи полипэктомии.
- Стадия 1 — опухоль начинает прорастать глубже в стенки кишечника, лимфатические узлы и близлежащие органы не поражены опухолевыми клетками. Основное лечение — передняя резекция прямой кишки. Дополнительно может быть назначена лучевая или химиотерапия.
- Стадия 2 — рак поражает все слои слизистой кишечника и начинает постепенно распространяться на близлежащие ткани. Онкобольному показано два этапа лучевой и/или химиотерапии в комплексе с оперативным вмешательством.
- Стадия 3 — заболевание дает метастазирование в регионарные лимфатические узлы, но поражения соседних органов не наблюдается. Показана комбинированная терапия, сочетающая в себе предоперационную химиотерапию, операцию и послеоперационный курс химии.
- Стадия 4 — наблюдается обширное поражение злокачественными клетками других органов. Лечение включает в себя резекцию кишки и последующее частичное удаление органа, пораженного раком. Далее больному назначается интенсивный курс химиотерапии. Онколог наблюдая за состоянием больного и динамикой болезни, может назначать дополнительное лечение (химию, лучевую терапию).
ВАЖНО:
Если новообразование не операбельно, пациенту назначают только химиотерапию.
Химиотерапия колоректального рака
После радикальной операции по поводу распространенного или с метастазами в лимфоузлах КРР проводится профилактическая полугодовая химиотерапия, она должна начаться в течение первых 4 недель. Также поступают при одновременном удалении первичной опухоли и метастазов в печени или легких.
Если химиотерапию делали до операции, после оперативного вмешательства проводится лекарственное лечение, суммарно охватывающее период в 6 месяцев. Комбинаций цитостатиков несколько, но все они обязательно включают фторпиримидины.
При неоперабельной карциноме прямой кишки химиотерапию фторпиримидином проводят вместе с длительным облучением, а по завершении лучевой добавляют ещё несколько курсов ХТ.
При неоперабельном раке ободочной кишки после вывода колостомы начинается длительная химиотерапия схемами FOLFIRI, FOLFOX или иными комбинациями с фторпиримидинами.
Пациент с впервые выявленным метастатическим заболеванием может рассчитывать на длительное лекарственное лечение, при стабилизации процесса перерыв в ХТ продлится до появления симптомов прогрессирования.
В обязательном порядке и неоднократно у каждого больного должна рассматриваться возможность и целесообразность оперативного вмешательства после завершения каждого этапа лечения. Но есть одна проблема — городские онкологические учреждения грешат очередями на первичное лечение, поэтому нечасто берут на операционный стол пациентов с анамнезом отказа в оперативном вмешательстве.
Прогноз и выживаемость колоректальной карциномы
Прогноз определяется множеством факторов, но главные — распространение заболевания на момент начала лечения и морфологические особенности клеток, то есть агрессивность и устойчивость к лекарственному воздействию.
Основная причина смерти при ободочном раке — метастазирование в печень как изолированно, так и в сочетании с поражением легких и лимфатических узлов.
После лечения прямокишечной карциномы часто возникают рецидивы в месте операции или продолженный рост после химиолучевого лечения, а также метастатическое поражение печени.
Хороший прогноз обещает ранний КРР без метастазов в лимфатические узлы.
Виды колоректальной онкологии
Большая часть диагнозов представляют из себя аденокарциномы
, начинающиеся в клетках, вырабатывающих слизь, необходимую для смазывания внутренней поверхности толстой и прямой кишки. Гораздо менее распространены следующие типы новообразований:
- Карциноидные опухоли
: возникают в клетках, производящих гормоны – вещества, которые создаются нашими железами, попадают в кровоток, с ним перемещаются в органы и ткани и сообщают им, как действовать – работать или отдыхать, выделять что-то или поглощать. - Гастроинтестинальные
, или желудочно-кишечные стромальные
опухоли
: возникают в интерстициальных клетках Кахаля, задающих ритм сокращений кишечника. Не все они являются злокачественными, то есть способными прорастать в окружающие ткани и создавать метастазы – дополнительные раковые очаги в других областях организма. - Лимфомы
–онкологическое заболевание иммунной системы. В основном начинаются в лимфоузлах, которые задерживают и обезвреживают опасные вещества, но способны образовываться и в других органах – селезенке, костном мозгеКостный мозг – это мягкая ткань, расположенная в некоторых частях скелета. В ней образуются новые клетки крови и часть лимфоцитов – белков, защищающих организм от бактерий и вирусов., вилочковой железеТимус, или вилочковая железа – это небольшой орган, расположенный перед сердцем. В нем созревают и развиваются некоторые типы лимфоцитов – белков, защищающих организм от бактерий и вирусов., миндалинахМиндалины, или гланды – это расположенные в задней части глотки органы, в которых вырабатываются антитела – белки, останавливающие размножение вдыхаемых и проглатываемых микроорганизмов. и пищеварительном тракте. - Саркомы
: могут развиваться в кровеносных сосудах, мышечных слоях и в других областях стенки толстой и прямой кишки.
Профилактика колоректального рака
Невозможно предотвратить развитие множества злокачественных заболеваний, но регулярное эндоскопическое обследование кишечника после 45 лет жизни способно предотвратить развитие КРР — это научная истина.
Можно исключить все факторы риска заболевания, правильно питаться и держать в норме вес, но при множественных полипах канцерогенный риск приближается к 100%, маловероятно избежать злокачественной опухоли, отказываясь от регулярного колоноскопического наблюдения и удаления ворсинчатых полипов.
Несколько полипов или даже один увеличивают риск КРР до 20%, болезнь Крона и другие язвенные поражения слизистой могут завершиться раком у каждого 20–25 пациента.
Лечение и выявление онкологических заболеваний — профиль нашей Клиники, наша цель — вернуть вам здоровье, если это невозможно, то мы готовы качественно изменить вашу жизнь.
| Подробнее о лечении в «Евроонко»: | |
| Проктолог-онколог | 5 100 руб |
| Онколог-гастроэнтеролог | 5 100 руб |
| Приём химиотерапевта | 6 900 руб |
| Скорая онкологическая помощь | от 12 100 руб |
| Паллиативная терапия в Москве | от 44 300 руб в сутки |
| Консультация радиолога | 11 500 руб |
Запись на консультацию круглосуточно
+7+7+78