Рак желудка представляет собой один из самых распространенных видов онкологических заболеваний. Эффективное, информативное и точное средство диагностики этого и ряда других заболеваний – гистологическое исследование тканей желудка. Гистологический анализ подразумевает взятие образцов тканей желудка посредством биопсии и их микроскопическое исследование. Эта процедура дает врачу возможность поставить точный диагноз и назначить оптимальное лечение. Прежде всего, биопсия тканей желудка и их гистологическое исследование обязательно производится, если врач подозревает у пациента опухоль. Гистологический анализ предоставляет информацию о типе новообразования, клеточном составе опухоли. Если расшифровка результатов гистологии желудка дает положительный результат (наличие злокачественной опухоли), он расценивается как окончательный диагноз. Важно понимать, что плохой анализ гистологии – еще не приговор, так как многие виды опухолей, обнаруженные своевременно, успешно излечиваются. Если же результат отрицательный, нельзя исключать ошибку, виной которой может быть несовпадение местонахождения раковых клеток и места взятия биоптата. Если результат гистологического исследования отрицательный, однако симптомы опухолевого процесса присутствуют, процедура повторяется.
Технические аспекты
Описаны многочисленные способы забора адекватного количества биопсийного материала. Чаще всего используется щипковая биопсия выполняемая с помощью биопсийных щипцов. Множественная биопсия повышает диагностическую ценность исследования. Важны и такие аспекты, как размер кусочков, место забора, ориентация, фиксация и окрашивание препаратов. При щипковом методе в биоптат обычно попадает только слизистая оболочка. Иногда крупные биопсийные щипцы захватывают и подслизистый слой. Тем не менее, таким щипцам требуется биопсийный канал не менее 3,6 мм в диаметре, при этом обычно забираемый ими материал бывает в 2-3 раза крупнее по поверхности, но не в глубину. Цитологическое исследование препаратов, получаемых при щеточной биопсии может быть полезным дополнением к щипковой биопсии в диагностике ряда злокачественных и инфекционных процессов. Петлевая эксцизия применяется для удаления крупных полипов. Комбинация технических приемов может повысить диагностические возможности. Аспирационная биопсия с помощью тонкой иглы под контролем эндоскопического ультразвукового исследования позволяет взять биопсию с субэпителиальных очагов, а также объектов, располагающихся вне желудочно-кишечного тракта (лимфоузлы, опухоли поджелудочной железы).
Стоимость и срок исследования
| Наименование | Срок | Стоимость, руб. |
| Гистология без иммуногистохимии | от 3 дней | 12 500 |
| Гистология с иммуногистохимией | от 3 дней | 28 300 |
* Организация и оплата доставки сырого материала (не в блоках) осуществляется клиентом.
По всем возникшим вопросам Вы можете проконсультироваться у нашего медицинского администратора по телефону: 8-800-555-92-67 или написать нам в WhatsApp: +7 925 740 05 87
Пищевод
Злокачественные опухоли пищевода могут быть диагностированы с помощью биопсии в 95% случаев, за исключением тех ситуаций, когда обструкция препятствует адекватной визуализации и биопсии из патологического очага. Следует забирать от 8 до 10 биоптатов. Дополнительно проводимая щеточная цитология может повысить диагностические возможности.
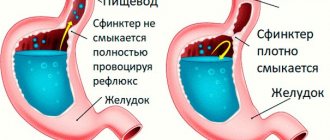
Наиболее часто воспалительные изменения в пищеводе встречаются при рефлюкс-эзофагите, развивающимся при гастроэзофагеальной рефлюксной болезни (ГЭРБ). Эндоскопическое исследование с биопсией показано при диагностике пищевода Барретта, либо для исключения инфекционных или злокачественных поражений пищевода, маскирующихся под гастроэзофагеальную рефлюксную болезнь. Выявляемые при эндоскопическом исследовании эрозивные изменения хорошо коррелируют с гистологической картиной, но одиночная эритема — ненадежный критерий для диагностики эзофагита. Напротив, гистологические отклонения от нормы (воспалительно-клеточная инфильтрация, включающая нейтрофильные и эозинофильные лейкоциты) могут выявляться в биоптатах у пациентов с ГЭРБ при нормальной эндоскопической картине слизистой оболочки. Биопсия и взятие материала на цитологическое исследование с патологически выглядящей слизистой оболочки необходимы для исключения злокачественных, инфекционных процессов, некоторых аутоиммунных заболеваний и пищевода Барретта.
Пищевод Барретта представляет собой состояние, при котором нормальный выстилающий поверхность плоский эпителий заменяется метапластическим специализированным кишечным эпителием. Его диагностика требует выполнения биопсии при эндоскопическом обследовании. На основании выявления метаплазии слизистой оболочки пищевода пациенты включаются в национальные раковые программы (ставятся на учет и периодически осматриваются). При гистологическом исследовании выявляют выстилку слизистой оболочки цилиндрическим эпителием лишенным щеточной каймы. Последний отличается от желудочного эпителия присутствием бокаловидных клеток, которые можно распознать с помощью дополнительного окрашивания альциановым синим.
Разрушение слизистой оболочки в зоне пищевода Барретта нередко сопровождается образованием в пищеводе крупных изъязвлений, а индуцированная воспалением атипия эпителиальных клеток по краям дефекта может быть ошибочно расценена как дисплазия.В таких случаях интенсивная медикаментозная терапия ведет к заживлению слизистой оболочки и правильной последующей гистопатологической интерпретации биоптатов.
Биопсия также проводится для выявления дисплазии или аденокарциномы. Если дисплазия установлена или ее наличие предполагается, следует осуществлять 4-квадрантную биопсию с 1-2 сантиметровым интервалом, а также забор дополнительных кусочков из любых патологически измененных участков слизистой. Забор материала через 2 см ведет к нераспознаванию 50% раков у пациентов с тяжелой дисплазией по сравнению с биопсией через 1 см. Хотя до сих пор рекомендовалась биопсия крупным форцептом, ретроспективный анализ установил, что при 4-квадрантной биопсии через 2 сантиметра было пропущено одинаковое количество раков при заборе как крупными щипцами (4/12, 33%), так и щипцами стандартного размера (6/16, 38%). Забор бипсийного материала из слизистой оболочки пищевода следует осуществлять способом вращательной аспирации, при этом открытый форцепт подводится близко к концу эндоскопа, эндоскоп поворачивается к стенке, выполняется аспирация, форцепт выдвигается, закрывается и кусочек извлекается. Сообщается, что у пациентов с тяжелой дисплазией отказавшихся от операции, эта методика (проводимая с 3-6 месячным интервалом) позволяла эффективно диагностировать рак, который на момент выявления в 96% случаев располагался в пределах слизистой оболочки.
Эндоскопическое исследование с высоким разрешением и хромоэндоскопия с метиленовым синим увеличивают частоту выявления короткого сегмента пищевода Барретта за счет выполнения прицельной биопсии. Хромоэндоскопия с раствором Люголя и метиленовым синим увеличивают частоту выявления соответственно плоскоклеточного рака и неопластических изменений в зоне пищевода Барретта, хотя значение использования метиленового синего в ходе наблюдения за пациентами с пищеводом Барретта остается дискутабельной.
Исследование биоптатов методом проточной цитометрии с проведением ДНК-анализа позволяет выявлять пациентов с анэуплоидией, полиплоидией, а с помощью р-53 потерю гетерозиготности, что свидетельствует о повышенном риске развития рака.
Локальные очаги в пищеводе могут быть удалены путем эндоскопической резекции слизистой. При этом в подслизистый слой вводится физиологический раствор с целью приподнятия патологически измененного участка, а затем он удаляется методом петлевой электроэксцизии. Эта методика с успехом применяется для удаления неопластических очагов в участках пищевода Барретта и для удаления доброкачественных опухолей пищевода.
Инфекционный эзофагит развивается у больных с иммунодефицитными состояниями, обусловленными проведением системной противоиммунной терапии, ингаляцией стероидных препаратов, злокачественными опухолями (после химиотерапии), при диабете, СПИДе. Наиболее частым возбудителем инфекционного эзофагита являются грибы рода Candida, вирус герпеса простого, цитомегаловирус. Грибковый эзофагит распознается по наличию белого налета на фоне воспаленной слизистой. Выполняются щеточная биопсия и забор кусочков, но цитологическое исследования мазков после щеточной биопсии является более чувствительным методом. Вирусный эзофагит проявляется образованием изъязвлений. Биопсию следует брать как из края, так и из центра язвенных дефектов. Гистологическое исследование обычно информативно, но при СПИДе требуется забор большого количества кусочков (до 10). Выделение вируса в культуре способствует диагностике, но этот метод менее чувствителен, чем гистологическое исследование направленное на диагностику цитомегаловирусной инфекции.
Желудок
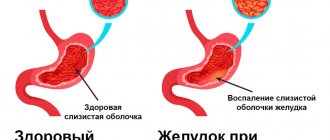
Опухоли желудка могут иметь вид язв, полипов, подслизистых образований или утолщенных складок слизистой оболочки. Адекватный забор материала иногда требует применения комбинированной техники. Щипковая биопсия дает наилучшие результаты при язвенных или полиповидных образованиях. Следует осуществлять забор нескольких кусочков с края каждого квадранта язвы и ее дна. Комбинация со щеточной цитологией повышает возможности морфологической диагностики. Биоптаты необходимо брать из всех мелких полиповидных образований, полипы более 2 см, при наличии технической возможности, должны удаляться целиком. Удаление полипов желудка связано с более высоким риском развития кровотечения, чем удаление полипов кишечника, поэтому должна рассматриваться возможность назначения антисекреторной терапии в пост операционном периоде.
Эндоскопическая резекция слизистой применяется для взятия материала с утолщенных складок слизистой желудка с целью исключения рака желудка и для лечения его ранних форм. Этим методом удаляются очаги раннего рака желудка размером менее 20 мм, не выходящие за пределы слизистой оболочки, что подтверждается с помощью эндоскопического ультразвукового исследования или на основании эндоскопических критериев. Патологический очаг поднимают над подслизистым слоем путем эндоскопического введения жидкости, а затем резецируют с использованием одного из технических приемов.
У пациентов с язвенной болезнью, мальтомой и у лиц с повышенным риском развития рака желудка (рак желудка у родственников по анамнестическим данным) следует исключить или подтвердить наличие Нр инфекции. Для этого используются методы основанные на исследовании полученного при эндоскопии биоптата. Сюда входит тестирование на уреазную активность (быстрый уреазный тест), выявление типичных извитых бактерий при гистологическом исследовании, выделение бактерий в культуре. У нелеченных больных забор материала следует осуществлять из малой кривизны антрального отдела вблизи угла желудка. Быстрый уреазный тест является не дорогим, высокоспецифичным и может выполняться в отделении эндоскопии, давая результат в течение 1 часа. Если уреазный тест негативный, можно применить другие способы выявления Нр.
Гистологическое исследование желудочного биоптата должно включать оценку воспалительно-клеточной инфильтрации и наличие типичных извитых бактерий, что может потребовать дополнительных методов окраски. Наличие выраженной воспалительно-клеточной инфильтрации при отсутствии бактерий обязывает выполнить серологическое исследование (определение специфичных к Нр антител), дыхательный уреазный тест или выявление антигена в фекалиях. Культуральное исследование предназначено для установления резистентности к антибиотикам, но обладает низкой чувствительностью и трудно в исполнении.
Чувствительность методов выявления Нр в тканевых образцах может быть снижена у пациентов, получающих ингибиторы протонной помпы или антибиотики, у тех, кто недавно прошел курс антихеликобактерной терапии (но инфекция персистирует), либо при наличии желудочно-кишечного кровотечения. У таких пациентов следует выполнять забор материала из многих участков слизистой оболочки антрального отдела и тела желудка и негативный быстрый уреазный тест должен дополняться другими способами диагностики. По возможности, пациентов следует просить о прекращении приема ингибиторов протонной помпы за одну неделю до проведения диагностических исследований на Нр.
ПАП-тест и жидкостная цитология
Забор материала осуществляется однотипно (стандартизированный забор): комбинированной щеткой или двумя цитологическими щеточками (рисунок 1), так как эпителий должен быть взят как с наружной вагинальной поверхности шейки матки (эктоцервикса), так и с внутренней – из цервикального канала (эндоцервикса). Необходимость забора клеточного материала из цервикального канала обусловлена тем, что зона стыка эпителиев (цилиндрического и многослойного плоского неороговевающего –места, где чаще всего начинаются «нехорошие» процессы (90-96%случаев)) с возрастом смещается ближе к центру и внутрь цервикального канала.
Рисунок 1 – Цитологические щетки (слева – комбинированная, справа – 2 цитологические щетки)
Рекомендуют осуществлять забор цитологического материала до бимануального (двуручного) вагинального обследования, кольпоскопии и ультразвукового исследования. Не следует сдавать мазки при наличии вагинита (воспалительного процесса во влагалище), в период его лечения, во время менструации. Также за двое суток необходимо половое воздержание.
Техника забора биоматериала:
- пациентка лежит на гинекологическом кресле;
- во влагалище вводят зеркало, визуализируя шейку матки;
- область наружного зева аккуратно промакивают ватным тампоном с целью удаления слизи;
- при использовании двух цитощеток: первую щетку располагают на влагалищной поверхности шейки матки и в экзоцервиксе и поворачивают на 360⁰ по часовой стрелке 5 раз, а вторую – в цервикальном канале на глубине около 2 см и поворачивают не менее 3 раз против часовой стрелки;
- при использовании комбинированной цитощетки: в цервикальный канал вводится центральная часть щетки, имеющая короткие щетинки, расположенные горизонтально, при этом длинные щетинки располагаются на влагалищной части шейки матки, щетку поворачивают по часовой стрелке 3 – 5 раз.
Отличия ПАП-теста и жидкостной цитологии
- В случае выполнения традиционного цитологического исследования (ПАП-теста) полученный материал распределяют на предварительно обезжиренном предметном стекле равномерным тонким слоем, что не всегда возможно, ввиду присутствия человеческого фактора (микропрепарат изготавливает непосредственно специалист), а также при наличии воспалительного процесса или кровянистых выделений (эпителиальные клетки часто могут быть заслонены нагромождениями лейкоцитов и эритроцитов и не видны под микроскопом). Ввиду вышесказанного, 10% мазков окажутся неинформативными, что потребует проведения повторного анализа. Кроме того, большая часть собранных клеток остается на цитощетках, для проведения дополнительных исследований (в случае получения сомнительного результата) будет необходим повторный забор.
- Чувствительность ПАП-теста (вероятность достоверного обнаружения «нездоровых» клеток) составляет 55-74%, а специфичность (гарантия того, что «нездоровые» клетки будут установлены при их присутствии в мазке) – 63,2 – 99,4%. Метод жидкостной цитологии имеет ряд преимуществ перед традиционным исследованием.
- При проведении жидкостной онкоцитологии забор материала всегда выполняется комбинированной цитологической щеточкой, собранный материал вместе со съемной щеточкой помещается в специальную емкость (виалу), заполненную стабилизирующим раствором, что предотвращает потерю биоматериала и обеспечивает его длительное хранение и выполнение дополнительных исследований в случае необходимости.
- Информативность жидкостной цитологии выше, что обеспечивается автоматической системой приготовления и окрашивания микропрепаратов, позволяющей расположить эпителиальные клетки в один слой, отделив их от других клеточных элементов. Оценка препаратов также производится автоматически при помощи системы CytoScreen.
- Количество неадекватных мазков при использовании жидкостной методики в 10 раз ниже, чем при использовании традиционной и не превышает 1%.
- Оставшийся в результате проведения жидкостной онкоцитологии биологический материал может впоследствии быть использован для дополнительных исследований, к примеру — иммуноцитохимического определения белка p16(INK4α) или определения высокоонкогенных типов вирусов папилломы человека.
В 99% случаев результат, полученный при использовании жидкостной цитологии, совпадает с результатами гистологического исследования.
Единственный недостаток метода – он не включен в систему обязательного медицинского страхования, т. е. анализ платный.
Тонкая кишка
Биопсия имеет важное значение в диагностике заболеваний тонкой кишки. Пероральный забор биопсийного материала традиционно осуществляется в области трейцевой связки. Эндоскопическая биопсия в настоящее время используется наиболее часто, так как позволяет за короткое время выполнить несколько прицельных биопсий в более комфортных для пациента условиях. Объем кусочков, полученных при щипковой биопсии, обычно бывает достаточным для постановки диагноза при диффузных поражениях слизистой оболочки тонкой кишки, если берется не менее 3 биоптатов из участков дистальнее луковицы ДПК (для исключения неправильной интерпретации морфологической картины, связанной с бруннеровыми железами). При заболеваниях с сегментарным характером поражения осуществляется забор нескольких биоптатов из более удаленных отделов тонкой кишки, что требует более длинного эндоскопа меньшего диаметра. Гистологическое исследование бывает полезным для установления диагноза даже при нормальной макроскопической картине.
Биопсия тонкой кишки является стандартным методом исследования для подтверждения диагноза синдрома мальабсорпции. При диагностике целиакии гистологическое исследование биоптатов тонкой кишки крайне необходимо даже при позитивном тесте на присутствие в крови эндомизиальных антител или тканевой трансглютаминазы. Биопсия должна выполняться до назначения лечения, поскольку вышеуказанные тесты могут быть ложно позитивными
Инфекционное поражение тонкой кишки также может быть установлено при гистологическом исследовании. Лямблии и ряд других протозойных возбудителей способны вызывать воспалительные изменения в слизистой оболочке тонкой кишки. Типирование зрелых взрослых возбудителей, их трофозоидов, либо промежуточных форм жизненного цикла в составе эпителия или на его поверхности может способствовать установлению точного диагноза. У некоторых пациентов морфологические проявления бывают сходными с эозинофильным гастроэнтеритом, диагноз последнего может быть установлен лишь после исключения паразитарной инвазии.
У пациентов с иммунодефицитными состояниями (пострансплантационная болезнь, ВИЧ-инфекция) в биоптатах тонкой кишки могут выявляться такие возбудители, как Isospora belli, Cryptosporidia, Cyclospora и Microsporidia. Другими возбудителями, выявляемыми в тонкой кишке при иммунодефицитных состояниях, являются цитомегаловирус, грибы рода Candida, гистоплазмы и Mycobacterium avium-intracellulare complex. При заборе материала у таких пациентов бывает полезным применение биoпсийных щипцов крупного размера. Рекомендуется также применять щипцы без иглы-фиксатора для исключения механического повреждения слизистой оболочки и потери эксудата на ее поверхности.
Опухоли 12-й кишки выявляются при эндоскопическом исследовании с биопсией. Техника забора материала зависит от локализации и размера опухоли. Дуоденальные и еюнальные полипы могут встречаться у 33-100% пациентов с анамнезом семейного аденоматозного полипоза (САП). Желудочные полипы у пациентов с САП наиболее часто имеют вид полипов фундальных желез. Они не подвергаются злокачественной трансформации, но требуют биопсийной верификации с целью исключения аденомы. Дуоденальные же полипы, как правило аденоматозные и встречаются в основном в ампуле или околоампулярной зоне. Верхние желудочно-кишечные полипы могут развиваться синхронно или метахронно по отношению к выявляемым полипам в толстой кишке. Аденокарцинома, развивающаяся из околоампулярной аденомы представляет собой легко распознаваемое состояние и является наиболее частой причиной смерти пациентов с САП после рака толстой кишки. Пациенты с САП должны быть включены в программу наблюдения, хотя эффективность данной тактики еще требует подтверждения.
В нескольких литературных источниках описано возникновение панкреатита после биопсии большого дуоденального соска, но осложнения после эндоскопических исследований с выполнением биописии слизистой оболочки тонкой кишки или удалением дуоденальных аденом из соседних с большим дуоденальным соском участков встречаются редко.
Отличия исследований
Если говорить о названных научных направлениях, то разница между ними будет ясна сразу:
- Гистология – научное направление, занимающееся анализом строения ткани;
- Цитология – научное направление, предметом исследования которого являются клетки.
У цитологии и гистологии в плане анализа есть определенные расхождения.
Первое – это метод оценки характеристик элементов клетки исследуемого биоматериала. Метод применим для выявления опухолей и неопухолевых патологий.
Второе являет собой метод диагностики лабораторной, предметом исследования которой являются образцы биоптата, то есть забранных в ходе манипуляции тканевых элементов.
Оба направления важны с чисто практической точки зрения: они дают врачу картину для постановки диагноза, предварительного либо окончательного, при различных патологиях. Широко применимы они и в онкологии.
Толстая кишка
Визуализация патологического очага в толстом кишечнике обуславливает необходимость его патогистологической оценки. При слишком большом, для единовременного удаления, количестве полипов должен осуществляться забор репрезентативного количества кусочков. Мельчайшие полипы, выявляемые при скрининговой сигмоскопии, должны подвергаться биопсии, более крупные полипы следует удалять целиком при последующей колоноскопии. Морфологическая констатация наличия аденомы или аденокарциномы должна служить поводом для исследования всей толстой кишки. Опубликованные данные о значении выявления гиперпластических полипов во время сигмоскопии остаются спорными. Многие гастроэнтерологи США не считают, что эти полипы несут в себе повышенный риск тяжелой проксимальной неоплазии.
При колитах эндоскопическое исследование с биопсией помогает в установлении протяженности процесса, дифференциальной диагностике и планировании лечения. Биопсийное исследование в остром периоде у пациента с кровянистой диареей позволяет отличить самопроизвольно излечивающийся острый колит от первичной или рецидивной атаки хронического язвенного колита или ишемического колита. Биопсия терминального отдела подвздошной кишки может быть полезной в диагностике болезни Крона, инфекционного илеита и лимфоидной нодулярной гиперплазии. Как болезнь Крона, так и язвенный колит связаны с повышенным риском развития колоректального рака. При этих заболеваниях с целью выявления дисплазии рекомендуется проведение эндоскопического исследования через 8 лет после первичной диагностики, если процесс носил правосторонний характер. У пациентов с левосторонней локализацией патологических изменений угроза развития рака возрастает к 15 году от начала заболевания. У больных с панколитом наиболее часто используемым подходом является 4-квадрантный забор материала через каждые 10 см (через 5 см на протяжении 25 см дистального отдела). При левостороннем колите биопсия из проксимальных отделов толстой кишки также должна выполняться для уточнения распространенности процесса.
Тактические подходы к очагам дисплазии у пациентов с хроническим колитом продолжают развиваться. Если участок слизистой оболочки с диспластическими изменениями крупный, с неровной поверхностью или сочетается со стриктурой, требуется хирургическое лечение. Однако аденому типичного вида, развившуюся на участке толстой кишки с признаками хронического колита, следует удалить с забором биопсийного материала из соседних участков слизистой оболочки. Если аденоматозный полип удален целиком и в окружающей слизистой оболочке нет признаков дисплазии, можно считать что проведено адекватное лечебное мероприятие при доброкачественной спорадической аденоме и продолжать наблюдение за больным с повторными эндоскопическими исследованиями.
Остается неясным, сколько кусочков и в каком месте следует забирать при хронической диарее и эндоскопически нормальной толстой кишке. Диагноз микроскопического колита устанавливается после выявления соответствующих гистологических признаков у больных с хронической водной диареей, при наличии нормальной эндоскопической картины и отсутствии дисбиоза. Биопсийные фрагменты, получаемые при сигмоскопии гибкой волоконной оптикой могут быть адекватны для диагностики данного состояния.