В лечении свищей прямой кишки врачи отделения проктологии Юсуповской больницы применяют самые современные методики, гарантирующие скорейшее и безболезненное выздоровление пациентов клиники, перенесших иссечение свища прямой кишки. Послеоперационный период после иссечения свища прямой кишки проходит под контролем лучших специалистов (проктологов, реабилитологов) Юсуповской больницы, обеспечивающих круглосуточную медицинскую поддержку, внимание и заботу каждому пациенту.
Что это такое?
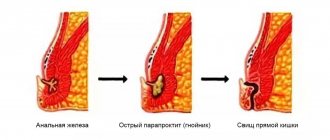
Свищ прямой кишки является трубчатым ходом, отверстия которого выходят в просвет кишки и кожу на ягодицах.
Свищи причиняют больному много дискомфортных ощущений:
- постоянное гнойное отделяемое оставляет следы на нижнем белье;
- больного мучают частые воспаления и нагноения;
- в тяжелых случаях возникают грубые рубцовые изменения в области анального отверстия, тяжелый болевой синдром;
- нарушается работа мышечного аппарата прямой кишки;
- повышается риск возникновения злокачественных опухолей в перианальной области.
Преимущества экстирпации прямой кишки
- Методика позволяет удалить очаги злокачественного процесса в максимальном объеме;
- У пациентов со злокачественной опухолью III стадии удается увеличить показатель пятилетней выживаемости;
- В ходе операции исключена кровопотеря;
- Использование современного оборудования позволяет провести операцию максимально бережно;
- Если существует возможность проведения сфинктеросохраняющей операции, то сохраняется естественная работа кишечника, а стома формируется лишь на время, необходимое для заживления.
Лечение
Полное избавление от свища прямой кишки гарантирует только хирургическое вмешательство, консервативная терапия в этом случае абсолютно неэффективна.
В отделении проктологии Юсуповской больницы применяется лазерная сварка свищевых ходов, облитерация их с помощью специальных клеев. Успешно применяются другие прогрессивные методы устранения свищевых ходов, предполагающие отсутствие разрезов мышц прямой кишки.
Кроме того, в случае необходимости для лечения свища прямой кишки используются хирургические вмешательства, в ходе которых иссекается свищевой ход и выполняется первичная пластика сфинктера. Проведение подобных операций целесообразно при тяжелых формах патологии с большим количеством разветвлений свищей и полостей вдоль свищевых ходов. Может применяться радиоволновая хирургия, электросварка тканей, лазерная коагуляция и пр.
Благодаря индивидуальному подходу достигается полное выздоровление в кратчайшие сроки, минимальный дискомфорт и сохранение трудоспособности пациентов.
Результаты
Четверо пациентов исключены из исследования по различным причинам: операция Гартмана (2), генерализованный процесс, выявленный интраоперационно (1), острое нарушение мозгового кровообращения в раннем послеоперационном периоде (1). В итоге анализу подвергли результаты лечения 90 пациентов. На этапе хирургического вмешательства у 7 из 30 пациентов группы J-ОР произведена конверсия в анастомоз КВК и у 1 — в анастомоз БВК, лишь у 22 (24,4%) сформированы J-ОР. В группе БВК анастомозы БВК сформированы у 30 (33,3%) больных. Причинами конверсии были узкий таз, ожирение, недостаточная длина кишки. Пациенты, которым производили конверсию анастомоза, автоматически переходили в соответствующие группы исследования. Соответственно в группе КВК выполнено 38 (42,2%) НПР с формированием анастомоза КВК.
Распределение пациентов в группах по возрастно-половым показателям, индексу массы тела (ИМТ), стадии заболевания, локализации опухоли и виду лечения представлено в табл. 1.
Таблица 1. Характеристика пациентов в группах
| Параметр | J-образный резервуар (n=22) | Анастомоз бок в конец (n=30) | Анастомоз конец в конец (n=38) | p |
| Возраст (медиана) | 57 | 60 | 58 | 0,362 |
| Пол — мужской | 6 (27,3%)* | 18 (60,0%)* | 20 (52,6%) | <0,05* |
| ИМТ (медиана), кг/м2 | 24,9 | 26,5 | 27,2 | 0,101 |
| Расстояние от ануса, см | 7,0 | 7,0 | 7,5 | 0,391 |
| T1 | 1 (4,5%) | 1 (3,3%) | 0 | >0,05 |
| T2 | 4 (18,2%) | 4 (13,3%) | 2 (5,2%) | >0,05 |
| T3 | 13 (59,1%) | 17 (56,7%) | 20 (52,6%) | >0,05 |
| T4 | 4 (18,2%) | 8 (26,7%) | 16 (42,1%) | >0,05 |
| N+ | 8(36,4%) | 8 (26,7%) | 13 (34,2%) | 0,742 |
| Неоадьювантная химиотерапия | 6 (19,3%) | 13 (43,3%) | 13 (34,3%) | |
| Пролонгированная химиолучевая терапия | 11 (50,0%) | 14 (46,7%) | 18 (47,3%) | >0,05 |
Высокую перевязку нижней брыжеечной артерии в месте отхождения от аорты чаще выполняли в группе, где предполагали создание J-ОР. По остальным характеристикам группы были сопоставимы (табл. 2).
Таблица 2. Характеристики оперативных вмешательств
| Параметр | J-образный резервуар (n=22) | Анастомоз бок в конец (n=30) | Анастомоз конец в конец (n=38) | p |
| Малоинвазивная тотальная мезоректумэктомия | 17 (77,3%) | 26 (86,6%) | 26 (68,5%) | 0,210 |
| Время операции, мин | 185 | 230 | 210 | 0,144 |
| Объем кровопотери, мл | 75 | 50 | 125 | 0,201 |
| Илеостома | 11 (50,0%) | 22 (73,4%) | 21 (53,8%) | |
| Трансверзостома | 11 (50,0%) | 8(26,6%) | 16 (46,1%) | 0,422 |
| Высокая перевязка a. mesenterica inf. | 20 (91,0%) | 20 (66,6%) | 22 (57,9%) | 0,074 |
| Мобилизация селезеночного изгиба | 20 (91,0%) | 7 (23,3%) | 9 (23,7%) | <0,001 |
| Срок пребывания в стационаре после операции, койко-дни | 8 | 8 | 8 | 0,401 |
Достоверных различий по частоте послеоперационных осложнений в группах не выявлено, хотя тенденция к большему числу прослеживалась в группе больных с анастомозом КВК (J-ОР — 13,6%, БВК —16,7%, КВК — 34,2%, p=0,705). При этом частота несостоятельности швов анастомоза отмечена в 1 (4,5%) наблюдении в группе J-ОР, в 1 (3,3%) наблюдении в группе с анастомозом БВК и в 3 (7,9%) наблюдениях в группе с анастомозом КВК.
Исходные показатели аноректальной манометрии непосредственно перед планированием хирургического лечения у пациентов всех исследуемых групп не имели достоверных различий, равно как и количество баллов по шкале Wexner (0 баллов в группе J-ОР и по 1 баллу в группах с анастомозами БВК и КВК (p>0,05). С момента хирургического лечения до этапа восстановительной операции/закрытия превентивной кишечной стомы наблюдали стойкую тенденцию к снижению тонуса наружного сфинктера, однако уже в интервале с 6 до 12 мес после закрытия превентивной стомы прослеживали положительную динамику (рис. 1). Сравнительный общий и межгрупповой анализ показателей среднего давления сокращения в анальном канале выявил, что их значения перед закрытием стомы и до 12 мес после закрытия стомы были больше, чем перед операцией. Наибольшие показатели среднего давления сокращения во всех группах отмечены перед закрытием превентивной стомы и через 3 мес после этого (рис. 2).
Рис. 1. Показатели среднего давления покоя в анальном канале, мм рт.ст.
Рис. 2. Показатели среднего давления в анальном канале при сокращении, мм рт.ст.
Перед восстановительной операцией и через 3 мес после нее наблюдали снижение показателей максимального давления в анальном канале в покое в каждой группе исследования (рис. 3). При сравнительной межгрупповой оценке цифровых показателей максимального давления в анальном канале при волевом сокращении выявлена аналогичная тенденция к снижению значений в интервале с момента НПР прямой кишки до закрытия превентивной стомы. Однако в последующие 6—12 мес отмечена тенденция к статистически достоверному улучшению этих показателей (p<0,0001) (рис. 4).
Рис. 3. Максимальное давление в анальном канале в покое, мм рт.ст.
Рис. 4. Максимальное давление в анальном канале при сокращении, мм рт.ст.
В интервале времени после НПР прямой кишки до 3 мес после закрытия превентивной кишечной стомы наблюдали статистически достоверное снижение продолжительности сокращения анального сфинктера во всех группах. А уже с 3 и до 12 мес после закрытия стомы происходило улучшение мышечной выносливости, что означает увеличение продолжительности произвольного сокращения наружного сфинктера (рис. 5).
Рис. 5. Продолжительность сокращения анального сфинктера (выносливость), с.
Пороговое значение чувствительности реконструированной прямой кишки в группах больных с анастомозами КВК и БВК не имеют статистически значимых различий (p>0,05) в сроки 3—12 мес наблюдения. Наибольший порог неоректальной чувствительности отмечен в группе с J-ОР (p<0,0001) (рис. 6). Наибольший объем первого позыва к дефекации зарегистрирован в группе пациентов с J-ОР без стойкой тенденции к изменению на протяжении года (рис. 7).
Рис. 6. Порог ректальной чувствительности, см3.
Рис. 7. Первый позыв к дефекации, см3.
Показатели объема, вызывающего постоянный позыв к дефекации у пациентов на фоне раздувания манжеты баллона в просвете реконструированной кишки, в J-ОР имеют статистически достоверное превосходство этих конструкций в способности накапливания и удерживания кишечного содержимого по сравнению с другими видами анастомозов в сроки 3—12 мес соответственно (p<0,0001: J-ОР против КВК, J-ОР против БВК) (рис. .
Рис. 8. Постоянный позыв к дефекации, см3.
Наибольшее значение максимально переносимого объема реконструированной прямой кишки также наблюдали у пациентов с J-ОР на всех временных промежутках от 3 до 12 мес после закрытия превентивной кишечной стомы (рис. 9).
Рис. 9. Максимально переносимый объем, см3.
До начала лечения оценка по шкале Wexner не превышала 2 (0—2) баллов, что свидетельствовало о нормальных значениях у большинства пациентов, которые удерживали все компоненты стула и газы (табл. 3).
Таблица 3. Оценка по шкале Wexner, баллы
| Срок оценивания | J-образный резервуар* (n=22) | Анастомоз бок в конец** (n=30) | Анастомоз конец в конец*** (n=38) | p |
| Перед операцией | 0 (0—4) | 1 (0—4) | 1 (0—4) | >0,05 |
| Через 3 мес после операции | 5 (4—8) | 6 (4—10) | 10 (5—12) | *0,011*** *0,044** **0,015*** |
| Через 6 мес после операции | 3 (3—6) | 5 (3—6) | 6 (3—9) | *0,01*** *0,02** **0,042*** |
| Через 12 мес после операции | 0 (0—2) | 1 (0—3) | 1 (0—4) | >0,05 |
Через 3, 6 и 12 мес после закрытия превентивной кишечной стомы наилучшие показатели по шкале Wexner наблюдали у пациентов группы с J-ОР.
У пациентов с анастомозом БВК результаты были лучше по сравнению с пациентами с анастомозом КВК в сроки 3 и 6 мес, однако к 12 мес показатели всех групп сравнялись (рис. 10).
Рис. 10. Оценка по шкале Wexner, баллы.
По прошествии 12 мес после закрытия превентивной кишечной стомы частота стула у пациентов с J-ОР была достоверно реже по сравнению с пациентами с анастомозом БВК и КВК — соответственно 1,3, 1,6 и 1,8 раза в сутки (табл. 4).
Таблица 4. Средняя частота стула в 3, 6 и 12 мес после закрытия превентивной кишечной стомы
| Количество дефекаций в сутки после операции | J-образный резервуар* (n=22) | Анастомоз бок в конец** (n=30) | Анастомоз конец в конец*** (n=38) | p |
| Через 3 мес | 2,4 | 4,2 | 5,2 | *<0,0001*** **<0,0001*** *<0,0001** |
| Через 6 мес | 2,1 | 3,2 | 3,5 | <0,0001 **0,135*** <0,0001 |
| Через 12 мес | 1,3 | 1,6 | 1,8 | *<0,003*** **0,16*** *0,05** |
Однако наряду с урежением частоты стула в группе J-ОР выявлены проблема с опорожнением резервуарной конструкции, наличие фрагментированного многоэтапного стула (в одно посещение уборной, требующее длительного пребывания в туалете), жалобы на запор, требующие приема слабительных препаратов и применения микроклизм. При межгрупповом попарном сравнении в сроки 3 и 6 мес после закрытия стомы микроклизмы достоверно чаще применяли в группе с J-ОР (у 9 пациентов через 3 мес и 13 пациентов через 6 мес), нежели в группе с анастомозом КВК (7 и 8 наблюдений соответственно) и группе с анастомозом БВК (7 и 10 наблюдений соответственно) (J-ОР против анастомоза КВК: p=0,002 и p=0,007; анастомоз КВК против анастомоза БВК: p=0,823 и p=0,021; анастомоз БВК против J-ОР: p=0,005 и p=0,013).
Реабилитация после операции
Сроки реабилитации и течение восстановительного периода зависят от того, какая именно хирургическая методика была применена для удаления свища прямой кишки.
После лазерной коагуляции
Лазерная коагуляция представляет собой самую современную методику лечения заболевания. В процессе данной процедуры просвет очищается от гноя и эпителия с помощью специальных инструментов, после чего в него вводится лазерное волокно. Благодаря лазерному излучению обеспечивается заваривание свищевого хода и уничтожение в нем всех микроорганизмов.
Для проведения лазерной коагуляции применяется региональная анестезия, поэтому болезненные ощущения отсутствуют. Восстановление после иссечения свища прямой кишки предполагает использование ректальных свечей, ускоряющих регенерационные процессы. Как правило, больного выписывают из стационара на 7-10 сутки после операции.
После операции по иссечению с обтюрацией
В ходе данного хирургического вмешательства свищевой ход удаляют на всем протяжении. Операция считается малотравматичной, при этом довольно эффективной даже в самых сложных случаях. Для проведения вмешательства применяется спинальная или общая анестезия, поэтому болевые ощущения полностью отсутствуют.
После операции пациент находится в стационаре от четырех до пяти суток, после выписки ему необходимо соблюдать «охранительный режим» в течение 2-3 недель.
Данное оперативное вмешательство применяется для лечения пациентов с «поверхностно» расположенными свищевыми ходами. Для выполнения операции используется спинальная анестезия. Послеоперационный период после иссечения свища прямой кишки проходит практически безболезненно. Срок госпитализации составляет от двух до трех суток.
После иссечения с первичной пластикой сфинктера
Ранее подобное традиционное хирургическое вмешательство применялось в случаях, когда особенности свищевых ходов препятствовали применению лазерных и других новейших методик.
В ходе операции свищевой ход ликвидируется на всем протяжении, затем выполняется послойное ушивание раны со стороны кожи и прямой кишки.
Для проведения данного хирургического вмешательства используется спинальная или общая анестезия, благодаря чему оно абсолютно безболезненно. С целью обезболивания в послеоперационный период пациентам назначаются ненаркотические анальгетики.
Срок госпитализации составляет от трех до семи суток.
Рак прямой кишки. Послеоперационная профилактика расстройств
Хирургическое лечение рака прямой кишки в начале разработки этой проблемы было связано с обеспечением безопасности оперативных вмешательств и борьбой с интраоперационными осложнениями, затем — с возрастанием радикальности операций и расширением зоны лимфодиссекции. Впервые радикальную операцию по поводу рака прямой кишки — брюшно-промежностную экстирпацию — выполнил W.Miles. Суть операции заключалась в футлярном удалении непосредственно самой прямой кишки. В отечественной хирургии приоритет в разработке и внедрении в клиническую практику передней (чрезбрюшинной) резекции прямой кишки принадлежит Б.А. Петрову, впервые выполнившему эту ССО в 1937 году.
Уважаемые пациенты! Обратите внимание на следующие материалы сайта:
|
Новые возможности для увеличения доли ССО появились с внедрением в хирургическую практику циркулярных сшивающих аппаратов последних моделей в сочетании с зажимом для наложения кисетного шва и монофиламентных нитей на прямых гнущихся иглах. Все это упростило выполнение предельно низких от анокутанной линии резекций прямой кишки. К этому добавились специальные исследования об особенностях внутрикишечного распространения ракового поля в дистальном направлении от видимого края опухоли. Оказалось, что достаточно отступить на 1,5 — 2 см от нижней границы пальпируемой части раковой опухоли, чтобы линия резекции пришлась по здоровой, непораженной опухолевыми клетками кишке. Стали выполняться не только низкие, но и ультранизкие резекции прямой кишки. Появились сообщения из высококвалифицированных и специализированных лечебно-научных учреждений о транссфинктерных резекциях ПК.
Профилактика послеоперационных колоректальных расстройств при раке прямой кишки
В последние годы с целью профилактики послеоперационных колоректальных расстройств широкое распространение получили операции формирования толстокишечного резервуара при резекциях прямой кишки. Исходные позиции этого предложения очевидны — создать вместо утраченных после резекции прямой кишки накопительной и эвакуаторной функций, подобие их, за счет резервуара из толстой кишки. Работ в этом плане довольно много. Использовался при этом многолетний опыт формирования тонкокишечных резервуаров при тотальной проктоколэктомии. Со временем стало очевидным, что чисто механически замена утраченных функций прямой кишки так просто не решается и последовала оценка результатов операций с формированием толстокишечных резервуаров, сообщения об изменении методики операции и новые предложения. Термин «неоректум» стал применяться все реже и реже.
Первоначально резервуар стремились формировать достаточно объемным 7,5-10 см. По мере изучения функциональных результатов резекций ПК с созданием толстокишечных резервуаров становилось очевидным, что лучшие данные выявляются при резервуарах меньшего размера — 5 см. Так, Jin-Ichi Hida et all. (1996 г.) проводили рандомизированные исследования с формированием резервуаров 10 и 5 см (длина). Первая группа (10 см) — 20 чел., вторая группа (5 см) — тоже 20 чел. Оценивали результаты через 1 год. Эвакуаторная функция при резервуаре 5 см была значительно выше, чем при «неоректум» 10 см. Сфинктерная функция была одинаковой в обеих группах. Оценивая функцию по ряду параметров, авторы определенно высказываются за создание толстокишечного резервуара 5 см. Они пишут: «J-резервуар 5 см дает адекватную резервуарную функцию без компрометирующей эвакуации». Через 3 года авторы вернулись к этому вопросу и убежденно пришли к заключению, что наблюдающиеся затруднения с эвакуацией кишечного содержимого после операций определенно связаны с размером резервуара — чем он больше, тем чаше наблюдаются затруднения.
Необходимость формирования толстокишечного резервуара возникает при низких резекциях прямой кишки. Правда понятие «низкая резекция» определяется по-разному и значение здесь имеет каждый сантиметр. Обычно речь идет о раке среднеампулярного отдела прямой кишки с определением нижней границы резекции. Т.С.Одарюк с соавт. (2000 г.) пишут, что это в среднем 1,5 см от аноректальной линии. Необходимость в резервуаре авторы обуславливали развитием «Синдрома низкой передней резекции» после прямых наданальных анастомозов.
Jin-ichi Hida et all (1998 г.) приходят к заключению, что при резекции прямой кишки выше 4 см от зубчатой линии нужно выполнять прямой колоанальный анастомоз, а ниже 4 см — формировать J-резервуар.
Для оценки колоректальной функции у больных после резекций прямой кишки с формированием толстокишечного резервуара используется метод анкетирования (вопросник) и объективные исследования аноректальной функции в разные сроки после оперативного вмешательства.
Наряду с безусловно положительной оценкой резекции прямой кишки при раковом ее поражении с формированием толстокишечного резервуара, ряд авторов обращает внимание на недостатки такой операции. Справедливо замечают Г.И.Воробьев с соавт. (2000 г.), что «до настоящего времени сохраняется нестабильность и непредсказуемость функциональных результатов, особенно в отдаленные сроки после данного вмешательства (операции с резервуарами)». Так, у 15-20% больных не удается добиться нужной континенции.
В связи с выявленными негативными сторонами J-резервуаров в литературе стали обращать внимание на особенности формирования самого толстокишечного резервуара. Г.А.Покровский с соавт. (1998 г.) вместо J-образного создавали Э-образный резервуар, но число таких операций невелико — всего пять оперированных больных. G.A.Maurer et all (1999 г.) высказывают мнение, что короткий толстокишечный резервуар более физиологичен и приближается к «неоректум». В эксперименте на свинках они формировали несколько видов резервуаров и наиболее приемлемой оказалась простая конструкция с поперечной колопластикой которая создает подобие ампулы прямой кишки. Они анастомозировали ее с оставшейся частью анального канала. R.Ruppert &D.Staimmer (1999 г.), зная эти экспериментальные исследования на свинках и видя недостатки J-резервуаров, использовали колопласткиу у 31 больного. Функциональные результаты оказались заметно лучше.
Интересный вариант ССО предложили В.В.Яновой с соавт. при низких резекциях ПК, когда опухоль располагается не выше 3 см от зубчатой линии анального канала. Эти авторы с 1989 г. делают в низведенной кишке две продольные насечки с последующим сшиванием их поперек, что создает S-образный изгиб и увеличивает объем кишки. Функция финктерного аппарата признана хорошей и удовлетворительной у 60.5% больных: 5-летнее выживание — 69%. Опыт авторов — лечение 700 больных РПК.
Поиск лучших вариантов формирования толстокишечных резервуаров и оценка колоанальной функции в таких случаях продолжается. Совершенствование колопластических операций в этом плане, вероятно, займет определяющее место.
Склонностью к лимфотропизму при раке прямой кишки
В связи с тем, что рак прямой кишки, согласно исследованиям, обладает склонностью к лимфотропизму, именно лимфаденэктомии в хирургическом лечении рака прямой кишки придается весьма важное значение. Лимфогенное метастазирование рака прямой кишки является одной из вероятных причин развития локорегионального рецидива после операции. Поэтому наряду с удалением первичной опухоли целью хирургического лечения является радикальное удаление зон регионарного метастазирования опухоли.
Еще W.Miles в 1908 г. были определены три основные пути лимфогенного метастазирования при раке прямой кишки — восходящий, нисходящий и латеральный, что послужило началом разработки принципов лимфодиссекции при неопластических образованиях ПК.
- Восходящее метастазирование охватывает параректальные, верхние ректальные и нижние брыжеечные лимфоузлы.
- Латеральное метастазирование затрагивает средние ректальные, запирательные, внутренние подвздошные и общие подвздошные узлы.
- Нисходящее метастазирование — паховые лимфоузлы.
Периневральная инвазия
При наличии инвазии опухоли в нервную ткань метастазы в лимфоузлах обнаруживается в 81%, а без такового — в 37%.
Первичный рак прямой кишки характеризуется тем, что опухоль остается длительное время локализованной и относительно медленно растет по сравнению с другими опухолями пищеварительного тракта. Локализованный и медленный рост характерен так же и для метастазов в лимфоузлы. Исходя из этой биологической особенности рака прямой кишки, было сделано предположение, что, увеличив объем лимфаденэктомии, можно достичь снижения количества рецидивов.
Впервые расширенная лимфаденэктомия была описана Kuru в 1942 г. Однако, результаты исследований не показали статистически значимой разницы в 5-летней выживаемости между группами больных, которым проводились стандартная и расширенная лимфаденэктомия. Вновь интерес к расширенной лимфаденэктомии появился в 80-е годы, когда Heald и соавт. предложили выполнение тотальной мезоректумэктомии, т.е. удаление совокупности тканей и органов, находящихся в пределах фасциальной оболочки прямой кишки, включающей в себя параректальную клетчатку, кровеносные и лимфатические сосуды. Используя данную методику, этим авторам удалось снизить частоту местных рецидивов до 5%, что, однако не удалось воспроизвести другим исследователям, но вновь возник интерес к расширенной лимфаденэктомии.
Takahashi T. и соавт. предложили различать несколько вариантов лимфаденэктомии: ограниченную, стандартную и расширенную. Однако такое деление не является общепризнанным.
- Ограниченной лимфаденэктомии соответствует тотальная мезоректумэктомия.
- Стандартная лимфаденэктомия — ограниченная + высокая перевязка нижней брыжеечной артерии у аорты и удаление лимфоузлов по ходу подвздошных сосудов.
- Расширенная лимфаденэктомия — стандартная + лимфодиссекция в запирательном пространстве.
По мнению японских хирургов, ограниченная лимфаденэктомия показана при ранних стадиях рака прямой кишки, стандартная — при распространенном раке верхних отделов ПК, расширенная — при распространенном раке нижних отделов ПК.
Данные о влиянии расширенной лимфаденэктомии на 5-летнюю выживаемость больных раком стадии В и С по Dukes весьма противоречивы. Необходимы дальнейшие многоцентровые исследования.
Недостатки лимфаденэктомии при раке прямой кишки
Основным недостатком лимфаденэктомии является нарушение мочевой и половой функций, которые встречаются в 30% и 80 — 100% наблюдений соответственно. Такие нарушения могут быть связаны с разными причинами, но, несомненно, они возникают при пересечении вегетативных нервов таза. Выясняя функциональные результаты ССО выполненных по поводу РПК, мы также обращали внимание на частоту мочеполовой дисфункции у этих больных. Это послужило поводом для проведения собственных исследований по выяснению особенностей строения и расположения вегетативных нервов таза.
Казалось бы очевидным, что для получения лучших функциональных результатов после низкой резекции ПК необходимо позаботиться о сохранении вегетативной иннервации органов таза, однако специальных исследований в этом плане очень мало. Вероятно, правы Yasutomi Masayuki et all. (1995 г.), которые пишут, что в предыдущие годы все внимание было сосредоточено на повышение радикальности операций. К этому нужно добавить, что не существует, а мы специально интересовались, специфических методов идентификации нервных структур (окраска, свечение и т.д.).
Проблему составляет сохранение иннервации при резекциях ПК и ряд хирургов призывают бережно относиться к нервным структурам таза. В этом отношении нужно отметить определенную настойчивость и последовательность исследований японских хирургов.
Сохранение вегетативных нервов малого таза при операциях у больных РПК реально при начальных формах ракового поражения при стадиях по Dukes А и В. Окончательно неясным и спорным является вопрос о возможности и целесообразности сохранения гипогастральных нервов при более распространенных формах опухолевого поражения ПК, не пренебрегая онкологическими интересами.
Оригинальные исследования T.Kono et all. (1998 г.), которые провели исследование на крысах по трансплантации тазовых нервов после их предварительного иссечения. Через 6 недель они уже регистрировали ритмичные сокращения мочевого пузыря у всех подопытных. Авторы делают смелый вывод, что трансплантация нервов таза успешно восстанавливает функцию мочевого пузыря и поэтому такую операцию можно рекомендовать в практику.
Yasutomi M. et all. при низких резекциях ПК у 185 больных ранними формами ракового поражения всегда стремились сохранить пучки вегетативных нервов. Дисфункция мочеиспускания после операции уменьшилась до 15% (раньше — 33%), половая потенция снизилась до 21% (раньше — 81%), 5-летняя выживаемость — 81%.
Sugihara Kenichi et all., сохраняя нервные пучки с обеих сторон при резекциях прямой кишки отметили способность к произвольному мочеиспусканию у 93,5%, а половую потенцию — у 70,4%. При ранних раках прямой кишки, замечают авторы, нервы должны сохраняться полностью, а при обнаружении метастазов опухоли в тазу — следует стремиться к сохранению нервов хотя бы с одной стороны. 5-летняя выживаемость составила при стадиях по Dukes А — 96,4%, В — 84,0%, С — 67,3%. Ishikura S. et all. (1999 г.) оперировали 50 больных низким РПК, сохраняя нервные тазовые пучки. 3-летняя выживаемость составила в среднем — 88%. При I-II стадиях — 97%, при III стадии — 73%. Авторы подчеркивают, что сохранение нервных пучков не было причиной местного рецидива раковой опухоли. Matsumoto A. et all. (1995 г.) обращают внимание на то, что рассечение пучка гипогастрального нерва с одной стороны не нарушает функцию мочевого пузыря. Sugihara K. et all. (1996 г.) при операции 214 больных с низким РПК сберегали нервы таза. У 70,4% мужчин сохранилась половая функция. 5-летняя выживаемость после таких операций составила: при стадии А — 96,4%, В — 84%, С — 67,3%.
Интересна работа хирургов из Нидерланд. Хирурги этой страны обратили внимание на то обстоятельство, что после операций по поводу рака на прямой кишке, возникает значительное число мочеполовых нарушений, что, безусловно, сказывается на КЖ этих пациентов. В связи с этим они пригласили японских хирургов и с их помощью оперировали 47 больных с низким раком ПК, которым сохраняли нервы таза. Мочевых расстройств не развилось ни у кого из больных. 19 из 30 мужчин были сексуально активны. Половое бессилие связано по их наблюдениям с повреждением гипогастрального сплетения. Для сохранения эякуляции необходимо сохранение верхнего гипогастрального сплетения. Авторы заключают, что операции с сохранением нервов таза должны стать хирургическим стандартом при оперативном лечении начальных форм рака прямой кишки.
О возможности сохранения нервов таза при резекциях прямой кишки сообщают и отечественные авторы: Г.И.Воробьев с соавт., П.В.Царьков с соавт. А.И.Темников и Ю.П.Дугин.
Мы провели собственное исследование с целью изучить некоторые особенности и варианты расположения верхнего подчревного сплетения, подчревных нервов и их ветвей, с целью возможного сохранения их при операциях по поводу низкого рака ПК.
Материалом для исследования послужили 12 бальзамированных и 5 нефиксированных трупов людей, умерших от причин не связанных с патологией органов малого таза. Методика исследования заключалась в проведении общей и специальной антропометрии, препарирования, зарисовки, протоколирования, фотографирования, видеозаписи.
Верхнее подчревное сплетение формируется при слиянии вегетативных нервов расположенных впереди нижней части абдоминального отдела аорты и, как правило, по своей ширине соответствует поперечным размерам аорты в области ее бифуркации. В результате проведенных исследований было выявлено в основном два варианта строения верхнего подчревного сплетения — многоветвистая и маловетвистая формы. Многоветвистая форма представлена нервным сплетением в виде широкой «пластины», имеющей треугольную или трапецивидную форму с основанием обращенным вниз, образованной большим количеством нервных волокон, формирующих густую сеть ниже бифуркации аорты. При этом сплетение располагается кзади от позадипрямокишечной клетчатки и прямокишечных сосудов. Позади верхнего подчревного сплетения располагается пристеночный листок фасции таза и левая общая подвздошная вена. Нижний край сплетения определялся четко при выделении тупфером и располагался ниже мыса крестца (по средней сагиттальной линии) на 0,4 — 2,4 см. От нижнего края сплетения, являясь продолжением его, отходят правый и левый подчревные нервы. Они располагаются на заднебоковой поверхности таза и направляются вниз, вдоль и медиальнее мочеточников и внутренней подвздошной артерии. В местах перекреста мочеточника с маточной артерией или семенным протоком, эти нервы располагаются так, что артерия матки (семенной проток) находится спереди, а мочеточник сзади от нервов. В этой зоне нервы распадаются преимущественно на три группы нервных волокон, образуя нижнее подчревное билатеральное сплетение. Эти группы нервных волокон направляются соответственно: к мочевому пузырю, к матке (семенным пузырькам, простате), к прямой кишке. К стенке кишки волокна нервов подходят в составе боковой связки прямой кишки вместе со средней прямокишечной артерией и веной, располагаясь произвольно относительно друг друга.
Маловетвистая форма строения нервов характеризовалась наличием отдельных, немногочисленных, относительно толстых волокон с единичными анастомозами между ними. Волокна сплетения так же располагаются кзади от позадипрямокишечной клетчатки, верхних прямокишечных сосудов и не связаны с этими образованиями.
С учетом особенностей топографо-анатомического расположения автономных нервов таза, мы применили нерв-сберегающую технику оперирования при выполнении операций на прямой кишке по поводу рака ее различной локализации.
Показанием к операции у всех больных была аденокарцинома. Большинство новообразований соответствовало стадии Dukes B с высокой и умеренной степенью дифференцировки опухоли и локализацией ее в средне и нижнеампулярном отделах. Преобладающим типом операции была низкая передняя аппаратная резекция и брюшно-промежностная экстирпация прямой кишки. Обязательными этапами операции у всех больных были: высокая перевязка нижнебрыжеечной артерии и вены непосредственно у аорты, иссечение мезоректальной клетчатки, определение формы верхнего подчревного сплетения, выделение, взятие на «держалку» и мобилизация правого и левого подчревных нервов.
После предварительной перевязки нижних мезентериальных сосудов у аорты и пересечения сигмовидной кишки, мы считали необходимым выяснить особенности строения верхнего гипогастрального сплетения, а затем приступали к выделению правого и левого подчревных нервов, до этапа мобилизации прямой кишки. Ориентиром для определения верхнего гипогастрального сплетения является тазовый мыс, где нетрудно визуализировать его нижний край. Над поверхностью нерва тупфером сдвигали жировую ткань, брали его на “держалку” и преимущественно острым путем выделяли из параректальной клетчатки, передвигая “держалку” вниз к боковой связке прямой кишки. С помощью такого приема выделяли нерв с другой стороны. После этого подчревные нервы становились подвижными и смещаемыми в стороны на 5 — 6 см. Это обстоятельство является весьма важным, так как дает возможность производить иссечение мезоректальной клетчатки в необходимом объеме, без ущерба для онкологических принципов проведения операции. У большинства больных гипогастральные нервы никак не выделяются, а сливаются с окружающими тканями и представляются в виде тонкой и узкой “полоски”. Именно у таких пациентов подчревные нервы могут быть легко повреждены при мобилизации прямой кишки или иссечения мезоректальной клетчатки. Только у трех больных подчревные нервы были представлены хорошо контурирующимися, достаточно толстыми стволами и легко визуализировались.
При дальнейшей мобилизации прямой кишки, мы старались выделить и визуализировать боковые связки ее (которые пересекаем на зажимах), с тем чтобы в инструмент, вместе со средними прямокишечными сосудами, попали только те веточки нижнего билатерального сплетения, которые направляются к стенке прямой кишки. Ветви идущие к другим органам малого таза, сохраняли с удалением окружающей их клетчатки. В тех случаях, когда раковая опухоль распространялась на окружающие ткани и вовлекала гипогастральный нерв с одной стороны, мы принебрегали им, соблюдая онкологические принципы оперирования и старались сохранить целостность подчревного нерва с другой стороны. Так мы оперировали трех больных.
В тех же случаях, когда опухоль распространяется на окружающие ткани с вовлечением вегетативных нервов таза с обеих сторон, ее следует удалять единым блоком совместно с нервами.
Мочевую функцию оценивали путем расспроса пациентов о характере позывов, частоте мочеиспускания и объеме выделяемой мочи, после удаления мочевого катетера, который вводили на 2 — 4 суток. У 94% больных было свободное, произвольное мочеиспускание сразу после извлечения катетера Фоллея. Пациенты не отмечали разницы в характере позывов, частоте мочеиспускания и объеме мочи, по сравнению с дооперационным периодом. У всех сексуально-активных мужчин сохранилась половая функция.
- Мы представили современное состояние проблемы, связанной с функциональными результатами после операций на прямой кишке при раковом поражении ее.
- Мы не склонны давать категорические рекомендации относительно выбора одного единственного способа лечения, для уменьшения частоты функциональных расстройств после операций на прямой кишке.
- Знание литературы этой проблемы — залог для оперирующих хирургов правильно подойти к выбору нужной тактики в каждом конкретном случае. Однако несомненно, что соблюдение онкологических принципов оперирования нужно иметь в виду прежде всего. Далее — всегда следует стремиться к выполнению ССО, если даже для этого придется делать интерсфинктерные резекции ПК. Несомненно, оперирующим на ПК хирургам нужно освоить методику формирования толстокишечных резервуаров и колопластику.
- Бережное отношение к нервам таза — еще одна забота при операциях на прямой кишке. Это реально, о чем свидетельствуют, как литературные данные, так и наши целенаправленные исследования и результаты проводившихся оперативных вмешательств.
Часто задаваемые вопросы
Нужна ли специальная подготовка к экстирпации прямой кишки?
Перед операцией может быть назначена радиотерапия — для уменьшения опухоли в размерах и предупреждения рецидива в будущем. Также возможно назначение антибактериальных препаратов. За несколько дней до операции из рациона исключаются продукты с высоким содержанием клетчатки. Накануне вмешательства следует очистить кишечник, используя очистительную клизму и слабительные. За день до процедуры разрешена только пища жидкой консистенции. В день операции проводится очистительная клизма, последний прием пищи — не менее 8 часов до вмешательства.
Как проводится брюшно-промежностная экстирпация прямой кишки?
При проведении операции различают два этапа: внутрибрюшной и промежностный, в нашем Центре вмешательство выполняется силами двух бригад хирургов.
На брюшном этапе выполняется лапаротомия, в ходе которой сигмовидная кишка на 12-15 см выше верхней границы опухоли отсекается, ее нисходящий сегмент для уменьшения просвета слегка ушивается и выводится в рану, затем подшивается к передней стенке брюшины — формируется колостома, предназначенная для вывода каловых масс. Затем мобилизуется прямая кишка: перевязываются артерии, рассекаются фиксирующие связки, после чего рана ушивается.
- На промежностном этапе выполняется круговой разрез ткани вокруг анального отверстия, иссекается клетчатка, окружающая прямую кишку, после чего вместе с нисходящим отделом сигмовидной кишки удаляется, промежность ушивается в месте ануса. При поражении раковыми клетками соседних органов необходимы дополнительные манипуляции, что влияет на продолжительность операции, но в среднем она занимает 2-3 часа.
Возможны ли осложнения при экстирпации прямой кишки и какие?
Среди осложнений можно, прежде всего, выделить несостоятельность колостомы в результате ослабления или разрыва шва между кожей и кишкой, что вызывает перитонит; лечение только хирургическое. При повреждении во время операции нервов возможна сексуальная дисфункция, недержание мочи, дискомфорт в зоне уретры. Вследствие укорочения толстого кишечника возможно расстройство пищеварения, вздутие живота, появление неприятного запаха испражнений; в этом случае коррекция проводится с помощью диеты. В отдаленном периоде не исключено появление спаек, что может привести к непроходимости кишечника.
Реабилитационный период после экстирпации прямой кишки — каковы особенности
Пациенту разрешается вставать уже в день операции, но еще несколько дней не следует сидеть из-за послеоперационной раны. На второй день снимается повязка с колостомы и фиксируется калоприёмник. Пищу разрешается принимать на второй день, но поначалу только в жидком виде. Рацион расширяется постепенно, начиная со второй недели. В дальнейшем следует питаться 5-6 раз в день небольшими порциями, исключив раздражающую кишечник пищу. Снятие швов планируется на 7-8 сутки, выписка возможна на 10-14 день. Для снижения напряжения брюшных мышц в послеоперационный период рекомендуется ношение специального бандажа. Первые два года пациент должен проходить осмотры каждые три месяца, через пять лет — раз в год.
Почему экстирпацию прямой кишки лучше сделать в Швейцарской Университетской клинике?
- В Центре колопроктологии можно пройти все необходимые обследования: начиная с лабораторных анализов (более 5 000 параметров) до исследований с использованием сложнейшего современного компьютерного или видеоэндоскопического оборудования.
- Пациенты клиники могут рассчитывать на помощь других узких специалистов, у нас проводится врачебно-консультативный прием более чем по 15 специализациям. Ежегодно на консультацию в клинику обращаются более 5 000 человек, в том числе и с заболеваниями кишечника.
- Все хирургические вмешательства, проводимые в Центре при лечении пациентов с онкологическими заболеваниями прямой кишки, являются максимально радикальными, по эффективности не уступают открытым операциям, но акцент всегда делается на нервосберегающие и косметически эффективные технологии.
- У нас — только индивидуальный подход к каждому человеку, лечение назначается опытной командой специалистов, исходя из особенностей организма конкретного пациента. В клинике принимают врачи с высшей категорией, некоторые из наших специалистов известны не только в стране, но и в лучших европейских клиниках.