Иногда это возникает как итог нагноения или воспаления в месте рубца. В других случаях — если образовавшаяся соединительная ткань оказалась слабой из-за сопутствующих заболеваний или обменных нарушений, к которым приводят сахарный диабет, ревматологические заболевания, наследственная патология соединительной ткани.
Статистика показывает, что послеоперационные грыжи возникают у 6-8 % больных, которые перенесли лапаротомные или люмботомические вмешательства. У 50 % пациентов грыжа возникает уже на первом году после оперативного вмешательства, у всех остальных в течение 5 лет после этого. Часто грыжи появляются после экстренных вмешательств, при нагноениях операционной раны, после больших онкологических операций. Однако, они могут возникать и после лапароскопических операций в местах установки троакаров или в месте извлечения удаленной опухоли или органа.
Проблемы лечения послеоперационных грыж не всегда компетентно освещаются в широкой литературе и на интернет-сайтах. «Информированность» населения о неудачных результатах лечения и собственный негативный опыт реабилитации после первой перенесенной операции приводят к тому, что многие пациенты с послеоперационными грыжами долгое время отказываются от планового хирургического лечения. Это способствует удлинению времени грыженосительства. При этом увеличивается размер грыжи, развивается спаечный процесс в брюшной полости и возникают необратимые изменения в тканях брюшной стенки и в тех органах, которые оказались в неестественном анатомическом положении. Все вышеуказанное значительно ухудшает результаты лечения.
Некоторые аспекты терминологии
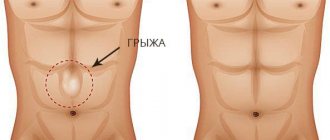
В любой грыже выделяют грыжевой мешок, грыжевое содержимое и грыжевые ворота.
- Грыжевой мешок
представляет собой растянутый участок брюшины, который вместе с внутренними органами вышел через дефект в брюшной стенке и прикрывает их. При послеоперационных грыжах часто встречаются «многокамерные» грыжи, когда в рубце имеется не один, а несколько рядом расположенных дефектов. - Грыжевое содержимое
— это те органы или их части, которые вышли за пределы полости живота. - Под грыжевыми воротами
понимают само отверстие или дефект в брюшной стенке, через который в дальнейшем выходит грыжа.
Диагностика
Диагностические мероприятия включают хирургический осмотр с пальпацией и ряд лабораторно-инструментальных исследований:
- УЗИ брюшной полости
- Ирригоскопия
- Обзорный рентген
- Герниография
- Анализы крови и мочи
Чтобы уточнить некоторые параметры, может потребоваться назначение МСКТ или МРТ брюшной полости, колоноскопия и другие методы обследования.
У вас есть вопросы? С радостью ответим на любые вопросы Координатор Татьяна
Почему образовываются послеоперационные грыжи?
Образованию послеоперационной грыжи способствует множество факторов. Важным моментом их возникновения является нарушение динамического равновесия между давлением внутри живота и способностью стенок брюшной полости ему противодействовать.
Факторы образования грыж.
- К предрасполагающим факторам относят:
индивидуальные особенности каждого конкретного человека — такие, как наследственность, состояние питания, возраст, сопутствующие болезни и обменные нарушения. При некоторых заболеваниях соединительной ткани, например, при синдроме Марфана возникает её слабость, рубцы на месте проведенной операции формируются слабые. Часто слабая соединительная ткань образуется при недостаточности питания, у людей старческого возраста, при онкологических или ревматологических заболеваниях. Сахарный диабет, ожирение также приводят к замедлению формирования рубца.
- Производящими факторами
могут служить заболевания или состояния человека, которые приводят к значительному повышению внутрибрюшного давления (бронхиальная астма, хронический бронхит с постоянным кашлем, продолжительные запоры, затруднение мочеиспускания при проблемах с предстательной железой, беременность и роды, физический труд или спортивные занятия, связанные с подъемом и переносом тяжестей. В нормальных условиях формирование прочного рубца происходит в течение 2,5-3 месяцев, а его окончательная организация — к 12 месяцам. Несвоевременное и, самое главное, резкое увеличение физической нагрузки на еще не сформировавшийся рубец приводит к снижению его прочности и образованию грыж в первый год после хирургической операции.
- Существуют и местные факторы
, которые влияют на заживление послеоперационной раны и могут служить причиной образования грыжи. Воспаление (и тем более нагноение) послеоперационной раны может оказать значительное действие на рубец, делая его ненадежным и непрочным, увеличивая опасность появления грыжи. К этому же приводит и непереносимость организмом больного шовного материала. Появляющаяся при этом реакция воспаления на нитки часто приводит к формированию лигатурных свищей, и в дальнейшем, к появлению дефектов в послеоперационном рубце. Сейчас существует большое количество современных нитей, созданных на основе биоинертных материалов, которые практически не вызывают реакций воспаления или отторжения. Нарушение восстановления тканей и снижение прочности рубца также провоцируется техническими погрешностями закрытия операционной раны (грубая травматизация тканей, несоблюдение анатомической последовательности их соединения, плохой гемостаз) или необходимостью оставления тампонов или дренажей, что чаще встречается в экстренной хирургии при наличии гнойно-воспалительных заболеваний.
Источники
- Romain B., Fabacher T., Ortega-Deballon P., Montana L., Cossa JP., Gillion JF., Antor R., Beck M., Barrat C., Berney C., Binot D., Bousquet J., Blazquez D., Bonan A., Cas O., Champault-Fezais A., Chastan P., Chollet JM., Cossa JP., Dabrowski A., Delaunay T., Démaret S., Drissi F., Demian H., Dubuisson V., Dugue T., Fromont G., Gillion JF., Jacquin C., Jurczak F., Khalil H., Launay-Savary M., Lepère M., Lépront D., Longeville JH., Le Toux N., Loriau J., Magne E., Ngo P., Oberlin O., Passot G., Pavis d’Escurac X., Putinier JB., Renard Y., Romain B., Soler M., Roos S., Thillois JM., Tiry P., Vu P., Verhaeghe R., Warlaumont M., Zaranis C. Longitudinal cohort study on preoperative pain as a risk factor for chronic postoperative inguinal pain after groin hernia repair at 2-year follow-up. // Hernia — 2022 — Vol — NNULL — p.; PMID:33891224
- Santos DA., Zhang L., Do KA., Bednarski BK., Robinson Ledet C., Limmer A., Gibson H., You YN. Chemotherapy and Abdominal Wall Closure Technique Increase the Probability of Postoperative Ventral Incisional Hernia in Patients With Colon Cancer. // Am Surg — 2021 — Vol — NNULL — p.31348211011149; PMID:33877925
- Min JS., Seo KW., Jeong SH., Kim KH., Park JH., Yoon KY., Kim TH., Jung EJ., Ju YT., Jeong CY., Kim JY., Lee YJ. A comparison of postoperative outcomes after open and laparoscopic reduction of Petersen’s Hernia: a multicenter observational cohort study. // BMC Surg — 2022 — Vol21 — N1 — p.195; PMID:33858393
- Du Z., Wei SW., Zhang XY., Xiang Z., Qu SQ. The effect of dexmedetomidine premedication on postoperative systemic inflammatory response in children undergoing hernia repair surgery: A randomized controlled trial. // Paediatr Anaesth — 2022 — Vol — NNULL — p.; PMID:33825304
- Danneberg S., Sayk F., Marquardt JU. [61/m-Postoperative wound healing disorder after umbilical hernia repair and unclear elevation of transaminases : Preparation for the medical specialist examination: part 41]. // Internist (Berl) — 2022 — Vol — NNULL — p.; PMID:33822244
- Yörükoğlu HU., İçli D., Aksu C., Cesur S., Kuş A., Gürkan Y. Erector spinae block for postoperative pain management in lumbar disc hernia repair. // J Anesth — 2022 — Vol — NNULL — p.; PMID:33751203
- Espinosa-de-Los-Monteros A., Frias-Frias R., Alvarez-Tostado-Rivera A., Caralampio-Castro A., Llanes S., Saldivar A. Postoperative Abdominal Bulge and Hernia Rates in Patients Undergoing Abdominally Based Autologous Breast Reconstruction: Systematic Review and Meta-Analysis. // Ann Plast Surg — 2022 — Vol86 — N4 — p.476-484; PMID:33720921
- Rodoman GV., Malgina NV., Razbirin VN., Epiphanova SV., Dolgina TY., Kuznetsov AI. . // Khirurgiia (Mosk) — 2022 — Vol — N3 — p.36-41; PMID:33710824
- Seher N., Nayman A., Koplay M., Çiftci İ. Comparison of Preoperative and Postoperative Testicular Elasticity and Vascularity in Pediatric Patients with Inguinal Hernia. // J Ultrasound Med — 2022 — Vol — NNULL — p.; PMID:33665883
- Schaaf S., Willms A., Schwab R., Güsgen C. Recommendations on postoperative strain and physical labor after abdominal and hernia surgery: an expert survey of attendants of the 41st EHS Annual International Congress of the European Hernia Society. // Hernia — 2021 — Vol — NNULL — p.; PMID:33629178
Классификация послеоперационных грыж
Грыжевые выпячивания классифицируют по размерам. Выделяют:
- малую послеоперационную грыжу,
которая находится в какой-либо одной из областей живота и не изменяет его конфигурацию. Определяется только при пальпации или при ультразвуковом исследовании с размерами грыжевых ворот до 5 см; - средние послеоперационные грыжи
, которые занимают часть одной области живота с образованием видимого выпячивания и размерами грыжевых ворот от 5 до 10 см; - большие послеоперационные грыжи,
полностью занимающие какую-либо область передней брюшной стенки, изменяя форму живота, с размерами ворот от 10 до 15 см; - гигантские послеоперационные грыжи
, занимающие две — три области живота и более, резко деформирующие живот, мешающие в повседневной жизни, при размерах грыжевых ворот более 15 см. Обществом герниологов России в 2006 г. было рекомендовано придерживаться SWR Классификации, признанной в Мадриде на XXI Международном конгрессе герниологов.
Эта классификация учитывает три основных параметра: локализацию грыжи по отношению к пупку (срединные, боковые и сочетанные), размеры грыжевых ворот и наличие рецидивов.
Доля послеоперационной вентральной грыжи составляет 6—8% всех грыж передней брюшной стенки. В связи с неуклонным ежегодным ростом количества лапаротомий отмечается увеличение числа больных, страдающих этим заболеванием. По сводным данным ряда отечественных авторов, подобная грыжа встречается в России приблизительно у 500 тыс. человек [3, 4]. Послеоперационная грыжа вызывает атрофию и дряблость мышц, истончение апоневроза, резко нарушает функцию как брюшной стенки, так и органов брюшной полости, что приводит к частым случаям временной утраты трудоспособности, а нередко (при большой и гигантской грыже) к инвалидности больных. Известный медицинский афоризм «болезнь легче предупредить, чем лечить» как нельзя лучше подходит к проблеме профилактики послеоперационной вентральной грыжи [18].
В настоящее время профилактика проводится по четырем направлениям. Первым и наиболее изученным являются профилактика и лечение осложнений раннего послеоперационного периода. Во время операций на органах брюшной полости необходимо строго соблюдать правила асептики и антисептики для исключения попадания инфекционного материала в операционную рану, проводить тщательный гемостаз, исключать необоснованное дренирование и тампонирование брюшной полости через рану [24, 35].
Следует рационально выбирать операционный доступ, исключающий пересечение нервных стволов, тщательно послойно ушивать рану современным биосовместимым (отсутствие токсического, аллергенного, канцерогенного и тератогенного воздействия на организм) шовным материалом.
В раннем послеоперационном периоде необходимо предупреждать повышение внутрибрюшного давления вследствие рвоты, кашля, задержки мочеиспускания, вздутия живота, так как это создает повышенную нагрузку на швы брюшной стенки и нередко приводит к развитию эвентрации. Дозированная компрессия раны с помощью эластического, пропускающего воздух бандажа предупреждает повышенную нагрузку на швы, способствует формированию прочного послеоперационного рубца [38, 39].
Второе направление заключается в стимуляции репаративных процессов в ране. С этой целью существенное значение имеет своевременное устранение гипопротеинемии, анемии, авитаминоза, кандидамикоза. Рационально должны применяться глюкокортикоиды, сульфаниламиды и антибиотики, поскольку эти препараты могут вызывать депрессию репаративных процессов. Некоторые авторы предлагают введение фибриногена, криопреципитата, клеток костного мозга в глубокие слои раны (подапоневротический, межапоневротический, межмышечный) в фазу репарации раневого процесса, что способствует ранней индукции фибропластической активности, формированию прочного, адаптированного к конкретным условиям соединительнотканного рубца [5, 10].
Третье направление — оптимизация способов закрытия лапаротомной раны местными тканями. Техника закрытия брюшной стенки — один из важнейших факторов профилактики послеоперационной грыжи. Окончательного мнения о лучшем способе закрытия лапаротомной раны до настоящего времени нет. Успех хирургического вмешательства во многом зависит от свойств используемых при его выполнении шовных материалов. Основные требования к шовной нити: биосовместимость, гладкая поверхность, высокие манипуляционные свойства, минимальный фитильный эффект [11]. Перспективным направлением является внедрение в хирургическую практику биологически активных шовных материалов — нитей, в состав которых включаются вещества, обладающие способностью оказывать при имплантации в ткани биологическое действие. Наиболее часто за рубежом используются антимикробные шовные нити, содержащие антисептик триклозан [31, 37]. В исследованиях in
vitro
и
invivo
доказано их выраженное и пролонгированное действие на широкий спектр микроорганизмов [32]. Отечественные шовные материалы с антибиотиком доксициклином и препаратом из группы фторхинолов ципрофлоксацином также показали высокую антимикробную активность. Максимальные порции антибактериальных препаратов высвобождались из нитей в первые 5—7 сут, что обеспечивало наиболее интенсивное воздействие на течение раневого процесса [8]. В последние годы в России начали применять шовные материалы, не только обладающие антимикробной активностью, но и стимулирующие регенераторные процессы. Стимуляция репарации тканей достигается введением в структуру оболочки нити органических соединений, содержащих германий. Шовный материал, обладающий антимикробной и репаративной активностью, позволяет снизить количество гнойных осложнений в ране брюшной стенки в 2 раза по сравнению с контрольной группой больных, в которой применяли капроновые нити [9].
Определенное значение в профилактике послеоперационных грыж имеет способ применения шовного материала. Прочность на разрыв узловатых швов на 80% меньше таковой при непрерывном шве, поэтому для ушивания брюшной стенки целесообразно использовать непрерывный шов [29, 30].
Отечественные и зарубежные хирурги предлагают модифицировать имеющиеся способы закрытия раны брюшной стенки местными тканями путем применения различных технических приемов: создания дубликатуры апоневроза, наложения погружных двухэтажных швов, восьмиобразных и ретенционных швов [4, 35]. Однако использование любых способов аутопластики брюшной стенки не ведет к снижению частоты послеоперационных грыж, так как при этом не учитывают изменение брюшной стенки вследствие дряблости, атрофии мышц и дегенеративных процессов в апоневротических структурах. Имеющаяся до операции слабость брюшной стенки становится еще больше после оперативных вмешательств [19].
Четвертое направление заключается в первичном закрытии лапаротомной раны сетчатым эндопротезом с целью предупреждения возникновения послеоперационной грыжи. Это направление наименее изучено, но наиболее перспективно. В России большинство хирургов сдержанно относятся к этому направлению, считая, что основными причинами развития послеоперационной грыжи являются дефекты оперативной техники ушивания брюшной стенки или раневые гнойные осложнения.
Первые публикации, посвященные превентивному эндопротезированию, появились в зарубежной литературе в 70—80-х годах прошлого столетия. Вплоть до середины первого десятилетия XXI века эта технология укрепления брюшной стенки применялась эпизодически в колопроктологии для предупреждения парастомальной грыжи, в сосудистой хирургии после полной срединной лапаротомии, выполненной по поводу аневризмы брюшной аорты, в абдоминальной хирургии у лиц пожилого и старческого возраста, страдающих ожирением. Обобщающие результаты этих исследований представлены в ранее опубликованном комментарии Б.Ш. Гогия и соавт. [2].
Первым предметом дискуссии является определение показаний к превентивному эндопротезированию брюшной стенки. Следует подчеркнуть, что в работах зарубежных авторов отсутствовала научно обоснованная система определения показаний к превентивному эндопротезированию брюшной стенки. Этот недостаток был исправлен в работах отечественных хирургов, в которых была представлена шкала количественной оценки факторов риска развития послеоперационной грыжи [12].
Изучение эффективности прогнозирования развития послеоперационной вентральной грыжи по этой шкале у 93 больных, перенесших срединную лапаротомию, дало следующие результаты. При сумме баллов от 0 до 5 (низкий риск) послеоперационная грыжа развилась в 5,3% наблюдений, от 6 до 10 (средний риск) — в 13,3%, от 11 до 15 (высокий риск) — в 17,3% и от 16 и выше (крайне высокий риск) — в 30% наблюдений [16].
На первом месте среди показаний к превентивному эндопротезированию находится анатомо-функциональная недостаточность брюшной стенки (слабость), которая проявляется дряблостью, птозом живота с формированием кожно-жирового фартука, куполообразной формой живота с выраженным диастазом прямых мышц, отсутствием уменьшения окружности живота при напряжении брюшного пресса. Для женщин характерна послеоперационная дряблость в сочетании с птозом живота, а для мужчин — куполообразная форма живота в сочетании с диастазом прямых мышц.
Ультразвуковые исследования брюшной стенки пациентов до и после операций на органах брюшной полости и забрюшинном пространстве позволили уточнить основные механизмы развития ее анатомо-функциональной недостаточности. Так, было выявлено поражение всех слоев брюшной стенки — кожи, подкожной клетчатки, апоневроза, мышц. Кожа становится дряблой, истонченной. Подкожная жировая клетчатка утолщается, в ней развивается соединительная ткань, что приводит к изменению ее структуры, которая из однородной превращается в дольчатую. Апоневротический слой истончается, структура его становится неоднородной. Ширина белой и спигелевой линий живота увеличивается в 2 раза при легкой и в 4 раза при тяжелой степени анатомо-функциональной недостаточности. Происходит истончение и расширение мышечного слоя брюшной стенки в 1,5 раза при легкой и в 2 раза при тяжелой степени поражения с уменьшением степени сужения и утолщения мышц при напряжении соответственно в 2,5 и 3,5 раза. Структура мышечного слоя теряет однородность, его эхогенность повышается вследствие жирового и соединительнотканного перерождения. Выявлены следующие критические параметры, свидетельствующие об анатомо-функциональной недостаточности брюшной стенки: неоднородная структура подкожной жировой клетчатки толщиной 5,2±0,4 см с появлением соединительнотканных включений, ширина белой линии живота 2,2±0,09 см, неоднородная эхоструктура прямых мышц живота с повышенной эхогенностью, толщиной 1,35±0,04 см и шириной 11,76±0,1 см, с сократимостью прямых мышц при напряжении 20,7±1,0% исходной величины, ширина спигелевой линии 0,5±0,04 см, неоднородная структура широких мышц боковой стенки живота с повышенной эхогенностью, толщиной 1,3±0,1 см и сократимостью 20,3±1% исходной величины [12].
При проведении генетических исследований у больных с вентральной грыжей и без нее установлено, что в основе развития анатомо-функциональной недостаточности брюшной стенки, прямо пропорциональной частоте развития послеоперационных грыж, лежит снижение функциональной активности рибосомных генов [1].
Интересные данные были получены при поляризационной микроскопии кожи и апоневроза у больных при грыже живота и без нее. Оказалось, что у больных с вентральной грыжей соотношение коллагенов типов I и III резко нарушено в сторону повышения содержания коллагена типа III. При сопоставлении генетических и гистологических данных установлено, что соотношение коллагенов типов I и III в коже и апоневрозе менее 2,1 взаимосвязано с мутантным генотипом АА в полиморфизме гена EGF +61G/A и выявлением мутантного аллеля полиморфизма 1117 5А/6А гена матриксной металлопротеиназы 3, что является достоверным прогностическим критерием риска развития вентральной грыжи [7].
Второе место занимает ожирение пациентов с индексом массы тела, превышающим 30 кг/м2, что клинически проявляется значительным увеличением размера живота за счет избыточного развития подкожной жировой клетчатки, толщина которой превышает 6 см. У этих пациентов боковая поверхность туловища не подтянута, талия отсутствует. Центрально расположенные ткани брюшной стенки дряблые, кожа растянута. При пальпации брюшная стенка не эластична, сократимость мышц практически отсутствует [2]. Особенно резко нарушены репаративные процессы при развитии метаболического синдрома (синдрома резистентности к инсулину), который проявляется абдоминальным ожирением, сахарным диабетом 2-го типа, артериальной гипертензией и ишемической болезнью сердца. При этом синдроме вероятность развития вентральной грыжи после лапаротомии составляет 100% [23].
Третье место среди показаний к эндопротезированию занимает возраст больных. У больных пожилого (старше 60 лет) и особенно старческого (свыше 75 лет) возраста начинают развиваться инволюционные процессы в соединительнотканных и мышечных структурах брюшной стенки, снижается интенсивность репаративных процессов. Кроме того, у возрастных больных имеются и другие факторы риска: запор, затруднение мочеиспускания, хроническая дыхательная недостаточность, аневризма брюшного отдела аорты. Частота развития заболевания находится в прямой зависимости от возраста: чем старше пациент, тем чаще развивается послеоперационная грыжа. Все это позволяет считать, что при проведении широкой срединной лапаротомии у больных пожилого и старческого возраста следует прибегать к превентивному эндопротезированию брюшной стенки [20].
Одним из показаний к первичному закрытию лапаротомной раны сетчатым эндопротезом следует считать повторную лапаротомию, которая является важным предиктором развития послеоперационной вентральной грыжи. По мнению ряда авторов, повторная операция в той же анатомической зоне брюшной стенки, где ранее уже была выполнена первичная лапаротомия, уменьшает васкуляризацию рубца в области фасции, повышает вероятность бактериальной контаминации раны, ухудшает ее заживление [27]. В проведенном отечественными хирургами исследовании установлено, что послеоперационная грыжа развивается в 2 раза чаше при выполнении повторной операции, чем у пациентов, впервые перенесших срединную лапаротомию [16].
Одной из проблем лечения распространенного перитонита является развитие послеоперационной грыжи у большинства больных, перенесших широкую срединную лапаротомию с программированными санациями брюшной полости [33]. Развитие при перитоните системной воспалительной реакции и абдоминального сепсиса, синдрома внутрибрюшной гипертензии, энтеральной недостаточности, эндотелиальной дисфункции и окислительного стресса резко угнетает процессы заживления лапаротомной раны. Нами изучено влияние закрытия лапаротомной раны при распространенном перитоните полипропиленовой сеткой на результаты лечения больных. Из 45 наблюдений, в которых применили эту технологию закрытия раны брюшной стенки, ни в одном не наблюдали эвентрации в ближайшем послеоперационном периоде и развития послеоперационной грыжи в отдаленные сроки [14].
В проведенных в последние годы исследованиях установлено, что частота послеоперационных вентральных грыж у онкологических больных после выполнения лапаротомии колеблется от 18,6 до 44,4% в зависимости от локализации первичной опухоли [6]. Статистически значимое влияние на грыжеобразование оказывают химиотерапия, лучевая терапия и количество лапаротомий у больного. При операциях, выполняемых на фоне лучевой и/или химиотерапии, авторы рекомендуют закрывать лапаротомную рану с использованием аутодермальной шнуровки, что, по их мнению, способствует снижению частоты формирования послеоперационных вентральных грыж [5]. В зарубежной литературе нами обнаружена единственная публикация, посвященная изучению качества жизни больных после онкологических операций на органах брюшной полости, в которой указано, что формирование послеоперационной грыжи является отрицательным фактором, и обосновывается необходимость превентивного эндопротезирования брюшной стенки [21].
Вторым предметом дискуссии является выбор протеза для превентивного эндопротезирования. Исследования поздней тканевой реакции на имплантацию в брюшную стенку различных полипропиленовых протезов показали, что их биосовместимость зависит от толщины нити. Вокруг стандартного полипропиленового эндопротеза с толщиной нити 120 мкм в поздние сроки имплантации образуется грубоволокнистая деформированная капсула с преобладанием гигантских клеток инородных тел. В отдаленном послеоперационном периоде в результате сморщивания сетки ограничивается подвижность брюшной стенки, что вызывает у 5—10% пациентов ощущение «инородного тела» в месте имплантации [18]. При изучении поздней тканевой реакции брюшной стенки на имплантацию легкого полипропиленового протеза с толщиной нити 90 мкм установлено, что эндопротез полностью обрастает соединительной тканью через 2—4 мес после имплантации. Соединительнотканная капсула вокруг легкого протеза имеет также гигантские клетки инородных тел, но уже в меньшем количестве, что при укреплении интактных тканей брюшной стенки может вызывать в них воспалительную реакцию. Суперлегкий эндопротез с толщиной нити 70 мкм через 2 мес оказывается в окружении очень тонкой соединительнотканной капсулы с минимальным количеством клеточных элементов и преобладанием волокнистых структур, что не вызывает воспалительных изменений брюшной стенки и отличает оптимальный материал для ее превентивного эндопротезирования [15].
Третьим предметом дискуссии являются варианты размещения протеза. При пластике средней линии живота после экстренной операции по поводу острого воспалительного процесса брюшной полости с переходом на париетальную брюшину целесообразно размещать сетчатый имплантат над апоневрозом, что снижает риск его инфицирования в ходе вмешательства, выполняется проще других вариантов и лишь незначительно увеличивает длительность манипуляции. Протез, наложенный на апоневроз, должен быть длиннее на 4 см и шире на 5—6 см линии его шва, поскольку этого достаточно, чтобы устранить напряжение тканей. Рекомендуется фиксировать эндопротез узловатыми швами к апоневрозу на всем протяжении в шахматном порядке. Это дает возможность в случае релапаротомии рассекать эндопротез в начале операции и сшивать его в конце [12, 33]. К сожалению, надапоневротическое расположение протеза сопровождается развитием сером, что требует длительного дренирования раны с активной аспирацией [26].
В плановой абдоминальной хирургии после выполнения срединной лапаротомии для укрепления белой линии живота целесообразно размещать протез под апоневрозом, что более оправдано с патогенетической точки зрения развития послеоперационной грыжи. Следует подчеркнуть, что субапоневротическое расположение протеза значительно сложнее в техническом плане и увеличивает длительность операции. Положительным моментом является отсутствие сером в месте имплантации протеза [4, 22, 28].
Подапоневротическое эндопротезирование также следует применять при пластике боковых стенок живота во время урологической операции на мочевыводящих путях и сосудистых операций на брюшном отделе аорты, выполняемых из забрюшинного доступа. После выполнения основного этапа операции из бокового доступа производят послойное сшивание поперечной и внутренней косой мышц край в край. Сверху на наложенный шов в ретромаскулярное пространство между внутренней и наружной косыми мышцами укладывают эндопротез, который должен быть длиннее на 4 см и шире на 3 см с каждой стороны линии шва. Протез фиксируют за широчайшую мышцу спины, влагалище прямой мышцы живота, апоневротические структуры гребня подвздошной кости и ткани в области нижнего края реберной дуги. Таким образом достигается перекрытие эндопротезом слабого места брюшной стенки — спигелевой линии и рассеченной внутренней косой мышцы, которая наиболее подвержена атрофическому перерождению вследствие поперечного пересечения ее волокон. Дренирования раны не требуется [13]. Подапоневротическое расположение протеза применяют для предупреждения парастомальной грыжи в колопроктологии [36].
При наличии морбидного ожирения, сахарного диабета, анемии некоторые авторы предлагают внутрибрюшинное размещение протеза с помощью видеоассистированной поддержки, что, по их мнению, снижает риск послеоперационных осложнений. Для укрепления брюшной стенки используют композитный эндопротез, состоящий из фиксированных друг к другу полипропиленового и политетрафторэтиленового эндопротезов, последний из которых обращен к органам брюшной полости [17].
Внутрибрюшная фиксация эндопротезов может осуществляться с помощью герниостеплеров и фибринового клея. Применение бесшовной технологии фиксации полимерных эндопротезов снижает частоту раневых послеоперационных осложнений, обеспечивает надежную фиксацию эндопротезов к тканям передней брюшной стенки. В ближайшем послеоперационном периоде после превентивной имплантации полипропиленовой сетки в 3,5—5% наблюдений формируется кишечный свищ. В связи с этим для интраабдоминальной имплантации целесообразно применять протезы из политетрафторэтилена, не вызывающие спайкообразования в брюшной полости [39].
В настоящее время результаты операции оценивают на основе изучения качества жизни больных, которое находится в прямой зависимости от размера послеоперационной вентральной грыжи: чем больше грыжа, тем хуже качество жизни [34, 40, 43]. Рядом зарубежных авторов проведено сравнительное изучение качества жизни больных, перенесших срединную лапаротомию в сочетании с превентивным эндопротезированием и без него. Наблюдение в течение первого года после операции показало статистически достоверно более высокий уровень качества жизни больных, которым было выполнено первичное закрытие раны сетчатым эндопротезом [22, 25, 40—42].
Таким образом, превентивное эндопротезирование находит все большее распространение в абдоминальной и сосудистой хирургии, колопроктологии, урологии, онкологии. Показания к применению этой технологии с целью профилактики послеоперационной вентральной грыжи следующие: анатомо-функциональная недостаточность брюшной стенки тяжелой степени; ожирение III—IV степени в сочетании с метаболическим синдромом или без него, пожилой и старческий возраст больных в сочетании с другими факторами риска; повторная лапаротомия по старому операционному рубцу; закрытие лапаротомной раны у больных перитонитом и лечившихся с применением программированных санаций брюшной полости; лапаротомия на фоне неоадъювантной лучевой и/или химиотерапии у больных с онкологическими заболеваниями. Для превентивного эндопротезирования лучше применять суперлегкие эндопротезы с толщиной нити 70 мкм. При наличии воспалительного процесса в брюшной полости протезы следует располагать надапоневротически, а при отсутствии инфекционного агента — подапоневротически или интраабдоминально, используя эндоскопические технологии.
Обследование
Выявление грыжи, как правило, не вызывает трудностей. Чаще всего хватает визуального осмотра и пальпации выпячивания. При необходимости проводится ультразвуковое исследование.
Однако, при подготовке к хирургическому лечению необходимо провести полноценное обследование с целью выявления и своевременной коррекции сопутствующих заболеваний, которые могут стать факторами риска рецидива грыжи. А также оценить функцию дыхательной и сердечно-сосудистой системы для того, чтобы выбрать наиболее подходящий для каждого пациента способ операции.
При возникновении затруднений в диагностике — при сложных многокамерных грыжах, когда необходимо определить особенности топографии грыжевого дефекта, измерить грыжевые ворота для индивидуального подбора сетчатого импланта — выполняется или МРТ органов брюшной полости.
Хотите избавиться от грыжи быстро и навсегда?
Вам повезло, что вы нашли нас. Обратитесь к нам за консультацией.
- Мы проведем углубленную диагностику состояния вашей брюшной полости
- Подберем для вас оптимальный метод лечения из всего спектра современных высокотехнологичных хирургических методик
- Наши высококлассные специалисты — кандидаты и доктора медицинских наук — проведут операцию использованием новейших технологий, дорогостоящего специализированного оборудования и материалов
- Ваши живот станет здоровым и красивым, а следы от вмешательства будут совершенно незаметны постороннему глазу
- В течение шести месяцев мы будем проводить контрольные осмотры и следить за состоянием вашей брюшной полости, чтобы гарантировать отсутствие рецидива (бесплатно)
Предоперационная подготовка
Необходима больным с большими и гигантскими послеоперационными грыжами, а также при наличии заболеваний, предрасполагающих к возникновению грыж. Подготовка должна включать не только медикаментозную коррекцию сопутствующих заболеваний, но и подготовку кожного покрова в области операции (лечение лигатурных свищей, опрелостей, мацераций); подготовку кишечника (лечение запоров); профилактику дыхательных и сердечно-сосудистых осложнений, профилактику синдрома внутрибрюшной гипертензии. Большая часть подготовительных мероприятий проводится амбулаторно под контролем терапевта (кардиолога) и хирурга.
Течение заболевания
Послеоперационные грыжи на ранних стадиях являются вправимыми и не сопровождаются болевыми ощущениями. Однако при резком натуживании, падении, поднятии тяжести боли появляются и выпячивание увеличивается. При прогрессировании грыжи болевые ощущения усиливаются, приобретая иногда схваткообразный характер. Одновременно развиваются вялость кишечника, запор, метеоризм, тошнота, отрыжка, резко снижается активность больных, периодически наблюдаются каловые застои, сопровождающиеся интоксикацией.
Лечение послеоперационной грыжи
Единственный способ лечения любых видов грыж, в том числе и послеоперационных — это хирургическая, основной задачей которой является возвращение грыжевого содержимого в брюшную полость в правильное анатомическое положение и восстановление целостности брюшной стенки (то есть ее пластика). Принципиально различать два основных вида пластики брюшной стенки.
1) Пластика передней брюшной стенки собственными тканями (мышечно-апоневротическая или фасциально-апоневротическая).
Преимущество этого метода состоит в соединении однородных тканей и отсутствии необходимости использования синтетических материалов. Однако возможность его выполнения зависит от величины ворот грыжи и состояния тканей брюшной стенки. Пластика послеоперационной грыжи местными тканями осуществима только при маленьком размере дефекта менее 5 см, отсутствии натяжения тканей и при хорошем состоянии апоневроза и мышечной ткани. Если устраняются малые послеоперационные грыжи, допускается местная анестезия, в других случаях — дается наркоз.
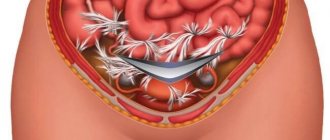
2) Протезирующая пластика: пластика синтетическими имплантами «сетками», закрытие дефекта апоневроза при послеоперационной грыже синтетическим протезом.
Необходимость в установке импланта возникает в подавляющем большинстве случаев послеоперационных грыж. Имплант может быть установлен как при полном ушивании грыжевых ворот с целью укрепления линии шва, так и для закрытия грыжевых ворот «без натяжения».
Протезирующая герниопластика выполняется при рецидивных грыжах, при наличии множественных грыжевых дефектов вдоль послеоперационного рубца, при наличии системного заболевания соединительной и мышечной тканей.
При больших и гигантских послеоперационных грыжах, при наличии дыхательной или сердечно-сосудистой недостаточности применяются только «безнатяжные» методы пластики, когда сетка закрывает грыжевые ворота в виде заплатки.
Сетчатый протез устанавливается как традиционным способом после иссечения старого послеоперационного рубца, так и лапароскопически через проколы на боковых поверхностях живота. Для лапароскопической установки используются специальные «антиадгезивные» сетчатые импланты, которые исключают «прилипание» петель кишечника к поверхности сетки. Подобные импланты подбираются индивидуально в зависимости от размеров грыжевых ворот брюшной полости пациента. Преимуществом лапароскопической установки является более быстрое восстановление после операции, меньший болевой синдром, возможность ранней активизации и возвращения к обычной жизни. Кроме того, исключается риск инфицирования импланта от воспалительных гранулем вокруг старого шовного материала. Но существует ряд противопоказаний, которые исключают выбор этого метода операции.
Получить подробные разъяснения и подобрать оптимальный в каждом случае способ лечения послеоперационной грыжи можно, обратившись в нашу клинику на консультацию к врачам нашего хирургического отделения. На базе клиники проводится лечение любых грыж, в том числе и послеоперационных. Лечение пациентов проводится при использовании различных источников финансирования: по программам обязательного и добровольного медицинского страхования, и на хозрасчетной основе.
Почему нужна операция
Единственным надежным способом избавиться от патологии является операция с установкой сетчатого протеза – ненатяжная герниопластика. Все иные способы лечения (медикаментозные, ЛФК, народные методы) бессильны. Такая грыжа возникает вследствие недостаточных условий формирования постоперационного рубца:
- Недостаточная предоперационная подготовка (при экстренных вмешательствах).
- Дефект хирургической техники (шовный материал плохого качества, чрезмерное натяжение тканей, разошедшийся шов и т.д).
- Длительный дренаж или тампонирование брюшной полости.
- Нарушение послеоперационного режима (физическое напряжение, нарушения диеты, отказ носить бандаж и др.).
- Патологии соединительной ткани.
- Болезни, сопровождающиеся напряжением брюшной стенки (заболевания кишечника, пневмония, бронхит и т.д).
Устранить дефекты рубцовой ткани можно только при помощи хирургического вмешательства. Поэтому не стоит затягивать с визитом к врачу, даже самая маленькая грыжа опасна защемлением и развитием опасных для жизни состояний, вплоть до заражения крови.
Симптомы патологии
Послеоперационная вентральная грыжа образуется на месте рубца в оперированной области. Не заметить патологию невозможно, так как появляется характерное выпячивание. Убедиться в том, что это грыжа можно довольно простым способом: стоя в вертикальном положении наблюдается увеличение выпячивания, при положении лежа грыжа будет уменьшаться.
На ранних сроках формирования грыжа практически не заметна, в этот период грыжевое содержимое можно вправить без хирургического вмешательства. В дальнейшем размеры грыжи начинают увеличиваться, вызывать дискомфорт и болевые ощущения. Именно поэтому важно обращаться за медицинской помощью сразу, как были обнаружены хоть малейшие признаки патологии.
У пациента с послеоперационной вентральной грыжей могут наблюдаться такие симптомы, как:
- Приступы тошноты и рвоты.
- Изжога и отрыжка.
- Болевые ощущения в животе.
- Вздутие кишечника.
- Запоры.
- Снижение активности, слабость.
Послеоперационная вентральная грыжа может получить осложнения и дать начало развитию перфорации стенки кишечника, закупорки грыжи, непроходимости кишечника. Осложнения патологии усиливают ее клиническую картину. В этом случае перечисленные выше симптомы сопровождаются сильным болевым синдромом, наличием сгустков крови в каловых массах.
Как часто встречаются грыжи белой линии живота?
Самыми распространенными грыжами являются паховые, а также пупочные, в то время как грыжи белой линии живота встречаются значительно реже. Данной разновидностью грыж страдают в большей степени женщины после беременности и молодые мужчины при занятии тяжелыми физическими нагрузками.
Причин формирования грыж белой линии достаточно много.
Самым значительным фактором может являться генетическая предрасположенность. Унаследованная физиолого-анатомическая несостоятельность соединительнотканных структур организма может приводить к растяжению белой линии, формированию эктазии (расширения) прямых мышц живота, что в дальнейшем влечет за собой утончение фасции; в ней формируются дилатации и прощелины, через которые возможно формирование грыжи.
Нарушения обмена веществ, сахарный диабет и другие патологические состояния организма, приводящие к изменения метаболических процессов, могут вызвать истощение соединительнотканной структуры белой линии. К заболеваниям, которые могут повлечь за собой склонность к грыжевыпячиванию, а также воздействий, которые влекут за собой повышение давления в брюшной полости, — множество: накопление в ней жидкости, тяжелая физическая нагрузка, беременность, тяжелое течение родов, хронические заболевания легких, хронический запор.
Этапы формирования грыжи белой линии
Формирование данной разновидности грыж проходит в несколько этапов.
- При самом раннем, как правило, незаметном для пациента, этапе сквозь щелевидный дефект в соединительной ткани выпячивается предбрюшинная жировая ткань, образуется так называемая предбрюшинная липома.
- Вслед за этим вытягивается брюшина, и формируется грыжевой мешок, который удается пропальпировать. В последующем на стадии уже сформированной грыжи вовлекаются иные органы брюшной полости: сальник, петли тонкого кишечника, пупочно-печеночная связка, поперечно-ободочная кишка. При этой стадии уже сформировавшейся грыжи можно обнаружить абсолютно все составляющие части патологического процесса: грыжевые ворота и грыжевой мешок с грыжевым содержимым. Риск ущемления грыжевого выпячивания, как очень грозного состояния, напрямую зависит от формы и величины грыжевых ворот, размеры которых могут варьировать от нескольких миллиметров до нескольких сантиметров и приобретать форму овала, окружности или даже ромба; при этом чем меньше ворота, тем выше вероятность, что грыжа внезапно ущемится.
Редко, но случается, что описываемый в данной статье вид грыж достигает больших размеров, в общей своей массе они относительно не велики. Зачастую формирование грыжи не происходит дальше стадии предбрюшинной липомы, которая не вызывает болезненных ощущений, и без воздействия усугубляющих факторов не эволюционирует в прогрессии и не распространяется за границы белой линии.