Операции на кишечнике считаются одними из самых сложных и требующих особого профессионализма хирурга. Важно не просто восстановить нарушенную целостность органа, но и сделать это так, чтобы кишечник продолжил функционировать нормально, не утратил своей сократительной функции.
Анастомоз кишечника является сложной операцией, которая проводится только в случае крайней необходимости и в 4-20% случаев приводит к различным осложнениям.
Результаты
Создание колоректальных анато-мозов после передних и низких передних резекций прямой кишки нередко сопровождается формированием «временной» протективной стомы с целью уменьшить последствия возможной несостоятельности анастомоза (НА). Тем не менее, у некоторых больных эти «временные» стомы так и остаются незакрытыми. К моменту выписки из стационара 111 (52%) пациентов имели колостому на передней брюшной стенке: у 103 из них была сформирована превентивная двуствольная трансверзостома в ходе первичного оперативного вмешательства, остальным 8 пациентам потребовалось ее выведение в послеоперационном периоде в связи с развившейся НА. Средний срок прослеженности — 32,3 мес (12-70 мес). Из 111 больных восстановительные операции выполнены 96 (86,5%). При мультива-риантном анализе выявлены следующие факторы, являющиеся предикторами «незакрытия» стомы после передней резекции: смерть от прогрессирования заболевания (p=0,24) и проведение химиотерапии (p=0,22).
Выводы. Риск того, что «временная» стома сохранится в качестве постоянной, даже в специализированном центре составляет 13,5%. При выполнении сфинктеросохраняющих операций для всех стадий рака прямой кишки наиболее существенными факторами риска «незакрытия» стомы являются прогрессирование заболевания и связанные с этим необходимость проведения химиотерапии, а также смерть больного.
Если формируется непроходимость кишечника
Возникновение непроходимости может вызвать отечность зоны анастомоза, рубцовое сужение. В случае острых симптомов проводится повторная лапаротомия (разрез в области живота и вскрытие брюшной полости) с устранением патологии.
При хронической непроходимости в отдаленном послеоперационном периоде назначается интенсивная антибактериальная терапия, снятие интоксикации. Пациент обследуется с целью решения вопроса о необходимости оперативного вмешательства.
Любые осложнения требуют проведения лечения
Results
Creation of colorectal anastomoses after anterior and low anterior resections is quite often accompanied by formation of «temporary» protective stoma to reduce consequences of possible anastomotic leak (AL). Nevertheless, in some patients these «temporary» stomas are never reversed.. By the moment of discharge from hospital 111 (52%) patients had colostomies: in 103 of them were preventive double-barrelled transverse colostomies were created at primary surgical intervention, the remaining 8 patients underwent colostomy formation in postoperative period because of development of AL. Average follow-up was 32,3 months (12 to 70 months). Among 111 patients the restorative operations were done in 96 (86,5 %). At multivariant analysis the following factors were identified as predictors of non-closure of stoma after anterior resection: death due to disease progression (correlation coefficien = 0,24) and chemotherapy treatment (correlation coefficient = 0,22).
Conclusions
The risk of «temporary» stoma nonclosure even in specialized center is 13,5%. When sphincter-sparing operations are performed for all stages of rectal cancer the most essential risk factors of non-closure of stoma were progression of disease and chemotherapy treatment and patient death related to it, and patient’s death.
Разработка и широкое внедрение сшивающих аппаратов стандартизировало технику наложения анастомоза в глубине малого таза и сделало возможным его формирование на любом расстоянии от края ануса, включая сам анальный канал [18]. Благодаря этому около 80% плановых операций по поводу рака прямой кишки сегодня носят сфинктеросохраняющий характер [2]. Однако это совсем не означает, что все указанные больные в итоге будут опорожнять кишечник естественным путем. Главной причиной считается несостоятельность аппаратного колоректального анастомоза, для профилактики и лечения которой в большинстве лечебных учреждений применяется формирование проксимально расположенной стомы [13].
При временном выключении из пассажа участка кишечника, несущего анастомоз, формируется двуствольная стома, если же анастомоз разобщается, то отведение кишечного содержимого осуществляется путем формирования одноствольной стомы [9]. Между тем четкое представление о том, какова вероятность сохранения естественного хода кишечника в случае, если планируется проведение передней резекции, позволит мультидисципли-нарному консилиуму правильно спланировать возможные варианты лечения, а хирургу выстроить отношения с пациентом и его родственниками еще на дооперационном этапе. Актуальность такого рода знаний объясняется тем, что недооценка вероятности формирования и невозможности последующего закрытия стомы в процессе хирургического лечения первичной опухоли, часто в комплексе с переоценкой хирургом собственных сил, являются основными слагаемыми того, что несостоятельность анастомоза (НА) после резекции прямой кишки нередко становятся трагедией как для пациента и его близких, так и для врача, выполнявшего операцию.
Целью настоящего исследования является анализ причин и частоты оставления толстокишечных стом, созданных с профилактической или лечебной целью после выполнения передних и низких передних резекций с формированием аппаратного колоректального анастомоза по поводу рака прямой кишки.
Описание и характеристика сути анастомозов
Формированию анастомоза кишечника, как правило, предшествует удаление части кишки (резекция). Далее возникает необходимость соединить приводящий и отводящий концы.
Тип «конец в конец»
Используется для сшивания двух одинаковых отрезков толстой кишки или тонкой. Выполняется двух– или трехрядным швом. Считается наиболее выгодным с точки зрения соблюдения анатомических особенностей и функций. Но технически сложен для выполнения.
Условием соединения является отсутствие большой разницы в диаметре сопоставляемых участков. Тот конец, который меньше по просвету, надрезается для полного соответствия. Способ используется после резекции сигмовидной кишки, в лечении кишечной непроходимости.
Сначала формируется задняя стенка анастомоза, затем — передняя
Анастомоз «конец в бок»
Метод применяется для соединения участков тонкой кишки или с одной стороны – тонкой, с другой – толстой. Обычно подшивается тонкая кишка к боковой стороне стенки толстого кишечника. Предусматривает 2 этапа:
- На первом этапе образуют плотную культю из конца отводящей кишки. Другой (открытый) конец прикладывается к предполагаемому месту анастомоза сбоку и подшивается по задней стенке швом Ламбера.
- Затем делается надрез вдоль отводящей кишки по длине равной диаметру приводящего участка и прошивают непрерывным швом переднюю стенку.
Применяется при разных сложных операциях, например, после полного удаления (экстирпации) пищевода с соседними лимфоузлами и жировой клетчаткой.
Тип «бок в бок»
Отличается от предыдущих вариантов предварительным «глухим» закрытием двухрядным швом и формированием культей из соединяемых кишечных петель. Конец, выше расположенной культи, боковой поверхностью соединяется с нижележащим участком швом Ламбера, который по длине в 2 раза больше диаметра просвета. Считается, что технически выполнение такого анастомоза наиболее легкое.
Может применяться как между однородными отделами кишечника, так и для связи разнородных участков. Основные показания:
- необходимость резекции большого участка;
- опасность перерастяжения в зоне анастомоза;
- малый диаметр соединяемых участков;
- формирование соустья между тонкой кишкой и желудком.
К преимуществам метода относят:
- отсутствие необходимости в зашивании брыжеек разных участков;
- плотное соединение;
- гарантированное предупреждение образования кишечного свища.
При анастомозе «бок в бок» предварительное создание культей относится к недостаткам методики
Тип «бок в конец» Если выбирается этот вид анастомоза, это означает, что хирург предполагает вшить конец органа или кишечника после резекции в созданное отверстие на боковой поверхности приводящей кишечной петли. Чаще применяют после резекции правой половины толстого кишечника для соединения тонкой и толстой кишки.
Соединение может иметь продольное или поперечное (более предпочтительное) направление по отношению к главной оси. В случае поперечного анастомоза пересекается меньше мышечных волокон. Это не нарушает волну перистальтики.
Материал и методы исследования
Анализу подвергнуты материалы проспективно заполняемой базы данных, а также истории болезни пациентов, пролеченных в отделении колопроктологии с хирургией тазового дна РНЦХ им. Б.В. Петровского РАМН в период с июня 2006 г. по июнь 2011 г.
Критериями включения в исследование были: первичный гистологически подтвержденный рак прямой кишки и выполнение сфинктеросохраняющего резекционного вмешательства в объеме R0. Критериями исключения служили:
- резекция прямой кишки без формирования первичного колоректального анастомоза (обструк-тивная резекция прямой кишки, или операция по типу Гартмана);
- резекция прямой кишки с формированием первичного колоректального анастомоза ручным способом;
- предшествующие оперативные вмешательства на ободочной или прямой кишке, а также органах малого таза;
- первично-множественные опухоли толстой кишки;
- наступление смерти пациента в течение 30 дней после операции.
Таким образом, были отобраны больные, у которых выполнено вмешательство по поводу рака прямой кишки с сохранением анального сфинктера и формированием аппаратного колоректального анастомоза с применением различных циркулярных степлеров — DST (Covidien, США), KYGW (Kangdi, Китай), CDH (Ethicon Endosurgery, США). По способу сбора материала исследование является проспективно-ретроспективным, по типу наблюдения — когортным.
Для проведения анализа использовались следующие данные из электронной базы и архивных историй болезни: пол, возраст пациента, индекс массы тела (ИМТ), заболевание сахарным диабетом и дивертикулезом, индекс Американской ассоциации анестезиологов ASA, информация о проведении химио-, лучевой или химиолучевой терапии, высота расположения опухоли, параметры опухолевого процесса и его осложнения (непроходимость, анемия, гипопротеинемия), характер хирургического вмешательства (сочетанное, комбинированное), объем лимфодиссекции, формирование превентивной колостомы, частота и характер развития НА, объем лечебных мероприятий по ее устранению (консервативная терапия, малоинвазивные методы лечения, повторное хирургическое вмешательство), время закрытия стомы (если она формировалась), причины ее поздней ликвидации или отказа от закрытия, а также мероприятия, направленные на лечение полости в зоне несостоятельности швов анастомоза, дата последнего визита и наличие признаков возврата заболевания, при наступлении летального исхода — дата и причина смерти, при выявлении местного рецидива рака прямой кишки — дата, локализация и распространенность заболевания.
Для оценки НА использована классификация, предложенная в 2010 г. Международной исследовательской группой по изучению рака прямой кишки. Согласно классификации выделены три степени тяжести данного осложнения: степень А — соответствует несостоятельности без клинических проявлений, выявляемой, как правило, при контрольной проктографии; степень В — для купирования осложнения требуется проведение антибактериальной терапии и/или миниинвазивных (консервативных) мероприятий; степень С — необходимо повторное хирургическое вмешательство [17].
В случае подозрения на НА в раннем послеоперационном периоде выполнялась проктография с использованием водорастворимого контрастного вещества. По показаниям для определения скрытых затеков и абсцессов проводили компьютерную томографию органов малого таза. Состояние сформированного аппаратного колоректального анастомоза в поздние сроки наблюдения (более 30 дней после операции) определяли с помощью проктографии жидкой бариевой взвесью.
Учитывая, что работа основана на ретроспективном анализе проспективно собираемого клинического материала, подписание пациентом информированного согласия для участия в исследовании и одобрение этическим комитетом не требовались.
При сравнении межгрупповых параметров количественные признаки оценивали при помощи i-критерия Стьюдента, качественные признаки — с использованием точного теста Фишера. Для определения факторов риска отказа от выполнения восстановительной операции применяли метод множественной логистической регрессии и составление корреляционной матрицы с последующим многофакторным анализом и расчетом коэффициента корреляции (КК). Выживаемость пациентов рассчитывали по методу Каплана-Майера. Статистически значимыми считали различия при значениях р<0,05.
Обследование перед операцией
Перед наложением билиодигестивного анастомоза врачи Юсуповской больницы проводят комплексное обследование пациента. Онкологические больные сдают общий анализ крови, мочи, коагулограмму. Им выполняют инструментальные исследования:
- рентгенографию желчевыводящих путей;
- ультразвуковое эндоскопическое исследование;
- компьютерную томографию;
- эндоскопическую ретроградную холангиографию.
Перед операцией пациентов осматривает анестезиолог. Он определяет степень операционного риска, выбирает вид анестезии, который планируется использовать во время оперативного вмешательства, назначает премедикацию.
Результаты исследования
За период с июня 2006 г. по июнь 2011 г. было выполнено 293 сфинктеросохраняющие резекции прямой кишки. Из исследования были исключены 68 больных, которым анастомоз формировали ручным способом, 8 пациентов после выполнения обструктивной резекции прямой кишки по типу операции Гартмана и еще 2 больных, умерших на 16-е и 22-е сутки от прогрессирующего мезентериального тромбоза верхней брыжеечной артерии.
Таким образом, анализу были подвергнуты 215 пациентов (среди них 117 мужчин), которым выполнены передняя или низкая передняя резекция прямой кишки с формированием первичного колоректального анастомоза с помощью циркулярного сшивающего аппарата. Средний возраст больных составил 61,2±11,3 года (возрастной диапазон 29-87 лет). ИМТ более 30, соответствующий ожирению, имели 42 (19,5%) пациента. В 90% наблюдений степень местного распространения процесса соответствовали T3-T4. Лишь 12% пациентов были подвергнуты предоперационной химио- и/или лучевой терапии, что было связано с отказом от проведения неоадъювантного лечения при заболеваниях I, II и IV стадий. Кроме того, из всех больных с III стадией при отсутствии тяжелых сопутствующих заболеваний и осложнений опухолевого процесса на предоперационное комбинированное лечение направляли только тех, у кого была диагностирована опухоль «высокого риска». Клинико-морфологическая характеристика больных, включенных в исследование, представлена в табл. 1.
У 103 (47,9%) больных в ходе первичного оперативного вмешательства сформирована превентивная двуствольная трансверзостома. У 99 из них выполнена низкая передняя резекция прямой кишки с формированием наданального колоректального анастомоза: создание превентивной колостомы в таких случаях является стандартной практикой в нашей клинике. Еще в 4 наблюдениях причинами формирования стомы стали поступление воздуха через зону скрепочного шва при воздушной пробе и/или неудовлетворительная предоперационная подготовка кишечника. Среди 112 больных, у которых в ходе первичной операции превентивная колостома не была сформирована, у 8 (7,1%) потребовалось ее выведение в послеоперационном периоде в связи с развившейся несостоятельностью аппаратного анастомоза — в 6 наблюдениях сформирована двуствольная колостома и в 2 произведено разобщение анастомоза с выведением концевой колостомы. Таким образом, из 215 пациентов, которым в процессе операции был сформирован аппаратный колоректальный анастомоз, 111 (52%) к моменту выписки из стационара имели колостому на передней брюшной стенке.
Таблица 1
Характеристика пациентов, включенных в исследование
| Параметры | Количество больных (n=215) | |
| абс. число | % | |
| Сопутствующие заболевания: | ||
| анемия | 45 | 20,9 |
| гипопротеинемия | 38 | 17,7 |
| дивертикулез ободочной кишки | 21 | 9,8 |
| сахарный диабет | 18 | 8,4 |
| Состояние по шкале ASA: | ||
| 1-2 | 143 | 66,5 |
| 3 | 70 | 32,6 |
| 4 | 2 | 0,9 |
| Глубина инвазии опухоли: | ||
| T1 | 3 | 1,4 |
| T2 | 19 | 8,8 |
| T3 | 133 | 61,9 |
| T4 | 60 | 27,9 |
| Наличие лимфогенных метастазов: | ||
| рШ-2 | 98 | 45,6 |
| рШ | 117 | 54,4 |
| Наличие гематогенных метастазов: | ||
| сМ1 | 68 | 31,6 |
| сМ0 | 147 | 68,4 |
| Сочетание лимфогенного и гематогенного метастазирования | 43 | 20,0 |
| Неоадъювантная лучевая и химиотерапия | 26 | 12,1 |
| Расположение опухоли в прямой кишке: | ||
| верхнеампулярный отдел | 89 | 41,4 |
| среднеампулярный отдел | 49 | 22,8 |
| нижнеампулярный отдел | 77 | 35,8 |
| Вид операции: | ||
| передняя резекция | 116 | 54,0 |
| низкая передняя резекция | 99 | 46,0 |
| Характеристика оперативного вмешательства: | ||
| комбинированное | 85 | 39,5 |
| сочетанное | 28 | 13,0 |
| Сформировано колостом: | ||
| превентивных | 103 | 47,9 |
| лечебных | 8 | 3,7 |
Средний срок прослеженности составил 32,3 мес (9—70 мес.) Среди 103 пациентов, у которых была выведена колостома с превентивной целью, у 57 (55,3%) ее закрытие выполнено в стандартные для нашей клиники сроки — в течение 4—8 нед после операции. Еще у 32 (31,1%) больных ликвидация двуствольной колостомы осуществлена в более поздние сроки (свыше 8 нед после операции): у 17 пациентов это вмешательство отложено в связи с необходимостью послеоперационной химиотерапии и у 15 — в связи с проведением длительных лечебных мероприятий, направленных на лечение НА (консервативная терапия, марсупилизация, ререзекция зоны анастомоза). У остальных 14 пациентов с превентивной колостомой не удалось выполнить восстановление естественного хода кишечника. Один из этих больных отказался от повторного вмешательства. Вследствие НА у него образовался длительно незаживающий свищ, в течение 10 мес после операции проводилось консервативное лечение, в том числе марсупилиза-ция остаточной полости, в результате чего свищ зажил, однако пациент не захотел подвергать себя дополнительному риску при повторной операции, сославшись на то, что качество его жизни со стомой является вполне удовлетворительным. Остальные 13 больных, у кого колостома не была ликвидирована, имели на момент операции отдаленные метастазы, которые быстро прогрессировали в послеоперационном периоде: 7 из них умерли от метастатических очагов, 5 продолжают химиотерапию, один пациент потерян для наблюдения, судьба его в настоящий момент не известна.
Из 8 пациентов, которым колостома была сформирована по поводу несостоятельности колоректального анастомоза, резвившейся в раннем послеоперационном периоде, у 7 проведены восстановительные операции после ликвидации последствий НА. У одной пациентки с IV стадий заболевания восстановление естественного хода кишечника не выполнено по причине прогрессирования отдаленных метастазов: несмотря на проводимую адъювантную химиотерапию, через 7 мес после операции наступил смертельный исход.
Следовательно, ликвидация сформированной превентивной или лечебной колостомы осуществлена 96 больным, у 91 (94,8%) из них в течение первого года после основной операции, при этом средний срок между первичным вмешательством и закрытием колостомы составил 3,4±3,7 мес. (интервал 0,7—22,9 мес.).
Таким образом, из 215 пациентов, перенесших переднюю резекцию прямой кишки с формированием аппаратного колоректального анастомоза, достичь сохранения естественного хода кишечника удалось у 200 (93,0%) при общем уровне несостоятельности 12,8% и уровне клинически значимой НА, соответствующей степени С, 5,6%. В то же время из 111 больных, выписанных из стационара со стомой после основной операции, восстановительные операции выполнены в 96 (86,5%) наблюдениях.
При унивариантном анализе большого числа факторов не удалось установить достоверного влияния ни одного из них на факт выполнения повторной операции, направленной на восстановление естественного хода кишечника (табл. 2).
Таблица 2
Унивариантный анализ влияния различных факторов на закрытие стомы
| Фактор | Р |
| Пол | 0,26 |
| Возраст | 0,71 |
| Индекс ASА | 0,6 |
| ИМТ | 0,2 |
| Анемия | 0,8 |
| Гипопротеинемия | 0,58 |
| Дивертикулез | 0,28 |
| Химиотерапия | 0,052 |
| Лучевая терапия | 0,93 |
| Т4 | 0,9 |
| N | 0,5 |
| M | 0,12 |
| Длительность операции | 0,76 |
| Объем кровопотери | 0,66 |
| Объем лимфодиссекции | 0,71 |
| Формирование превентивной колостомы | 0,16 |
| Несостоятельность анастомоза (степень С) | 0,24 |
| Прогрессирование заболевания | 0,11 |
| Смерть от прогрессирования заболевания | 0,09 |
| Наличие признаков местного рецидива | 0,47 |
При мультивариантном анализе выявлены следующие факторы, являющиеся предикторами «незакрытия» стомы после передней резекции: смерть от прогрессирования заболевания (КК=0,24) и проведение химиотерапии (КК=0,22). Несмотря на получение возможной связи стадии М с риском «незакрытия» стомы при составлении корреляционной матрицы, при многофакторном анализе значимой корреляции не установлено (КК=0,17).
Преимущества Клинического госпиталя на Яузе
В клинике на Яузе успешно выполняют оперативное вмешательство любой сложности лапароскопическим и открытым способом. Лечение в госпитале имеет множество преимуществ. К основным можно отнести:
- новейшие диагностические аппараты;
- современные реабилитационные палаты;
- высококвалифицированный персонал;
- индивидуальный подход к каждому пациенту;
- доступные цены.
Запись к врачу хирургу можно забронировать по номеру горячей линии или на сайте клиники.
Записаться на процедуру
Обсуждение результатов исследования
Представленное исследование отражает результаты действующего протокола формирования превентивных и лечебных стом при выполнении передних резекций с использованием циркулярных сшивающих аппаратов в специализированном колопроктологическом отделении.
С исторической точки зрения передняя резекция с формированием колоректального анастомоза стала использоваться около 80 лет назад [10]. Однако период ее расцвета наступил с конца 70-х и начала 80-х годов прошлого столетия после появления циркулярных сшивающих аппаратов. И здесь не лишним будет упомянуть о том, что идея и первое практическое воплощение циркулярного степлера принадлежит советским инженерам и хирургам [4]. Наступившая вслед за этим эпоха тотальной мезоректумэктомии в корне изменила представление об онкологической эффективности сфинтеросохраняющих операций, что сделало переднюю резекцию прямой кишки наиболее часто используемым вмешательством по поводу злокачественного поражения [18]. Дальнейшее развитие аппаратных технологий привело к возможности формирования анастомоза на сколь угодно низком уровне, даже интраанально [2].
Между тем эйфория первых лет использования сшивающих аппаратов при выполнении передней резекции разбилась о «камень» послеоперационных осложнений в виде НА, особенно после выполнения тотальной мезоректумэктомии с формированием «низкого» колоректального анастомоза [13]. Если в среднем частота клинически значимой несостоятельности толстокишечно-пря-мокишечного анастомоза находилась на уровне 5-10%, то после «низких» резекций она диагностировалась у каждого десятого оперированного пациента, а ее частота иногда достигала 15% [6]. Это обстоятельство послужило поводом для широкого использования в практической деятельности двуствольных стом, которые формируются с целью временного отведения каловых масс от зоны колоректального анастомоза и для профилактики угрожающих жизни осложнений в виде инфицирования малого таза или брюшной полости вследствие несостоятельности колоректального анастомоза.
Тем не менее, вопрос о целесообразности формирования превентивных стом до сих пор остается в фокусе внимания колоректальных хирургов по нескольким причинам. Лишь единичиные из числа многих проведенных исследований свидетельствуют о том, что выключение анастомозированного участка кишки из пассажа способствует снижению числа случаев несостоятельности колоректальных анастомозов [14, 16]. Большинство работ демонстрирует, что формирование превентивной стомы лишь нивелирует грозные последствия несостоятельности, улучшая непосредственные результаты передних резекций прямой кишки, и способствует более полному восстановлению выделительной функции и контролю за выделением кишечного содержимого, снижая вероятность развития местного рецидива, в сравнении с группой больных, у которых стома не создавалась [5, 12]. Кроме того, противники использования «профилактических» стом указывают на возможность развития осложнений, связанных как с ее формированием, так и с ликвидацией [11, 15].
Отсутствие достаточного числа исследований, посвященных порядку использования превентивных стом в хирургии рака прямой кишки, и их ретроспективный характер являются основными причинами того, что практически во всех национальных рекомендациях на этот счет нет четких указаний. Вместе с тем частота их создания при выполнении тотальной мезоректумэктомии в отдельных центрах, по данным голландских исследователей, составляет 70% [7]. Следует отметить, что стандартно ликвидация формируемой с профилактической целью стомы осуществляется в сроки от 6 до 12 нед после операции, но только при условии полной состоятельности колоректального анастомоза. В ряде случаев к созданию стомы на передней брюшной стенке в процессе лечения приходится прибегать вынужденно по причине развившейся несостоятельности.
Что же происходит с теми больными, кому с профилактической или лечебной целью была сформирована стома и какова их последующая судьба? Ответ на этот вопрос носит отнюдь не риторический характер, потому что от него зависит правильный настрой на операцию как самого пациента, так и хирурга. Традиционно после завершения обследования и принятия решения о выполнении передней резекции прямой кишки с применением аппаратных технологий хирург сообщает пациенту желанную для него новость о реальности сохранения естественного хода кишечника, добавляя при этом, что возможно придется прибегнуть к формированию превентивной стомы или лечебной, если превентивная не будет сформирована, а осложнение разовьется. При этом, как правило, высказывается уверенность в окончательном восстановлении естественного хода кишечника по окончании лечения. В такого рода беседах не затрагиваются вопросы, связанные с возможными сроками заживления анастомоза в случае его несостоятельности и вероятностью того, что сформированная «временная» стома может остаться на всю последующую жизнь. Это связано не только с тем, что хирург, стараясь оберегать психику больного, избегает «неприятных» тем перед началом лечения, маскируя их под определением, прописанным в согласии больного на операцию как «возможные непредвиденные осложнения», но и с тем, что на сегодня крайне мало сведений, посвященных этому вопросу.
В 80-90-е годы прошлого столетия превентивная стома формировалась менее чем у половины больных, перенесших тотальную мезоректумэкто-мию с низким колоректальным анастомозом, при этом частота клинически значимой НА превышала 10%, что сопровождалось необходимостью выполнения повторных оперативных вмешательств и 7%-ной летальностью [13]. Более современные данные, основанные на результатах Dutch trial, демонстрируют, что при формировании низкого колоректального анастомоза частота формирования превентивной стомы превышает 50%, достигая в отдельных центрах 70% [9]. Кроме того, среди больных, у которых не формировали превентивную стому во время первичной операции, около 20% были повторно оперированы в связи с осложнениями в области анастомоза. В нашей выборке пациентов после формирования аппаратного колоректального анастомоза повторным хирургическим вмешательствам в связи с НА было подвергнуто лишь 8 (7%) человек. Более чем двукратное снижение числа повторных операций при сравнимом уровне НА в анализируемом исследовании является результатом правильно выбранных показаний к формированию превентивной стомы. Кроме того, на это влияет значительно меньшая частота проведения предоперационной лучевой терапии, что отражается в лучших условиях регенерации у большинства пациентов.
Как и в голландском исследовании (97%), в нашей серии подавляющему большинству больных (94,8%) закрытие стомы выполнено в течение первого года после операции при среднем сроке около 12 нед. Факторами, оказавшими наиболее существенное негативное влияние на решение о закрытии стомы, были прогрессирование основного заболевания и связанные с этим гибель пациентов, а также проводимая по поводу усугубления процесса химиотерапия. Следует отметить, что не все указанные факторы фигурируют в ранее выполненных исследованиях и в нашей работе приводятся впервые. Объяснением этому является то, что в настоящее время в мировой практике еще не сформировано четкое представление о месте резекции первичной опухоли при лечении IV стадии рака прямой кишки и тем более о возможности использования для данной категории больных сфинктеросохраняющих операций [3].
С другой стороны, на представленном материале не обнаружено влияния на закрытие стомы таких факторов, как возраст и связанную с ним коморбидность, а также пол пациентов, на что указывалось в ряде ранее проведенных исследований[8]. Причин этому может быть несколько. Прежде всего крайне малое число (n=2) одноствольных колостом, которые были в итоге наложены при формировании аппаратного колоректального анастомоза. Вероятно, это связано с протоколом обязательного применения превентивного отключения участка кишки с низко расположенным анастомозом при выполнении тотальной мезоректумэктомии. Кроме того, использование мультидисциплинарного подхода к ведению больных старческого возраста [1] и с выраженными сопутствующими заболеваниями в условиях многопрофильного высокоспециализированного стационара привело к тому, что в нашей серии эти факторы ни в одном наблюдении не стали причиной отказа от проведения восстановительного вмешательства.
Что такое анастомоз кишечника, и в каких случаях он назначается?
Свищи — причина рака толстой кишки.
Анастомозом называют соединение двух полых органов и их сшивание. В данном случае речь идет о сшивании двух частей кишечника.
Существует два вида операций на кишечнике, требующих последующего анастомоза — это энтероктомия и резекция.
В первом случае кишечник разрезается для удаления из него инородного тела.
При резекции без анастомоза не обойтись, в этом случае кишечник не просто разрезается, но и удаляется его часть, после всего две части кишки сшиваются тем или иным образом (разновидности анастомоза).
Анастомоз кишечника является серьезной хирургической процедурой. Он проводится под общим наркозом, а после него больному требуется длительная реабилитация, и не исключены осложнения. Резекция кишечника с анастомозом может назначаться в следующих случаях:
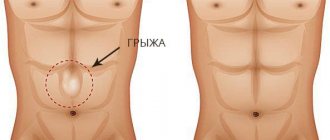
- Рак толстой кишки. Рак толстой кишки занимает лидирующее место среди онкологических заболеваний, встречающихся в развитых странах. Причиной его возникновения могут быть свищи, полипы, язвенный колит, наследственность. Резекция пораженного участка с последующим анастомозом назначается на начальных стадиях заболевания, но может проводиться и при наличии метастаз, так как оставлять опухоль в кишечнике опасно из-за возможного кровотечения и непроходимости кишечника вследствие роста опухоли.
- Непроходимость кишечника. Непроходимость может возникать из-за инородного тела, опухоли или сильного запора. В последнем случае можно промыть кишечник, но с остальных вероятнее всего придется делать операцию. Если ткани кишки уже начали отмирать из-за передавленных сосудов, часть кишки удаляется и проводится анастомоз.
- Инфаркт кишечника. При этом заболевании отток крови к кишечнику нарушается или совсем прекращается. Это опасное состояние, приводящее к некрозу тканей. Оно чаще встречается у людей в возрасте, имеющих заболевания сердца.
- Болезнь Крона. Это целый комплекс различных состояний и симптомов, которые приводят к нарушению работы кишечника. Это заболевание не лечится хирургическим путем, но больным приходится идти на операцию, поскольку в ходе болезни могут возникать осложнения, опасные для жизни.
О раке толстой кишки расскажет видеосюжет:
Выводы
Применение аппаратных технологий для восстановления естественного хода кишечника в лечении рака прямой кишки сопровождается необходимостью формирования превентивной стомы у 52% больных и лечебной у 7%. При этом риск того, что стома сохранится в качестве постоянной даже в специализированном центре составляет 13,5%.
При выполнении сфинктеросохраняющих операций для всех стадий рака прямой кишки наиболее существенными факторами риска «незакрытия» стомы являются прогрессирование заболевания и связанные с этим необходимость проведения химиотерапии, а также смерть больного.
Царьков Петр Владимирович — доктор медицинских наук, профессор, заведующий отделением колопроктологии с хирургией тазового дна РНЦХ им. Б.В. Петровского РАМН
Tsarkov Petr V. — MD, PhD, professor, head of department of coloproctology with pelvic floor surgery, «Russian Research Center of Surgery named after acad. B.V. Petrovsky Russian Academy of Medical Science»
Кравченко Александр Юрьевич — старший научный сотрудник отделения колопроктологии с хирургией тазового дна РНЦХ им. Б.В. Петровского РАМН. Контактная информация: [email protected]; 119991, Москва, Абрикосовский пер., д. 2
Kravchenko Aleksander Yu. — senior research associate of department of coloproctology with pelvic floor surgery, «Russian Research Center of Surgery named after acad. B.V. Petrovsky Russian Academy of Medical Science»
Технические причины
Иногда осложнения связаны с неумелым или недостаточно квалифицированным проведением операции. К этому приводит чрезмерное натяжение шовного материала, лишнее наложение многорядных швов. В месте соединения выпадает фибрин и формируется механическая непроходимость.
Анастомозы кишечника требуют соблюдения техники операции, внимательного учета состояния тканей, мастерства хирурга. Их накладывают в результате хирургического вмешательства только при отсутствии консервативных способов лечения основного заболевания.