Панкреатический сок и его ферменты
Поджелудочная железа (ПЖ) вырабатывает панкреатический сок, который, в отличие от желудочного, имеет ярко выраженную щелочную реакцию. Панкреатический сок содержит амилазу, липазу и протеазу, другие энзимные соединения. Эти вещества участвуют в расщеплении белков, жиров и углеводов, помогают пище усваиваться. Ферменты вырабатываются железой в форме проферментов, а их активация, то есть превращение в активные энзимы, происходит в просвете кишечника. Это необходимо, чтобы избежать повреждения клеток ПЖ.
При нормальной работе железы панкреатический сок начинает вырабатываться спустя некоторое время после приема пищи. Если человек голоден, поджелудочная не выделяет секрет. Во время еды активизируется желудочное пищеварение, выделяется желудочный сок. Это дает сигнал поджелудочной железе начать свою работу. Ее жидкость попадает в 12-перстную кишку, где происходит активация проферментов и запускается процесс пищеварения. Выработка панкреатического сока естественным образом снижается через 9-10 часов после еды. При следующем приеме пищи этот процесс снова активизируется.
Выделению панкреатического сока способствует употребление кислых блюд и напитков, небольшие порции алкоголя. В слизистой 12-перстной кишки вырабатываются особые гормоны, которые также участвуют в регуляции отделения панкреатического сока. Снижение или увеличение его выработки может быть вызвано поступлением в организм определенных лекарств, изменениями в работе нервной системы.
При болезнях поджелудочной или ее частичном удалении из-за патологии у пациента развивается дефицит ферментов и гормонов, которые вырабатываются органом. В этом случае нормализовать состояние помогает заместительная терапия, которая включает препараты инсулина и ферментные средства.
Таблетки «Креон»: показания к применению
Препарат применяют в рамках курса заместительной терапии. Основное показание – нарушения функционирования поджелудочной железы по причине разных патологий:
- муковисцидоз;
- обструкция протоков;
- панкреатит хронической формы;
- рак поджелудочной железы;
- возникновение новообразований;
- цирроз печени;
- панкреатэктомия;
- дегенеративные изменения в пожилом возрасте;
- гепатит холестатический;
- осложнения после частичного удаления (резекции) желудка;
- гастростаз;
- дуоденостаз;
- обструкция билиарная;
- поражения терминального отдела тонкого кишечника;
- резкое увеличение колонии бактерий в отделах тонкого кишечника.
Действие
Патологическое состояние недостаточности ферментов при заболеваниях поджелудочной железы и органов ЖКТ негативно сказывается на пищеварительной функции, препятствует нормальному расщеплению белков, жиров и углеводов, усвоению питательных веществ организмом. Внешне это проявляется признаками пищеварительной дисфункции. В их числе:
- боли;
- подташнивание, позывы к рвоте;
- повышенное газообразование;
- нарушение дефекации.
При попадании в желудок капсулы «Креона 10000» быстро растворяются. Минимикросферы высвобождаются и вместе с пищей поступают в кишечник, где начинают лечебную активность. В тонкой кишке происходит растворение устойчивой к кислотам оболочки. Это высвобождает панкреатические ферменты, которые необходимы для расщепления питательных веществ, поступивших с пищей. Далее они всасываются в кишечнике или расщепляются энзимами кишечника.
По своей структуре действующее вещество препарата «Креон 10000» имеет белковую природу. Для проявления терапевтической активности оно не нуждается во всасывании в кишечнике. Препарат работает, когда проходит через просвет ЖКТ. В организме панкреатин, как и другие белки, расщепляется до аминокислот и пептидов.
Креон 10000 20 шт. капсулы кишечнорастворимые
Фармакологическое действие
Пищеварительное ферментное средство.
Состав и форма выпуска Креон 10000 20 шт. капсулы кишечнорастворимые
Капсулы — 1 капс.:
- Активное вещество: панкреатин — 150 мг (что соответствует 10000 ЕД Евр.Ф. липазы, 8000 ЕД Евр.Ф. амилазы, 600 ЕД Евр.Ф. протеазы.);
- Вспомогательные вещества: макрогол 4000 — 37,50 мг, гипромеллозы фталат — 56,34 мг, диметикон 1000 — 1,35 мг, цетиловый спирт — 1,18 мг, триэтилцитрат — 3,13 мг;
- Твердая желатиновая капсула: желатин — 60,44 мг, краситель железа оксид красный (Е 172) — 0,23 мг, краситель железа оксид желтый (Е 172) — 0,05 мг, краситель железа оксид черный (Е 172) — 0,09 мг, титана диоксид (Е 171) — 0,07 мг, натрия лаурилсульфат — 0,12 мг.
По 20, 50 или 100 капсул во флакон из полиэтилена высокой плотности белого цвета с навинчивающейся крышкой из полипропилена е контролем первого вскрытия. На флакон наклеивают этикетку. По 1 флакону вместе с инструкцией по применению в пачку картонную.
Описание лекарственной формы
Твердые желатиновые капсулы №2, состоящие из коричневой непрозрачной крышечки и прозрачного бесцветного корпуса.
Содержимое капсул — минимикросферы светло-коричневого цвета.
Способ применения и дозы
Креон принимают внутрь. Доза препарата зависит от возраста и степени недостаточности функции поджелудочной железы и рассчитывается в пересчете на фермент-липаза.
Средняя доза для взрослых — 150 000 ЕД липазы/сут. При полной недостаточности функции поджелудочной железы — 400 000 ЕД/сут, что соответствует суточной потребности взрослого человека в липазе. Максимальная суточная доза — 15 000-20 000 ЕД/кг веса.
Детям в возрасте до 1.5 лет назначают 50 000 ЕД/cут; старше 1.5 лет — 100 000 ЕД/сут. Капсулы принимают во время еды, проглатывают целиком, запивая большим количеством не щелочной жидкости (вода, фруктовые соки).
Фармакодинамика
Ферментный препарат, улучшающий процессы пищеварения. Панкреатические ферменты, входящие в состав препарата, облегчают расщепление белков, жиров, углеводов, что приводит к их полной абсорбции в тонкой кишке. Капсулы, содержащие мини-микросферы, покрытые кишечно-растворимой оболочкой, быстро растворяются в желудке, высвобождая сотни мини-микросфер. Целью принципа многоединичной дозы является перемешивание мини-микросфер с кишечным содержимым, и, в конечном счете, лучшее распределение ферментов после их высвобождения внутри кишечного содержимого.
Фармакокинетика
Когда мини-микросферы достигают тонкой кишки, кишечно-растворимая оболочка разрушается, происходит высвобождение ферментов с липолитической, амилолитической и протеолитической активностью, которые обеспечивают расщепление жиров, крахмалов и белков.
Показания к применению Креон 10000 20 шт. капсулы кишечнорастворимые
Креон — ферментный препарат, улучшающий процессы пищеварения. Креон используется как заместительная терапия недостаточности экзокринной функции поджелудочной железы, для симптоматической терапии нарушений процессов пищеварения в следующих случаях: состояния после холецистэктомии, частичная резекция желудка , тотальная гастрэктомия, дуодено- и гастростаз, билиарная обструкция, холестатический гепатит, цирроз печени, патология терминального отдела тонкой кишки, избыточный бактериальный рост в тонкой кишке.
Противопоказания
Креон не следует принимать на ранних стадиях острого панкреатита , а также при повышенной чувствительности к панкреатину свиного происхождения или к любому другому компоненту препарата.
Применение Креон 10000 20 шт. капсулы кишечнорастворимые при беременности и кормлении грудью
Применение креона возможно под контролем врача.
Особые указания
У пациентов с муковисцидозом, получавших высокие дозы препаратов панкреатина, описаны стриктуры подвздошной, слепой и толстой кишки (фиброзирующая колонопатия). В качестве меры предосторожности, при появлении необычных симптомов или изменений в брюшной полости необходимо медицинское обследование для исключения фиброзирующей колонопатии, особенно у пациентов, которые принимают препарат в дозе более 10000 липазных единиц/кг в сутки.
Влияние на способность к вождению автотранспорта и управлению механизмами
Применение препарата Крсон® 10000 не влияет или оказывает незначительное влияние на способность к управлению автомобилем и механизмами.
Передозировка
Симптомы: гиперурикурия, гиперурикемия. Лечение: отмена препарата, симптоматическая терапия.
Побочные действия Креон 10000 20 шт. капсулы кишечнорастворимые
При применении креона возможно возникновение побочных реакций, таких как диарея, тошнота, аллергические реакции.
Лекарственное взаимодействие
Сообщений о взаимодействии с другими ЛС не имеется.
Показания к приему Креона 10000 у взрослых
Поджелудочная железа обладает гормональной и экзокринной функциями. Гормональная функция заключается в выработке инсулина, который необходим для усвоения глюкозы клетками. Экзокринная функция характеризуется выработкой и выделением панкреатических энзимов. Они обладают ферментной активностью, участвуют в расщеплении белковых, жировых и углеводных соединений.
При многих заболеваниях происходит снижение секреции панкреатина или его повышенное разрушение в просвете кишечника. Это приводит к симптомам ферментной недостаточности. С таким явлением сталкиваются пациенты при следующих заболеваниях:
- хронический панкреатит и его осложнения;
- муковисцидоз;
- нарушения в работе поджелудочной на фоне хронического холецистита, обструкции желчных протоков;
- опухолевые заболевания железы;
- хирургическое удаление части органа;
- гастрэктомия.
С ферментной недостаточностью могут сталкиваться пациенты без патологии поджелудочной железы в случае неправильной организации питания. Секреция ферментов ухудшается при переедании, обилии тяжелой жирной пищи в рационе, больших промежутках между приемами пищи.
Консервативное лечение хронического панкреатита в амбулаторных условиях
Хронический панкреатит объединяет гетерогенную группу заболеваний, характеризующихся структурными (морфологическими) и/или функциональными изменениями, несмотря на прекращение воздействия этиологического фактора, с дальнейшим прогрессированием поражения поджелудочной железы и развитием экзокринной и/или эндокринной недостаточности. Морфологическим субстратом хронического панкреатита являются различной степени отек, воспаление и очаговые некрозы ацинарной ткани, развивающиеся на фоне стриктур по ходу панкреатических протоков, белковых пробок и кальцинатов в мелких протоках; псевдокисты, возникающие в период атаки острого панкреатита. Все это приводит к нарушению тока панкреатического сока, внутрипротоковой гипертензии, прогрессированию некроза ацинарной ткани с последующей атрофией ацинусов; интралобулярному и перилобулярному фиброзу поджелудочной железы. При потере 90% функционирующей паренхимы развивается панкреатическая недостаточность, обусловленная синдромом нарушенного переваривания пищи (maldigestion).
На поздних стадиях болезни при очевидной экзокринной недостаточности поджелудочной железы или развитии сахарного диабета диагностика хронического панкреатита не вызывает серьезных затруднений; определенные препятствия возникают на ранних стадиях болезни, когда превалируют функциональные изменения, проявляющиеся наиболее отчетливо в период действия этиологического фактора. Диагностика хронического панкреатита основывается на изучении факторов риска его развития, уточнении возможных этиологических факторов, оценке клинической картины заболевания. Нередко диагноз хронического панкреатита формируется после длительного наблюдения за больным, у которого имеются клинические признаки, позволяющие предположить наличие хронического панкреатита.
В качестве этиологических факторов хронического панкреатита наиболее часто выступают 2 основные причины — алкоголизм и желчнокаменная болезнь, причем 60–70% всех случаев хронического панкреатита обусловлены систематическим, длительным (6–18 лет) приемом алкоголя в дозе более 150 г в день до развития явных признаков заболевания (табл. 1). Частота выявления хронического панкреатита при аутопсии у интенсивно пьющих людей достигает 45–50%. Высокобелковая диета, курение усугубляют повреждающее действие алкоголя. Алкогользависимый панкреатит развивается преимущественно у мужчин и наиболее часто приходится на возраст 35–45 лет. Проведенный ретроспективный анализ историй болезни и последующее проспективное наблюдение за 372 больными позволили оценить течение хронического панкреатита при идиопатическом и алкогольном панкреатитах в зависимости от доз потребляемого алкоголя (менее 50 г/сут и более 50 г/сут) [1]. Показано, что в группе пациентов с алкогольным панкреатитом превалируют абдоминальные боли в начале заболевания. У больных из этой группы чаще развивались осложнения хронического панкреатита: фистулы, псевдокисты, абсцессы, обструктивная желтуха. Отмечено, что у пациентов с дебютом проявлений хронического панкреатита в возрасте старше 35 лет употребление алкоголя даже в небольших дозах (менее 50 г в день) приводит к раннему развитию заболевания, характеризующегося более частыми и интенсивными болями в животе, кальцификацией поджелудочной железы и наличием осложнений. Прием больших количеств алкоголя (50 и более граммов в день) ускоряет формирование кальцифицирующего панкреатита и повышает частоту фатального исхода при хроническом панкреатите.
Хронический панкреатит, развивающийся при желчнокаменной болезни (ЖКБ), холедохолитиазе, чаще встречается у женщин в возрасте 50–60 лет. Как правило, такие больные демонстрируют признаки метаболического синдрома: ожирение, гиперлипидемию, склонность к артериальной гипертензии, ИБС, нарушение толерантности углеводов, гиперурикемию и/или гиперурикозурию и т. д. У части пациентов с хроническим панкреатитом не удается уточнить этиологию заболевания — такой панкреатит относят к группе идиопатического панкреатита.
Исследования последних лет показали, что причиной развития идиопатического панкреатита могут быть микрокристаллы холестерина, гранулы билирубината и микросферолиты кальция [2]. Дисфункция сфинктера Одди (структурная или функциональная) также может привести к развитию идиопатического панкреатита, в том числе из-за пассажа микролитов. В норме сфинктер Одди выполняет 3 главные функции: регулирует ток желчи и панкреатического сока в просвет двенадцатиперстной кишки; препятствует рефлюксу дуоденального содержимого в желчные протоки и панкреатический проток; способствует наполнению желчного пузыря печеночной желчью. При дисфункции сфинктера Одди повышается сопротивление току желчи через сфинктер, в результате чего развиваются желчные колики в отсутствие изменения желчевыводящей системы при диагностическом обследовании (включая УЗИ желчных протоков (Fukuda, Aloka, Philips)); постхолецистэктомические абдоминальные боли и хронической рецидивирующий панкреатит. Манометрия (ДСП-УС, МТМ-1, МА-4) сфинктера Одди определяет повышение базального давления сфинктера у 15–57% больных с подобной формой панкреатита. О наличии дисфункции сфинктера Одди билиарного типа могут свидетельствовать типичная боль билиарного типа, повышение уровня аспартатаминотрансферазы и/или щелочной фосфатазы сыворотки более чем в 2 раза; удлинение времени транзита контраста при эндоскопической ретроградной панкреатохолангиографии (ЭРХПГ) более 45 мин и расширение общего желчного протока более 12 мм. При дисфункции сфинктера Одди панкреатического типа отмечается более чем 2-кратное повышение уровня панкреатических ферментов в период последовательных приступов болей, а также расширение панкреатического протока более 5 мм3.
В зависимости от морфологических изменений в поджелудочной железе выделяют следующие формы хронического панкреатита (1989): кальцифицирующий, обструктивный, фиброзно-индуративный панкреатит, а также кисты и псевдокисты поджелудочной железы. Группу кальцифицирующих панкреатитов представляют алкогольный панкреатит, панкреатит, развивающийся при воздействии органических растворителей, некоторых химических соединений, лекарств, а также панкреатиты, начавшиеся вследствие гиперлипидемии, гиперкальциемии при гиперпаратиреозе, хронических вирусных инфекций (в том числе при хронической HCV- и HBV-инфекции), врожденных изменений протоков поджелудочной железы (удвоение панкреатического протока — pancreas divisum). Наследственный панкреатит с аутосомно-доминантным типом наследования с неполной пенетрацией также относится к группе кальцифицирующего панкреатита и развивается у детей 10–12 лет или в возрасте 30–40 лет. Он неотличим от обычных форм панкреатита, сопровождается рецидивирующими атаками абдоминальной боли, через 8–10 лет у 20% больных присоединяется сахарный диабет и у 15–20% пациентов — выраженная стеаторея. Отсутствие других этиологических факторов и указание на случаи панкреатита в семье делают обоснованным подозрение на наследственную форму хронического панкреатита.
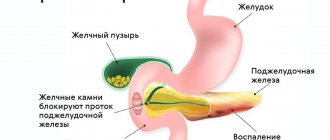
Хронический обструктивный панкреатит развивается при обструкции главного панкреатического протока опухолью поджелудочной железы, воспалении дуоденального сосочка или его стенозе, дуодените вследствие болезни Крона, закрытой травме живота и хирургических операциях в пилородуоденальной зоне, наличии псевдокист поджелудочной железы, врожденной аномалии (pancreas divisum). Желчнокаменная болезнь и холедохолитиаз, дисфункция сфинктера Одди билиарного и панкреатического типов являются основными причинами формирования хронического обструктивного панкреатита.
Уточнение этиологического фактора в развитии хронического панкреатита позволяет более эффективно проводить профилактику и лечение, чем и обусловлено появление следующей классификации хронического панкреатита по этиологическому принципу, с учетом морфологического варианта:
- алкогольный (кальцифицирующий) панкреатит;
- идиопатический ювенильный и старческий;
- тропический;
- наследственный;
- хронический обструктивный панкреатит.
Клинические признаки хронического панкреатита наиболее ярко представлены в период обострения (табл. 2).
| Клинические признаки хронического панкреатита |
Нередко развитию болевой формы хронического панкреатита предшествует безболевая, латентная стадия различной продолжительности, маскирующаяся дискомфортом в эпигастрии, метеоризмом, неустойчивым стулом со склонностью к диарее с наличием непереваренной клетчатки в стуле или стеатореей. Повторные атаки болевой формы хронического панкреатита формируют панкреатическую недостаточность с преимущественным поражением экзокринной или эндокринной функций с развитием сахарного диабета 2 типа.
Болевой синдром — наиболее постоянный признак острого и хронического панкреатита — отмечается в 70–80% случаев и имеет типичные признаки: локализацию в эпигастрии, «опоясывающий» характер с иррадиацией в спину, провоцирующийся и быстро усиливающийся после приема пищи; боли облегчаются в положении сидя с наклоном вперед. Часто сопровождаются тошнотой, рвотой, лихорадкой. У 3–6% больных атаки болевого синдрома могут продолжаться несколько дней; у 70–90% эпизоды болевого синдрома перемежаются безболевым периодом. У части пациентов эквивалентом болей в эпигастрии могут быть боли в спине, иногда сопоставимые с интенсивностью болей в животе. В генезе болевого абдоминального синдрома при хроническом панкреатите основное внимание уделяется внутрипротоковой гипертензии за счет сохраняющейся секреции панкреатических ферментов воспаленной железой в условиях обструкции главных или мелких протоков. Другие факторы — воспаление внутрипанкреатических нервных стволов, перипанкреатическое воспаление с вовлечением двенадцатиперстной кишки, ретроперитонеального пространства, стенозом дистального отдела общего желчного протока — также играют определенную роль в развитии болевого синдрома. У 15% пациентов отмечается безболевая форма заболевания, проявляющаяся у 1/3 больных стеатореей, чаще всего это бывает при хроническом кальцифицирующем панкреатите алкогольной этиологии. Эндокринная функция наиболее чувствительна к воспалительному процессу при хроническом панкреатите и проявляется у 2/3 пациентов нарушением толерантности к глюкозе и сахарным диабетом. В большинстве случаев страдают обе — и экзокринная, и эндокринная — функции, признаки панкреатической недостаточности развиваются при потере 80–90% функционирующей паренхимы поджелудочной железы. В ряде случаев прогрессирующее снижение экзокринной функции приводит к снижению и даже полному исчезновению болевого синдрома.
Данные об эффекте абстиненции на течение алкогольного панкреатита противоречивы: у части пациентов отказ от алкоголя приводит к уменьшению выраженности и частоты болевых атак, признаков экзо- и эндокринной недостаточности, у других отмечается усиление болей через 12–24 ч абстиненции. Течение хронического панкреатита может быть непредсказуемым — прогрессирующим, несмотря на строгую абстиненцию, и довольно стабильным, независимо от того, что прием алкоголя продолжается. В одном наблюдении у 45% пациентов, злоупотребляющих алкоголем, не было клинических симптомов панкреатита, но имелись признаки хронического панкреатита при аутопсии.
Тошнота, рвота, анорексия и потеря массы тела часто отмечаются при хроническом панкреатите. Одной из основных причин снижения веса является уменьшение каллоража принимаемой пищи из-за усиления болей в животе, а также развивающийся синдром нарушенного всасывания вследствие maldigestion и некомпенсированный сахарный диабет. В течении хронического панкреатита синдром нарушенного всасывания с диареей и стеатореей развивается относительно поздно, как правило, на фоне менее 20% функционирующей ацинарной ткани. У части пациентов синдром нарушенного всасывания может протекать с оформленным стулом, что объясняется хорошей всасываемостью воды неизмененной слизистой тонкого кишечника и малым количеством воды в кале. Иногда пациенты отмечают жирные пятна на поверхности воды в унитазе, «жирный», блестящий кал, трудно смываемый со стенок унитаза, что обычно свидетельствует о панкреатической стеаторее. Абсорбция жирорастворимых витаминов A, D, E, K страдает мало, значительный дефицит их редко выявляется при панкреатической недостаточности.
Хотя нарушение толерантности глюкозы случается часто и при хроническом панкреатите проявляется рано, клинически очевидный сахарный диабет встречается относительно поздно. У большинства пациентов диагноз хронического панкреатита устанавливается задолго до развития гипергликемии, однако у части из них, страдающих безболевой формой панкреатита, сахарный диабет может быть первой и единственной манифестацией заболевания. Особенностью течения сахарного диабета при хроническом панкреатите следует считать редкое развитие кетоацидоза, диабетической нефропатии и хорошую переносимость уровня гипергликемии до 200 мг/дл, однако при длительном течении диабета ретинопатия и полинейропатия встречаются с одинаковой для разных вариантов диабета частотой.
Другие клинические проявления хронического панкреатита включают желтуху, обусловленную сдавлением общего желчного протока увеличенной головкой поджелудочной железы, асцит или плевральный выпот в связи с подтеканием панкреатического секрета из разрушенных протоков; псевдокисты. Редко встречаются атипичные варианты хронического панкреатита с развитием липонекрозов подкожной клетчатки или «химического» полиартрита мелких суставов кистей.
Уровень смертности при хроническом панкреатите достигает 50% при 20–25-летнем сроке заболевания. 15–20% пациентов погибают от осложнений, связанных с обострениями панкреатита, другие варианты смерти обусловлены травмой, нарушением питания, инфекцией, курением, которые часто отмечаются у больных хроническим панкреатитом.
Осложнения хронического панкреатита включают синдром нарушенного всасывания, сахарный диабет, псевдокисты, тромбоз портальной или селезеночной вены, стеноз привратника, обструкцию общего желчного протока и опухоль. Аденокарцинома поджелудочной железы развивается в 4% случаев у лиц с более чем 20-летним анамнезом хронического панкреатита.
Диагностика хронического панкреатита достаточно сложна и базируется на 3 основных признаках: характерном анамнезе (болевые приступы, злоупотребление алкоголем), наличии экзокринной и/или эндокринной недостаточности и выявлении структурных изменений поджелудочной железы.
Уровень амилазы, липазы сыворотки чаще остается нормальным или сниженным в период атаки панкреатита, что объясняется уменьшением числа ацинарных клеток, продуцирующих эти ферменты. При сочетании алкогольного панкреатита с алкогольной болезнью печени могут быть выявлены нарушенные функциональные печеночные тесты. В 5–10% случаев хронического панкреатита имеются признаки компрессии внутрипанкреатической части желчного протока, обусловленные отеком или фиброзом головки поджелудочной железы, что сопровождается желтухой, повышением уровня прямого билирубина и щелочной фосфатазы сыворотки.
Нарушение толерантности глюкозы развивается у 2/3 пациентов, сахарный диабет — у 30% больных хроническим панкреатитом.
Экзокринная недостаточность становится явной и легко обнаруживается при развитии синдрома нарушенного всасывания, при котором жир в кале можно определить качественным (окраска по Судану) или количественным методом. Секреторная недостаточность на более ранних этапах выявляется с помощью панкреатических функциональных тестов.
В последние годы в клиническую практику для диагностики хронического панкреатита внедряется иммуноферментный метод определения эластазы-1 в сыворотке крови и кале больных, позволяющий оценить внешнесекреторную функцию поджелудочной железы [4].
Инструментальные данные для подтверждения предположения о наличии хронического панкреатита можно считать довольно информативными. Используются ультразвуковое исследование органов брюшной полости; эндоскопическое ультразвуковое исследование, спиральная компьютерная и магнитно-резонансная томография поджелудочной железы. ЭРХПГ позволяет выявить стеноз протока, локализацию обструкции, структурные изменения мелких протоков, внутрипротоковые кальцинаты и белковые пробки, однако при этом имеется высокий риск развития острого панкреатита [5, 6].
Целью лечения хронического панкреатита можно считать решение нескольких задач: исключение провоцирующих факторов (алкоголь, лекарства, обструкция); облегчение боли; коррекция экзо- и эндокринной недостаточности; лечение сопутствующих расстройств. Основными целями консервативного лечения являются прекращение или замедление прогрессирования хронического панкреатита и борьба с его осложнениями. В зависимости от степени выраженности болевого абдоминального синдрома, используется поэтапное лечение хронического панкреатита, включающее следующие составляющие (модификация Ihse et al.,1993).
- Диета, дробное питание, жиры менее 60 г/сут.
- Панкреатические ферменты (панкреатин, креон, мезим, панзинорм, фестал, пензитал, энзистал) + H2-блокаторы (фамотидин, ранитидин, циметидин, низатидин).
- Ненаркотические анальгетики (ацетилсалициловая кислота, диклофенак, ибупрофен, пироксикам).
- Октреотид (сандостатин).
- Эндоскопическое дренирование (Olimpus, LOMO, Pentax, Fujinon).
- Наркотические анальгетики (буторфанол, антаксон, фортал, трамадол, седальгин-нео).
- Блокада солнечного сплетения.
- Хирургическое вмешательство.
При слабом болевом синдроме успеха можно достичь благодаря строгой диете, дробному (каждые 3 ч) приему пищи и ограничению жира до 60 г в день, что способствует снижению панкреатической секреции при низкокалорийной диете. Учитывая тот факт, что основной причиной боли является внутрипротоковая гипертензия, целесообразно использовать лекарства, блокирующие стимулированную панкреатическую секрецию. В норме высвобождение холецистокинина — основного стимулятора экзогенной функции поджелудочной железы — регулируется холецистокинин-релизинг пептидом в проксимальном отделе тонкой кишки, который чувствителен к трипсину и активен в просвете кишки. Назначением панкреатических ферментов (мезим форте, панкреатина, панзинорма, панцитрата ликреазы) обеспечивается значительное облегчение болевого синдрома у части больных за счет включения механизма обратной связи: повышение уровня протеаз в просвете двенадцатиперстной кишки снижает высвобождение и синтез гастроинтестинальных гормонов (холецистокинина), что приводит к снижению стимуляции экзокринной функции поджелудочной железы, уменьшению внутрипротокового и тканевого давления и облегчению боли [7, 8].
Следует помнить о возможности инактивации экзогенных пищеварительных ферментов кислотой желудка и панкреатическими протеазами. Для предотвращения данного эффекта широко используется комбинация ферментов (панкреатин, креон, мезим, панзинорм, фестал, пензитал, энзистал) с H2-гистаминоблокаторами (фамотидин, ранитидин, циметидин, низатидин). Дозы ферментных препаратов для купирования боли должны быть адекватны; в плацебо-контролируемом двойным слепым методом исследовании панкреолипаза в дозе 6 таблеток 4 раза в день в течение 1 мес значительно снижала боль у 75% больных с умеренным и выраженным панкреатитом. Панкреатические ферменты в капсулированной форме, содержащей кислотоустойчивые мини-микросферы (креон), являются в настоящее время препаратами первого выбора в лечении абдоминальной боли в экзокринной недостаточности поджелудочной железы. Микрогранулированные лекарственные формы (креон 10000 или 25000) характеризуются быстрым (через 45 мин) высвобождением более 90% ферментов при pH дуоденального и тонкокишечного содержимого 5,5 и выше. При очень низких значениях pH в желудочно-кишечном тракте используется адъювантная терапия H2-антагонистами или ингибиторами протонной помпы (ланзопразол, омепразол, пантопразол, рабепрозол). Кроме того, показано, что ферментозаместительная терапия улучшает транзит пищи по желудочно-кишечному тракту, воздействуя на моторную функцию ЖКТ и способствуя тем самым снижению нарушений всасывания. Ферменты поджелудочной железы назначают во всех случаях хронического панкреатита для коррекции экзокринной функции поджелудочной железы. Прием этих препаратов уменьшает растяжение кишечника и диарею, обусловленную нарушением всасывания жиров, в связи с чем уменьшаются боли. Ферментные препараты снижают интенсивность болей при хроническом панкреатите средней тяжести, особенно у женщин с обструктивным панкреатитом; на фоне pancreas divisum. У мужчин с алкогольным кальцифицирующим панкреатитом эти препараты значительно менее эффективны. Для купирования стеатореи при хроническом панкреатите показаны препараты с высоким содержанием липазы, покрытые оболочкой; для купирования болей — препараты с высоким содержанием протеаз без оболочки.
При отсутствии эффекта ферментнозаместительной терапии в сочетании с H2-гистаминоблокаторами необходимо назначение анальгетиков, с этой целью могут использоваться также парацетамол (далерон, проходол, эффералган), нестероидные противовоспалительные препараты: диклофенак (апо-дикло, вольтарен, диклофенак, ортофен), ибупрофен (апо-ибупрофен, ибупрофен, ибуфен, солпафлекс), пироксикам (пироксикам, пироксифер, фельден, эразон), целекоксиб (целебрекс), лорноксикам (ксефокам), мелоксикам (мелоксикам, мовалис), нимесулид (месулид, найз, никулид), напроксен (апо-напроксен, налгезин, напроксен). Для купирования болевого синдрома при хроническом панкреатите назначают октреотид (сандостатин). Являясь мощным ингибитором нейроэндокринных гормонов желудочно-кишечного тракта, сандостатин угнетает экзогенностимулированную и эндогенностимулированную экзокринную секрецию поджелудочной железы путем прямого действия на экзокринную ткань и снижает высвобождение секретина и холецистокинина. В многоцентровом исследовании сандостатин в дозе 200 мкг подкожно 3 раза в день в течение 4 нед уменьшал выраженность болевого синдрома у 65% пациентов с хроническим панкреатитом. Препарат также эффективен в лечении псевдокист, панкреатического асцита и плеврита. Мы используем небольшие дозы: 50–100 мкг подкожно 2 раза в день в течение 1 нед для лечения болевой формы хронического панкреатита.
При сохранении болевого синдрома необходимо провести ЭРПХГ для морфологического уточнения характера поражения протоков, исключения дисфункции сфинктера Одди. В этом случае обсуждается возможность использования инвазивных методов лечения: эндоскопического дренирования и шунтирования, блокады солнечного сплетения стероидами, панкреатикоеюностомия и панкреатическая резекция.
Наибольшие трудности связаны с лечением дисфункции сфинктера Одди, одной из причин развития хронического панкреатита, трудной для диагностики. При дисфункции сфинктера Одди отмечается повышенная чувствительность стенки панкреатического и желчного протоков к изменениям объема и давления. Необходимо исключить лекарственные препараты, обладающие холеретическим действием (желчные кислоты, в том числе в составе ферментных препаратов — фестал, энзистал и т. д.; отвары желчегонных трав, синтетические желчегонные средства). Для снятия спазма гладкой мускулатуры сфинктеров Одди и пузырного протока используются нитраты: нитроглицерин — для быстрого купирования болей, нитросорбит — для курсового лечения (под контролем переносимости препаратов).
Миотропные спазмолитики (бендазол, бенциклан, дротаверин, мебеверин, папаверин) снижают тонус и двигательную активность гладкой мускулатуры. Основными представителями данной группы являются папаверин, дротаверин (но-шпа, но-шпа форте, веро-дротаверин, спазмол, спаковин), бенциклан (галидор).
Наиболее эффективным миотропным спазмолитиком является дюспаталин (мебеверин) — мышечнотропный, антиспастический препарат, оказывающий прямое действие на гладкую мускулатуру. Избирательно действуя в отношении сфинктера Одди, он оказывается в 20–40 раз эффективнее папаверина в том, что касается способности релаксировать сфинктер Одди.
Важно то, что дюспаталин не влияет на холинергическую систему и поэтому не вызывает таких побочных эффектов, как сухость во рту, нарушение зрения, тахикардия, задержка мочи, запор и слабость. Он активно метаболизируется при прохождении через печень, все метаболиты быстро выводятся с мочой. Полная экскреция препарата происходит в течение 24 ч после приема однократной дозы, в результате он не накапливается в организме, даже пожилым пациентам не требуется коррекция дозы. Дюспаталин назначают по 1 капсуле (200 мг) 2 раза в день, лучше принимать его за 20 мин до еды.
Другим миотропным спазмолитиком, обладающим селективными свойствами, является гимекромон (одестон) — фенольное производное кумарина, не имеющее свойств антикоагулянтов и оказывающее выраженное спазмолитическое и желчегонное действие. Гимекромон — синтетический аналог умбеллиферона, обнаруженного в плодах аниса и фенхеля, которые применялись как спазмолитические средства. Препарат обеспечивает тот или иной эффект в зависимости от особенностей его действия на различных уровнях билиарного тракта. Одестон вызывает дилатацию желчного пузыря, снижает внутрипротоковое давление и, таким образом, является антагонистом холецистокинина. На уровне сфинктера Одди он действует синергично с холецистокинином, снижает базальное давление и увеличивает длительность открытия сфинктера Одди, увеличивая тем самым пассаж желчи по желчным путям. Будучи высокоселективным спазмолитиком, одестон обладает также желчегонными свойствами. Холеретический его эффект обусловлен ускорением и увеличением поступления желчи в тонкую кишку. Увеличение поступления желчи в просвет двенадцатиперстной кишки способствует улучшению процессов пищеварения, активизации кишечной перистальтики и нормализации стула.
Одестон назначают по 400 мг (2 таблетки) 3 раза в день за 30 мин до приема пищи, что обеспечивает относительно постоянную концентрацию препарата в сыворотке, превышающую 1,0 мкг/мл. Продолжительность лечения индивидуальная — от 1 до 3 нед. Одестон малотоксичен, переносимость его обычно хорошая.
При отсутствии эффекта от консервативной терапии дисфункции сфинктера Одди и наличии данных о его стенозе восстановление проходимости сфинктера Одди проводят оперативным путем (сфинктеротомия).
Заместительная терапия экзокринной панкреатической недостаточности в исходе хронического панкреатита проводится при наличии стеатореи более 15 г жира в сутки, прогрессирующей потере массы тела и диспепсических нарушениях. Разовая доза ферментов должна содержать не менее 20 000–40 000 ед липазы, поэтому его назначают по 2–4 капсулы при основных приемах пищи и по 1–2 капсулы при дополнительных приемах небольшого количества пищи. При клинически выраженной панкреатической недостаточности часто не удается устранить стеаторею полностью. Увеличение массы тела, нормализация стула, снижение метеоризма свидетельствуют об адекватности подобранной дозы пищеварительных ферментов. Неэффективность заместительной терапии требует исключения других причин синдрома нарушенного всасывания — болезни Крона, целиакии, тиреотоксикоза. С целью коррекции питательной недостаточности назначают среднецепочечные триглицериды (трисорбон) и жирорастворимые витамины A, D, E, K.
По вопросам литературы обращайтесь в редакцию.
Т. Н. Лопаткина, кандидат медицинских наук, доцент ММА им. И. М. Сеченова, Москва
Как принимать «Креон»
Дозировка Креона 10000 у взрослых определяется состоянием здоровья пациента и степенью проявления ферментной недостаточности. Желатиновые капсулы с панкреатином принимают во время еды или сразу же после нее. Это касается не только полноценного приема пищи, но и перекусов.
Капсулы необходимо глотать целиком, запивая достаточным количеством воды. Если лекарство принимает человек пожилого возраста, лежачий больной, у которого затруднено глотание, можно вскрыть оболочку и смешать содержимое капсул с мягкой пищей. Здесь необходимо соблюсти некоторые правила:
- Пища не должна быть горячей.
- Можно использовать продукты с кислым вкусом. Для смешивания подходит кефир или йогурт, фруктовый сок с кислинкой, фруктовое или овощное пюре.
- После размешивания минимикросфер содержимое необходимо сразу принять внутрь. Смешанные с едой ферменты нельзя хранить, в том числе и в холодильнике.
- Нежелательно разжевывать минимикросферы во время приема. Разжевывание приводит к разрушению защитной оболочки гранул и высвобождению активных компонентов во вру. Это снижает эффективность лекарственного средства, может приводить к раздражению слизистых ротовой полости.
- При приеме ферментных препаратов следует контролировать питьевой режим. При недостатке жидкости прием «Креона 10000» может вызвать запоры.
Применение ферментных препаратов при нарушениях пищеварения у детей
Пищеварение является единым, целостным процессом благодаря тесным взаимосвязям между деятельностью различных отделов пищеварительного тракта. Нарушение функций одного из отделов желудочно-кишечного тракта, как правило, приводит к расстройству функции других органов. В разных отделах пищеварительного тракта протекают различные процессы усвоения пищевых веществ. В желудке — расщепление белка, секреция внутреннего фактора, окисление ионов железа; у новорожденных — расщепление жиров (образование диглицеридов под действием желудочной липазы). В двенадцатиперстной кишке — поступление желчных кислот, эмульгация жира, расщепление триглицеридов, образование моно- и диглицеридов, расщепление крахмала и дисахаридов, расщепление белка, всасывание моносахаров, аминокислот, железа, кальция, цинка, магния. В тощей кишке — расщепление дисахаридов; всасывание моносахаров, моноглицеридов, желчных кислот, жирорастворимых витаминов, фолата, кальция, железа, магния, цинка, витамина В12. В подвздошной кишке — всасывание желчных солей, воды, натрия, основного количества витамина В12. В толстой кишке — всасывание воды, калия, натрия, кальция, желчных солей.
Важным органом пищеварения в организме является поджелудочная железа (ПЖ), выполняющая экзокринную функцию. При поступлении пищи в желудочно-кишечный тракт ПЖ секретирует в тонкую кишку не только панкреатические ферменты, но и бикарбонаты, нейтрализующие соляную кислоту и поддерживающие щелочную среду в двенадцатиперстной кишке, необходимую для нормального функционирования панкреатических ферментов. В физиологических условиях ПЖ образует в сутки от 50 до 2500 мл секрета — в зависимости от возраста человека и характера поступающей пищи. Панкреатический сок представляет собой бесцветную жидкость щелочной реакции (рН 7,8–8,4). Он содержит органические вещества (белки) и неорганические компоненты (бикарбонаты, электролиты, микроэлементы), а также слизь выводящих протоков. Ферментная часть секрета образуется в ацинарных клетках, а жидкая (водно-электролитная) — муцин и бикарбонаты — протоковым эпителием. С помощью панкреатических ферментов (липазы, амилазы и протеаз), играющих ключевую роль во внешнесекреторной функции ПЖ, происходит расщепление пищевых веществ. Большинство из них находятся в неактивной форме — это проэнзимы, которые активируются в двенадцатиперстной кишке энтерокиназой. В активной форме секретируются липаза, амилаза и рибонуклеаза. Указанный механизм обусловливает активность панкреатического сока в полости кишечника, что, в свою очередь, предохраняет ткань ПЖ от аутолиза.
Пищеварительные ферменты ПЖ имеют свои мишени: амилаза — α-1,4-гликозидные связи крахмала, гликогена; липаза — триглицериды (образование ди-моноглицеридов и жирных кислот); фосфолипаза А — фосфатидилхолин (образование лизофосфатидил-холина и жирных кислот); карбоксилэстераза — эфиры холестерина, эфиры жирорастворимых витаминов, три-, ди-, моноглицеридов; трипсин — внутренние связи белка (основные аминокислоты); химотрипсин — внутренние связи белка (ароматические аминокислоты, лейцин, глутамин, метионин); эластаза — внутренние связи белков (нейтральные аминокислоты); карбоксипептидаза А и В — наружные связи белков, включая ароматические и нейтральные алифатические аминокислоты (А) и основные (В) аминокислоты с карбоксильного конца.
Последние четыре фермента секретируются ПЖ в неактивной форме (проферменты) и активируются в двенадцатиперстной кишке.
Экзокринная дисфункция ПЖ наблюдается при различных наследственных и приобретенных заболеваниях и может быть обусловлена нарушением образования ферментов ПЖ или их активацией в тонкой кишке. Вследствие дисфункции ПЖ, сопровождающейся дефицитом ферментов, развивается нарушение переваривания пищи (мальдигестия) и всасывания пищевых веществ (мальабсорбция) в кишечнике.
Мальдигестия у детей обусловлена рядом нарушений.
- Снижение активности панкреатических ферментов. Оно может быть вызвано хроническим или острым панкреатитом, муковисцидозом, врожденной патологией поджелудочной железы — морфологические аномалии ПЖ (абберантная ПЖ, кольцевидная ПЖ, стеноз фатерова соска или сфинктера Одди, кисты, раздвоенная ПЖ), наследственные синдромы, сопровождающиеся врожденной панкреатической недостаточностью (синдром Швахмана-Даймонда, синдром панкреатической недостаточности с множественными аномалиями, глухотой и нанизмом (Iohanson-Bizzard), синдром панкреатической недостаточности c вакуолизацией клеток костного мозга и сидеробластической анемией (Pearson); изолированной ферментативной недостаточностью (липазы — Sheldon-Rey синдром; амилазы, трипсина, энтерокиназы), а также травмой ПЖ, карциномой ПЖ, первичным склерозирующим холангитом.
- Дефицит желчных кислот в тонком кишечнике, связанный с функциональными нарушениями билиарного тракта, гепатитом, циррозом печени, билиарной обструкцией.
- Нарушение синтеза холецистокинина, вызванные повреждением луковицы двенадцатиперстной кишки (хронический дуоденит, хронический гастродуоденит).
- Инактивация панкреатических ферментов в тонкой кишке в результате дисбактериоза кишечника или быстрого пассажа пищи.
- Нарушение перемешивания ферментов с пищевым химусом, связанное с гастро- и дуоденостазом.
Причиной мальабсорбции служит нарушение активности секреции кишечных энзимов, обусловленное дисахаридазной недостаточностью, гастроинтестинальной формой пищевой аллергии, нарушением внутриклеточного пищеварения (целиакия, болезнь Крона, энтериты и т. д.), нарушением транспорта всосавшихся веществ (экссудативная энтеропатия, лимфома, опухоли, туберкулез).
Известно, что ПЖ обладает большими компенсаторными возможностями, и нарушения панкреатической секреции проявляются лишь при тяжелом поражении железы. Существует мнение, что выраженная стеаторея и креаторея у взрослых развиваются в тех случаях, когда секреция панкреатической липазы и трипсина снижается более чем на 90%. Однако у детей такой порог не установлен.
Причины и механизмы развития внешнесекреторной недостаточности ПЖ разнообразны. Выделяют абсолютную панкреатическую недостаточность, обусловленную уменьшением объема функционирующей паренхимы ПЖ, и относительную, которая может быть связана с различными заболеваниями желудочно-кишечного тракта.
При выявлении симптомов, свидетельствующих об экзокринной недостаточности ПЖ, необходимо как можно раньше, до того как начала развиваться мальабсорбция, начать заместительную терапию панкреатическими ферментами.
Клиническими признаками внешнесекреторной недостаточности ПЖ являются:
- боли в животе,
- снижение аппетита,
- метеоризм,
- неустойчивый стул,
- стеаторея,
- тошнота,
- рецидивирующая рвота,
- общая слабость,
- похудание,
- снижение физической активности,
- отставание в росте (при тяжелых формах).
Существует достаточно большое количество методов оценки переваривающей способности желудочно-кишечного тракта.
- Определение содержания панкреатических ферментов в крови и в моче. При остром панкреатите уровень амилазы в крови и моче может повышаться в 5-10 раз; уровень амилазы и липазы в крови при обострении хронического панкреатита может быть нормальным или на короткое время повышаться в 1-2 раза (от нескольких часов до нескольких дней), определение эластазы-1 в плазме крови, уровень ее повышения отражает тяжесть панкреатита. Развитие гиперферментемии зависит от периода и тяжести панкреатита.
- Копрологические исследования. Следует признать, что копрологическое исследование до настоящего времени не потеряло своей актуальности и является самым доступным методом. Его следует проводить до назначения больному панкреатических ферментов. Однако на точность данного метода также влияют состояние моторики кишечника, объем выделяемой желчи в просвет кишечника, ее качественный состав, наличие воспалительных процессов в кишечнике и др.
При нарушении пищеварения выявляют следующие симптомы: стеаторея — наличие в каловых массах нейтрального жира (стеаторея 1-го типа); жирных кислот, мыла (стеаторея 2-го типа); того и другого (стеаторея 3-го типа); креаторея — может быть признаком нарушения внешнесекреторной функции ПЖ. В норме мышечных волокон в каловых массах очень мало; амилорея — наличие в испражнениях большого количества крахмальных зерен — свидетельствует о нарушении расщепления углеводов; выявляется у больных с панкреатической недостаточностью редко, так как гидролиз крахмала практически не нарушается ввиду высокой активности кишечной амилазы. Наиболее ранним признаком экзокринной панкреатической недостаточности является стеаторея, креаторея появляется несколько позже. Амилорея редко наблюдается при внешнесекреторной недостаточности ПЖ.
- Исследование содержания панкреатических ферментов в дуоденальном секрете. Метод позволяет определить тип секреции: нормосекреторный, гиперсекреторный, гипосекреторный или обтурационный. Выделенные типы секреции отражают различную степень функционально-морфологических изменений в ПЖ, что позволяет дифференцированно проводить лечебные мероприятия.
- Количественное определение жира в кале (липидограмма кала). Этот метод дает возможность суммарно определить общее количество жира в фекалиях с учетом жира экзогенного (пищевого) происхождения. В норме количество жира, выделяющегося с калом, не должно превышать 10% жира, введенного с пищей. При заболеваниях ПЖ количество выделенного с калом жира иногда увеличивается до 60%. Метод может быть использован для уточнения характера стеатореи, оценки эффективности ферментотерапии.
- Определение содержания эластазы-1 в кале. Эластаза-1 — протеолитический фермент ПЖ. Известно, что панкреатическая эластаза человека не меняет своей структуры по мере прохождения через желудочно-кишечный тракт. Данный метод имеет определенные преимущества перед используемыми сегодня в диагностике экзокринной недостаточности ПЖ (липидограмма кала, копрограмма, определение химотрипсина в кале) в силу высокой специфичности метода (93%), его неинвазивности и отсутствия влияния ферментных препаратов на результаты эластазного теста.
Впервые ферментные препараты в гастроэнтерологической практике стали использоваться около 100 лет назад. Пищеварительные ферменты в настоящее время широко применяются при различной гастроэнтерологической патологии. Несмотря на многообразие проявлений ферментативных нарушений пищеварения, основным направлением терапии таких больных является заместительная ферментная терапия. В настоящее время в клинической практике используется большое число ферментных препаратов, характеризующихся различной комбинацией компонентов, энзимной активностью, способом производства и формой выпуска. При выборе ферментного препарата в каждом конкретном случае врач прежде всего должен обращать внимание на его состав и активность его компонентов.
Выделяют два направления действия ферментных препаратов:
- первичное — гидролиз пищевых субстратов, что является основанием для назначения ферментов в качестве заместительной терапии при внешнесекреторной недостаточности ПЖ;
- вторичное — уменьшение абдоминального болевого синдрома (при панкреатите), диспепсии (ощущение тяжести, метеоризм, отрыжка, нарушения стула и т. д.).
Показаниями для назначения ферментной терапии являются:
- нарушение секреции ферментов ПЖ;
- синдром мальдигестии и мальабсорбции;
- нарушения моторики желудочно-кишечного тракта.
Классификация ферментных препаратов
Различают следующие группы ферментных препаратов.
- Препараты, содержащие панкреатин (панкреатин, пензитал, мезим форте, панзинорм форте — Н, креон, панцитрат).
- Препараты, содержащие панкреатин, компоненты желчи, гемицеллюлазу и другие компоненты (фестал, дигестал, энзистал, панзинорм форте).
- Препараты растительного происхождения, содержащие папаин, экстракт рисового грибка и другие компоненты (пепфиз, ораза).
- Комбинированные ферменты, содержащие панкреатин в сочетании с растительными энзимами, витаминами (вобэнзим, флогензим).
Несмотря на то что в арсенале врача в настоящее время существует много ферментных препаратов ПЖ, до сих пор не всегда удается подобрать адекватную заместительную терапию ферментами у больных с тяжелыми формами панкреатической недостаточности. Серьезной проблемой остается неустойчивость многих ферментов в кислой среде.
Средства, содержащие панкреатин, включают липазу, амилазу, протеазы. Сырьем для приготовления этих препаратов служит поджелудочная железа свиней, крупного рогатого скота. При выборе ферментных препаратов необходимо учитывать уровень входящих в их состав ферментов (табл. 1).
Препараты, содержащие панкреатические ферменты, могут применяться как постоянно, в качестве заместительной терапии, так и однократно, при высокой пищевой нагрузке. Доза подбирается индивидуально и зависит от степени выраженности клинико-лабораторных показателей экзокринной функции ПЖ. Об эффективности дозы судят по клиническим (исчезновение болей в животе, нормализация частоты и характера стула) и лабораторным показателям (исчезновение стеатореи и креатореи в копрограмме, нормализация триглицеридов в липидограмме стула).
Ферментосодержащие препараты наряду с панкреатином могут содержать желчные кислоты, гемицеллюлазу, растительные желчегонные компоненты (куркума), симетикон и др. (табл. 2). Основным показанием к применению препаратов этой группы у детей является дисфункция билиарного тракта (гипомоторная дискинезия). Желчные кислоты и соли повышают сократительную функцию желчного пузыря, нормализуют биохимические свойства желчи, а также регулируют моторику толстого кишечника у детей с запорами. Их следует применять во время или сразу после приема пищи (не разжевывая) 3–4 раза в день курсами до 2 мес. Ферменты этой группы не используются при панкреатите, так как они содержат компоненты желчи, способствующие усилению перистальтики кишечника.
Желчные кислоты, входящие в состав препаратов, усиливают панкреатическую секрецию, холерез; стимулируют моторику кишечника и желчного пузыря.
В условиях микробной контаминации кишечника происходит деконъюгация желчных кислот, при этом активируется циклический аденозинмонофосфат энтероцитов с развитием осмотической и секреторной диареи. Желчные кислоты вступают в энтеропатическую циркуляцию, метаболизируются в печени, увеличивая на нее нагрузку. Кроме того, желчные кислоты способны оказывать прямое повреждающее действие на слизистую кишечника.
Гемицеллюлаза обеспечивает расщепление полисахаридов растительного происхождения (перевариваемой клетчатки), уменьшает газообразование.
Противопоказания к назначению ферментных препаратов, содержащих компоненты желчи:
- острый панкреатит;
- хронический панкреатит;
- острый и хронический гепатит;
- диарея;
- язвенная болезнь желудка и двенадцатиперстной кишки;
- воспалительные заболевания кишечника.
Ферментные препараты растительного происхождения, содержащие папаин, экстракт рисового грибка и другие компоненты, могут использоваться для коррекции экзокринной недостаточности ПЖ. Они производятся из растительного сырья.
В группу ферментных препаратов растительного происхождения входят:
- нигедаза — липаза растительная (Nigella damascene) — 20 мг; препарат в связи с отсутствием в его составе протео- и амилолитических ферментов назначают в сочетании с панкреатином;
- ораза — комплекс амилолитических и протеолитических ферментов грибкового происхождения — Aspergillus oryzae (липаза, амилаза, мальтаза, протеаза);
- пепфиз — грибковая диастаза — 20 мг, папаин — 60 мг, симетикон — 25 мг;
- солизим — липаза, продуцируемая грибком Penicillum solution (20 000 ЕД);
- сомилаза — солизим и L-амилаза грибная;
- юниэнзим — грибковая диастаза — 20 мг, папаин — 30 мг, симетикон — 50 мг, активированный уголь — 75 мг, никотинамид — 25 мг;
- вобэнзим — панкреатин — 100 мг, папаин — 60 мг, бромелаин — 45 мг, трипсин — 24 мг, химотрипсин — 1 мг, рутозид — 50 мг;
- меркэнзим — панкреатин — 400 мг, бромелаин — 75 Ед, желчь — 30 мг;
- флогэнзим — бромелаин — 90 мг; трипсин — 48 мг, рутозид — 100 мг.
Препараты пепфиз, юниэнзим, вобэнзим, меркэнзим и флогэнзим содержат бромелаин — концентрированную смесь протеолитических ферментов из экстракта свежих плодов ананаса и его ветвей. Эффективность бромелаинов не зависит от количества соляной кислоты в желудке (pH 3-8,0).
Все перечисленные ферментные препараты растительного происхождения противопоказаны больным с грибковой и бытовой сенсибилизацией, при бронхиальной астме (А. А. Корсунский, 2000). Солизим и сомилазу нельзя назначать при аллергии к антибиотикам пенициллинового ряда.
Ферменты на основе растительного сырья могут использоваться для коррекции экзокринной недостаточности ПЖ, особенно в тех случаях, когда пациент не переносит панкреатических энзимов (аллергия к свинине, говядине).
Следует отметить, что в литературе появились данные, свидетельствующие о низкой ферментативной активности ферментов растительного и грибкового происхождения (в 75 раз менее эффективных, чем препараты животного происхождения), в связи с чем они не нашли широкого применения в детской практике.
Простые ферменты (бетаин, абомин) не относятся к группе панкреатических ферментов. В настоящее время зарегистрированы следующие препараты, обладающие протеолитической активностью:
- абомин (комбинированный препарат из слизистой оболочки желудка телят и ягнят);
- ацидин — пепсин (в таблетке 1 часть пепсина и 4 части бетаина гидрохлорида; при попадании в желудок происходит гидролиз бетаина гидрохлорида и высвобождение соляной кислоты);
- пепсидил (содержит пепсин и пептоны);
- пепсин (протеолитический фермент, получаемый из слизистой оболочки свиней и ягнят).
Получают эти препараты из слизистой оболочки желудка свиней, телят или ягнят. Наличие в препаратах пепсина, катепсина, пептидаз, аминокислот способствует высвобождению гастрина, являющегося регуляторным полипептидом, в связи с чем препараты этой группы могут назначаться при функциональных нарушениях желудочно-кишечного тракта, при гастритах с секреторной недостаточностью, которые у детей старшего возраста встречаются сравнительно редко. Назначаются эти препараты внутрь во время еды.
Не следует назначать эти препараты при экзокринной недостаточности ПЖ.
Успех терапии внешнесекреторной недостаточности ПЖ зависит от многих причин. Последние исследования не выявили существенных различий в эффективности при почасовом приеме ферментных препаратов и применении их во время еды. Однако наиболее удобным и физиологическим для пациента является прием ферментных препаратов во время еды.
В случае адекватно подобранной дозы и формы ферментного препарата, наступает значительное улучшение состояния больного. Критериями эффективности лечения является исчезновение полифекалии, уменьшение или ликвидация диареи, нарастание массы тела, исчезновение стеатореи, амилореи и креатореи. Первой обычно на фоне терапии ферментами исчезает креаторея. Это может быть связано с тем, что секреция панкреатической протеазы сохраняется несколько дольше, чем липазы.
Доза ферментного препарата подбирается индивидуально в течение первой недели лечения, в зависимости от выраженности экзокринной недостаточности ПЖ. Дозу ферментного препарата целесообразно рассчитывать по липазе начинать следует с небольших дозировок (1000 ЕД липазы на кг массы в сутки). В случае отсутствия эффекта доза препарата постепенно увеличивается под контролем копрологических исследований. При тяжелой экзокринной недостаточности используется 4000–5000 ЕД липазы на кг массы в сутки в 3–4 приема. Длительность терапии определяется индивидуально. Прием ферментов прекращают в случае исчезновения клинических и копрологических признаков мальдигестии и мальабсорбции.
Причины отсутствия эффекта при терапии ферментами:
- недостаточная доза препарата;
- потеря активности фермента в препарате вследствие нарушения сроков хранения;
- инактивация фермента в желудке;
- разрушение ферментов при кишечном дисбактериозе с высокой колонизацией желудка и двенадцатиперстной кишки;
- инактивация ферментных препаратов из-за высокого «закисления» двенадцатиперстной кишки (для предупреждения этого феномена назначают антациды, блокаторы Н2-гистаминовых рецепторов);
- неправильный диагноз (стеаторея 2-го типа; лямблиоз и т. д.);
- нарушение режима приема препарата.
Несмотря на то что с помощью ферментных препаратов можно значительно уменьшить степень стеатореи, полного и стойкого ее исчезновения удается достичь не всегда.
Факторы, препятствующие исчезновению стеатореи:
- синдром нарушенного всасывания;
- низкая мицеллярная концентрация желчных кислот из-за того, что они осаждаются в патологически кислом содержимом двенадцатиперстной кишки;
- неодновременный выход ферментов из желудка с пищей (микротаблетки или микросферы, имеющие диаметр не более 2,0 мм, транспортируются из желудка быстрее, нежели таблетки или драже большого диаметра);
- чувствительность липазы к кислотному содержимому желудка (до 92% липазы, входящей в «обычные» ферменты, легко разрушается под воздействием соляной кислоты).
Способы, позволяющие преодолеть инактивацию фермента желудочным соком:
- увеличение дозы препарата;
- назначение антацидов (необходимо помнить, что антациды, содержащие кальций или магний, ослабляют действие ферментов);
- назначение Н2-блокаторов гистаминовых рецепторов.
Противопоказания к назначению ферментных препаратов:
- острый панкреатит (первые 7-10 дней);
- обострение хронического панкреатита (в течение первых 3-5 дней);
- аллергия к продуктам из свинины, говядины.
В настоящее время, благодаря большому выбору ферментных препаратов ПЖ, появилась реальная возможность индивидуальной коррекции нарушений пищеварения у детей с экзокринной недостаточностью ПЖ, функциональными нарушениями желудка, желчевыводящих путей. Назначение ферментных препаратов требует от врача дифференцированного подхода в каждом конкретном случае — необходимо учитывать механизмы развития заболевания, приведшего к нарушению процессов пищеварения.
Н. А. Коровина, доктор медицинских наук, профессор И. Н. Захарова, доктор медицинских наук, профессор РМАПО, Москва
Дозировка
Заместительная терапия ферментными препаратами требует врачебного контроля. Врач обращает внимание на причину ферментной недостаточности, возраст и массу тела пациента. Дозировка «Креона 10000» измеряется в липазных единицах. Например, в начале лечения при муковисцидозе взрослым пациентам требуется 500 единиц липазы на килограмм веса во время приема пищи. В дальнейшем дозировка не должна быть больше 10000 ед./кг массы тела в день при наличии регулярного контроля стеатореи.
Поскольку больные муковисцидозом получают увеличенные дозировки препарата, необходим постоянный контроль за состоянием кишечника в связи с риском развития фиброзирующей колонопатии. В медицинской практике имеются случаи, когда на фоне регулярного приема больших доз панкреатина у человека развивались стриктуры отдельных участков кишечника. При таком состоянии просвет кишки сужается, что затрудняет прохождение пищи. Во избежание осложнений пациентам с муковисцидозом важно регулярно проходить медицинское обследование и принимать своевременные меры при признаках кишечной непроходимости.
Что касается других заболеваний, которые сопровождаются снижением выработки панкреатина, то здесь нужно учитывать не только тяжесть болезни, но и особенности рациона пациента. Как правило, для взрослых дозировка варьируется от 25000 до 80000 единиц за один прием пищи. Эти дозировки подходят для полноценного приема пищи, а при перекусах достаточно принять половину дозы. Потребность в липазе повышается, если в рационе много жирных блюд.
Если у пациента отсутствуют болезни ЖКТ, а ферментная недостаточность вызвана неправильным рационом, требуется от 10000 до 20000 единиц панкреатина на один прием пищи. Важно помнить, что назначение и дозировку препарата следует согласовывать с лечащим врачом.
Инструкция по применению «Креон»
Препарат принимают внутрь, причем разовая доза подбирается индивидуально, в зависимости от возраста, состояния пациента, рациона питания, сопутствующих заболеваний. Перед началом терапии показана консультация врача.
Общие рекомендации по приему:
- Разовая в количестве 1/2 или 1/3 во время начала еды.
- Остальная часть – через несколько минут (но во время еды).
В обычном случае капсулы проглатывают и запивают водой. Но если глотание затруднено (младенцы, тяжелобольные люди, пациенты в пожилом возрасте), капсулы нужно аккуратно вскрыть и пересыпать содержимое в воду, суп или другую жидкую пищу. При этом она не должна иметь высокую температуру (лучше до 35-37 градусов), чтобы ферменты не разрушились. Разжевывать, грызть капсулы нельзя. Лучше всего запивать их водой комнатной температуры.
При диагностированном муковисцидозе дозу назначают в зависимости от массы тела и возраста пациента:
- До 4 лет включительно – в количестве 1000 липазных единиц на каждый килограмм тела.
- От 5 лет – в количестве 500 липазных единиц на каждый кг.
Также дозировка зависит от характера заболевания, стадии его развития. Максимальное количество средства, поступающее за сутки, не должно составлять более 10000 липазных единиц на 1 кг.
Для лечения других заболеваний поджелудочной железы дозировку устанавливают в зависимости от степени недостаточности пищеварительных процессов и доли жиров в принимаемой пиши. Причем количество препарата во время основного приема составляет от 20000 до 75000 единиц, а во время перекуса – от 5000 до 25000 единиц.
На начальном этапе дозировка должна быть меньше – оптимальным значением считается диапазон от 10000 до 25000 единиц. Чтобы уменьшить стеаторею и улучшить самочувствие, дозировку увеличивают, делая это постепенно. В общем случае суточное количество препарата составляет от 20000 до 50000 липазных единиц.
Побочные эффекты и противопоказания
«Креон 10000» не имеет противопоказаний за исключением случаев повышенной чувствительности к компонентам средства. Что касается побочных эффектов, то нежелательные реакции чаще всего возникают со стороны органов пищеварительной системы. Некоторые пациенты сталкиваются со следующими проявлениями:
- тошнота и рвота;
- боль в животе;
- нарушение стула (диарея или запор);
- стриктуры (сужение просвета) кишечника (при продолжительном лечении высокими дозами);
- метеоризм.
Прием «Креона 10000» у взрослых может приводить к появлению сыпи и зуда, покраснению кожи. Частота аллергических реакций невысокая.
Как правило, при правильно выбранной дозировке и соблюдении пациентом правил приема препарат переносится хорошо.
Как применять «Креон 10000» в период гестации и лактации
На данный момент отсутствуют результаты клинических испытаний по лечению беременных женщин препаратами на основе энзимов ПЖ. Тестирование данных лекарств на животных подтвердило их безопасность для плода и ребенка, который находится на грудном вскармливании.
В то же время специалисты советуют избегать самостоятельного бесконтрольного применения ферментных средств беременными и кормящими женщинами. Назначение должно проводиться врачом с учетом физиологического состояния пациентки и особенностей ее здоровья. Предполагаемая польза от приема препарата для матери должна превышать потенциальный риск для плода или новорожденного.