Инсулинома
В течении инсулиномы выделяют фазы относительного благополучия, на смену которым периодически приходят клинически выраженные проявления гипогликемиии и реактивной гиперадреналинемии. В латентном периоде единственными проявлениями инсулиномы могут являться ожирение и повышенный аппетит.
Острый гипогликемический приступ является результатом срыва адаптационных механизмов ЦНС и контринсулярных факторов. Приступ развивается натощак, после продолжительного перерыва в приеме пищи, чаще в утренние часы. Во время приступа происходит падение содержания глюкозы в крови ниже 2,5 ммоль/л.
Нейрогликопенические симптомы инсулиномы могут напоминать различные неврологические и психиатрические нарушения. У больных может возникать головная боль, мышечная слабость, атаксия, спутанность сознания. В некоторых случаях гипогликемический приступ у больных с инсулиномой сопровождается состоянием психомоторного возбуждения: галлюцинациями, бессвязными выкриками, двигательным беспокойством, немотивированной агрессией, эйфорией.
Реакцией симпатико-адреналовой системы на резкую гипогликемию служит появление тремора, холодного пота, тахикардии, страха, парестезий. При прогрессировании приступа могут развиться эпилептический припадок, потеря сознания и кома. Обычно приступ купируется внутривенным вливанием глюкозы; однако, придя в себя, больные о случившемся не помнят. Во время гипогликемического приступа возможно развитие инфаркта миокарда вследствие острого нарушения питания сердечной мышцы, признаки локального поражения нервной системы (гемиплегия, афазия), которые могут быть ошибочно приняты за ОНМК.
При хронической гипогликемии у пациентов с инсулиномой нарушается функционирование центральной и периферической нервной системы, что отражается на течении фазы относительного благополучия. В межприступном периоде имеет место преходящая неврологическая симптоматика, нарушения зрения, миалгия, снижение памяти и умственных способностей, апатия. Даже после удаления инсулиномы снижение интеллекта и энцефалопатия обычно сохраняются, что приводит к утрате профессиональных навыков и прежнего социального статуса. У мужчин при часто повторяющихся приступах гипогликемии может развиваться импотенция.
При неврологическом обследовании у пациентов с инсулиномой выявляется асимметрия периостальных и сухожильных рефлексов, неравномерность или снижение брюшных рефлексов, патологические рефлексы Россолимо, Бабинского, Маринеску-Радовича, нистагм, парез взора вверх и др. Ввиду полиморфности и неспецифичности клинических проявлений, больным с инсулиномой могут ставиться ошибочные диагнозы эпилепсии, опухоли головного мозга, вегетососудистой дистонии, инсульта, диэнцефального синдрома, острого психоза, неврастении, остаточных явлений нейроинфекции и пр.
Опухоль поджелудочной железы — симптомы и лечение
Первым этапом при планировании лечения опухолей поджелудочной железы является определение морфологического варианта рака и его резектабельности. При местно-распространённом процессе помимо стандартного хирургического вмешательства может использоваться кибер-нож, нано-нож, стереотаксическая лучевая терапия, протонная терапия и др.
Протоковые опухоли, как правило, требуют обширных резекций с удалением всех вовлечённых в процесс тканей. Частичное удаление такого вида рака нецелесообразно ввиду его быстрого роста и прогрессирования. А вот при непротоковом раке объём операции может быть уменьшен. В некоторых случаях допускается частичная резекция опухоли и даже её полное удаление (энуклеация).
В первую очередь, возможность радикального хирургического удаления протоковой опухоли зависит от её взаимоотношения с крупными кровеносными сосудами, располагающимися в данной области. Если опухоль резектабельна, лечение начинают с операции, в остальных случаях на первом этапе показана химиотерапия (возможно в комбинации с лучевой терапией). После нескольких курсов проводят повторное исследование. Если опухоль хорошо отреагировала на лечение (произошло уменьшение её размера), вопрос о хирургическом вмешательстве решается повторно.
В связи с тем, что большинство пациентов с опухолями поджелудочной железы, как правило, преклонного возраста, лечение данной патологии всегда представляет сложную задачу [9].
Хирургическое лечение
Как и в абсолютном большинстве случаев злокачественных новообразований внутренних органов, единственным методом радикального удаления первичной опухоли поджелудочной железы является хирургическое вмешательство. Учитывая то, что обычно диагноз выставляется на распространённых стадиях заболевания, операции носят обширный характер и требуют частичной резекции смежных органов [10]:
- При расположении рака в головке поджелудочной железы проводят не только удаление головки, а также выполняют резекцию желудка, желчных протоков, 12-перстной кишки и части тонкой кишки.
- При локализации рака в теле или хвосте ПЖ удаляют всю железу единым блоком с вовлечёнными в процесс тканями. Селезёнку пытаются сохранить, но если это невозможно, её тоже удаляют. Технически эта операция проще, чем резекция головки поджелудочной железы, но после тотального удаления органа такие пациенты вынуждены принимать пожизненную заместительную инсулинотерапию и ферменты.
Учитывая большой объём операций, после них требуется пластика, которая направлена на восстановление проходимости пищеварительной системы и желчевыводящих путей. После неё обязательно проводится многокурсовая химиотерапия по схеме FOLFIRINOX. Необходимость комбинированного лечения обусловлена следующими причинами:
- В большинстве случаев рак ПЖ представлен протоковой аденокарциномой, которую необходимо расценивать как первично-генерализованный процесс, т. е. на момент постановки диагноза есть основания предполагать наличие отдалённых микрометастазов.
- Причиной смерти после радикального удаления опухоли являются именно отдалённые метастазы.
Химиотерапия
Химиотерапия при протоковой карциноме не предотвращает ни развитие рецидива, ни рост метастазов, но она увеличивает период безрецидивной выживаемости, на какое-то время сдерживая генерализацию процесса [4].
При условно нерезектабельном раке первым этапом лечения является химиотерапия (если нет желтухи, в противном случае проводят паллиативные операции по желчеотведению).
Преимуществ у такой тактики несколько. Во-первых, во время лечения определяется группа больных с неблагоприятным прогнозом, у которых уже на фоне проведения химиотерапии начинается прогрессирование. В этом случае дальнейшая операция нецелесообразна. Во-вторых, дооперационная химиотерапия позволяет системно воздействовать на организм, уничтожая микрометастазы. Это благоприятно сказывается на продолжительности жизни и качестве лечения. В-третьих, предоперационную терапию можно проводить практически всем больным. В то же время после обширных операций последующее лечение невозможно у четверти больных ввиду ухудшения их состояния и развития осложнений.
Ввиду того, что рак ПЖ часто диагностируется на поздних стадиях, встает вопрос об оказании паллиативной помощи таким больным (паллиативная помощь подразумевает улучшение качества жизни пациента с неизлечимым заболеванием). Ключевым моментом на этом этапе может стать желчеотведение. С этой целью проводятся несколько видов операций:
- Наложение обходных анастомозов — в обход опухоли формируется искусственный «путь», по которому желчь из печени будет попадать в тонкий кишечник. Это довольно травматичная и устаревшая методика, но в отдельных случаях (если опухоль «непроходима» или в конкретной клинике другие операции не выполняются в силу различных причин) она может быть вариантом выбора.
- Стентирование желчных протоков — в просвет протока в месте его компрессии устанавливается стент, который будет поддерживать его проходимость.
- Чрескожное чреспечёночное дренирование протоков — желчь выводится наружу с помощью дренажа, который устанавливается выше места обструкции желчевыводящих протоков.
Клиническое наблюдение
Пациентка Ш., 16 лет, поступила в ФГБУ ЭНЦ в связи с жалобами на приступы потери сознания с последующей ретроградной амнезией, сопровождавшиеся слабостью и головокружением. Из анамнеза известно, что подобные приступы отмечаются в течение 3 мес. Неоднократно осматривалась врачами в момент приступа, однако гликемия не измерялась. В очередной приступ была зафиксирована потеря сознания, в связи с чем девочка была госпитализирована в реанимационное отделение, где зафиксирована гипогликемия (1,5 ммоль/л). На фоне инфузионной терапии раствором глюкозы состояние было купировано. Ребенок был переведен в эндокринологическое отделение, где при регулярном контроле гликемии зафиксированы низкие значения (2,0–2,5 ммоль/л). На магнитно-резонансной томографии (МРТ) органов брюшной полости обнаружено объемное образование в области хвоста ПЖ размерами 10 × 7 × 6 мм (рис. 1). Установлен диагноз “инсулинома пожелудочной железы? Гиперинсулинизм”. Для дальнейшего обследования ребенок был направлен в НИИ детской эндокринологии ФГБУ ЭНЦ.
На момент поступления в ФГБУ ЭНЦ при объективном осмотре патологии не выявлено. В отделении была проведена проба с голоданием, по результатам которой диагностирован органический гиперинсулинизм: через 14 ч отмечен повышенный уровень инсулина (31,6 мкЕд/мл) на фоне гипокетотической гипогликемии (гликемия – 2,4 ммоль/л, кетонемия – 0,1 ммоль/л). Мультиспиральная компьютерная томография (МСКТ) брюшной полости – в хвосте ПЖ имеется овальной формы образование размерами 12 × 10 мм, плотность образования – 175 ед.Н (рис. 2). Заключение: образование хвоста поджелудочной железы (нейроэндокринная опухоль, Grage I?).
Рис. 1. Магнитно-резонансная томограмма. В области задних отделов хвоста ПЖ определяется округлой формы слабогиперинтенсивный на Т2ВИ, слабогипоинтенсивный на Т1ВИ очаг, накапливающий контраст в артериальную фазу, быстро вымывающий его, размерами 9 × 7 × 6 мм (стрелка).
Рис. 2. Компьютерная томограмма. Структура ПЖ неоднородна за счет наличия в хвосте овальной формы гиперконтрастного в артериальную фазу образования размерами 12 × 10 мм (стрелка).
Девочке были исследованы основные биохимические и гормональные маркеры составляющих синдрома МЭН1, отклонений не выявлено. Также было проведено молекулярно-генетическое исследование гена MEN1 – мутаций в исследованном гене не выявлено. В гормональном анализе крови показатели в пределах референтных значений: паратгормон 34,58 пг/мл, ИПФР-1 542,1 нг/мл, СТГ 3,74 нг/мл, пролактин 186,1 мЕд/л, кортизол 150 нмоль/л, АКТГ 14,76 пг/мл, св.Т4 12,58 пмоль/л, ТТГ 1,034 мМЕ/л. По данным ультразвукового исследования (УЗИ) щитовидной железы и паращитовидных желез объемных образований не выявлено. На МРТ головного мозга гипофизарно-селлярная область без изменений. На период предоперационной подготовки с целью профилактики гипогликемического синдрома девочке был назначен прогликем (диазоксид) в дозе 100 мг/сут, на фоне которого отмечалась стабилизация показателей гликемии. С диагнозом “органический гиперинсулинизм. Инсулинома поджелудочной железы” больная переведена в ДГКБ № 7 им. З.А. Башляевой для проведения оперативного лечения.
13.07.2016 ребенку под интубационным наркозом выполнено оперативное вмешательство – лапароскопическая резекция ПЖ, дренирование сальниковой сумки. Под пупком введен 5-миллиметровый троакар, наложен карбоксиперитонеум под давлением 14 мм рт. ст. и потоком 5,5 л/мин, введена 5-миллиметровая оптика. Дополнительные 5-миллиметровые троакары введены справа и слева от пупка и в левой люмбодорзальной области. Желудок по большой кривизне временно фиксирован к передней брюшной стенке тракционными швами. Широко рассечена желудочно-ободочная связка. По верхнему и нижнему краю в области хвоста ПЖ рассечен задний листок брюшины. Позади железы создан туннель, через который проведен ниппельный катетер и железа отведена кпереди (рис. 3). С помощью монополярной коагуляции хвост железы отделен от селезеночной артерии и вены. Используя EnSeal, выполнена поперечная резекция на границе тела и хвоста ПЖ. Культя ПЖ ушита непрерывным обвивным швом PDS 3-0 (рис. 4). Смена 5-миллиметрового троакара в околопупочной области на 10-миллиметровый троакар, через который резецированный фрагмент ПЖ удален из брюшной полости. Сальниковая сумка дренирована трубчатым дренажом через левый троакарный доступ. Троакары удалены. Швы на раны. Асептические повязки. Время операции – 1ч 40 мин. Кровопотеря – 50,0 мл.
Рис. 3. Интраоперационное фото. ПЖ взята на держалку и отведена кпереди от селезеночных сосудов.
Рис. 4. Интраоперационное фото. Ушивание культи ПЖ обвивным швом нитью PDS II 4-0.
При макроскопическом исследовании в резецированном фрагменте ПЖ выявляется узел белесоватого цвета размерами 1 × 1 см с капсулой плотной консистенции. При микроскопическом исследовании определяется узел трабекулярного строения без прорастания в капсулу (рис. 5). Вне опухоли отмечается выраженная гиперплазия островков Лангерганса. При проведении иммуногистохимического исследования отмечается позитивная реакция опухолевых клеток к маркерам нейроэндокринной дифференцировки – с антителами к инсулину (рис. 6), синаптофизину и хромогранину А, индекс пролиферации Ki-67 (MIBI) – 1%. Заключение: нейроэндокринная опухоль ПЖ G1 (материал консультирован врачом отдела фундаментальной патоморфологии ФГБУ ЭНЦ Л.С. Селивановой).
Рис. 5. Поджелудочная железа. Четко отграниченная капсула от опухолевого узла. Окраска гематоксилином и эозином. ×100.
Рис. 6. Поджелудочная железа. Иммуногистохимическое исследование с антителами к инсулину, позитивная реакция. ×400.
В послеоперационном периоде отмечена эугликемия, не требующая дополнительной терапии. На 5-е сутки отмечено увеличение до 150 мл отделяемого по дренажу из сальниковой сумки с содержимым альфа-амилазы 30902 ед/л. Наряду с проводимой антибактериальной терапией к лечению добавлен октреотид (сандостатин) по 100 мкг 3 раза в день. С 12-х суток из дренажа отмечено значительное уменьшение отделяемого, которое приобрело серозный характер. Показатели амилазы в экссудате – 171 ед/л. При контрольном УЗИ органов брюшной полости свободной жидкости в проекции ПЖ не выявлено. Дренаж удален на 15-е сутки. Выписана на 20-е сутки в удовлетворительном состоянии.
Результаты
Продолжительность лапароскопических операций варьировала от 1,5 до 2,5 ч, в среднем составила 2,1 ± 0,2 ч. Продолжительность роботизированных операций была несколько больше: от2до5ч,всреднем3,1±0,8ч. Это было обусловлено необходимостью подготовки роботического комплекса. При лапароскопических операциях было произведено 4 конверсии на лапаротомию из 10, при робот-ассистированных – 2 из 11. 3D-изображение, обеспечиваемое роботическим комплексом, было более четким, чем при лапароскопии, и чаще позволяло обнаружить инсулиному при поверхностном расположении. Лечение во всех наблюдениях было эффективным, у пациентов не отмечено признаков гиперинсулинизма. Гистологическим и иммуногистохимическим исследованием операционного материала у всех пациентов был подтвержден диагноз инсулиномы поджелудочной железы G1. Интраоперационных осложнений не отмечено. Структура послеоперационных осложнений представлена в таблице. Среди послеоперационных осложнений, несмотря на проводимую профилактику аналогами соматостатина, преобладал острый панкреатит, проявлявшийся преимущественно послеоперационным отеком железы с формированием парапанкреатических жидкостных скоплений и наружных панкреатических свищей. Для устранения этих состояний применяли современные миниинвазивные технологии – чрескожные пункции и дренирование острых жидкостных скоплений под контролем УЗИ. Свищи закрылись самостоятельно, повторных оперативных вмешательств по этому поводу не выполняли. В 1 наблюдении вследствие нагноения жидкостного скопления сформировался абсцесс в левом поддиафрагмальном пространстве с развитием перитонита, что потребовало лапароскопии, санации и дренирования брюшной полости. В 1 наблюдении после конверсии выполнена дистальная резекция поджелудочной железы, послеоперационный период осложнился инфицированным панкреонекрозом. Для лечения неоднократно применяли традиционные и миниинвазивные оперативные вмешательства. Вследствие этого грозного осложнения у пациента развился панкреатопривный сахарный диабет 2 типа, для лечения которого был назначен инсулин. Летальных исходов не было. Продолжительность пребывания в стационаре больных, оперированных лапароскопически, составила 17 ± ± 3 сут, при робот-ассистированных операциях – 12 ± 2 сут, при конверсии на лапаротомию – 39,5 ± 7 сут.
Структура послеоперационных осложнений. Примечание: * – осложнения, развившиеся после конверсий.
| Вмешательство | Число наблюдений, абс. | ||||
| Острый панкреатит, острое парапанкреатическое скопление жидкости | Острый панкреатит, наружный свищ | Острый панкреатит, инфицированный панкреонекроз | Абсцесс левого поддиафрагмального пространства, перитонит | Всего | |
| Лапароскопическая энуклеация | 2 | 1* | – | 1 | 4 |
| Лапароскопическая дистальная резекция ПЖ | – | 1* | – | – | 1 |
| Робот-ассистированная энуклеация | – | 2 (1*) | – | – | 3 |
| Робот-ассистированная дистальная резекция ПЖ | – | – | 1* | – | 1 |
Осложнения
источники: pexels.com
Течение инсулиномы напрямую зависит от того, является ли опухоль злокачественной или доброкачественной. В любом случае у большинства пациентов наблюдаются симптомы гипогликемии и связанной с этим нарушения концентрации и головокружения. Позже присоединяются головные боли, тошнота, что во много снижает качество жизни заболевших. Часто имеют место нарушения речи или зрения, тремор рук, и, с развитием заболевания, судороги и боли в мышцах.
Если лечение при инсулиноме, при заданных рекомендациях врача, не начато во время, опухоль может распространиться в другие области организма. Поэтому необходимой является ранняя диагностика и последующее лечение. Как правило, удаление инсулиномы происходит с помощью операции, достаточно легко и без осложнений.
Патогенез
β-клеточные аденомы, постоянно высвобождая инсулин даже при низкой концентрации глюкозы, вызывают развитие хронической гипогликемии. Гиперинсулинизм также вызывает повышенный распад гликогена в печени и мышцах. Глюкоза — это важный компонент метаболизма и источник энергии для всех тканей, особенно мозга. Мозг не имеет запасов глюкозы, поэтому на его функцию расходуется около 20% глюкозы, поступившей в организм. Если в кору полушарий прекращается поступление глюкозы, в ее клетках развиваются необратимые изменения (гибель элементов коры) и возникают когнитивные и другие психические нарушения.
Гипогликемия является причиной выброса в кровь катехоламинов, это проявляется слабостью, тревогой, потливостью, учащенным сердцебиением, дрожью, возбудимостью. В результате гипогликемии замедляются все виды обмена в головном мозге, снижается тонус сосудов и увеличивается приток крови к мозгу из-за спазма сосудов на периферии. Все это ведет к развитию отека мозга.
Лечение инсулиномы
Первым шагом после подтверждения инсулиномы является, как правило, полное оперативное удаление опухоли. Дополнительно, как перед, так и после операции, возможно применение специальных препаратов: Октероид и Диазоксид. Они тормозят неконтролируемые выбросы инсулина.
Если патологическое исследование операционного препарата подтверждает злокачественность опухоли, проводится диагностический поиск метастаз. И пациенту назначается индивидуальный план лечения, состоящий из химиотерапии и, при необходимости, облучения.
Стоимость лечения инсулиномы в Германии
Полный объём терапевтических действий, необходимых для выздоровления пациента и его реабилитации после болезни, рассчитывается, исходя из мер диагностики, использованных для выявления особенностей развития новообразования, и фактических методов лечения: химиотерапии, облучения или операции. Все сведения о ценах на услуги сопровождения на время восстановления и лечения, а также на препараты, используемые в этом периоде, обсуждаются с пациентом по мере необходимости, в зависимости от наличия или отсутствия тех исследований, которые применяются в его случае.
Обсуждение
Применение эндовидеохирургических технологий для лечения инсулином ПЖ было эффективным как при лапароскопических, так и при робот-ассистированных вмешательствах. Недостатком этих операций по сравнению с традиционными является невозможность пальпаторной ревизии ПЖ с целью локализации инсулином небольших размеров. Эту проблему позволяет решить применение интраоперационного лапароскопического УЗИ. Продолжительность робот-ассистированных операций больше по сравнению с лапароскопическими, что обусловлено необходимостью подготовки роботического комплекса. Следует отметить, что робот-ассистированные операции обладают рядом преимуществ по сравнению с лапароскопическими: кроме комфорта хирурга и минимального объема работы ассистента при операциях по поводу инсулином особенно важную роль приобретает обеспечение оптимального изображения с помощью технологии 3D, что позволяет уменьшить число конверсий для поиска инсулиномы [9]. Прецизионность работы с тканями при использовании роботического комплекса также позволяет минимизировать травматизацию ПЖ. Наибольшее число осложнений отмечено у пациентов, которым была произведена конверсия в связи с невозможностью локализовать инсулиному и необходимостью пальпаторной ревизии ПЖ. Реже всего осложнения возникали у пациентов, перенесших робот-ассистированные операции, в этой группе результаты соответствуют литературным данным [1, 7]. Полагаем, что это обусловлено упомянутой выше прецизионностью работы с тканью ПЖ, минимизирующей ее травму, тем самым уменьшающей вероятность развития послеоперационного панкреатита. В подавляющем большинстве наблюдений для лечения послеоперационных осложнений успешно применяли миниинвазивные технологии.
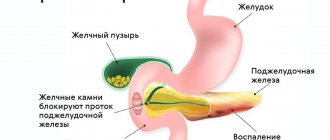
Причины
Причиной возникновения инсулиномы является перерождение бета-клеток островков Лангерганса. В большинстве случаев речь идет о доброкачественной аденоме, но в 10% случаев об аденокарциноме, которая часто метастазирует в печень.
Каким образом возникает перерождение клеток в области поджелудочной железы и образование инсилуномы до сих пор остается не ясным. Обращает на себя внимание значительно частое возникновение инсулиномы у пациентов, страдающих синдромом МЭН-1 (синдромом Вермера), который манифестирует в новообразованиях в области гипофиза, поджелудочной и паращитовидной железы.