Прежде чем начать разбираться в симптоматике заболевания, давайте узнаем, что это такое и как оно появляется. Эзофагит представляет собой целую группу заболеваний, которые по своему природному возникновению совершенно отличаются друг от друга. Но есть то, что связывает их всех – воспаление слизистой оболочки пищевода.
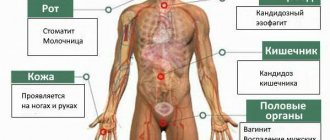
Кандидоз является одним из заболеваний, поражает он пищевод, характеризуется грибом Кандида. Очень интересным фактом является то, что кандидозный эзофагит распространился с началом широкого применения антибиотиков.
А на сегодняшний день многие заболевания дыхательных путей лечатся только антибиотиками, но это заболевания может возникать по разным другим причинам. Итак, общее представление об кандидозном эзофагите мы получили, определимся с симптомами патологии.
Введение
В последнее время отмечается неуклонный рост злокачественных новообразований пищевода, среди которых лидирующие позиции занимают плоскоклеточный рак и аденокарцинома пищевода. Нами были проанализированы редкие опухоли пищевода за период с 2000 по 2017 г., частота возникновения которых не превышает 2% от общего числа опухолей данной локализации и морфологическая диагностика которых может вызывать сложности у патологоанатомов. К таким опухолям относятся первичная меланома пищевода, нейроэндокринные и гастроинтестинальные стромальные опухоли пищевода, а также зернистоклеточная опухоль.
Проанализированы данные мировой литературы, а также собственные наблюдения в МНИОИ им. П.А. Герцена за период с 2000 по 2022 г.
Наиболее серьезным осложнением ГЭРБ является пищевод Баррета (метаплазия Баррета), заболевание, являющееся фактором риска развития рака пищевода (аденокарциномы). Перерождение клеток слизистой оболочки при пищеводе Баррета происходит по типу так называемой кишечной метаплазии, когда обычные клетки слизистой оболочки пищевода замещаются клетками, характерными для слизистой оболочки кишечника.
Кишечная метаплазия может перейти в дисплазию (метаплазия и дисплазия – последовательные по нарастающей тяжести изменений процессы перерождения клеток) и затем развиться в злокачественную опухоль. Поэтому метаплазия Баррета является предраковым состоянием, хотя рак пищевода – довольно редкое заболевание, больше распространенное среди мужчин. Распространенность пищевода Баррета среди взрослого населения составляет 8-10%. Кроме собственно рефлюксной болезни независимым фактором риска развития аденокарциномы пищевода является ожирение. При наличии обоих факторов риск развития аденокарциномы значительно повышается. Однако абсолютный риск аденокарциномы остается достаточно низким даже у людей с выраженными симптомами рефлюкса. В зависимости от участка пищевода, где развивается метаплазия Баррета (и затем, возможно, аденокарцинома), специалисты разделяют это заболевание на три типа: метаплазия в области длинного сегмента пищевода, метаплазия в области короткого сегмента пищевода (в 3 см и менее от места перехода пищевода в желудок) и метаплазия в области кардиальной части желудка (часть желудка, расположенная сразу после перехода пищевода в желудок). Распространенность метаплазии Баррета в области длинного сегмента пищевода по данным эндоскопических исследований составляет около 1%. Этот процент возрастает с увеличением тяжести ГЭРБ. Этот тип метаплазии чаще встречается в возрасте 55-65 лет, значительно чаще у мужчин (соотношение мужчин и женщин 10:1). Метаплазия Баррета в области короткого сегмента встречается чаще, однако, распространенность этого заболевания оценить сложно, так как этот тип метаплазии при эндоскопическом исследовании сложно отличить от метаплазии в кардиальном отделе желудка. При этом злокачественная опухоль при метаплазии в области короткого сегмента пищевода и кардиальной части желудка развивается реже, чем при метаплазии в области длинного сегмента пищевода. Хотя совершенно очевидно, что метаплазия Баррета в пищеводе возникает на фоне ГЭРБ и иногда приводит к развитию рака пищевода, остается не совсем ясно, почему происходит перерождение клеток по типу кишечной метаплазии в области кардиальной части желудка. Этот тип метаплазии встречается как при ГЭРБ, так и при гастрите при наличии инфекции Helicobacter pylori. Причем согласно данным исследований, метаплазия Баррета с области кардиальной части желудка, скорее всего, развивается на фоне гастрита даже чаще, чем на фоне ГЭРБ. Однако кишечная метаплазия и воспаление в этой области могут появиться и в отсутствии Helicobacter pylori, и в этом случае являться следствием хронического рефлюкса. Распространенность этого типа метаплазии составляет 1,4%. Хотя непосредственная причина метаплазии Баррета остается неясной, тем не менее, очевидным является тот факт, что метаплазия развивается на фоне ГЭРБ и связана с чрезмерным патологическим воздействием кислоты на слизистую оболочку пищевода. Исследования с использованием рН-мониторирования показали, что у пациентов с метаплазией Баррета значительно увеличена частота рефлюксов и продолжительность пищеводного клиренса. Это может быть связано с выраженным нарушением сократительной функции мышц пищевода, развивающимся вследствие тяжелого эзофагита. Кроме того, у большинства пациентов с тяжелым эзофагитом имеется грыжа пищеводного отверстия диафрагмы. Кроме того, манометрические измерения в области длинного сегмента пищевода при метаплазии Баррета показали, что при этом имеется снижение тонуса нижнего пищеводного сфинктера и нарушение перистальтики, сходные с таковыми при тяжелом эзофагите. Остается неясным, почему у одних пациентов с выраженным эзофагитом развивается метаплазия Баррета, а у других – нет. Существует предположение, что определенное значение имеет генетическая предрасположенность. Пищевод Баррета — Наблюдение и лечение В терапии больных с пищеводом Баррета основное внимание уделяется двум моментам: лечению ГЭРБ, на фоне которой развилась метаплазия, и предотвращение развития аденокарциномы пищевода. Принципы лечения имеющегося эзофагита и метаплазии Баррета остаются такими же, как и при обычной ГЭРБ, с учетом того, что поскольку имеется более выраженное воздействие кислоты на слизистую оболочку пищевода, терапия должна быть более интенсивной. Обычно бывает достаточно назначения ингибиторов протонной помпы, однако, может потребоваться и хирургическое вмешательство в случае неэффективности медикаментозного лечения. Некоторые специалисты, основываясь на данных исследований, которые показали, что клеточные изменения происходят именно за счет патологического воздействия кислоты на слизистую оболочку желудка, предлагают использовать для лечения пищевода Баррета препараты, подавляющие секрецию соляной кислоты в желудке. Однако клинически не доказано, что применение антисекреторных препаратов или антирефлюксная операция могут предотвратить развитие аденокарциномы пищевода или привести к обратному развитию кишечной метаплазии. Таким образом, основной целью лечения является терапия эзофагита.. Поскольку в настоящее время не известны пути предотвращения развития метаплазии Баррета, действия врача должны быть направлены на уменьшение риска развития рака пищевода. С этой целью пациенты с пищеводом Баррета периодически проходят эндоскопическое обследование с обязательной биопсией на предмет степени перерождения клеток слизистой оболочки пищевода (метаплазия или дисплазия; насколько выраженная). Сроки обследования устанавливаются в зависимости от тяжести имеющихся изменений слизистой оболочки пищевода. Так пациенты, у которых имеется только метаплазия Баррета без дисплазии, проходят обследование один раз в 2-3 года. Если обнаружена дисплазия, проводится более тщательное обследование для определения степени дисплазии, так как при дисплазии высокой степени рак может развиться в течение 4 лет. Пациентам с низкой степенью дисплазии назначается 12-недельный курс ингибиторов протонной помпы в высоких дозах, затем проводится повторное обследование с биопсией. Если обследование подтверждает наличие дисплазии низкой степени выраженности, то в последующем эндоскопия проводится через 6 месяцев, а затем ежегодно, если не отмечено развития дисплазии высокой степени. Хирургическое лечение пищевода Баррета Хирургическое лечение пищевода Баррета направлено на снижение количества эпизодов рефлюкса. Хотя рефлюксная болезнь является фактором риска развития аденокарциномы пищевода, до конца не ясно, само ли существование пищевода Баррета предрасполагает к развитию рака или какие-то другие причины способствуют злокачественно перерождению клеток при наличии пищевода Баррета. Уменьшению симптомов заболевания способствует как медикаментозное, так и хирургическое лечение пищевода Баррета. Однако по данным исследований даже прием ингибиторов протонной помпы в больших дозах не способствует уменьшению частоты рефлюкса. Поэтому, несмотря на улучшение состояния пациентов вследствие приема лекарств, хирургическое лечение пищевода Баррета имеет большое значение. Кроме того, данные некоторых исследований показывают, что после лапароскопической фундопликации риск развития рака пищевода значительно снижается, по сравнению с медикаментозной терапией. Хотя после хирургической операции повышается риск смертности, что связано с необъяснимым увеличением частоты заболеваний сердца у таких пациентов. В связи с этим решение об операции принимается врачом после тщательного взвешивания всех аргументов за и против хирургического лечения. Если операция проводится опытным хирургом, то ее результат может быть очень хорошим, хотя и не гарантирует полностью исчезновение симптомов заболевания, что иногда требует послеоперационного приема препаратов. Данные исследований показывают, что медикаментозная терапия, в отличие от хирургического лечения, оказывает меньший эффект на частоту возникновения рефлюкса во время сна. В этой ситуации достаточно эффективными оказываются как лапароскопическая, так и открытая операция. Кроме того, по некоторым данным, основанным на продолжительных наблюдениях, после фундопликации риск развития дисплазии и рака пищевода ниже, чем после лекарственной терапии. Хирургическое лечение рекомендуется также пациентам, с пищеводом Баррета в сочетании с наличием грыжи пищеводного отверстия диафрагмы. Эндоскопическая абляция Этот метод хирургического лечения пищевода Баррета сопряжен с меньшим риском развития осложнений, чем большая хирургическая операция. Теоретически, данный метод является относительно безопасным. Методика операции состоит в удалении пораженной части слизистой оболочки пищевода. На этом месте в дальнейшем происходит восстановление нормальной слизистой оболочки, что снижает риск развития рака пищевода. Пораженная часть слизистой оболочки удаляется с помощью воздействия лазерного или другого высокоэнергетического излучения. При этом пациенту назначается дополнительный прием ингибиторов протонной помпы в высоких дозах для улучшения восстановления нормальной слизистой оболочки пищевода. Операция проводится либо без подготовки, либо после приема специальных препаратов, воздействующих на клетки измененной части пищевода и подготавливающих к лазерному воздействию для улучшения результата операции. Хирургическое лечение при наличии высокой степени дисплазии При дисплазии высокой степени риск развития аденокарциномы также становится высоким. Дисплазия может быть обнаружена только на одном участке слизистой оболочки пищевода (фокальная), а может развиться сразу в нескольких местах (мультифокальная), и такая дисплазия сочетается со значительным риском развития аденокарциномы (27% в течение 3 лет). У пациентов с пищеводом Баррета с высокой степенью дисплазии не всегда целесообразно проведение эндоскопической абляции слизистой оболочки пищевода. Это связано с тем, что при таком подходе достаточно трудно полностью удалить пораженную ткань, а при высокой степени дисплазии риск развития рака пищевода также является высоким, даже при наличии небольшого участка пораженной ткани. Поэтому для проведения эндоскопической операции должны быть строгие показания. Должен быть тщательно оценен риск операции. Эндоскопическая абляция проводится у тех пациентов, которым не рекомендуется проведение эзофагэктомии (большая операция, при которой удаляется часть пищевода или весь пищевод). В остальных случаях предпочтительным методом хирургического лечения пищевода Баррета с высокой степенью дисплазии остается эзофагэктомия. Эзофагэктомия является эффективным методом лечения у молодых и в остальном здоровых пациентов, однако сопряжена с относительно высоким риском смертности (3-10%). В связи с этим некоторые специалисты рекомендуют вместо немедленной операции при дисплазии высокой степени у пациентов с пищеводом Баррета поводить постоянное (с высокой периодичностью) эндоскопическое наблюдение. Поскольку операция удаления пищевода сопряжена с высоким риском, в качестве альтернативного метода хирургического лечения пищевода Баррета с высокой степенью дисплазии применяется эндоскопическая абляция. Эта операция может проводиться термическим, химическим или механическим способом. В любом случае операция состоит в удалении метаплазированного или дисплазированного эпителия в сочетании с интенсивной антисекреторной терапией, что в последующем обуславливает восстановление нормального эпителия слизистой оболочки пищевода. Эндоскопическая резекция слизистой оболочки пищевода Это еще один метод хирургического лечения пищевода Баррета. Методика операции состоит в хирургическом иссечении пораженной части слизистой оболочки с помощью специальных эндоскопических инструментов, в том числе электрокоагулятора (который используется, например, при эндоскопическом удалении полипов). Успех данной операции достаточно высок, однако часто уже в течение первого года после операции может развиться рецидив заболевания. Термическая абляция производится с помощью электрокоагулятора, аргонового плазменного коагулятора или лазерного облучения. Одним из осложнений данной операции является перфорация пищевода. Другой способ абляции – фотодинамическое облучение с помощью специального прибора. Как и термическая абляция, данный метод может вызвать некоторые побочные эффекты: боль в груди, тошноту и развитие стриктур пищевода. Кроме того, следует предупредить пациентов о том, что после операции необходимо избегать длительного пребывания на солнце, так как возможно развитие реакции повышенной чувствительности к ультрафиолетовому облучению со стороны кожи. Данная процедура является весьма эффективной и приводит к обратному развитию дисплазии у 90% пациентов. Остаточные явления метаплазии Баррета наблюдаются в течение 2-62 месяцев у 58% пациентов, прошедших процедуру фотодинамической абляции. Механическая абляция заключается в механическом удалении измененной части слизистой оболочки пищевода с помощью специальных эндоскопических инструментов. Эта процедура рекомендуется тем пациентам, у которых наблюдается ранняя стадия развития рака пищевода и которым по тем или иным причинам не может быть проведена большая хирургическая операция (удаление пищевода).
Первичная меланома пищевода
Традиционно меланома рассматривается в группе опухолей кожи, поскольку наиболее часто онкологи и патологоанатомы сталкиваются в своей рутинной работе именно с этой локализацией. Внекожные формы, по данным разных авторов [3, 4], составляют менее 1—1,5%. Меланома ЖКТ в сравнении с другими злокачественными опухолями данной локализации является редким заболеванием. На его долю приходится менее 1% от числа всех диагностируемых в мире меланом слизистых оболочек. Наиболее часто встречаются первичные меланомы ротовой полости и аноректальной зоны, на третьем месте — первичная меланома тонкой кишки [5].
Меланома пищевода чаще бывает метастатическая, чем первичная, которая составляет 0,1—0,2% от всех злокачественных опухолей пищевода и 0,18% от всех меланом слизистых оболочек. В мировой литературе на данный момент описано всего 300 наблюдений. Ежегодная заболеваемость данной патологией составляет около 0,02—0,036 на 1 млн населения [5]. Пик заболеваемости приходится на шестую-седьмую декаду жизни, а соотношение заболевших мужчин и женщин равно 2:1 [1].
Первоначальные клинические проявления заболевания скудные, не имеют специфических черт и становятся более выраженными в более поздней стадии заболевания. Больные жалуются на дисфагию, боли в эпигастрии или за грудиной, связанные с приемом пищи. Эпизоды желудочно-кишечного кровотечения и резкая значительная потеря массы тела характерны для запущенных стадий заболевания.
В момент постановки диагноза метастазы выявляются у 30—40% больных. Частота появления метастазов в региональных лимфатических узлах достигает 40—80%. Чаще других поражаются параэзофагеальные и чревные лимфатические узлы, а также лимфатические узлы средостения.
Гематогенное метастазирование происходит в основном в печень, легкие и головной мозг [5].
Опухоль наиболее часто локализуется в средней и нижней трети пищевода. Лишь в 10% всех описанных в литературе наблюдений меланома обнаруживалась в верхней трети пищевода. Опухоль имеет вид одиночного полиповидного образования на широком основании, с гладкой или изъязвленной поверхностью, либо солитарного плоского образования, от светло-коричневого до черного цвета в зависимости от содержания пигмента. Возможно обнаружение видимых глазом «отсевов» на некотором расстоянии от основной опухоли. В 25% случаев меланомы пищевода не имееют окраски. Чаще всего опухоль растет экзофитно, однако имеется тенденция опухоли распространяться в продольном направлении вдоль подслизистой оболочки стенки пищевода.
Гистологически меланома пищевода не отличима от меланомы кожи (рис. 1).
Рис. 1. Меланома пищевода. Рис. 1. Меланома пищевода. Выделяют эпителиоклеточный, веретеноклеточный, невоклеточный, смешанный варианты меланомы. Необходимо отметить, что меланома пищевода зачастую развивается на фоне атипичной меланоцитарной пролиферации, и очень часто такие участки обнаруживаются рядом с инвазивной опухолью, что подтверждает первичное, а не метастатическое поражение.
Для установления диагноза первичной меланомы пищевода помогает метод иммуногистохимического исследования, особенно в таких случаях, когда диагноз меланомы не является однозначным. В клетках опухоли выявляется положительная экспрессия с антителами к Виментину, S-100 протеину, HMB-45, Melan-A, Tyrosinase в сочетании с отсутствием экспрессии кератинов и общего лейкоцитарного антигена (рис. 2).
Рис. 2. Первичная меланома пищевода. Рис. 2. Первичная меланома пищевода.
Средняя продолжительность жизни при первичной меланоме пищевода составляет 10 мес (диапазон от 4—6 до 9—14,5 мес). В МНИОИ им. П.А. Герцена за период с 2000 по 2022 г. диагностированы два наблюдения первичной меланомы пищевода у женщин в возрасте 59 лет и 61 года. Обе пациентки обратились к врачу по месту жительства с жалобами на боли за грудиной, которые появлялись непосредственно после приема пищи. При обследовании выявлена опухоль в средней трети пищевода, и с диагнозом: рак пищевода, направлены в наш институт. При ЭГДС и КТ органов грудной полости — картина, расценена как лейомиосаркома пищевода, исходящей из заднеправой стенки, без признаков выхода в клетчатку. Выполнена операция в объеме одномоментной резекции и пластики пищевода желудочным стеблем с лимфаденэктомией.
При патологоанатомическом исследовании операционного материала в нижней трети пищевода визуализировалась крупнобугристая опухоль темно-багрового цвета с изъязвленной поверхностью, размером 2×1,5×1,5 см, обтурирующая просвет пищевода на ¾ его окружности. При микроскопическом исследовании: злокачественная пигментная меланома смешанного эпителио-веретено-невоклеточного строения, с инвазией мышечного слоя стенки пищевода, участками лентиго-меланомы в краях опухоли. В 4 бифуркационных, 3 трахеобронхиальных, 2 параэзофагеальных, 2 паратрахеальных лимфатических узлах метастазов не выявлено. Диагноз подтвержден иммуногистохимическим исследованием: обнаружена положительная экспрессия Melan-A и HMB-45 в клетках опухоли.
В дальнейшем проведено три курса иммунотерапии. Спустя 3 мес у пациентки возник рецидив в области послеоперационного рубца, в связи с чем она была госпитализирована в МНИОИ им. П.А. Герцена.
При обследовании: в проекции верхней трети желудочного трансплантата определяется пигментное образование, диаметром до 2 см, с изъязвлением, с нарушением целостности стенки трансплантата. Выявлено метастатическое поражение печени, селезенки.
Проведено три курса ПХТ с некоторым положительным эффектом: изъязвление на коже в проекции верхней трети желудочного трансплантата эпителизировалось, также отмечалось уменьшение размеров метастаза в печени на 25%.
Однако при контрольном УЗИ органов брюшной полости обнаружены увеличение количества и размеров метастазов в печени до 10 см в диаметре, появление множественных узловых образований в селезенке диаметром до 6 см. В области стебля желудочного трансплантата — рецидив изъязвления, появление участков гиперпигментации кожи; при пальпации описанной области — в парастебельчатой клетчатке два плотных лимфатических узла, диаметром по 0,5 см.
Проведен курс полихимиотерапии с последующей операцией в объеме: резекция стенки желудочного трансплантата, иссечение узлов парастебельчатой клетчатки. При гистологическом исследовании: метастаз меланомы смешанного строения.
Течение послеоперационного периода осложнилось несостоятельностью швов анастомоза, формированием желудочного свища.
Спустя 5 мес больная умерла.
Повреждение пищевода
Непроникающие повреждения пищевода подлежат консервативному лечению. Необходимость в госпитализации и проведении консервативной терапии возникает при обнаружении во время рентгенологического исследования или эзофагоскопии глубоких ссадин слизистой оболочки и подслизистого слоя, сопровождающихся отеком околопищеводной клетчатки. При поверхностных ссадинах слизистой оболочки без реакции околопищеводной клетчатки больные могут находиться на амбулаторном лечении. Им необходимо рекомендовать щадящую диету в теплом виде, измерение температуры тела и немедленное обращение к врачу при появлении или усилении боли при глотании, при появлении дисфагии, озноба, повышения температуры тела.
Консервативное лечение непроникающих повреждений пищевода эффективно в подавляющем большинстве случаев. Однако у 1,5-2 % больных в околопищеводной клетчатке через 5-6 суток может сформироваться абсцесс, что требует оперативного вмешательства.
Перфорация пищевода инородным телом всегда сопровождается воспалением околопищеводной клетчатки. Это воспаление в первые часы и сутки после перфорации ограничено небольшой зоной, прилежащей к стенке пищевода, и интенсивная антибактериальная терапия, начатая в первые сутки, приводит в большинстве наблюдений к выздоровлению. Показанию к дренированию отграниченного абсцесса, возникающего на фоне антибактериальной терапии, возникают в 5-8 % наблюдений.
Пребывание инородного тела в просвете пищевода более суток приводит к инфицированию этой зоны и перфорация пищевода в таких условиях вызывает массивное инфицирование околопищеводной клетчатки, часто неклостридиальной анаэробной флорой. Существование в течение суток и более нелеченного гнойного очага в клетчатке шеи или средостения становится чрезвычайно опасным для жизни больного, несмотря на небольшие размеры повреждения пищеводной стенки. Попытки консервативного лечения такого рода повреждений ошибочны, так как при промедлении с хирургическим вмешательством развивается диффузный медиастинит, иногда заканчивающийся смертью больного, несмотря на предпринятое в последующем адекватное дренирование гнойного очага.
Таким образом, хирургическому лечению подлежат все больные, если инородное тело находилось в просвете пищевода более суток.
Инструментальные и спонтанные разрывы пищевода требуют хирургического лечения. В исключительных случаях, когда риск оперативного вмешательства у больного чрезвычайно велик (наличие у больного пневмонии, туберкулеза, гнойного бронхита и т.д.), возможно проведение консервативной терапии при условии хорошего оттока гнойного отделяемого из средостения в просвет пищевода (разрыв стенки пищевода не более 1-1,5 см, не сопровождается повреждением медиастинальной плевры, а ложный ход в клетчатке средостения не превышает 2 см). Перечисленные условия консервативного лечения предусматривают строгий контроль эффективности проводимой терапии. Лечение заключается в массивной антибактериальной терапии (тиенам, амикацин), исключения приема жидкости и пищи через рот, инфузионной терапии и парентеральном питании в течение 6-7 дней.
Следует предостеречь от использования такой тактики у больных сахарным диабетом. Учитывая особенности течения гнойных процессов при этом заболевании, любое проникающее повреждение пищевода подлежит раннему хирургическому лечению.
При лечении химических ожогов пищевода используется комплекс интенсивной консервативной терапии. Неотложная помощь заключается в удалении остатков прижигающей жидкости, попавшей в желудок и ее нейтрализации. Это достигается промыванием желудка большим количеством воды, в которую при отравлении кислотами добавляют раствор бикарбоната натрия. Следует помнить, что поспешное и грубое введение зонда в желудок само по себе может привести к разрыву пищевода.
Больным назначают антибактериальную, инфузионную детоксикационную терапию, обезболивающие препараты. Широкое применение получили стероидные гормоны, обеспечивающие противовоспалительный эффект и лучшую регенерацию тканей. Значительно улучшают репаративные процессы сеансы гипербарической оксигенации, местное облучение через эндоскоп ожоговой поверхности гелий-неоновым лазером. При ожогах нижней трети пищевода благоприятное влияние на заживление оказывает нанесение через эндоскоп на ожоговую поверхность клеевых композиции, что защищает поврежденные ткани от агрессивного действия желудочного сока.
Однако в 10-15 % ожогов пищевода в течение года происходит формирование рубцовых стриктур, что требует хирургического лечения в отсроченном порядке.
Хирургическое лечение
Хирургическое лечение разрывов и перфораций пищевода является сложным и трудным вмешательством. В это лечение входит комплекс, состоящий из эндоскопических манипуляций, хирургического доступа, вмешательств на поврежденном пищеводе и методики дренирования зоны повреждения.
Хирургическое лечение направлено на достижение следующих целей:
1. Прекращение поступления инфицированного содержимого через дефект стенки пищевода в средостение;
2. Адекватное дренирование гнойного очага в средостении;
3. Временное выключение пищевода из акта пищеварения;
4. Обеспечение энергетических потребностей организма путем парентерального и энтерального питания.
Реанимационные мероприятия и предоперационная подготовка. К мероприятиям реанимационного характера относятся трахеостомия, необходимость которой возникает в связи со стридорозным дыханием при позднем поступлении больных с перфорацией шейного отдела пищевода и дренирование плевральной полости.
Дренировать плевральную полость следует при одновременном повреждении пищевода и медиастинальной плевры. Эвакуация жидкости и газа из плевральной полости перед операцией предупреждает возникновение напряженного пневмоторакса во время вводного наркоза и инсуфляции кислорода через маску.
Больные, поступившие более через 2 суток после перфорации пищевода, резко обезвожены вследствие интоксикации и невозможности приема жидкости через рот. У них наблюдаются волемические нарушения (гипотония, тахикардия, олигурия или анурия), без коррекции которых начинать хирургическое вмешательство рискованно. Такие больные нуждаются в кратковременной (не более 2 часов), но интенсивной инфузионной терапии, включая введение растворов электролитов, бикарбоната натрия, крупномолекулярных растворов и плазмы.
Проведение обезболивания при операциях у больных с травмой пищевода имеет свои особенности и трудности, обусловленные в том числе локализацией повреждений в непосредственной близости от трахеобронхиального дерева и органов средостения. Раздражение мощных рефлексогенных зон и быстрое нарастание интоксикации создают условия для возникновения шоковых реакций. Значительный отек околопищеводных тканей и обширная эмфизема приводят к расстройству внешнего дыхания и гипоксии. При этом существует реальная опасность сдавления верхних дыхательных путей и асфиксии.
Существенную трудность в проведении обезболивания представляет невозможность предоперационного опорожнения желудка при помощи зонда, так как попытка его проведения увеличивает разрыв, и зонд попадает вместо желудка в ложный ход в клетчатке средостения и даже в плевральную полость.
У больных с разрывом пищевода используют эндотрахеальный наркоз с миорелаксантами. Насыщение кислородом при помощи маски должно быть сведено к минимуму, особенно при повреждении шейного и верхнегрудного отделов пищевода, так как через дефект пищеводной стенки газ легкого проникает в средостение, увеличивая эмфизему клетчаточных пространств, а при наличии дефекта медиастинальной плевры — увеличивая пневмоторакс.
Эндотрахеальная интубация у больных с повреждением пищевода -ответственная и трудная процедура. Наличие ссадин глотки вследствие предшествующих врачебных инструментальных манипуляций или самостоятельных попыток больных избавиться от инородного тела, выраженный отек надгортанника и околосвязочного пространства затрудняют ориентировку при проведении ларингоскопии. При этом существует реальная опасность проведения эндотрахеальной трубки в поврежденный пищевод.
При проведении предоперационной эзофагоскопии и использовании чресшейного доступа анестезиолог должен внимательно следить за положением эндотрахеальной трубки, не допуская ее случайного смещения.
Хирургические доступы. При повреждениях шейного и верхне-грудного отдела пищевода используют чресшейный доступ. Если вмешательство ограничивается областью шеи, используется термин — коллотомия. В случаях проникновения хирурга в верхнее средостение речь идет о чресшейной медиастинотомии. Наложение швов на дефект стенки грудного отдела пищевода через шейный доступ возможно на уровне Тh1 — Th2. Это объясняется узостью зоны оперативного действия, невозможностью хорошо мобилизовать стенку пищевода и наложить швы под контролем зрения. Дренировать заднее средостение из этого доступа возможно на всем его протяжении, вплоть до диафрагмы, но на практике ограничиваются уровнем бифуркации трахеи (Th4 — Th5).
Разрез кожи и подкожной мышцы осуществляют продольно вдоль переднего края грудно-ключично-сосцевидной мышцы на стороне повреждения пищевода (при повреждении задней стенки удобнее использовать левосторонний доступ). Затем отодвигают щитовидную железу с трахей и возвратным нервом медиально, грудно-ключично-сосцевидную мышцу и сосуды шеи — латерально и широко обнажают боковую стенку пищевода. При необходимости приходится пересекать лопаточно-подъязычную мышцу и нижнюю щитовидную артерию.
Следует помнить, что при повреждениях пищевода из-за гематом, отека и инфильтрации мягких тканей топографоанатомические взаимоотношения могут быть изменены, и поэтому в ходе доступа необходимо соблюдать осторожность.
Чресплевралъный доступ используют для наложения швов на грудной отдел пищевода, причем для ушивания стенки пищевода в верхней и средней третях грудного отдела применяют правостороннюю боковую торакотомию, а для ушивания стенки пищевода в нижней трети грудного отдела — левостороннюю боковую торакотомию. Если возникают показания к резекции поврежденного пищевода, применяют правостороннюю торакотомию.
Доступ к грудному отделу пищевода связан с возможной травмой целого комплекса важных образований: заднего средостения, зоны дуги аорты, перикарда, корня легкого, аортального сплетения, ветвей блуждающего нерва и симпатического ствола. При грубых повреждениях этой зоны возникает ряд тяжелых осложнений, как во время операций, так и в ближайшем послеоперационном периоде.
После выполнения торакотомии легкое отводят кпереди и обнажают медиастинальную плевру, которая выглядит отечной и утолщенной, покрытой фибрином. Иногда она буквально отслоена от пищевода мелкими пузырьками газа. После тщательной изоляции плевральной полости медиастинальную плевру вскрывают в продольном направлении. В поздние сроки хирург встречается с плотным инфильтратом, включающим корень легкого и магистральные сосуды средостения (непарную вену, нисходящую аорту), что затрудняет и даже делает невозможным мобилизацию стенки пищевода для наложения швов и, тем более, для резекции. Поэтому этот доступ используют в ранние сроки после разрыва пищевода.
Но и в ранние сроки пожилой и старческий возраст больных, наличие тяжелых сопутствующих заболеваний значительно повышает риск чресплеврального вмешательства. В таких случаях следует ограничиться вне-плевральным дренированием зоны повреждения.
Чрезбрюшинный доступ является доступом выбора при разрывах нижнегрудного и абдоминального отделов пищевода, включая спонтанные разрывы.
У больных с недиагностированным спонтанным разрывом пищевода хирурги нередко выполняют верхнесрединную лапаротомию по поводу предполагаемой перфорации гастродуоденальной язвы. Не найдя прободной язвы, хирург ушивает рану брюшной стенки, не подозревая, что он был близок к установлению истины. В таких случаях всегда необходимо проводить тщательную ревизию левого поддиафрагмального пространства. В области пищеводного отверстия диафрагмы может быть гиперемия брюшины, налеты фибрина, инфильтрация тканей. При малейших сомнениях необходимо чресхиатально вдоль стенки пищевода вскрыть заднее средостение и туп-фером пройти вверх на расстояние 3-4 см. При отсутствии разрыва пищевода эта манипуляция останется без каких-либо последствий.
Важным элементом чрезбрюшинного доступа при разрывах пищевода является мобилизация левой доли печени, без чего манипуляция на уровне абдоминального и нижнегрудного отделов пищевода затруднены.
После того, как ассистент отведет желудок вниз и влево, хирург, оттеснив левой рукой печень вниз и натянув левую треугольную связку, захватывает ее длинным зажимом. Потягивая за зажим, связку под контролем зрения рассекают на протяжении 10-12 см, не доходя до опасного участка, где расположены печеночные вены. Захваченную зажимом треугольную связку необходимо лигировать, так как в редких случаях в ней проходит небольшой желчный проток, пересечение которого приводит к истечению желчи в брюшную полость.
После лигирования связки левую долю печени отводят вниз и вправо, и ассистент удерживает ее в таком положении большим печеночным зеркалом. Вторым зеркалом оттесняют влево дно желудка и селезенку. В результате широко открывается область кардии и пищеводного отверстия диафрагмы. Абдоминальный отдел пищевода выглядит как покрытый брюшиной тяж, продолжающийся в малую кривизну желудка, особенно хорошо он заметен при натяжении желудка.
Перед рассечением диафрагмы необходимо надежно прошить и перевязать с обеих сторон от предполагаемого разреза нижнюю диафрагмальную вену. Удобнее начинать прошивание и перевязку дистального отрезка этой крупной вены, располагающегося слева от намеченного разреза диафрагмы, т.к. в противном случае просвет ее спадется и при прошивании ее можно случайно ранить. Потягивая за нити, как за держалки, остроконечными ножницами рассекают диафрагму от переднего края пищеводного отверстия строго кпереди на протяжении 10-12 см.
Сагиттальная диафрагмотомия, широко открывая средостение, позволяет наложить швы на стенку пищевода до уровня Th8 — Th9, в зависимости от конституции больного. При этом без особой необходимости не следует производить ваготомию, особенно обоих стволов. При наложении швов на стенку пищевода и укрытии их дном желудка требуется предварительная мобилизация стволов блуждающего нерва.
Особенность чрезбрюшинной медиастинотомии при разрывах пищевода заключается в трудности послойного разделения и рассечения тканей в области пищеводного отверстия диафрагмы. Здесь встречается различной плотности инфильтрат, распространяющийся нередко в брюшную полость по ходу малого сальника, желудочно-поджелудочной связки и малой кривизны желудка. В таких случаях ориентиром служит стенка пищевода.
Серьезными осложнениями, отягощающими прогноз, являются повреждение плеврального листка или перикарда. Причинами этих осложнений являются: 1)узкая зона оперативного действия (небольшая лапаротомия, недостаточная мобилизация левой доли печени); 2)отклонение влево при выполнении сагиттальной диафрагмотомии; 3)чрезмерное рассечение диафрагмы.
Наиболее опасным является вскрытые полости сердечной сорочки, что неизбежно приведет к возникновению перикардита.
Вмешательства на поврежденном пищеводе. Возможны два варианта — наложение швов на дефект пищеводной стенки и удаление всего измененного пищевода.
Методика ушивания разрыва пищевода включает три последовательных манипуляции: обнаружение дефекта стенки пищевода и ее мобилизация, наложение швов и их укрытие окружающими тканями.
Уже в первые часы после перфорации в зоне повреждения определяются эмфизема, отечность тканей и наложения фибрина. При использовании в целях диагностики взвеси сульфата бария она хорошо заметна и имеет вид желтоватых крапчатых пятен, просвечивающих сквозь отечные ткани. При возникновении трудностей в просвет пищевода через зонд можно ввести раствор метиленового синего, который через некоторое время поступает в хирургическую рану.
Для наложения швов на рану пищевода необходимо мобилизовать его стенку. При этом надо стремиться сохранить, во-первых, питающие сосуды и, во-вторых, его соединительнотканную оболочку (адвентицию), которая в значительной степени несет нагрузку при наложении швов. Швы на рану пищевода следует накладывать в продольном направлении, т.к. в таком случае при сокращениях пищевода они несут меньшую нагрузку и являются более надежными. В редких случаях поперечных резаных ран или пересечения всего пищевода приходится накладывать швы в поперечном направлении. При наличии рваной или огнестрельной раны с пролабированием имбибированной кровью слизистой оболочки последнюю экономно иссекают на границе неизмененной слизистой. Некоторые авторы рекомендуют иссекать всю измененную стену пищевода в зоне повреждения, однако после этого размеры раны пищевода становятся значительно больше, от чего опасность несостоятельности швов не уменьшается, а если удается избежать несостоятельности, возникает сужение просвета пищевода.
Наиболее надежными являются двухрядные узловые швы на атравматической игле. Внутренний ряд должен быть из рассасывающегося материала (викрил 2-0), наружный — из монофиламентного нерассасывающегося материала или длительно рассасывающегося (полидиоксанон 2-0).
Первый ряд узловых швов накладывают на все слои стенки, делая вкол и выкол иглы на 3 мм от краев раны. Каждый шов завязывает узлом внутрь просвета, тщательно сопоставляя края слизистой оболочки и избегая чрезмерного затягивания. Наложение этого ряда облегчается при заранее введенном в просвет пищевода зонде. Вторым рядом швов сшивают мышечный слой, завязывая узлы снаружи.
Заключительным и чрезвычайно важным элементом этой операции является укрытие линии швов окружающими тканями. Для этого используют такую хорошо кровоснабжаемую ткань, как мышечный лоскут на ножке. Для укрытия линии швов шейного отдела пищевода и области верхней грудной апертуры выкраивают медиальную порцию грудино-ключично-сосцевидной мышцы с соответствующей стороны, для укрытия швов грудного отдела пищевода при чресплевральном доступе — межреберную мышцу, покрытую париетальной плеврой.
Для нижней трети грудного и абдоминального отделов наилучшим способом укрытия линии швов является создание из дна желудка манжеты типа фундопликации по Ниссену или укрытия частично мобилизованным дном желудка типа фундораффии.
Если есть соответствующая возможность, предпочтение следует отдавать фундопликации по Ниссену, т.к. манжета не только надежно прикрывает линию швов, но и препятствует рефлюксу агрессивного желудочного содержимого, играющего большую роль в генезе несостоятельности швов в этой области.
Резекция поврежденного пищевода — большая по объему и травматичная операция. В пожилом и старческом возрасте, при наличии тяжелых сопутствующих заболеваний резекцию пищевода, даже пораженного рубцовым процессом, производить не следует. Главной задачей в таких случаях является спасение жизни больного, и все усилия необходимо направить на предупреждение и лечение медиастинита. Исключение составляют больные, у которых произошла перфорация пищевода, пораженного раком. У этих больных в резектабельных случаях необходимо идти на удаление пищевода, независимо от возраста и тяжести их состояния.
Обеспечение адекватного дренирования зоны повреждения. Высокая летальность при разрывах пищевода прежде всего обусловлена развивающимся при этом гнойным медиастинитом. До настоящего времени она достигает 20-50 %, в зависимости от вида микрофлоры, локализации и распространенности гнойного процесса.
Тяжесть течения медиастинита обусловлена в значительной степени анатомофизиологическими особенностями заднего средостения. Как известно, средостение представляет собой труднодоступное для хирурга пространство, содержащее жизненно-важные органы и заполненное рыхлой жировой клетчаткой, пронизанной большим количеством нервных сплетений, лимфатических и кровеносных сосудов. Постоянные изменения объема средостения при дыхании, движения, обусловленные пульсацией сердца и аорты, перистальтическими сокращениями пищевода, создают фактор насоса и способствуют быстрому распространению гнойной инфекции.
Дренирование средостения наиболее удобно и наименее травматично при использовании узких и длинных внеплевральных доступов. Однако самостоятельный отток гноя по этим каналам чрезвычайно затруднен, а при направленном вверх чресшейном дренировании — невозможен.
Выход был найден в использовании методики активного дренирования, когда по одному из каналов двухпросветной дренажной трубки в зону повреждения клетчатки средостения поступает антисептический раствор, а по другому осуществляется аспирация содержимого. Постоянное разрежение в зоне поврежденной околопищеводной клетчатки не только обеспечивает полноценную эвакуацию продуктов воспаления и распада клеток, но и способствует быстрому спадению и облитерации образовавшейся в результате травмы и хирургического вмешательства полости.
Для осуществления надежной эвакуации гнойного экссудата длина дренажного хода и его направление (вверх или вниз) при этом большого значения не имеют. Гораздо большее значение для эффективности этого метода дренирования имеет создание герметичности в области проведения дренажных трубок, что достигается послойным ушиванием мягких тканей в зоне доступа и выведением их путем проколов в стороне от ушитой хирургической раны.
При использовании чресшейного доступа один дренаж, несущий одно-два боковых отверстия, устанавливают к месту ушитого дефекта стенки пищевода, второй — на всю длину ложного хода.
При использовании чрезбрюшинного доступа один дренаж устанавливают к месту ушитого и прикрытого манжетой пищевода, второй, контрольный — в левое поддифрагмальное пространство к пищеводному отверстию диафрагмы. Этот дренаж необходим для предотвращения распространения гноя по брюшной полости в случае развития несостоятельности швов пищевода. Оба дренажа укладывают поверх печени и выводят через проколы брюшиной стенки в правом подреберьи. Зону диафрагмотомии и стояния дренажей укутывают прядью большого сальника. Обеспечение энтерального питания. При хирургическом лечении пищевод должен быть исключен из пассажа пищи на длительное время. Это достигается либо проведением мягкого назогастралыюго зонда (при повреждениях шейного и верхне-грудного отделов пищевода) либо наложением гастростомы или еюностомы.
Если дефект нижнегрудного или абдоминального отделов пищевода ушит и адекватно укрыт фундопликационной манжетой по Ниссену, больному можно наложить гастростому, так как пища, введенная в желудок, не будет попадать в зону повреждения. Гастростому для питания накладывают и в случаях резекции грудного отдела пищевода. Обычно гастростома у этих больных является временной, поэтому используют наиболее простую методику Кадера.
Если в силу каких либо обстоятельств не удалось выполнить фундопликацию, препятствующую забросу содержимого желудка в пищевод, гастростому используют для аспирации желудочного сока, а для питания накладывают еюностому по Майдлю на выключенной по Ру петле.
Послеоперационный период. Течение послеоперационного периода зависит от локализации и вида повреждения пищевода. При ушивании дефектов шейного отдела пищевода в ранние сроки после травмы послеоперационный период протекает гладко.
При повреждениях грудного отдела пищевода больные нуждаются в комплексном интенсивном лечении, направленном на предупреждение осложнений. Травматический медиастинит течет исключительно тяжело и его послеоперационное лечение требует усилий персонала на протяжении длительного времени.
В течение 3-5 суток после операции большое значение придают достаточному обезболиванию, особенно при чресплевральном и чрезбрюшинном доступах. Сразу же после выхода из наркоза больным придают полусидячее положение, осуществляют постоянную санацию трахеобронхиального дерева, а после перевода на самостоятельное дыхание — санации полости рта.
Комплексная интенсивная терапия включает в себя антибактериальную, иммунную, инфузионно-трансфузионную, детоксикационную терапию, которая проводится при других формах генерализованной хирургической инфекции, например, при перитоните. При наличии показаний применяют активные методы детоксикации (плазмаферез, гемофильтрация и т.д.).
В значительной степени успех хирургического лечения повреждений пищевода определяется адекватной и надежной эвакуацией инфицированного содержимого из средостения, из плевральной полости и других областей, вовлеченных в травматический процесс. Продолжительность промывания и аспирации зависит от сроков заживления дефекта пищевода, масштабов разрушения клетчатки средостения и длины дренирующего канала.
В случаях профилактического дренирования у больных с ушитыми дефектами пищевода дренажи извлекают в среднем через 8-10 дней после операции.
При развитии гнойных осложнений промывание с аспирацией по дренажам продолжается иногда до полутора-двух месяцев, до тех пор, пока полости в средостении не облитерируются, после этого дренажи начинают постепенно подтягивать, заменять на более короткие.
Этот процесс нуждается в повседневном комплексном контроле эффективности лечения, который включает в себя клинические и иммунологические анализы крови, а также динамический рентгенологический контроль.
Рентгенологическое исследование на протяжении первых двух недель после операции выполняют каждые 3-4 дня. Оно позволяет установить:
1) состояние стенок пищевода (эзофагит, непроходимость, несостоятельность швов); 2) состояние клетчатки средостения (объем, инфильтрация, абсцедирование); 3) состояние плевральных полостей (выпот, осумкованные полости); 4) состояние легочной ткани (ателектазы, воспалительная инфильтрация, абсцедирование); 5) состояние полости перикарда (перикардит); 6) наличие сообщения пищевода с трахеобронхиальным деревом; 7) величину полости в средостении, ее отношение к стенке пищевода, медиастинальной плевре, диафрагме; локализацию дренажей, их положение по отношению к полости в средостении и адекватность ее опорожнения при подключении аспирации.
Перед выпиской больных из стационара следует проводить контрольное рентгенологическое исследование, при котором необходимо обращать внимание на функциональные и морфологические последствия травмы пищевода в виде стриктур, встречающихся в 1,2 % наблюдений и посттравматических дивертикулов, встречающихся в 3-4,8 %.
Хирургическое лечение последствий химических и термических повреждений пищевода проводят в отсроченном и плановом порядке. При этом объем вмешательств самый различный — от бужирования пищевода и наложения гастростомы для питания до сложных реконструктивных операций по созданию искусственного пищевода.
Нейроэндокринные опухоли пищевода
Нейроэндокринные опухоли (НЭО) относят к числу редких новообразований желудочно-кишечного тракта (ЖКТ). Повышенный интерес к этой проблеме у морфологов объясняется несомненным ростом их выявляемости, наличием многих нерешенных вопросов, касающихся терминологии, клинической и морфологической классификации. Однако НЭО пищевода встречаются исключительно редко и составляют примерно 0,04—0,05% НЭО всех локализаций, включая ЖКТ [6]. Их частота среди всех злокачественных опухолей пищевода 0,05—7,6% [1]. Согласно данным мировых источников литературы [6, 7], описано не более 100 случаев нейроэндокринных карцином пищевода (НЭК).
Несмотря на столь редкие наблюдения, в классификации ВОЗ (2010) НЭО пищевода выделены в самостоятельную нозологическую форму [1], которая предлагает стандартные определения «нейроэндокринная опухоль» и «нейроэндокринный рак». Все высокодифференцированные новообразования, независимо от того, ведут ли они себя «доброкачественно» или дают метастазы, обозначают термином «нейроэндокринная опухоль» (neuroendocrine tumor — NET), и они имеют градацию G1 или G2. Все низкодифференцированные новообразования называют термином «нейроэндокринный рак» (neuroendocrine carcinoma— NEC), они имеют градацию G3. В соответствии с классификацией (WHO, 2010), для обозначения всей группы опухолей данного типа предложен термин «нейроэндокринные неоплазии» (neuroendocrine neoplasm — NEN), который объединяет опухоли всех степеней злокачественности (низкой, промежуточной, высокой).
НЭО пищевода выявляют у лиц в возрасте от 30 до 82 лет, но чаще на шестой-седьмой декаде жизни. Средний возраст больных 56 лет. Мужчины поражаются в 6 раз чаще, чем женщины.
Большинство нейроэндокринных опухолей пищевода — высокодифференцированные, нефункционирующие и не сопровождаются специфическими гормональными синдромами, редко метастазируют в лимфатические узлы, отличаются медленным ростом и поэтому не имеют развернутой клинической картины, часто являясь случайной находкой. Иногда в более редких случаях сочетаются с пищеводом Барретта, аденокарциномой [7]. Дисфагия, потеря массы тела, боли за грудиной являются основными симптомами НЭО.
НЭО пищевода обычно локализуются в нижней трети пищевода, что скорее всего связано с большим количеством эндокринных клеток в этом отделе. Сравнительно реже опухоль обнаруживают в средней трети пищевода [8, 9].
Макроскопически высокодифференцированные НЭО мелкие, полиповидные, редко бывают изъязвленными. Умеренно дифференцированные НЭО имеют более крупные размеры, чаще встречается изъязвление. Карциномы же (НЭК) обычно больших размеров, бугристые, плотные, с глубоким инфильтративным ростом.
При микроскопическом исследовании НЭО G1 состоит из округлых мономорфных клеток, расположенных диффузно, или формирующих комплексы железистоподобных структур в виде «розеток», «палисада», а также криброзные структуры. Клетки опухоли с центрально расположенным ядром без полиморфизма и митозов со своеобразной структурой хроматина в виде «соли и перца». В отличие от мелкоклеточного рака отсутствуют признаки некроза, синдрома раздавливания клеток. При иммуногистохимическом исследовании клетки опухоли дают положительную реакцию с хромогранином, синаптофизином, NSE, цитокератинами. Необходимо отметить, что индекс пролиферативной активности Ki-67 в высокодифференцированных НЭО не превышает 5%.
НЭО G2 гистологически построены из солидных, ацинарных, трабекулярных структур. Клетки опухоли имеют более выраженный полиморфизм с очевидными многочисленными митозами. Часто присутствуют очаги некроза. Эти опухоли также экспрессируют нейроэндокринные маркеры.
Низкодифференцированная нейроэндокринная карцинома (НЭК) агрессивная, инфильтративно растущая опухоль, как правило, с одновременным метастазированием, построенная из мелких или крупных клеток.
Крупноклеточный нейроэндокринный рак пищевода в подавляющем большинстве случаев сочетается с пищеводом Барретта. Клетки больших и средних размеров, с широкой эозинофильной цитоплазмой, низким ядерно-цитоплазматическим соотношением, наличием нуклеол. Мелкоклеточный же вариант неотличим от мелкоклеточного рака легкого и составляет 1% от всех злокачественных опухолей пищевода. Макроскопически представляет собой опухоль больших размеров, экзофитно растущую в просвет пищевода, однако может быть выражен и инфильтративный рост опухоли. Клетки опухоли с малозаметной цитоплазмой, гиперхромными ядрами с наличием или отсутствием мелких нуклеол формируют солидные пласты и гнезда. Обращает на себя внимание значительное количество митозов. В 50% случаев наблюдается очаговая плоскоклеточная или железистая дифференцировка. Обнаруживается некроз, синдром раздавливания клеток. Клетки опухоли дают положительную реакцию с хромогранином, CD-56, Р-53, цитокератинами. Возможна положительная экспрессия NSE, синаптофизина.
Мелкоклеточный рак пищевода имеет плохой прогноз. Выживаемость при данном заболевании составляет от 6 до 12 мес. В МНИОИ им. П.А. Герцена за период с 2000 по 2022 г. диагностированы 48 нейроэндокринных опухолей пищевода, в 15 случаях это высокодифференцированные неактивные клинически опухоли.
Крупноклеточный нейроэндокринный рак пищевода мы диагностировали в 11 наблюдениях. В подавляющем большинстве — это были мужчины в возрасте от 59 до 80 лет. Средний возраст больных составил 69 лет.
Мелкоклеточный рак пищевода диагностирован в 22 наблюдениях. В основном это были мужчины в возрасте от 49 до 77 лет. Средний возраст больных составил 65 лет.
У женщин было 3 наблюдения мелкоклеточного рака пищевода и 1 — крупноклеточного рака. Возраст заболевших женщин от 49 до 79 лет. Около 2/3 больных не предъявляли никаких жалоб, а другая 1/3 больных жаловались на длительно существующую изжогу и дискомфорт за грудиной, связанный с приемом пищи.
Во всех описанных наблюдениях опухоль располагалась в нижней трети пищевода и выглядела как экзофитный узел на широком основании, с гладкой серой поверхностью, в части случаев — с изъязвлением по поверхности. Микроскопически наиболее часто мы наблюдали эпителиоидный вариант нейроэндокринных опухолей, представленный относительно одноморфными овальной или округлой формы клетками, формирующими трабекулярные, розеткоподобные структуры, а также солидные поля. Веретеноклеточный вариант нейроэндокринных опухолей пищевода встречается гораздо реже, по нашим данным, не более чем в 1% случаев от всех нейроэндокринных опухолей ЖКТ. В низкодифференцированных опухолях обращают на себя внимание выраженный полиморфизм, очень высокая митотическая активность, наличие некроза, синдрома «раздавливания клеток». В каждом конкретном случае диагноз нейроэндокринной опухоли подтверждался иммуногистохимическим исследованием.
Острые эзофагиты
Морфологически выделяют следующие формы острого эзофагита: катаральный, отечный, эрозивный, псевдомембранозный, геморрагический, эксфолиативный, некротический и флегмонозный. В соответствии с размерами пораженного участка они могут быть очаговыми и диффузными
- Катаральный эзофагит
Это наиболее распространенная форма острого поражения слизистой пищевода. Она является результатом воздействия практически всех вышеназванных этиологических моментов. В качестве ее субстрата следует назвать отечность, гиперемию, лейкоцитарную инфильтрацию эзофагеальной слизистой.
Клинические проявления легких случаев катарального эзофагита складываются из ощущения саднения или жжения за грудиной во время еды. Возможна изжога. Данные симптомы выражены весьма незначительно. Нарастание тяжести процесса характеризуется их усилением, а также присоединением ретростернальных болей. Эти последние воспринимаются пациентами как режущие, жгучие, прокалывающие. Боли иррадиируют в шею, челюсть, межлопаточную область и существенно усиливаются при приеме пищи, что в ряде случаев делает его невозможным. Клиническую картину дополняют саливация, отрыжка, срыгивание слизью. Общее состояние обычно не нарушено.
У подавляющей массы больных клиническая картина катарального эзофагита самопроизвольно нивелируется спустя несколько дней от начала заболевания.
- Эрозивный эзофагит
Это заболевание является результатом эволюции предыдущей формы. Как следует из определения, морфологической его особенностью является наличие значительного числа вариабельных по размерам эрозий. Поверхность последних покрыта геморрагическим экссудатом, гноем, налетом фибрина. Эрозии могут проникать в подслизистую оболочку. Окружающая их ткань гиперемирована, отечна, инфильтрирована лейкоцитами.
Клиническая картина эрозивного эзофагита имеет много общего с симптоматикой катаральной формы, однако отличается большей выраженностью. В ряде случаев дефекты слизистой пищевода могут служить источником кровотечения, интенсивность которого бывает довольно значительной.
Прогноз эрозивного эзофагита, как правило, благоприятный. Данное заболевание самопроизвольно излечивается по устранении вызвавшей его причины. Поскольку поверхностные дефекты слизистой оболочки эпителизируются практически без образования рубцов, стенозирования пищевода обычно не наблюдается. Осложнения, к которым в первую очередь относятся массивное кровотечение и медиастинит, встречаются редко.
- Геморрагический эзофагит
Эта форма возникает при тяжелых инфекционных заболеваниях, сопровождающихся бактериемией (сыпной тиф, сепсис, грипп и др.). Характерной особенностью эти формы поражения пищевода является выраженный геморрагический фон: мелкоточечные и очаговые кровоизлияния в слизистую и подслизистую оболочки, геморрагическая экссудация. Последнее и определяет клиническую картину настоящего заболевания. Среди симптомов на первое место выходят мелена, кровавая рвота, срыгивание слизью со значительным количеством крови. Нередко может возникать профузное кровотечение из пищевода, способное в ряде случаев закончиться фатально. На этом фоне классические проявления эзофагита (дисфазия, ретростернальные боли) как бы отходят на второй план.
Острая стадия заболевания длится 5-7 дней, после чего обычно наступает излечение. В качестве осложнений следует назвать массивное кровотечение, острую постгеморрагическую анемию. Прогноз геморрагического эзофагита в значительной степени обусловлен тяжестью основного заболевания
- Псевдомембранозный эзофагит
Эта форма может иметь место в процессе течения таких заболеваний, как скарлатина, дифтерия и др., отличительной особенностью которых является наличие фибринозного экссудата. Из фибрина на внутренней поверхности пищевода формируется сероватая пленка. Она легко снимается, поскольку интимно не спаяна с подлежащими тканями. Исключение составляют лишь очень тяжелые случаи псевдомембранозного эзофагита, при которых фибринозный экссудат пропитывает также слизистую и подслизистую оболочки. В дальнейшем на месте отторгнувшихся пленок остаются длительно не рубцующиеся эрозии и изъязвления.
В клинической картине данной формы эзофагита превалируют дисфагия и интенсивная ретростернальная боль, нарастающие во время еды. Выделение пленок фибрина с рвотными массами знаменует собою начало второго этапа в развитии болезни. В это время, помимо вышеперечисленных симптомов, можно наблюдать кровохарканье.
Тяжесть течения псевдомембранозного эзофагита и его прогноз определяются основным заболеванием. Своевременное и квалифицированное лечение последнего способствует полному устранению эзофагита, однако в целом ряде случаев формируется Рубцова я стриктура пищевода.
- Эксфолиативный (перепончатый) эзофагит
Эта форма возникает в результате химического ожога слизистой органа концентрированными кислотами или едкими щелочами, а также осложнениями некоторых инфекционных заболеваний (пемфигус, оспа, сепсис).
Эксфолиативный эзофагит сопровождается образованием на внутренней поверхности пищевода многослойных фибриновых пленок, которые в отличие от предыдущей формы заболевания имеют прочную связь с подлежащими тканями. Отторжение этих пленок вызывает обширные изъязвления слизистой, являющиеся в свою очередь морфологическим субстратом эзофагеальных кровотечений различной степени выраженности.
Проявлениями данной формы эзофагита служат дисфагия, за грудинная боль и геморрагический синдром. \
Прогноз заболевания в подавляющем большинстве случаев благоприятный. В качестве осложнений следует назвать абсцесс или флегмону пищевода, перфорацию его стенки с последующим развитием гнойного медиастинита. Исходом эксфолиативного эзо-фагита может быть стриктура пищевода.
- Абсцесс пищевода
Формируется при травматизации стенки органа инородным телом. Симптоматика заболевания складывается из дисфагии и сильных болей, локализующихся чаще всего в области верхней трети пищевода или за грудиной в зоне проекции верхней трети пищевода. Признаки интоксикации выражены незначительно, может иметь место субфебрильная лихорадка.
Клинический анализ крови демонстрирует нейтрофильный лейкоцитоз со сдвигом влево, увеличение СОЭ.
При рентгенологическом исследовании удается визуализировать выступающий в просвет пищевода округлый дефект наполнения с ровными и четкими контурами диаметром от 0,5 до 4 см. Складки эзофагеальной слизистой огибают это образование, что свидетельствует об интрамуральном его расположении. Перистальтика данного участка не прослеживается.
Посредством эзофагоскопии выявляются локальные гиперемия, отек, выбухание стенки органа. Вскрытие абсцесса в полость последнего определяется по наличию густого гноя, отхождение которого усиливается в результате надавливания на гнойник кончиком эндоскопа.
Течение и прогноз эзофагеального абсцесса благоприятные. Однако если он вскрывается не в просвет пищевода, а в средостение, то неизбежно развивается гнойный медиастинит. Данное осложнение резко утяжеляет состояние больного и требует срочного хирургического вмешательства.
- Флегмона пищевода
Также является результатом травматизации его стенки инородным телом (рыбья или куриная косточка). Однако в силу недостаточности местных защитных факторов или иммунитета воспаление захватывает соседние участки, а также глубжележащие слои, вследствие чего развиваются периэзофагит и медиастинит.
Общее состояние таких больных тяжелое. Налицо признаки интоксикации. Температура тела повышена. Пациенты предъявляют жалобы на интенсивные боли загрудинной локализации или в области шеи, повышенное слюноотделение, рвоту. При осмотре обращает на себя внимание припухлость шеи. Подвижность последней ограничена по причине сильных болей. Голова несколько наклонена на здоровую сторону. Пальпаторно отмечается болезненность с одной или двух сторон.
Рентгенография пищевода демонстрирует асимметричное выпячивание одного из его контуров. Слизистая над ним истончена, перистальтика не прослеживается. Функция здоровых участков пищевода не нарушена. Эзофагоскопия позволяет выявить гиперемию, отек и припухлость эзофагеальной слизистой в месте локализации флегмоны, из которой выделяется зловонный гной. Если нагноение пищевода захватывает проксимальные его отделы, то для осмотра входа в орган используется гортанное зеркало.
При клиническом анализе крови определяются нейтрофильный лейкоцитоз со сдвигом влево, увеличение СОЭ.
Заболевание протекает тяжело. Спонтанное излечение маловероятно. Риск развития гнойного медиастинита очень велик.
- Диффузный флегмонозный эзофагит
Чаще всего обусловлен стрептококками, внедрившимися в зону ранения пищевода инородным телом. В других случаях возможно распространение гнойного воспаления на пищевод со стороны соседних органов средостения или позвоночника, что наблюдается при абсцессе корня легкого, медиастинальном лимфадените, флегмоне полости рта, злокачественной опухоли пищевода или химическом его ожоге концентрированными кислотами и едкими щелочами.
Морфологическим субстратом данного заболевания являются гнойная имбибиция эзофагеальной стенки, расплавление субму-козной основы и как следствие отслоение слизистой оболочки органа. Последняя местами некротизируется и изъязвляется. Обычно процесс разыгрывается в подслизистом слое, однако может проникать вглубь, достигая серозной оболочки.
Диффузный флегмонозный эзофагит начинается остро. Появляются дисфагия, саливация, стойкие ретростернальные боли, усиливающиеся при глотании, кашле. Интенсивность подобных болей зачастую бывает столь значительной, что пациенты стараются избегать приема воды или пищи. Присоединение рвоты может иметь следствием выделение участков отторгнувшейся эзофагеальной слизистой различных размеров.
Выраженная интоксикация приводит к нарушению общего состояния таких больных (озноб, повышение температуры тела, слабость, анорексия).
В связи с угрозой разрыва пищевода рентгенологическое исследование в острой фазе флегмонозного эзофагита не проводится. После стихания интенсивности заболевания его рентгено-семиотика характеризуется изъеденностью контуров пищевода, отсутствием складчатости слизистой. Последняя покрыта множественными язвами, на что указывают дефекты наполнения различной формы и величины. Просвет пищевода неодинаков по своей ширине и заполнен слизисто-гноиным содержимым. Стенки органа гипотоничны, перистальтика вялая или отсутствует совсем.
Прогноз заболевания серьезный. Даже своевременно начатая массивная антибактериальная терапия не всегда оказывает ожидаемый результат. Флегмонозный эзофагит дает весьма высокий процент осложнений. У таких больных описаны случаи спонтанного пневмоторакса , а также эмпиемы плевры, периэзофагита, медиастинита, медиастинального абсцесса.
Клиническая картина последнего напоминает острый сепсис. Внезапно и резко ухудшается общее состояние пациента (гнетущая слабость, озноб, гектическая лихорадка, затемнение сознания), нарастают дисфагия и ретростернальные боли. Обильное газообразование вследствие размножения анаэробной инфекции приводит к образованию подкожной эмфиземы. Процесс может давать экспансию на близлежащие органы (щитовидную железу, аорту, позвоночник, плевру, легкие, пограничный симпатический ствол) и вызывать тяжелые поражения последних.
Медиастинит и медиастинальный абсцесс, как правило, завершается летально. Наблюдаемое в редких случаях спонтанное их излечение посредством прорыва гнойника в просвет пищевода либо в бронхиальное дерево относится к области казуистики. Возможно инкапсулирование абсцесса в средостении, однако это чревато серьезными последствиями для больного. Прогноз данного заболевания неблагоприятный.
Рентгеносемиотика гнойного медиастинита характеризуется расширением тени средостения, увеличением превертебрального пространства, уменьшением подвижности трахеи при дыхании, эмфиземой средостения. Медиастинальные абсцессы диагностируются на основании наличия полости с уровнем жидкости.
В клиническом анализе крови отмечаются нейтрофильный лейкоцитоз (гиперлейкоцитоз) со сдвигом влево, токсогенная зернистость лейкоцитов, значительное увеличение СОЭ.
Отдельные случаи флегмонозного эзофагита могут сопровождаться аррозией кровеносного сосуда с развитием профузного эзо-фагеального кровотечения.
Несмотря на адекватно проведенное лечение флегмонозного эзофагита, у таких больных обычно наблюдаются остаточные дефекты в виде одной или даже нескольких рубцовых стриктур пищевода. Эти последние в дальнейшем требуют соответствующей коррекции.
- Некротический эзофагит
Это наиболее тяжелая форма острых воспалительных поражений пищевода. Он развивается у ослабленных больных в качестве осложнения некоторых инфекционных заболеваний или патологических состояний (скарлатина, корь, тиф, сепсис, оспа, кандидамикоз, агранулоцитоз, уремия и некоторые другие).
Отличительной морфологической особенностью некротического эзофагита является омертвение обширных участков слизистой пищевода, сопровождающиеся их отторжением и образованием глубоких, длительно не заживающих язв. Одновременно с этим имеет место обильная экссудация кровянистого или гнойного характера.
Клиническая картина некротического эзофагита характеризуется тем, что на фоне симптомов основного заболевания, которое поначалу определяет тяжесть состояния больного, появляются дисфагия, интенсивные загрудинные боли при глотании, рвота. Нередко в рвотных массах обнаруживаются фрагменты некроти-зированной эзофагеальнои слизистой. В качестве осложнений данной формы острых эзофагитов следует назвать профузное кровотечение, перфорацию пищеводной стенки с развитием гнойного медиастинита или медиастинального абсцесса.
Прогноз некротического эзофагита крайне серьезный. Излечение почти во всех случаях сопровождается рубцовым стенозированием пищевода.
Опухоль Абрикосова
Зернисто-клеточная опухоль, или опухоль Абрикосова, в качестве самостоятельной нозологической единицы выделена А.И. Абрикосовым в 1925 г. в докладе на Всероссийском съезде патологоанатомов в Москве. Он же в 1931 г. впервые диагностировал поражение гортани, пищевода и отметил возможность злокачественного перерождения.
Зернисто-клеточная опухоль ранее включалась в группу миогенных опухолей на основании некоторого морфологического сходства ее клеточных элементов с эмбриональными мышечными клетками. В дальнейшем появился ряд работ, на основании результатов которых высказана гипотеза, что зернистые клетки опухоли скорее всего берут свое начало из оболочки нерва, а не из мышц. J. Garancis в 1970 г. предположил, что зернистые клетки представляют собой разновидность шванновских клеток. Происхождение опухоли из шванновских клеток было также подтверждено и другими авторами, обнаружившими в клетках опухолей экспрессию протеина основного миелина (S100) и других протеинов миелиновых волокон периферических нервов; мышечные же белки, напротив, при этом выявлялись не всегда [10, 11].
Чаще всего опухоль Абрикосова встречается у взрослых 30—60 лет, причем пик заболевания приходится на 39 лет. Женщины поражаются в три раза чаще, чем мужчины. Опухоли Абрикосова у детей казуистически редки [10]. Зернисто-клеточная опухоль наиболее часто поражает кожу, слизистую оболочку полости рта [11, 12]. Как правило, эти опухоли представляют собой единичные поражения, однако в 10% случаев встречаются и множественные поражения, которые могу быть синхронными и метахронными. Желудочно-кишечный тракт поражается редко, всего в 6—10% случаев, однако в большинстве случаев (30—60%) опухоль обнаруживалась в пищеводе [13].
В 65% случаев опухоль локализуется в нижней трети пищевода. Средняя и проксимальная треть пищевода поражаются в 20 и 15% случаев соответственно. Клинические проявления зернисто-клеточной опухоли пищевода не имеют каких-либо специфических черт, но имеют прямую взаимосвязь с размером опухолевого узла. Так, опухоли, не достигающие размеров 10 мм, могут протекать бессимптомно и быть случайной находкой при обследовании пациента по поводу другой патологии ЖКТ [14]. При увеличении опухоли более 10—20 мм больные обычно жалуются на дисфагию, загрудинные боли.
Макроскопически опухоль имеет вид одиночного опухолевого узла плотной консистенции, располагающегося в субмукозном слое стенки пищевода. На разрезе опухоль желтовато-серого цвета, с инфильтративным типом роста. В процесс вовлекается слизистая оболочка. Следует обратить особое внимание на то, что опухоль в большинстве случаев является доброкачественной, несмотря на инфильтративный тип роста. Злокачественные варианты встречаются крайне редко.
При микроскопическом исследовании опухоль представлена полигональными эпителиоподобными и вытянутыми веретенообразными клетками с обильной эозинофильной гранулярной цитоплазмой, содержащей фаголизосомы. Клетки содержат центрально расположенные, мелкие пикнотичные ядра (рис. 3).
Рис. 3. Опухоль Абрикосова. Рис. 3. Опухоль Абрикосова.
Иммуногистохимическое исследование играет немаловажную роль в постановке диагноза зернисто-клеточной опухоли. В соответствии с нейрогенным происхождением опухоль Абрикосова дает положительную реакцию с кислотой Шифа (ШИК-реакция), экспрессирует S100, нестин, CD-68 и не экспрессирует гладкомышечный актин, десмин, CD-117, CD-34 [13]. Согласно последним исследованиям, рекомендуется дополнительно использовать Ki-67 для классификации опухоли как доброкачественной, атипичной или злокачественной.
Злокачественные зернисто-клеточные опухоли, как уже было сказано выше, крайне редки. По данным мировой литературы, они встречаются всего в 1—2% всех случаев зернисто-клеточных опухолей. Тем не менее выявление признаков злокачественности важно из-за потенциально агрессивного поведения этих опухолей и плохого прогноза, связанного с метастатическим поражением.
В 1998 г. Fanburg-Smith и соавт. предложили 6 гистологических критериев для выделения доброкачественных и атипичных или злокачественных зернистоклеточных опухолей. Эти гистологические критерии определяются следующими характеристиками: повышенное ядерно-цитоплазматическое соотношение, ядерный полиморфизм, наличие везикулярных ядер с заметными ядрышками, некроз опухоли, веретеноклеточное строение и повышенная митотическая активность. Опухоли с сочетанием 3 и более из указанных критериев следует относить к злокачественным, в то время как опухоли с 1—2 критериями классифицируются как атипичные. Опухоли, не удовлетворяющие ни одному из предложенных критериев, являются доброкачественными.
Эндоскопическая резекция считается безопасным и эффективным вариантом лечения зернисто-клеточной опухоли пищевода. Рецидивы заболевания при условии радикального удаления встречаются крайне редко. Атипичные и злокачественные варианты опухоли Абрикосова имеют худший прогноз и требуют более тщательного обследования и наблюдения пациента.
Мы наблюдали зернисто-клеточную опухоль пищевода у мужчины 46 лет.
В течение года больной отмечал появление дискомфорта и болей за грудиной после приема пищи, в связи с чем обратился к гастроэнтерологу по месту жительства. По результатам ЭГДС-исследования выявлено образование в нижнегрудном отделе пищевода диаметром до 0,5 см.
В течение последующих 5 лет регулярно наблюдался. При очередном контрольном ЭГДС-исследовании образование в пищеводе увеличилось в диаметре до 2 см. Самостоятельно обратился в наш институт.
По результатам обследования в МНИОИ им. П.А. Герцена, при КТ органов грудной полости — в ретроперикардиальном сегменте пищевода, по правой стенке, определяется полиповидное образование, размером 1,6×1,5 см, пролабирующее в просвет пищевода, инфильтрирующее все слои его стенки. Эндоскопически и эндосонографически — картина неэпителиальной опухоли нижнегрудного отдела пищевода с признаками инвазии подслизистого слоя, увеличение параэзофагеальных лимфатических узлов неясного генеза.
Выполнена лапароскопическая резекция пищевода. Макроскопически в пищеводе в 34 см от резцов на передней стенке визуализируется подслизистая опухоль, умеренно подвижная, плотная, размером до 2 см, слизистая оболочка над ней разрыхлена, гиперемирована.
При гистологическом исследовании с учетом иммуногистохимического исследования был поставлен диагноз зернистоклеточной опухоли (опухоль Абрикосова).
Течение послеоперационного периода без осложнений.
Выписан в удовлетворительном состоянии под наблюдение онколога, хирурга по месту жительства. При контрольном обследовании спустя 3 и 6 мес — без признаков рецидива.
Причины возникновения заболевания
Грибок рода Кандида как причина кандидозного эзофагита
Как мы уже говорили, причины возникновения данного заболевания могут быть самые различные. Грибок кандидозного эзофагита может функционировать практически на всех тканях человеческого организма. Одной из самых распространенных причин является нарушение деятельности желудочно-кишечного тракта организма, точнее, его тканевой составляющей.
В большинстве случаев это происходит после длительного лечения антибиотиками, которые убивают практически все бактерии, тем самым создавая благоприятные условия для развития кандидоза на слизистой оболочке пищевода.
Также есть большая вероятность развития кандидозного эзофагите у тех, кто страдает алкогольной зависимостью или просто очень часто принимает алкоголь. Под риск этого заболевания попадают и те, кто часто принимает гормональные средства, а в частности, противозачаточные.
Как видите, в большинстве случаев кандидозный эзофагит возникает вследствие приема определенных лекарств (антибиотики, противозачаточные). Это не значит, что нужно отказаться от приема этих препаратов, просто быть осторожными и не увлекаться ими. Если есть возможность заменить антибиотики на другое средство, то лучше сделайте это.
Если вы можете обойтись без противозачаточных таблеток и выбрать другую защиту, то также сделайте это. В любом случае это далеко не весь перечень причин возникновения этого заболевания, так как они могут быть самыми разнообразными и зачастую эту болезнь даже не предугадаешь.
ГИСО пищевода
Гастроинтестинальные стромальные опухоли (ГИСО) являются наиболее распространенными мезенхимальными опухолями желудочно-кишечного тракта. По данным разных авторов [15], они составляют от 0,1 до 3% от всех злокачественных новообразований ЖКТ и могут локализоваться в любом его отделе — от пищевода до ануса, однако чаще всего эти опухоли встречаются в желудке (50—60%) и в тонкой кишке (30—40%).
В 1998 г. L. Kindblom и соавт. установили, что GIST развивается из интерстициальных клеток Кахаля, формирующих сеть в мышечной оболочке стенки ЖКТ и регулирующих его вегетативную двигательную активность, т. е. являются пейсмекерными клетками, обеспечивающими связь между гладкомышечными клетками и нервными окончаниями [16, 17]. В настоящее время к ГИСО относят мезенхимальные опухоли, в клетках которых отмечается положительная иммуногистохимическая реакция на CD-117 и CD-34, DOG-1.
ГИСО развиваются у лиц старше 40 лет и не имеют гендерной предрасположенности. Средний возраст больных 55—65 лет. До 40 лет эти опухоли обнаруживаются крайне редко. Все ГИСО считаются потенциально злокачественными. В ходе проведенных исследований показано, что ни пол, ни первичная локализация опухоли не влияют на уровень общей выживаемости [16].
Первичные ГИСО пищевода крайне редки и составляют менее 1% всех ГИСО. В литературе [18] упоминания о первичной ГИСО пищевода очень ограниченны: в основном это описания конкретных клинических случаев. Редкость этого заболевания является основным препятствием для всестороннего изучения ГИСО пищеводной локализации и его правильной диагностики.
В МНИОИ им. П.А. Герцена за период с 2000 по 2022 г. мы наблюдали 7 пациентов, среди которых преобладали лица мужского пола (4 наблюдения) в возрасте от 39 до 65 лет; у женщин — 3 ГИСО, возраст от 54 до 74 лет. Средний возраст больных составил 59 лет.
Клиническая картина ГИСО пищевода зависит от локализации и размеров опухоли. Чаще всего опухоли локализуются в дистальной части пищевода, нередко вовлекая эзофагогастросоединение. Небольшие образования чаще всего не дают клинических симптомов и являются случайными находками при проведении эндоскопических исследований или могут быть выявлены при обычном рентгенологическом исследовании органов грудной полости. В запущенной стадии заболевания основной жалобой больных, при локализации опухоли в пищеводе, является расстройство глотания. Часто у больных с ГИСО пищевода наблюдаются боль в эпигастрии, анемия и связанная с ней повышенная утомляемость.
ГИСО пищевода выглядит как подслизистый интрамуральный узел, как правило, с четкими внешними контурами, однако нередко над ним обнаруживается изъязвление слизистой (20—30%). Более крупные опухоли могут подвергаться массивному некрозу, оставляя лишь узкий ободок жизнеспособной ткани по периферии узла, возможно образование кист [19].
Гистологически ГИСО пищевода могут напоминать гладкомышечные опухоли этой же локализации. В связи с этим в первую очередь необходимо дифференцировать ГИСО и лейомиому пищевода (табл. 1).
Таблица 1. Дифференциальная диагностика лейомиомы и ГИСО пищевода
В подавляющем большинстве случаев ГИСО пищевода с умеренной клеточностью имеют веретеноклеточный тип строения, со слабым или умеренным полиморфизмом. Могут обнаруживаться участки с палисадообразным расположением ядер, напоминающие опухоли из оболочек периферических нервов (рис. 4).
Рис. 4. ГИСО пищевода. Рис. 4. ГИСО пищевода.
Эпителиоидное строение опухоли в пищеводе встречается реже, чем веретеноклеточное, и более характерно для локализации опухоли в области пищеводно-желудочного перехода. Ранее этот тип опухоли обозначался как лейомиобластома или эпителиоидная лейомиосаркома.
Как уже оговаривалось ранее, все ГИСО позитивны на CD-117 и 70—80% из них дают положительную реакцию на CD-34, DOG-1, 30–40% опухолей могут быть очагово или диффузно позитивны на SMA20. Количество опухолей экспрессирующих десмин и S100, не превышает 5% от числа всех ГИСО. Также рекомендуется использовать маркер пролиферативной активности Ki-67.
Оценка риска агрессивного показателя опухоли основана на таких показателях, как митотическая активность и размер опухоли (табл. 2).
Таблица 2. Риск агрессивного поведения ГИСО Опухоли размером менее 5 см с низкой митотической активностью (менее 5 фигур митоза в 50 полях зрения, ×400) рассматриваются как условно доброкачественные, с низким и очень низким риском злокачественного течения процесса. Опухоли более 5 см, но с менее чем 5 митозами в 50 полях зрения, относят к опухолям с неопределенным злокачественным потенциалом и средним риском агрессивного поведения. Большие опухоли (более 10 см в диаметре) без митотической активности, либо опухоли малых размеров, но с высокой митотической активностью (более 10 митозов в 50 полях зрения, ×400), считаются злокачественными и сопряжены с высоким риском метастазирования и местных рецидивов.
Пятилетняя выживаемость больных после хирургического лечения варьирует от 35 до 65%; медиана выживаемости — 40%.
В случае рецидива заболевания или при первичном диагностировании диссеминированного/неоперабельного процесса медиана выживаемости не превышает 10—20 мес. Хирургическое удаление рецидивных образований в целом не приводит к улучшению выживаемости больных.
Кандидоз пищевода: диагностика и современный выбор лечения
Оппортунистические инфекции, включая микозы органов пищеварения, представляют собой актуальную проблему современной гастроэнтерологии. Диагностика и лечение кандидоза пищевода в ряде случаев сопряжены с определенными трудностями.
Дрожжеподобные грибы рода Candida — одноклеточные микроорганизмы размерами 6–10 мкм. Эти дрожжи диморфны: в различных условиях они образуют бластоспоры (клетки-почки) и псевдомицелий (нити удлиненных клеток). Эта морфологическая особенность имеет, как будет показано ниже, важное клиническое значение.
Дрожжи рода Candida широко распространены в окружающей среде. Жизнеспособные клетки Candida spp. могут быть обнаружены в почве, питьевой воде, пищевых продуктах, на коже и слизистых оболочках человека и животных. Таким образом, контакт «открытых систем» индивида (кожи и слизистых оболочек) с этими грибами можно охарактеризовать как ординарный факт.
Исход контакта с дрожжеподобными грибами рода Candida обусловлен состоянием системы антифунгальной резистентности индивида. В большинстве случаев такой контакт формирует транзиторное кандидоносительство, когда структуры и механизмы антифунгальной резистентности обеспечивают деконтаминацию макроорганизма. В то же время у лиц с нарушениями в системе антифунгальной резистентности контакт может сформировать как персистирующее носительство, так и кандидоз. Таким образом, кандидоз пищеварительного тракта имеет типичные черты оппортунистический инфекции.
Заболевание кандидозом пищевода предопределено наличием факторов патогенности Candida spp. В частности, клетки гриба могут прикрепляться к эпителиоцитам (адгезия), а затем через трансформацию в нитевидную форму (псевдомицелий) внедряться в слизистую оболочку и даже «закрытые» системы (инвазия) и вызывать некроз тканей макроорганизма за счет секреции аспартилпротеиназ и фосфолипаз [1]. Перечисленным факторам патогенности естественным образом противостоят многочисленные факторы антифунгальной резистентности. В частности, большое значение имеет целостность слизистой оболочки пищеварительного тракта и мукополисахариды слизи. Защитная роль отводится антагонизму дрожжеподобных грибов и облигатных бактерий пищеварительного тракта, активности пищеварительных ферментов и фунгистатического действия неспецифических гуморальных факторов, таких как лизоцим, комплемент, секреторный IgA, трансферрин, лактоферин и др.
Однако решающее значение в системе антифунгальной резистентности имеет функция клеток фагоцитарного ряда — полиморфноядерных лейкоцитов, в первую очередь, и, в меньшей степени, мононуклеарных фагоцитов и естественных киллеров. Специфический антифунгальный гуморальный ответ реализуется за счет синтеза В-клетками специфических противокандидозных антител классов IgA, IgM, IgG и в определенной степени IgE. Наконец, сложная кооперация дендритных клеток, Т-хелперов 1 и 2 типа, а также Т-регуляторных клеток обеспечивает адекватный специфический клеточный иммунный ответ.
Дефекты в описанной выше системе антифунгальной резистентности являются факторами, способствующими возникновению кандидоза, или так называемыми факторами риска. Группы риска по развитию кандидоза пищеварительного тракта представлены ниже.
- Физиологические иммунодефициты (ранний детский период, старческий возраст, беременность).
- Генетически детерминированные (первичные) иммунодефициты.
- СПИД.
- Онкологические заболевания, особенно на фоне лучевой и химиотерапии.
- Аллергические и аутоиммунные болезни, особенно на фоне лечения глюкокортикостероидами.
- Заболевания эндокринной системы, в первую очередь сахарный диабет, аутоиммунный полиэндокринный синдром, гипотиреоз, ожирение и др.
- Дисбиоз слизистых оболочек на фоне антибиотикотерапии.
- Хронические «истощающие» заболевания.
- Нарушения нутритивного статуса.
- Трансплантация органов и тканей.
В указанных группах кандидоз выявляют чаще обычного. Отметим, что иногда причину нарушения антифунгальной резистентности определить не удается.
Патогенез кандидоза пищеварительного тракта характеризуется последовательным прохождением грибами следующих этапов — адгезии, инвазии, кандидемии и висцеральных поражений. На первом этапе дрожжи адгезируются к эпителиоцитам какого-либо участка слизистой оболочки. В дальнейшем дефекты в системе резистентности позволяют дрожжам через трансформацию в псевдомицелий внедряться (инвазироваться) в слизистую оболочку и подлежащие ткани. Цитопения — решающий фактор, который позволяет инвазирующим грибам достигать стенки сосудов, разрушать ее и циркулировать в сосудистом русле. Такой этап называют кандидемией. В отсутствие адекватной терапии кандидемия приводит к образованию очагов инвазивного кандидоза в висцеральных органах, например, печени, легких, центральной нервной системе и др.
Парадоксально, но внедрение грибов рода Candida чаще наблюдается в участках, представленных многослойным эпителием (полость рта, пищевод) и значительно реже в однослойный эпителий (желудок, кишечник).
На практике клиницисту приходится сталкиваться преимущественно с кандидоносительством, частота которого у здоровых лиц достигает в полости рта 25%, а в кишечнике — до 65–80%.
Объем обследования при кандидозе органов пищеварения включает изучение анамнеза и клинической картины, оценку рутинных клинических тестов, эндоскопические исследования, микологические (культуральные, морфологические и серологические) и иммунологические тесты.
Кандидоз пищевода встречается у больных общего профиля в 1–2% случаев, у больных сахарным диабетом 1 типа — в 5–10% случаев, у больных СПИДом — в 15–30% случаев. В то же время, по сообщению Yoo S.S. и соавт., при эндоскопическом исследовании 6683 практически здоровых лиц у 0,25% выявлен кандидоз пищевода. Среди местных факторов риска называют ожог, ахалазию, дивертикулез, полипоз пищевода. Характерными жалобами являются дисфагия, одинофагия, ретростернальный дискомфорт, однако встречается и латентное течение. Симптомы кандидоза пищевода могут нарушить акт глотания, что в свою очередь приводит к нарушению питания и значительному снижению качества жизни.
Показаниями для эндоскопического исследования с целью исключения кандидоза пищевода является: группа риска, клинические признаки эзофагита и верифицированный кандидоз других локализаций (например, орофарингеальный, кандидоз урогенитальной системы, диссеминированный кандидоз).
Эндоскопические признаки кандидоза пищевода — гиперемия и контактная ранимость слизистой оболочки, а также фибринозные налеты различной локализации, конфигурации и размеров. Среди всего разнообразия визуальных признаков кандидоза пищевода можно выделить три группы типичных изменений:
- Катаральный эзофагит. Наблюдают диффузную гиперемию различной степени (от слабовыраженной до яркой) и умеренный отек слизистой оболочки. Характерным эндоскопическим признаком является контактная кровоточивость слизистой оболочки, иногда — с образованием нежного, белесоватого («паутинообразного») налета на слизистой оболочке. Эрозивных изменений не отмечают.
- Фибринозный (псевдомембранозный) эзофагит. Наблюдают бело-серые или бело-желтые рыхлые налеты в виде округлых бляшек диаметром от 1 до 5 мм, выступающие над ярко гиперемированной и отечной слизистой оболочкой. Контактная ранимость и гиперемия слизистой оболочки заметно выражены.
- Фибринозно-эрозивный эзофагит. Характерно наличие грязно-серых «бахромчатых» налетов в виде «лент», расположенных на гребне продольных складок пищевода. При инструментальном отделении таких налетов обнажается эрозированная слизистая оболочка. Эрозии могут быть округлой или линейной формы, размерами чаще от 0,1 до 0,4 см в диаметре. Слизистая оболочка пищевода крайне ранима, отечна и гиперемирована. Выраженные изменения слизистой оболочки иногда препятствуют полноценному эндоскопическому осмотру пищевода (кровотечение, боль и беспокойство пациента, стеноз пищевода, вызванный отеком) [2].
Напомним, что схожие эндоскопические изменения могут наблюдаться при рефлюкс-эзофагите, пищеводе Барретта, герпес-эзофагите, плоских лейкоплакиях, красном плоском лишае, ожоге или опухоли пищевода. Поэтому диагностика кандидоза пищевода основана на эндоскопическом исследовании и лабораторном изучении биопсийных материалов из пораженных участков. Необходимо учитывать, что при однократной биопсии чувствительность лабораторных методов недостаточна.
«Стандарт» диагностики кандидоза слизистых оболочек — обнаружение псевдомицелия Candida spp. при морфологическом исследовании.
С целью обнаружения псевдомицелия используют морфологические микологические методы: цитологический — с окраской мазков по Романовскому–Гимза, и гистологический — с окраской биоптатов ШИК-реакцией. Таким образом, учет диморфности Candida spp. является ключом к дифференциальному диагнозу между кандидозом и кандидоносительством. В современных условиях клиницист должен требовать от морфолога точного описания морфологических структур гриба, ведь обнаружение отдельных дрожжевых клеток, как правило, свидетельствует о кандидоносительстве, а обнаружение псевдомицелия позволяет подтвердить диагноз кандидоза.
К недостатку морфологических методов можно отнести их ограниченную чувствительность при эндоскопической биопсии. Известно, что биопсионные щипцы позволяют получить для изучения миниатюрный фрагмент ткани, и вероятность обнаружения информативного признака при однократной биопсии недостаточна.
Культуральный микологический метод основан на посеве биоматериалов слизистых оболочек на среду Сабуро. Преимущество данного метода — в возможности видовой идентификации грибов рода Candida и тестирования культуры на чувствительность к антимикотикам. Актуальность таких исследований обусловлена тем, что различные виды Candida, в частности C. albicans, C. tropicalis, C. parapsilosis, C. krusei, C. glabrata и др. имеют различную чувствительность к современным антимикотическим препаратам. Недостаток культурального метода — в невозможности дифференцировать кандидоносительство и кандидоз при исследовании материалов «открытых систем», поскольку слизистые оболочки и в норме могут быть контаминированы колониеобразующими единицами Candida spp.
Культуральное исследование биоматериалов слизистых оболочек с определением вида возбудителя становится строго необходимым при рецидивирующем течении кандидоза или резистентности к стандартной антимикотической терапии.
Чувствительность и специфичность серологических тестов диагностики кандидоза пищевода (иммуноферментный анализ с антигеном Candida, уровень специфического IgE, тест латекс-агглютинации Platelia) пока не достигли требуемой точности и в практике применяются редко.
Кандидоз пищевода, даже протекающий субклинически, опасен своими осложнениями — стриктурой, кровотечением, перфорацией и диссеминацией микотического поражения.
Рентгенографический метод при кандидозе органов пищеварения малоинформативен, так как не уточняет этиологии процесса, но при развитии осложнений (например, стриктура, язва, перфорация) приобретает решающее значение.
Развитие стриктуры пищевода отмечают у 8–9% пациентов с кандидозным эзофагитом. Чаще они локализованы в верхней или средней трети грудного отдела пищевода и вызывают перманентную дисфагию. Другим частым осложнением кандидоза верхних отделов органов пищеварения является кровотечение, вызванное контактной ранимостью слизистой оболочки. Такое хроническое малоинтенсивное кровотечение приводит к анемии, а у пациентов с цитопенией кровотечение может развиваться стремительно (нередко наблюдается рвота алой кровью и псевдомембранозными массами) и приводить к серьезной потери крови. Клиническая картина перфорации пищевода характеризуется, кроме интенсивного болевого синдрома, развитием пневмомедиастинума и подкожной эмфиземы в области шеи.
В план ведения пациентов с кандидозом пищевода необходимо включить диагностику и коррекцию фоновых заболеваний, других очагов кандидозной инфекции, рациональную антифунгальную терапию и иммунокоррекцию. В клинике НИИ медицинской микологии СПбМАПО у пациента с кандидозом пищевода проводится уточнение фармакологического анамнеза, клинический анализ крови, анализ крови «Комбибест ВИЧ-1, 2 Аг/Ат», анализ крови на гликозилированный гемоглобин. Также необходимо исключение наиболее часто встречающихся злокачественных опухолей и в связи с этим — рентгенография легких, фиброколоноскопия, дополнительно для мужчин — УЗИ предстательной железы, дополнительно для женщин — УЗИ молочных желез и малого таза с консультацией гинеколога.
Лечение кандидоза пищевода основано на применении антифунгальных препаратов. Общий принцип действия всех антифунгальных средств — угнетение биосинтеза эргостерина клеточной стенки дрожжей. Антифунгальные средства, используемые для лечения кандидоза в целом, можно разделить на три группы. Первая группа — полиеновые антимикотики, практически нерезорбируемые при приеме per os. К ним относят амфотерицин В, нистатин и натамицин. Вторая группа — азольные антимикотики, относительно хорошо резорбируемые при приеме per os. К ним относятся: кетоконазол, флуконазол, итраконазол, вориконазол, позаконазол. Третья группа — эхинокандины: каспофунгин, анидулафунгин, микафунгин.
Цель лечения кандидоза слизистых оболочек верхних отделов пищеварительного тракта — устранение симптомов и клинико-лабораторных признаков заболевания, а также предотвращение рецидивов.
Нужно подчеркнуть, что при кандидозе пищевода местная терапия неэффективна. У больных с выраженной одинодисфагией, которые не способны глотать, должна использоваться парентеральная терапия.
Препаратом выбора для лечения кандидоза пищевода является флуконазол 100–200 мг/сут, назначаемый перорально или внутривенно в течение 2–4 нед. Подчеркнем, что как средство лечения кандидоза пищевода флуконазол превосходит по эффективности и кетоконазол, и итраконазол в капсулах из-за непостоянной абсорбции последних.
Лишь в случаях непереносимости флуконазола или резистентности возбудителя (чаще это C. krusei, C. glabrata, C. pseudotropicalis) показаны препараты второй линии (также в течение 2–4 недель ). Препаратами второй линии при кандидозе пищевода являются:
- 1)итраконазол в растворе для перорального применения 200–400 мг/сут;
- 2)кетоконазол 200–400 мг/сут;
- 3)амфотерицин В 0,3–0,7 мг/кг/сут;
- 4)каспофунгин внутривенно 70 мг/сут в первый день, а затем 50 мг/сут внутривенно в одно введение;
- 5)вориконазол внутривенно 6 мг/кг/сут каждые 12 часов в первый день, а затем 4 мг/кг/сут каждые 12 часов;
- 6)позаконазол по 400 мг (10 мл суспензии) 2 раза в день внутрь во время еды.
Необходимо добавить, что применение нерезорбируемых антимикотиков (нистатин, натамицин) неэффективно.
Несмотря на высокую эффективность флуконазола у пациентов с сохраняющимся иммунодефицитным состоянием высока вероятность рецидивов кандидоза пищевода. Необходимо помнить, что безрецидивного течения кандидоза можно достичь только у больных с полной коррекцией фонового состояния. Так, например, при СПИДе рецидивы кандидоза прекращаются только при успешной антиретровирусной терапии, обеспечивающей снижение вирусной нагрузки и увеличение числа CD4-лимфоцитов.
Для предотвращении рецидивов может быть эффективна длительная поддерживающая терапия флуконазолом (100мг/день) или назначение дозы флуконазола 200 мг еженедельно.
Литература
- Елинов Н.П. Химическая микробиология. М.: Высшая школа, 1989. С.349–365.
- 2.Шевяков М. А. Кандидоз слизистых оболочек пищеварительного тракта (лекция) // Проблемы медицинской микологии. 2000. Т.2, №2. С. 6–10.
- 3.Yoo S.S., Lee W.H., Ha J., Choi S., Kim H.J., Kim T.H., Lee O.J. Prevalence of esophageal disorders in the subjects examined for health screening // Korean J. Gastroenterol. 2007, Nov. 50 (5): 306–312.
- 4.Климко Н.Н. и др. Проект рекомендаций по лечению кандидоза // Проблемы медицинской микологии. 2001. Том 3, №3. С.12–25.
- 5.Шевяков М.А., Климко Н.Н., Антонов В.Б., Иншаков Л.Н., Колб З.К. Диагностика кандидоза пищевода // Проблемы медицинской микологии. 1999. Т.1, №4. С. 14–18.
- 6.Шевяков М.А., Антонов В.Б., Загорская Е.А. Стриктуры пищевода кандидозной этиологии // Вестник хирургии им. И.И.Грекова. 1991, № 3. С.39–41.
- 7.Pappas P.G., Rex J.H., Sobel J.D., Filler S.G., Dismukes W.E., Walsh T.J., Edwards J.E. Practical guyde of candidiasis treatment // Clinical Infection Diseases. 2004. Vol. 38. P. 161–189.
- 8.Gilbert D.N., Moellering R.C., Sande M.A. The Sandford Guide to antimicrobial therapy, Thirty-first edition, 2001. P 71.
- 9.Kalogeropoulos N.K., Whitehead R. Campylobacter-like organisms and Candida in peptic ulcers and similar lesions of the upper gastrointestinal tract: astudy of 247 cases // J. Clin. Pathol. 1988. Vol. 41. №10. P. 1093–1098.
- 10.Шевяков М.А., Колб З.К., Борзова Ю.В. Рецидивирующий кандидоз пищевода у ВИЧ-неинфицированных больных. (Тезисы докладов 7-х Кашкинских чтений) // Проблемы медицинской микологии. 2004, Т.6. №2, С.131.
- 11.Laine L. Thenatural history of esophageal candidiasis after successful treatment in patients with AIDS // Gastroenterology. 1994, Vol.107, №3. P.744–746.
- 12.Parente F. et al. Prevention of symptomatic recurrences of esophageal candidiasis in AIDS patient after the first episode: a prospective open study // American Journal of Gastroenterology. 1994. Vol. 89. №3. P.416–420.
М.А. Шевяков, доктор медицинских наук, профессор СПбМАПО, Санкт-Петербург