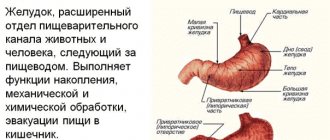
Введение
Гетеротопия, т. е. атипичная локализация, слизистой оболочки желудка (СОЖ) может встречаться в любом отделе желудочно-кишечного тракта (ЖКТ), включая прямую кишку и желчный пузырь. Гетеротопия СОЖ в верхние отделы пищевода, которая в англоязычной литературе известна под термином «inlet patch», представляет собой островок эктопической слизистой, характерной для желудка, в проксимальном отделе пищевода на уровне верхнего пищеводного сфинктера или дистальнее на несколько сантиметров (рис. 1, 2) [1]. В редких случаях локусы гетеротопии встречаются во всех отделах пищевода [2, 3].
Впервые случай обнаружения в верхнем отделе пищевода желез, содержащих париетальные клетки, описан в 1805 г. патологом Schmidt [1]. Благодаря развитию эндоскопических технологий представление о данной проблеме в настоящее время значительно расширено, однако многие вопросы до сих пор остаются малоизученными. В частности, исследователи значительно расходятся во мнениях о частоте «inlet patch». Так, по данным аутопсий гетеротопия СОЖ в проксимальном отделе пищевода встречается в 0,7–70% случаев [1], по данным эндоскопического исследования частота также колеблется в широких пределах и составляет от 0,1% до 14,5% [4–6].
Сведения об особенностях развития эзофагеальной гетеротопии СОЖ в зависимости от возраста и пола неоднозначны. H. Takeji et al. [1] считают, что с возрастом поражение может регрессировать, и отмечают его большую частоту у лиц мужского пола. Работы других исследователей не демонстрируют существенных возрастно-гендерных различий [7].
Патогенез и патоморфология
Патогенез гетеротопии СОЖ в верхнюю треть пищевода неизвестен. Предложено три гипотезы развития данной патологии. Большинство авторов придерживаются мнения о врожденном происхождении «inlet patch» [8, 9]. На 11-й неделе эмбриогенеза цилиндрический эпителий замещается многослойным плоским, распространяясь в дистальном и проксимальном направлениях со средней части пищевода, при этом проксимальный участок пищевода подвергается трансформации последним [8]. Данную теорию подтверждают следующие факты: во‑первых, при иммуногистохимическом анализе показано, что в локусах гетеротопии имеются клетки, характерные для СОЖ эмбриона [8, 10]; во‑вторых, распространенность гетеротопии СОЖ в верхнюю треть пищевода не увеличивается с возрастом, а, по некоторым данным, чаще встречается у детей [8].
Другая теория предполагает приобретенный характер метапластической трансформации плоскоклеточного эпителия вследствие хронического кислотного воздействия при гастроэзофагеальном рефлюксе, аналогично развитию пищевода Барретта [11].
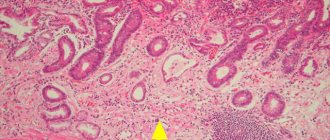
В качестве еще одного варианта происхождения гетеротопии СОЖ рассматривается разрыв ретенционных кист желез эпителия проксимального отдела пищевода (рис. 3, 4) [12].
Чаще всего эпителий в эктопированном локусе соответствует фундальному и кардиальному гистологическому типам, реже — антральному (рис. 5). В исследовании U. Peitz et al. [6] было отмечено, что кардиальный тип эпителия характерен для небольших гетеротопий, в то время как фундальный тип чаще встречается в гетеротопиях крупного размера. Существенным является то, что «inlet patch» при наличии париетальных клеток может продуцировать некоторое количество кислоты (рис. 6) [13]. Следует отметить, что анатомическая близость к слизистой оболочке гортани и ее высокая чувствительность к кислотному повреждению, даже при слабокислой секреции, могут приводить к появлению симптомов. Кроме того, как было показано, продукция слизи даже в отсутствие кислоты индуцирует ларингофарингеальные симптомы [14]. Гиперацидность также может индуцировать хроническое воспаление и ульцерацию слизистой пищевода, расположенной вокруг участка эктопированной СОЖ, и являться редкой причиной развития стриктур. Морфологически «inlet patch» часто ассоциирован с воспалительной инфильтрацией гранулоцитами и плазматическими клетками. Другие гистологические изменения включают атрофию, метаплазию, дисплазию и аденокарциному [8]. В 2004 г. B.H. von Rahden была предложена классификация, позволившая структурировать морфологические и клинические проявления гетеротопии СОЖ (табл. 1) [2].
Участки гетеротопии могут быть колонизированы Helicobacter pylori
(Нр) [4]. Распространенность хеликобактериоза в очагах эктопированной в пищевод СОЖ достигает 82% [11]. Показатели инфицированности, вероятно, коррелируют с распространенностью инфекции Нр в общей популяции. Хотя роль Нр в данной ситуации остается неясной, можно предположить, что он может вызывать изменения, подобные тем, которые наблюдаются в желудке: атрофию, метаплазию, дисплазию и карциному [8].
Диагностика пищевода Барретта
Способ оценки барьерной функции клапанов полых органов в абдоминальной хирургии
Пищевод Барретта диагностируется при эндоскопическом исследовании пищевода и желудка. Исследование проводится на видеоэзофагогастроскопе с NBI или хромоскопией с взятием биопсии, не менее, чем из 4 участков. Препараты подвергаются гистологическому или иммуногистохимическому исследованию. При этом визуально в нижней трети пищевода определяются изменения слизистой с яркой красной окраской как «языки пламени».
Высота изменений слизистой (протяженность пищевода Барретта) может быть трех типов: короткая – когда длина пораженного участка менее 3 см, средняя – 3-5 см и длинная – более 5 см. Очень важно понимать степень и вид диспластических изменений в измененной слизистой (классификация Р.Х. Риддела (1983)).
Стоит заострить внимание, что для осмотра такой деликатной зоны как нижняя треть пищевода и кардиальный отдел желудка, оценки состояния области гастроэзофагеального перехода и функции нижнего пищеводного сфинктера необходимо спокойное состояние пациента и отсутствие антиперистальтических сокращений из-за рвотного рефлекса. Как говорят многие авторы, необходим полный «внутрипросветный штиль на палубе корабля, когда в океане шторм». Поэтому использование короткой внутривенной седации облегчает пациенту перенос процедуры и дает врачу более точно выставить диагноз. В условиях нашей клиники мы предлагаем пациентам видеофиброскопию с использованием амбулаторных анестетиков производства США.
В последние годы гистологи стали отмечать, что материал, взятый из одного участка пищевода Барретта, может соответствовать различным видам дисплазии: кишечная метаплазия, желудочная метаплазия или кардиальный тип метаплазии. Таким образом, в одном участке пищевода может встречаться два или три типа эпителия. Это происходит в результате патологического рефлюкса агрессивного содержимого желудка в пищевод (желчи или кислоты) и последовательной перестройки пищеводного эпителия сначала в кардиальный, а потом в кишечный. Причем такая ситуация отмечается у 30% пациентов. С практической точки зрения важно понимать, это основывается на больших группах исследований, что вид дисплазии не влияет на частоту перерождения в рак. В связи с этим показания для комплексного хирургического лечения должны выставляться при наличии доказанного пищевода Барретта, вне зависимости от вида и стадии дисплазии.
Стоит отметить, что пищевод Барретта в 70% развивается на фоне грыжи пищеводного отверстия диафрагмы (ГПОД) и гастроэзофагеальной рефлюксной болезни (ГЭРБ) без ГПОД. Поэтому для постановки точного диагноза и главное понимания причин развития этого состояния мы должны иметь максимум информации о состоянии верхних отделов желудочно-кишечного тракта. С этой цельно необходимо выполнить эзофагогастроскопию, при которой оценить состояние слизистой пищевода и желудка, взять из нескольких точек биопсию (зона выраженных изменений) и определить протяженность изменой слизистой пищевода в сантиметрах, а также обнаружить наличие желчи в желудке и оценить состояние привратника. Далее необходимо выполнить суточную рН метрию пищевода и желудка, для четкого понимания вида патологического рефлюкса: кислый или щелочной. Затем провести рентгенологическое исследование пищевода и желудка, во время которого удается поставить или отвергнуть диагноз ГПОД, а также проанализировать эвакуацию из желудка и обнаружить явления и степень дуоденостаза.
Эта информация ложиться в основу выбора алгоритма индивидуального лечения конкретного пациента.
Для выявления ГПОД, определения вида метаплазии и степени поражения пищевода, а также выбора правильной индивидуальной тактики хирургического лечения, необходимо прислать мне на личный электронный адрес полное описание гастроскопии с биопсией пищевода минимум из 4 точек, рентгена пищевода и желудка с барием на ГПОД, желательно УЗИ органов брюшной полости, необходимо указать возраст и основные жалобы. В редких случаях при несовпадении жалоб, данных рентгена и ФГС, необходимо выполнить суточную рН-метрию и манометрию пищевода. Тогда я смогу дать более точный ответ по вашей ситуации.
Диагностика
Основным методом диагностики гетеротопии СОЖ в верхнюю треть пищевода является эзофагогастродуоденоскопия (ЭГДС) с биопсией. К сожалению, очаги гетеротопии часто пропускаются во время эндоскопии, поскольку проксимальный отдел пищевода или игнорируется, или осматривается бегло [15]. Вероятно, этот факт и объясняет значительное различие данных о распространенности, полученных на основании аутопсии и эндоскопических исследований. При ЭГДС участки СОЖ в проксимальном отделе пищевода визуализируются как округлые или овальные пятна лососевого цвета, бархатистого вида, чаще одиночные, реже встречаются парные и множественные. Поверхность может быть гладкой или зернистой, плоской или слегка приподнятой. Нечасто эктопированная СОЖ представляет собой участок депрессии слизистой оболочки. Большинство «inlet patch» расположены на боковых стенках, как правило, на несколько сантиметров дистальнее верхнего пищеводного сфинктера (на уровне 16–21 см от резцов). Размеры могут варьировать от микроскопических до 3–5 см (см. рис. 1, 2).
Ряд исследований показывает, что эндоскопия с узкоспектральной визуализацией (NBI) увеличивает частоту обнаружения гетеротопии примерно в 3 раза по сравнению со стандартной эндоскопией белого света (рис. 7) [11, 16]. В исследовании C.L. Cheng et al. [17], включавшем 99 пациентов с гетеротопией СОЖ в верхней трети пищевода, мелкие очаги гетеротопии у 54% обследуемых при использовании узкого спектра выявлены против 17%, обнаруженных в белом свете. Эти результаты позволяют уверенно рекомендовать использование виртуальной хромоэндоскопии для диагностики «inlet patch» [16].
С. Blanco et al. [15] предложили использовать частоту выявления участков гетеротопии в проксимальной части пищевода как критерий качества выполнения эндоскопии верхних отделов ЖКТ по аналогии с критерием adenoma detection rate (ADR) при колоноскопии.
Клинические проявления
Клинические проявления у пациентов с эзофагеальной гетеротопией СОЖ в большинстве случаев отсутствуют. Появление симптомов обусловлено ларингофарингеальным рефлюксом (ЛФР) или осложнениями, связанными с «inlet patch» (перфорации, стриктуры, свищи, а также нео-пластическая трансформация).
Наибольшую сложность для диагностики вызывают пациенты с симптомами, обусловленными ЛФР: дисфагия, одинофагия, регургитация, охриплость голоса, дискомфорт в горле, першение, жжение, хронический кашель, ощущение «кома» в горле [18]. По данным V. Chong et al. [8], клинические проявления присутствуют у 73,1% пациентов с «inlet patch», доминируют жалобы на боль в горле, охриплость и изжогу. В работах J.S. Baudet et al. [19] и O.K. Poyrazoglu et al. [20] при наличии гетеротопии СОЖ у пациентов чаще встречается дисфагия, по данным U. Weickert et al. [21] — рецидивирующая охриплость, дисфагия и изжога. В большом исследовании W.L. Neumann et al. [22], включавшем ретроспективный анализ 487 229 пациентов, подвергшихся эндоскопии, показано, что дисфагия, одинофагия, респираторные симптомы и ощущение «кома» являются наиболее частыми симптомами [22]. В литературе отмечена ассоциация гетеротопии СОЖ в верхние отделы пищевода с хроническими отитами и синуситами, бронхиальной астмой [8]. T. Talih et al. [23] предположили, что гетеротопия СОЖ в верхней трети пищевода могла явиться причиной загрудинных болей у пациента, имитирующих приступ нестабильной стенокардии, нуждающейся в проведении коронарной ангиографии. Большинство исследователей указывают на необходимость дальнейших исследований для изучения потенциальной связи клинических симптомов как с локализацией и/или размерами «inlet patch», так и с морфологическими особенностями гетеротопированной слизистой оболочки [8, 10, 24].
Гетеротопия СОЖ и функциональные расстройства ЖКТ
В настоящее время нет четкой позиции, касающейся характера связи пищеводной гетеротопии СОЖ и функциональных расстройств ЖКТ, прежде всего, функциональной диспепсии и неэрозивной гастроэзофагеальной рефлюксной болезни (ГЭРБ). Требует уточнения, насколько наблюдаемые симптомы могут быть обусловлены наличием «inlet patch» или отнесены к проявлениям функциональных расстройств. Тем не менее у определенных категорий пациентов информирование о присутствии гетеротопии СОЖ может помочь успокоить их и уменьшить тяжесть симптомов.
В качестве одного из возможных патогенетических механизмов появления симптомов рассматривается альтерация гетеротопической СОЖ колонизировавшим ее Hр [10]. Кроме того, имеются данные о нарушении моторики пищевода у пациентов с «inlet patch» [13].
Один из наиболее интересных симптомов — ощущение «кома» в горле (globus sensation), которое встречается у пациентов с «inlet patch» с частотой 1,6–23,1% и более распространено у женщин [10]. Такие больные могут длительно лечиться у психиатров, так как широко известно, что globus sensation считается психогенной проблемой [25]. Ощущение «кома» в горле может возникать из-за повышения давления в верхнем пищеводном сфинктере (ВПС) за счет раздражающего действия «inlet patch» или вследствие рефлекторного сокращения ВПС благодаря дыхательному защитному механизму, вероятно, связанному с рефлюксом. При этом причиной симптомов может быть не только выработка кислоты клетками «inlet patch», но и секреция муцина [14]. Данный факт подтверждается наличием симптомов у пациентов с кардиальным типом гетеротопированной СОЖ и отсутствием эффекта от ингибиторов протонной помпы (ИПП) у некоторых больных. Значимость симптомов ЛФР признана клиницистами и привела к изменению Римских критериев IV функциональных гастроинтестинальных расстройств. В дифференциально-диагностический перечень состояний, сопровождающихся ощущением «кома» в горле, внесен «inlet patch» [26].
Гетеротопия СОЖ и аденокарцинома пищевода
Наиболее серьезным вопросом является изучение связи гетеротопии СОЖ с аденокарциномой пищевода. В систематическом обзоре литературы, выполненном в 2022 г. M. Orosey et al. [27], описано всего 43 случая аденокарциномы в проксимальном отделе пищевода, возникшей в локусе желудочной гетеротопии, подавляющее большинство пациентов были мужского пола. Средний возраст пациентов составил 63,6±11,3 года. Другие авторы также демонстрируют низкую частоту неоплазий в «inlet patch» — 0–1,56% [28]. На основании этих данных в 2022 г. Британское общество гастроэнтерологов и Ассоциация верхней гастроинтестинальной хирургии Великобритании и Ирландии заключили, что «inlet patch» не требует динамического наблюдения и рутинной биопсии [29]. Большинство исследований показывает, что риск злокачественной трансформации гетеротопированной СОЖ в пищевод не зависит от возраста, расы, массы тела и употребления алкоголя, существенное значение имеет курение (23,7 пачка/лет против 16,3 пачка/лет, p=0,006) [30]. В 2022 г. французские исследователи [31] сообщили, что среди пациентов с выявленной мутацией гена CDH1, ассоциированного с высоким риском развития наследственного рака желудка диффузного типа, «inlet patch» обнаружен и морфологически верифицирован у 50%. Однако в этой группе пациентов не зафиксировано ни одного случая рака пищевода на фоне «inlet patch» [31]. Вслед за этой публикацией P. Leclercq et al. [24] предположили, что островок цилиндроклеточного эпителия в верхней трети пищевода представляет собой потенциальную опасность в отношении развития аденокарциномы у пациентов — носителей мутации гена CDH1, в том числе подвергшихся профилактической гастрэктомии, что обусловливает необходимость прицельного эндоскопического осмотра с забором гистологического материала эктопированной СОЖ в проксимальном отделе пищевода [24].
Результаты и обсуждение
При наличии клинических проявлений ГЭРБ и/или рентгенологических признаков ГПОД мы придерживались двухэтапной тактики: антирефлюксная операция и затем через 2—3 мес РЧА очагов метаплазии.
Антирефлюксные вмешательства, выполненные первым этапом, позволяют достигнуть условий подавления кислотопродукции и прекратить заброс дуо-денального содержимого в пищевод [1, 2, 11]. У ряда больных эти вмешательства позволяют уменьшить размеры очагов [12]. Выполнение РЧА вторым этапом возможно только после фундопликации по Тупе на 270°, так как этот вариант позволяет во время абляции расправить кардию до необходимого объема.
В нашем наблюдении при контрольной ЭГДС через 3 мес среди 65 пациентов, которым выполнялся первый антирефлюксный этап (58 пациентов с ГПОД и 7 пациентов с недостаточностью кардии), у 54 (83,1%) эндоскопическая картина пищевода осталась без существенных изменений, у 7 (10,7%) очаги уменьшились. Среди 37 пациентов, которым по различным причинам не выполнялся второй эндоскопический этап лечения, контрольное обследование прошли 10 пациентов. Из них самостоятельный регресс метаплазии СО пищевода отмечен у 4 в сроки от 3 мес до 1 года. Прогрессирование не выявлено ни в одном случае.
Мы рекомендовали выполнение РЧА всем пациентам, у которых имелась гистологически подтвержденная как кишечная, так и желудочная метаплазия СО пищевода. Эндоскопическое лечение цилиндроклеточной метаплазии без дисплазии не является методом выбора в повседневной практике [4, 5], однако полная эрадикация метаплазированного эпителия — единственный способ существенно снизить вероятность развития аденокарциномы. Объективной оценке риска малигнизации в каждом конкретном случае препятствуют мозаичность пищевода Барретта, низкая специфичность морфологических маркеров высокого риска дисплазии, отсутствие в арсенале современной фармакологии средств, эффективно нивелирующих повреждающее действие дуоденального содержимого на эпителий пищевода [11].
Данный метод эндоскопической деструкции СО выбран нами как имеющий наиболее безопасный и дающий наименьшее число побочных эффектов в настоящее время [5, 9]. Воздействие распространяется до уровня мышечной пластинки СО, поэтому РЧА характеризуется наименьшей частотой развития стриктур пищевода. Ввиду этого РЧА позволяет работать с очагами большой площади. По данным метаанализа 37 исследований, включающих 9200 больных, после РЧА частота стриктур составила 5,6%, кровотечений 1%, перфораций 0,06% (после РЧА в сочетании с эндоскопической резекцией), летальных осложнений после РЧА в мире не зафиксировано [3, 10]. Формирование стриктур — основная проблема при лечении пациентов с пищеводом Барретта. Частота их развития составляет 9—15% после аргон-плазменной коагуляции, до 30% после фотодинамической терапии, 9—10% после криодеструкции [3].
После РЧА пациенты предъявляли жалобы на незначительную боль в эпигастрии и за грудиной, не требовавшие назначения анальгетиков, сохранявшиеся до 7 дней (88,2% пациентов). У 4 пациентов с длинным сегментом отмечены выраженная боль и лихорадка до 38,0° в течение 1-х суток. У 1 пациента имелись явления эзофагоспазма. Данные симптомы могут быть объединены понятием «постабляционный синдром». Осложнений после проведения РЧА нами не отмечено.
Динамическое наблюдение проводилось по схеме: контрольная ЭГДС через 3, 6 и 12 мес. При контрольной ЭГДС через 3 мес после РЧА у 97,5% отмечен полный регресс эндоскопических признаков метаплазии СО пищевода — у 2 пациентов с длинным циркулярным сегментом отмечена неполная эрадикация очагов метаплазии за 1 сеанс. Одному из них выполнен второй сеанс РЧА и достигнута полная эрадикация. Второй пациент на повторный сеанс не явился, через 6 мес ему выполнено антирефлюксное оперативное вмешательство в другом учреждении, на фоне чего через 6 мес после операции очаг уменьшился с С3М3 до С0М1. При контрольной ЭГДС через 6 мес у 79 (96,3%) пациентов цилиндроклеточной метаплазии не отмечено, у 3 пациентов (включая вышеописанного) отмечен рецидив, у 2 из них РЧА выполнена повторно. Одному из этих пациентов ранее не выполнялся антирефлюксный этап ввиду отсутствия рентгенологических признаков ГПОД, у этого же пациента через 6 мес после второго сеанса РЧА вновь отмечен очаг желудочной эктопии, который самостоятельно регрессировал после выполненного вторым этапом в другом учреждении антирефлюксного вмешательства. Приведенные клинические данные могут служить свидетельством повышенного риска рецидива метаплазии в условиях продолжающегося рефлюкса даже в отсутствие рентгенологических признаков ГПОД.
Прогрессирование заболевания в виде развития дисплазии за период наблюдения после процедуры не зарегистрировано ни у одного пациента.
По данным мировой литературы, частота эрадикации очагов метаплазии достигает 92—98% без рецидива в течение 2,5 года и 92% без рецидива в течение 5 лет [3, 4, 5, 14]. Для полного устранения метаплазированного эпителия требуется, как правило, 1—2 процедуры. Число сеансов РЧА зависит от распространенности поражения и условий, в которых идет регенерация: в условиях сохраняющегося рефлюкса она происходит дольше. Рецидивы метаплазии обусловлены формированием в условиях рефлюкса метаплазированного эпителия вновь. Небольшие участки кишечной метаплазии могут также оставаться спрятанными под образовавшимся плоским эпителием (так называемый скрытый пищевод Барретта). Предикторами развития рецидива, согласно данным F. Van Vilsteren и соавт. [13], являются имевшаяся до процедуры пептическая стриктура пищевода или выраженный эзофагит, анамнестические данные о формировании после абляции или резекции вновь цилиндрического эпителия, длительный анамнез пищевода Барретта, вероятность рецидива также зависит и от длины сегмента [14].
Лечение
Единого подхода к терапии пациентов с пищеводной гетеротопией СОЖ не разработано. Практически все авторы склоняются к мнению, что бессимптомная желудочная гетеротопия пищевода не требует лечения [1]. При наличии жалоб показана кислотосупрессивная терапия ИПП для купирования симптомов, обусловленных секрецией кислоты. Длительность назначения ИПП четко не определена, но считается оправданной тактика, применяемая при лечении ГЭРБ: терапия «step-down» или «step-up» в течение 4–8 нед., с последующим назначением ИПП по требованию. Если, несмотря на высокую дозу ИПП, есть рецидивы, добавление антагонистов Н2-рецепторов вечером может предотвратить ночной кислотный прорыв. Интересно, что одно исследование показало уменьшение размеров локуса гетеротопии после курса ИПП [11].
Неэффективность консервативных мер является показанием к полному эндоскопическому либо хирургическому удалению очагов гетеротопии, причем эндоскопические абляционные методы являются предпочтительными.
В последние годы появилось несколько публикаций об использовании радиочастотной абляции (РЧА) для лечения гетеротопии СОЖ в проксимальном отделе пищевода [32]. В 2015 г. R.H. Cartabuke сообщил об успешном выполнении эндоскопической мукозальной резекции участка высокой дисплазии в «inlet patch» в сочетании с РЧА всей области гетеротопии, локализованной на расстоянии от 19 до 22 см от резцов и охватывающей 75% окружности пищевода. Последующее обследование через 6 мес. показало полную эрадикацию участка гетеротопии [18].
A. Meining et al. [33] изучили влияние аргоно-плазменной коагуляции (АПК) (мощность коагуляции составила 60 Вт, скорость потока аргона — 2 л/мин) на купирование симптомов у 10 пациентов с наличием гетеротопированной СОЖ и жалобами на чувство «кома» в горле и/или боль в горле. Авторы отметили существенное улучшение самочувствия больных, практически полное исчезновение указанных симптомов через 8 нед. после проведенной терапии [33]. В проспективном рандомизированном исследовании пациентов с аналогичными жалобами M. Bajbouj et al. [14] продемонстрировали, что у 82% пациентов, которым выполнили АПК, значительно уменьшился дискомфорт в горле, а у 90% эндоскопически зафиксировано полное исчезновение участков гетеротопии по сравнению с отсутствием таковых у пациентов группы контроля [14]. На следующем этапе исследования по истечении 27 мес. наблюдения АПК оценена как успешная у 74% пациентов [34]. В метаанализе 6 исследований по применению АПК у симптомных пациентов с гетеротопией СОЖ в верхнюю треть пищевода ответ на терапию был зафиксирован более чем у 80% пациентов. Медиана времени наблюдения в этих исследованиях составляла от 1 мес. до 36 мес. [14].
При наличии осложнений, таких как стриктуры и фиброз, показана биопсия для исключения малигнизации и проведение дилатации. Y. Shimamura et al. [35] продемонстрировали случай успешной баллонной дилатации стриктуры проксимального отдела пищевода, обусловленной наличием циркулярного «inlet patch» протяженностью 3 см у пациента 67 лет с дисфагией.
Наличие дисплазии и рака в локусе гетеротопии требует выполнения алгоритмов, принятых в онкологии, предусматривающих сочетание хирургического вмешательства с химиолучевой терапией.
Эндоскопическая резекция слизистой оболочки была описана в 1 случае дисплазии высокой степени [18] и у 6 пациентов с ранней формой аденокарциномы пищевода [36]. У двух из этих пациентов не было никаких признаков заболевания в течение 12 мес. и 31 мес. наблюдения соответственно.
За последние десятилетия произошли значительные изменения в показателях заболеваемости аденокарциномой и плоскоклеточным раком пищевода. Теперь в странах Западной Европы и США в большинстве случаев при раке пищевода выявляется именно аденокарцинома. В США за последние 30 лет частота встречаемости аденокарциномы пищевода увеличилась почти на 300% (рис. 1)
[1, 2].
Рисунок 1. Показатели заболеваемости аденокарциномой пищевода и плоскоклеточным раком в США (1975—2000 гг.) [3].
В России такая тенденция (увеличение заболеваемости аденокарциномой и уменьшение заболеваемости плоскоклеточным раком) прослеживается не столь отчетливо: в 7-20% случаев диагностированного рака пищевода имеются гистологические признаки аденокарциномы. Однако оценить достоверность и точность таких данных сложно: заболевание выявляется на поздних стадиях распространенного рака, когда невозможно определить, где образовалась опухоль — в дистальном отделе пищевода (ДОП) или в проксимальном отделе желудка. Среди всей онкологической патологии органов пищеварительной системы рак пищевода и рак желудка имеют наибольшие показатели смертности. Прогноз после постановки диагноза аденокарциномы неблагоприятный: 5-летняя выживаемость не превышает 10-20%, а совершенствование методик лечения вносит не столь значительный вклад в улучшение этих показателей [4, 5].
В последнее время значительно расширились наше понимание причин возникновения аденокарциномы пищевода, путей распространения и прогрессирования процесса и возможности раннего выявления опухоли. Это позволяет с оптимизмом рассматривать вопросы организации скрининга, выявления и своевременного лечения предопухолевой патологии. По мнению авторитетных экспертов, аденокарцинома пищеварительного тракта (ПВТ) наиболее часто развивается в патологически измененной слизистой оболочке. Хронический воспалительный процесс рассматривается как одно из важных звеньев в цепи процессов, приводящих к аденокарциноме пищевода [6, 7]. Определены и основные заболевания, на фоне которых рак развивается достоверно чаще. Для аденокарциномы пищевода фоновым заболеванием в большинстве случаев является пищевод Баррета (ПБ).
По мнению М.И. Давыдова, начиная с первого описания, сделанного в 1950 г. английским хирургом N. Barrett, заболевание, известное в гастроэнтерологии и онкологии как ПБ, остается наиболее противоречивой и малоизученной патологией ПВТ [8].
N. Barrett был убежден, что заболевание, описание которого он публикует, является сочетанием грыжи пищеводного отверстия диафрагмы (ПОД) с транслокацией проксимального отдела желудка в средостение в виде трубки («тубулированный желудок») с укорочением и изъязвлением дистальной трети пищевода [9]. Лишь через 3 года P. Allison и А. Johnstone показали, что то, что N. Barrett описывал как «тубулированный желудок», было пищеводом с цилиндроклеточной метаплазией эпителия и образованием пептических язв («язвы Баррета» — «Barrett ulcers»)[10]. С того времени на протяжении многих десятилетий патологический процесс, характеризующийся цилиндроклеточной метаплазией слизистой оболочки пищевода и нередко сопровождающийся изъязвлением или стриктурой, назывался ПБ. Однако наиболее значимым признаком «истинного» ПБ считалось выявление при морфологическом исследовании бокаловидных клеток, содержащих кислый муцин и окрашивающихся красителем алциановым синим (Alcian blue) при pH 2,5. Такая эволюция в понимании этой патологии определялась, с одной стороны, совершенствованием методов диагностики, а с другой — отсутствием четких критериев эффективного определения этой патологии и надежных методик выявления кишечной метаплазии, дисплазии и раннего рака. В результате многочисленных исследований, проведенных в течение последних 20 лет, произошла трансформация некоторых критериев ПБ. Было показано, что наличие очагов специализированного кишечного эпителия с бокаловидными клетками в сегменте цилиндроклеточной метаплазии повышает риск развития аденокарциномы ДОП, а именно это обстоятельство и определяет предраковый потенциал ПБ. Исходя из этого кишечная метаплазия стала важным критерием диагностики, проводимой у пациентов с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) [9]. Длительное время общепринятым в клинической практике было следующее определение ПБ: патологическое состояние, при котором часть плоского эпителия слизистой оболочки ДОП замещена метапластическим цилиндрическим эпителием. Сегмент цилиндрической метаплазии должен определяться при эндоскопическом исследовании, находиться выше зоны пищеводно-желудочного перехода или соединения (Z-линии) и подтверждаться морфологически путем обнаружения специализированной кишечной метаплазии (рис. 2)
[11].
Рисунок 2. ПБ. а — эндоскопическая картина
Рисунок 2. ПБ. б — гистологическая картина: кишечная метаплазия ДОП с бокаловидными клетками (окрашивание по Моури-ШИК с алциановым синим). Однако кишечная метаплазия не всегда является зоной роста аденокарциномы пищевода, поэтому в 2011 г. Американской гастроэнтерологической ассоциацией было предложено более современное определение ПБ: «ПБ — это сегмент цилиндрического метапластического эпителия ДОП, имеющий предраковый потенциал. Эпителий кишечного типа в сегменте метаплазии имеет наибольший предраковый потенциал и требует диагностики» [12].
Из этого определения следует, что два исследования — эндоскопическое и морфологическое — лежат в основе правильной диагностики этого патологического состояния. От врача-эндоскописта, его знаний, методических навыков, правильности интерпретации выявленных изменений слизистой оболочки, опыта и, наконец, технического оснащения зависит своевременная и отвечающая современным критериям диагностика ПБ, диспластических изменений слизистой оболочки и ранних форм аденокарциномы пищевода.
Распространенность ГЭРБ и цилиндроклеточной метаплазии в ДОП
ПБ является одним из наиболее серьезных осложнений ГЭРБ — хронического рецидивирующего заболевания, обусловленного спонтанным, регулярно повторяющимся ретроградным поступлением в пищевод желудочного и/или дуоденального содержимого, приводящего к повреждению ДОП и/или появлению характерных симптомов (изжоги, ретростернальных болей, дисфагии). Как самостоятельная нозологическая единица ГЭРБ официально получила признание в материалах по диагностике и лечению этого заболевания, принятых в октябре 1997 г. на междисциплинарном конгрессе гастроэнтерологов и эндоскопистов в г. Генвале (Бельгия) [13]. Исследования, проведенные в мире и охватывающие большие группы населения, показывают, что симптомы рефлюксной болезни испытывает более 1/3 населения, а ежедневную изжогу — 7-10%. Осложнения рефлюксной болезни и изжога (основной симптом ГЭРБ) чаще наблюдаются у представителей белой (12,3 и 34,6% соответственно) и черной (2,8 и 46,1% соответственно) расы по сравнению с жителями Восточной Азии (до 2,6%) [14]. Оценить распространенность цилиндроклеточной метаплазии в ДОП достаточно сложно, так как более 80% пациентов остаются недиагностированными, что отражают данные американского исследования материала аутопсий [15]. В исследовании, проведенном в США этой же группой специалистов (A. Cameron и соавт.), установлено 28-кратное увеличение числа клинически диагностированных случаев метапластических изменений в ДОП за 1965-1995 гг. Данные эндоскопического обследования верхних отделов ПВТ у пациентов, поступивших в клиники с симптомами диспепсии или по поводу проведения колоноскопии, свидетельствуют о различиях в преобладании цилиндроклеточной метаплазии пищевода в зависимости от этнических и географических факторов (таблица).
Распространенность ГЭРБ в России среди взрослого населения составляет около 40%, и у 45-80% из них обнаруживается эзофагит. В 10-35% случаев это тяжелый эзофагит с множественными эрозивными поражениями слизистой оболочки ДОП. ПБ разной степени протяженности диагностируется в среднем у 8-15% пациентов с эзофагитом. Аденокарцинома пищевода развивается у 0,5% пациентов с ПБ в год при низкой степени дисплазии, у 6% в год — при дисплазии эпителия высокой степени [22]. К факторам риска развития ПБ относятся средний и пожилой возраст, мужской пол: у большинства пациентов эта патология была диагностирована в 50-60 лет и у мужчин — в 3-4 раза чаще, чем у женщин.
Патогенез
Одной из основных причин развития ГЭРБ и ПБ является гастроэзофагеальный рефлюкс — заброс (попадание) желудочного содержимого, и в первую очередь соляной кислоты, в пищевод. При развитии такого рефлюкса рН в ДОП значительно смещается в сторону низких значений за счет попадания кислого содержимого желудка. Продолжительный контакт слизистой оболочки пищевода с кислым рефлюксатом, кроме того содержащим пепсин, способствует развитию ее воспаления. Желчные кислоты и ферменты, которые также могут входить в состав рефлюксата, при нарушении моторики верхних отделов ПВТ способны оказывать сильное повреждающее воздействие на слизистую оболочку пищевода. Эзофагит в ряде случаев сопровождается структурной перестройкой эпителия слизистой оболочки пищевода с формированием желудочной или кишечной метаплазии, которая и является фоном для развития аденокарциномы. Анализ результатов многочисленных исследований показывает, что риск развития рака в сегменте цилиндроклеточной метаплазии связан прежде всего с наличием кишечной метаплазии (неполной кишечной метаплазии, тип II и III) [23, 24].
В пищеводе метапластические изменения начинаются с появления сначала цилиндрического эпителия желудочного типа, а затем — эпителия толстокишечного типа. Экспозиция кислоты в пищеводе увеличивает, с одной стороны, активность протеинкиназ, инициирующих митогенную активность клеток и, соответственно, их пролиферацию, и с другой — угнетает апоптоз в пораженных участках слизистой оболочки. В 50-80% случаев дисплазия на фоне ПБ и аденокарциномы пищевода характеризуется мутациями генов, участвующих в регуляции клеточного цикла, репарации ДНК и апоптозе [21]. Результаты исследований в этой области свидетельствуют о важной роли генов (белков) Р53 и Р63, участвующих в развитии клеток плоского эпителия. В пищеводе экспрессия белка Р63 определяется только в клетках плоского эпителия и отсутствует в цилиндроклеточной метаплазии. При отсутствии Р63 стволовые клетки слизистой оболочки не могут начать дифференцировку по пути клеток плоского эпителия, в результате такого нарушения образуются клетки цилиндрического эпителия [25, 26]. Основой для происхождения клеток эпителия кишечного типа могут служить как многослойный плоский эпителий и кубический эпителий протоков желез подслизистого слоя пищевода [27], так и эпителий кардиального типа в ДОП, подверженные воздействию рефлюксата [28]. Среди факторов, влияющих на процессы канцерогенеза
в области пищеводно-желудочного соединения (ПЖС), необходимо учитывать также курение, алкоголь, повышенную массу тела и рефлюкс желчи.
Результаты динамических наблюдений за пациентами с ПБ свидетельствуют о том, что развитие аденокарциномы происходит через многоступенчатый патологический процесс, который характеризуется нарастанием степени дисплазии — патологии, предшествующей аденокарциноме. Важным промотором этого процесса является оксид нитрита, который может накапливаться в патологически измененных тканях ДОП и вызывать генетические изменения, которые происходят параллельно переходу метаплазии в дисплазию и затем в аденокарциному [29].
Диагностика и скрининг ПБ и аденокарциномы пищевода
Эндоскопическое исследование является ключевым при постановке диагноза ПБ. В то время как остальные методы (рентгенография, сцинтиграфия) предоставляют данные лишь для того, чтобы предположить этот диагноз, эндоскопический метод позволяет с высокой степенью вероятности установить его. При эндоскопическом исследовании определяются протяженность изменения слизистой оболочки, отношение зоны изменений слизистой оболочки по протяжению к ПЖС, а также проксимальная граница по отношению к резцам. При этом распространение зоны метаплазии хорошо визуализируется в виде очагов гиперемии («языки пламени») на фоне «жемчужно-белого» эпителия пищевода. Одной из важных задач эндоскопического исследования является получение биопсийного материала. Цель морфологического исследования заключается в подтверждении наличия метаплазии слизистой оболочки пищевода, а также в выявлении участков дисплазии и фокусов аденокарциномы.
C позиции эндоскопии точная диагностика ПБ связана с несколькими проблемами. Одна из них заключается в определении ключевых ориентиров — зоны ПЖС, Z-линии и границ сегмента цилиндроклеточной метаплазии. Другая проблема — это точность выполнения биопсии при очаговом распределении участков кишечной метаплазии и дисплазии в сегменте цилиндроклеточной метаплазии пищевода и трудности эндоскопической диагностики этих очагов [30].
Ключевые ориентиры эндоскопической диагностики
Зона ПЖС
— это область соединения мышечных слоев пищевода и кардиального отдела желудка. Она соответствует границе между трубчатой структурой пищевода и проксимальной частью желудка с продольными складками. Эта анатомическая граница определяется в области проксимального края продольных складок слизистой оболочки желудка
(рис. 3).
Рисунок 3. Эндоскопическая картина ПБ. Стрелками указан проксимальный край складок слизистой оболочки желудка, соответствующий зоне ПЖС. Еще одним дополнительным ориентиром ПЖС служит дистальная граница видимых при эндоскопии продольных сосудов слизистой оболочки (palisade or longitudinal intramucosal vessels). Эти сосуды, впервые описанные в 1963 г. Carvalho, представляют собой вены, расположенные в слизистой оболочке над собственной мышечной пластинкой. В желудке они расположены в подслизистом слое и выходят в поверхностные слои слизистой оболочки только в области границы желудка и пищевода.
В слизистом слое пищевода они проходят в проксимальном направлении около 2 см параллельно друг другу в виде «частокола» и затем вновь погружаются в подслизистый слой, образуя более крупные вены. Японское общество изучения болезней пищевода рекомендует определять ПЖС именно по дистальному краю этих продольных сосудов [31] (рис. 4).
Рисунок 4. Продольные сосуды слизистой оболочки ДОП. Часть сосудов переходит границу плоского и цилиндрического эпителия (Z-линию) в дистальном направлении. Стрелкой показана зона ПЖС.
Зубчатая линия, или Z-линия,
— граница между многослойным плоским эпителием пищевода бледно-розового цвета и более ярким и темным цилиндрическим эпителием желудка
(рис. 4).
Буква «Z» обозначает zero (ноль) — нулевую отметку зоны, где заканчивается плоский эпителий пищевода [32].
В норме эта неровная линия совпадает с анатомической границей пищевода и желудка. При наличии цилиндроклеточной метаплазии в ДОП Z-линия не совпадает с зоной ПЖС.
В том случае, когда Z-линия находится выше анатомической границы пищевода и желудка (ПЖС), определяется сегмент цилиндроклеточной метаплазии, расположенный между этими двумя ориентирами. Современная диагностика границ и протяженности сегмента цилиндроклеточной метаплазии ДОП основывается на Пражских критериях (The Barrett’s Prague C&M Criteria), разработанных Международной рабочей группой экспертов по классификации эзофагитов (The International Working Group for the Classification of Oesophagitis) на 12-й Европейской гастроэнтерологической неделе (Прага, 2004 г.). Эти критерии предполагают определение проксимальной границы циркулярного сегмента метаплазии, а также максимальной протяженности и самой верхней границы наиболее длинного «языка» метаплазии, идущего от циркулярного сегмента до его верхнего края (значение «М»). Измерение протяженности циркулярного сегмента цилиндроклеточной метаплазии происходит от края желудочных складок (ПЖС) до его проксимального уровня (значение «C»; рис. 5).
Рисунок 5. Пражские критерии диагностики ПБ [33]. Протяженность циркулярного сегмента метаплазии — 6 см, максимальная протяженность — 14 см; эндоскопическое заключение: ПБ С — 6, М — 14. Мелкие островки метаплазии, расположенные проксимальнее общего сегмента, отдельно от него и не связанные с ним, не учитываются.
Наличие у пациента аксиальной пищеводно-желудочной грыжи ПОД существенно изменяет положение ключевых ориентиров диагностики ПБ. Именно поэтому диагностика данного патологического состояния также является важным элементом эндоскопического исследования и предполагает определение сужения, соответствующего ПОД, расположенному дистальнее зоны ПЖС [34].
Диагностика кишечного эпителия в сегменте цилиндроклеточной метаплазии
При гистологическом исследовании в зоне ПБ определяются три типа железистого эпителия: эпителий фундального отдела желудка (покровно-ямочный), кардиального отдела (или переходного типа) и специализированный (особый) кишечный эпителий с бокаловидными клетками. Диагноз ПБ предполагает морфологическое подтверждение наличия специализированного, перестроенного по кишечному типу эпителия в дистальном сегменте пищевода. Если при гистологическом исследовании выявляются только клетки фундального или кардиального типа, следует говорить не о ПБ, а лишь о цилиндроклеточной метаплазии пищевода, не связанной с высоким риском возникновения аденокарциномы пищевода. Эндоскопическое исследование метаплазированного сегмента ДОП с выполнением так называемых слепых биопсий в четырех точках по окружности пищевода и на протяжении каждого сантиметра по длине сегмента являлось «золотым стандартом» диагностики ПБ. Однако показано, что точность такой диагностики очагов кишечной метаплазии составляет 48,2% [35].
Возможно ли повысить эффективность диагностики и динамического наблюдения за пациентами с ПБ с целью своевременного обнаружения не только специализированного кишечного эпителия, но и диспластических изменений эпителия, а также раннего рака?
В настоящее время актуальной является разработка новых и определение эффективности существующих методик окрашивания слизистой оболочки ДОП, позволяющих эффективно диагностировать метапластические, диспластические изменения, а также ранние формы рака. Кроме того, существует ряд новых оптических эндоскопических методик, позволяющих отказаться от выполнения «слепых» биопсий. Среди таких методик наиболее эффективными являются хромоэндоскопия, увеличительная и узкоспектральная эндоскопия.
Хромоэндоскопия
Методика окрашивания с метиленовым синим, основанная на поглощении красителя метаплазированным кишечным эпителием, эффективна при диагностике очагов кишечной метаплазии в сегменте цилиндроклеточной метаплазии ДОП. Именно эта методика позволяет объективно оценить локализацию, размеры и распространенность очагов кишечной метаплазии (рис. 6, а).
Рисунок 6. Хромоскопия. а — очаги кишечной метаплазии после окрашивания 0,5% раствором метиленового синего имеют вид пятен синего цвета на фоне розового эпителия желудочного типа, который не поглощает краситель. Методика окрашивания индигокармином, позволяющая выделять и подчеркивать структурные поверхностные изменения слизистой оболочки, помогает в диагностике очаговых поражений слизистой оболочки, в том числе и раннего рака. Выполнение прицельной биопсии окрашенных метиленовым синим участков с последующим морфологическим исследованием гастробиоптатов позволяет оценить тип кишечной метаплазии, своевременно диагностировать очаги дисплазии эпителия, встречающиеся на фоне метаплазии, и ранние формы рака. Однако методики хромоскопии не являются высокоспецифичными в отношении метапластических и диспластических изменений эпителия ДОП. Краситель метиленовый синий может прокрашивать не только очаги кишечной метаплазии, но и адсорбироваться в области эрозий и язв, что приводит к ложноположительным результатам диагностики
(рис. 6, б).
Рисунок 6. Хромоскопия. б — ложноположительные результаты хромоскопии, краситель метиленовый синий адсорбируется в области линейных эрозий и язв.
Увеличительная эндоскопия
Увеличительная эндоскопия позволяет детально исследовать микроархитектонику слизистой оболочки сегмента цилиндроклеточной метаплазии пищевода с помощью оптического 115-кратного увеличения ее поверхности, определить типы рисунка, соответствующего метапластическим и диспластическим изменениям эпителия. Эта методика в сочетании с хромоскопией 0,5% метиленовым синим показала высокую специфичность и чувствительность не только в диагностике очагов кишечной метаплазии, но и диспластических изменений эпителия у пациентов с ПБ, и позволила определить типы микроструктуры поверхности слизистой оболочки (рис. 7),
Рисунок 7. Увеличительная эндоскопия (115-кратное оптическое увеличение) сегмента цилиндроклеточной метаплазии ДОП. Тип рисунка «продольных гребней» соответствует кишечному эпителию (ПБ). соответствующие этим патологическим изменениям [36].
Узкоспектральная эндоскопия
Узкоспектральная эндоскопия является одной из наиболее современных эндоскопических методик, зарегистрированных Министерством здравоохранения РФ и разрешенных к применению в России. Эндоскопическое исследование с функцией узкоспектрального изображения (narrow band imaging) основано на использовании специальных узкоспектральных оптических фильтров, изменяющих спектр светового потока. Глубина проникновения светового потока зависит от длины волны: световые волны более длинного спектра (например, красный) глубже проникают в ткани, в то время как видимый синий спектр (более короткие волны) способен проникать только в поверхностные слои тканей, что позволяет более детально исследовать их микроструктуру. Таким образом, использование специальных узкоспектральных фильтров в этой системе, пропускающих световые потоки с длиной волны 415 и 445 нм и задерживающих световые волны, глубже проникающие в ткани, позволяет улучшить визуализацию поверхности слизистой оболочки. Кроме того, световые волны узкого спектра хорошо поглощаются гемоглобином тканей, что позволяет исследовать микрососудистый рисунок капилляров слизистой оболочки и подслизистого слоя пищевода. С помощью этой методики можно не только повысить эффективность определения ключевых ориентиров диагностики ПБ (продольных сосудов), но и выявить мельчайшие нарушения архитектоники эпителия, характерные для метапластических и диспластических изменений, а также начальных форм рака (рис. 8).
Рисунок 8. Узкоспектральная эндоскопия. а — ПБ: диагностика в обычном световом спектре
Рисунок 8. Узкоспектральная эндоскопия. б — узкоспектральная эндоскопия с оптическим увеличением изображения: более четкая визуализация сегмента метаплазии ДОП с нарушением микроархитектоники и сосудистого рисунка, участками кишечного эпителия и дисплазии (стрелка).
Скрининг
Риск развития аденокарциномы на фоне ПБ является значимым у пациентов с дисплазией эпителия высокой степени в зоне сегмента цилиндроклеточной метаплазии (рис. 9).
Рисунок 9. Риск развития рака у пациентов с ПБ без дисплазии и с дисплазией эпителия слизистой оболочки разной степени выраженности [37, 38].
Однако появлению аденокарциномы предшествует постепенное прогрессивное развитие диспластических изменений с потерей клетками признаков дифференцировки. Прогрессирование от легкой (низкой степени) к тяжелой (высокой степени) дисплазии в среднем может протекать в течение
29 мес, тогда как последующее развитие аденокарциномы занимает в 2 раза меньше времени — 14 мес [7]. Широкое распространение ГЭРБ и определение каскада предраковых событий являются потенциально привлекательной целью для проведения скрининга ПБ и аденокарциномы пищевода. Одни из последних американских рекомендаций (American College of Gastroenterology) предполагают, что проводить эндоскопическое исследование верхних отделов ПВТ необходимо всем пациентам, имеющим симптомы хронической ГЭРБ, в связи с высоким риском развития у них ПБ [39].
Эндоскопическое исследование является «золотым стандартом» в диагностике патологических процессов слизистой оболочки пищевода, так как позволяет не только визуально определить наличие цилиндрического эпителия в пищеводе, но и выполнить биопсию для морфологического подтверждения диагноза, диагностики дисплазии и раннего рака. Это позволяет считать эндоскопический метод наиболее реальным инструментом скрининга ПБ и аденокарциномы пищевода. С помощью увеличительной и узкоспектральной эндоскопии нами проведено исследование рисунка разных участков слизистой оболочки в сегменте цилиндроклеточной метаплазии ДОП, позволившее определить 5 типов рисунка эпителия, не имеющего признаков дисплазии, а также структурных изменений, соответствующих дисплазии и раннему раку пищевода (рис. 10).
Рисунок 10. Типы рисунка эпителия дистального отдела пищевода. а — ДОП без неопластических изменений: овальный рисунок ямок (эпителий кардиального отдела желудка в ДОП)
Рисунок 10. Типы рисунка эпителия дистального отдела пищевода. б — крупный и вытянутый овальный рисунок (овальные гребни) характеризует кишечную метаплазию
Рисунок 10. Типы рисунка эпителия дистального отдела пищевода. в — рисунок продольных гребней (кишечная метаплазия)
Рисунок 10. Типы рисунка эпителия дистального отдела пищевода. г — патологические сосуды и разрушенный тип рисунка поверхности эпителия (дисплазия высокой степени) Полученные результаты и корреляция эндоскопических находок с данными гистологического исследования показали высокие специфичность и чувствительность методик в диагностике типов эпителия ДОП [40]. Это позволяет говорить о новом направлении эндоскопического скрининга ПБ — «оптической биопсии» и своевременном, высокоэффективном выявлении предраковых изменений и ранних форм рака [41].
Лечение пациентов с ПБ
Большинство пациентов с ПБ имеют симптомы, обусловленные рефлюксом желудочного содержимого в пищевод и характерные для ГЭРБ, — изжогу, регургитацию, загрудинные боли, а иногда и экстапищеводные проявления (ларингит, хронический кашель, бронхиальную астму). Лечение пациентов с ПБ имеет два основных направления: 1) терапию симптомов и проявлений ГЭРБ; 2) снижение риска развития аденокарциномы пищевода. Современные принципы эффективной терапии любой формы ГЭРБ, и в частности эрозивного эзофагита, отражены в рекомендациях Российской гастроэнтерологической ассоциации и состоят из двух основных этапов: индукции ремиссии и поддержания ремиссии эрозивного эзофагита. Первый этап лечения предполагает назначение ингибиторов протонной помпы (ИПП) в стандартных дозировках в течение 4 нед при единичных эрозиях и в течение 8 нед при множественных эрозивных поражениях слизистой оболочки. Поддерживающая терапия предполагает прием ИПП в половинной дозировке в течение 26-52 нед. ИПП создают оптимальные условия рН для заживления эрозий и снижения гиперпролиферации в метаплазированном эпителии. Такая тактика позволяет добиться быстрого улучшения клинических проявлений, положительной динамики воспалительных изменений, определяемых при эндоскопии, сократить время и затраты на лечебный курс. ИПП являются основой как курсовой, так и поддерживающей терапии всех форм ГЭРБ, и по суммарной клинической эффективности превосходят блокаторы H2-рецепторов гистамина в 2 раза, а прокинетики — в 3 раза [42]. После длительного применения препаратов этой группы у пациентов с ПБ отмечается снижение маркеров пролиферации. И хотя считается, что ПБ, как правило, не подвергается обратному развитию, в ряде случаев удается добиться частичной регрессии ограниченного участка кишечной метаплазии [43]. В одном из немногих рандомизированных исследований, в котором 68 пациентов с ПБ в течение 24 мес получали 40 мг омепразола (1-я группа) и 150 мг ранитидина (2-я группа) 2 раза в сутки, установлена небольшая, но статистически достоверная регрессия сегмента метаплазии. Уменьшение длины сегмента и его площади на 8% зарегистрировано только в 1-й группе пациентов (у получавших омепразол). При приеме ранитидина никаких изменений не отмечено [44].
Предотвращение прогрессирования метапластических изменений и неоплазии у пациентов с ПБ остается сложной и недостаточно изученной проблемой. В двух исследованиях показано, что у 230 и 80 пациентов с ГЭРБ, получавших длительную терапию омепразолом в разных суточных дозах (от 20 до 80 мг), в процессе динамического наблюдения (в среднем в течение 6,9 года) в 12,0 и 14,5% случаев соответственно обнаружены метапластические изменения в ДОП, характерные для ПБ [45, 46]. В другом исследовании у 350 пациентов с ПБ риск развития диспластических изменений был в 5,6 раза выше (на протяжении не менее 2 лет), чем у не получавших регулярную терапию ИПП в течение всего периода наблюдения, продолжавшегося в среднем 4,7 года [47]. Результаты работ в этой области в целом свидетельствуют о том, что терапия ИПП не может во всех случаях предотвратить развитие метапластических и диспластических изменений в ДОП у пациентов с ГЭРБ. Необходимы дальнейшие исследования в этой области, совершенствование механизмов регистрации мельчайших структурных изменений в слизистой оболочке, которое возможно при использовании новых оптических эндоскопических методик.
При неэффективности медикаментозной терапии, а также выявлении диспластических изменений слизистой оболочки возможно применение хирургических и эндоскопических методов лечения. Ретроспективный анализ результатов хирургических операций (фундопликаций) не выявил значимых преимуществ этой методики по сравнению с лекарственной терапией ИПП. Фундопликация не предотвращает ни появлений ПБ у пациентов с ГЭРБ, ни его прогрессирования в аденокарциному пищевода [48]. Эндоскопические методики радиочастотной абляции и резекции метапластических и диспластических изменений у пациентов с ПБ являются альтернативой хирургической резекции, имеющей высокий риск развития осложнений (рис. 11)
[49, 50].
Рисунок 11. Результаты лечения пациента с ранним раком пищевода. а — ранний рак в проксимальной части ПБ (обозначен стрелками)
Рисунок 11. Результаты лечения пациента с ранним раком пищевода. б — результат эндоскопической резекции опухоли: язвенный дефект большого размера в зоне выполненной операции
Рисунок 11. Результаты лечения пациента с ранним раком пищевода. в — макропрепарат: резецированный ранний рак и зона сегмента метаплазии закреплены иглами на специальной плате и подготовлены для гистологического исследования
Рисунок 11. Результаты лечения пациента с ранним раком пищевода. г — гистологический препарат: аденокарцинома (ранний рак) в зоне ПБ pT1 m2 V0 L0 G2 R0
Рисунок 11. Результаты лечения пациента с ранним раком пищевода. д — проведение вторым этапом лечения радиочастотной абляции всего сегмента ПБ (через 4 мес после резекции раннего рака)
Рисунок 11. Результаты лечения пациента с ранним раком пищевода. е — результат лечения: абляции подвергнут весь сегмент цилиндроклеточной метаплазии ДОП
Рисунок 11. Результаты лечения пациента с ранним раком пищевода. ж — эпителизация язвенного дефекта в зоне выполненной резекции раннего рака через 2 мес после абляции и длительной терапии ИПП: плоский эпителий в зоне резекции и сегмента ПБ.
Эндоскопическое лечение должно сопровождаться адекватной антисекреторной терапией ИПП для обеспечения эффективного заживления дефектов слизистой оболочки в области удаленных очагов метаплазии или дисплазии и создания условий для появления в этих зонах многослойного плоского эпителия пищевода. Несмотря на высокую эффективность и относительную безопасность аргоноплазменной и электрокоагуляции, а также лазерной деструкции, эти методики абляции не всегда приводят к гистологической эрадикации кишечной метаплазии и не могут в 100% случаев предупредить развитие диспластических изменений [51]. Современные стратегия и алгоритм ведения пациентов с ПБ представлены на рис. 12.
Рисунок 12. Алгоритм ведения пациентов с ПБ [53]. Такой алгоритм действий врача предполагает, во-первых, диагностику ПБ в соответствии с Пражскими критериями, во-вторых, обязательные биопсии всех видимых патологических участков и эпителия в зоне сегмента метаплазии, а также применение новых оптических эндоскопических технологий диагностики диспластических изменений и раннего рака пищевода. Эндоскопическое наблюдение за пациентами без дисплазии в дальнейшем осуществляется каждые 3 года. При обнаружении дисплазии и раннего рака диагноз необходимо установить как минимум двум морфологам. При обнаружении аденокарциномы или дисплазии высокой степени рекомендована эндоскопическая операция (при наличии показаний и возможности ее проведения) с последующим стадированием процесса и определением тактики лечения. В случае дисплазии низкой степени возможно выполнение радиочастотной абляции с последующим динамическим наблюдением в экспертном центре [52].
Агрессивное течение опухолей пищевода, неудовлетворительные результаты лечения диктуют необходимость поиска и исследования новых возможностей предупреждения развития опухолевого процесса, эффективной эндоскопической диагностики предопухолевой патологии, выбора п