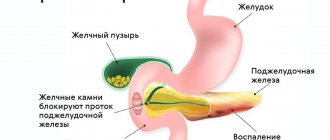
Синдром Золлингера-Эллисона (СЗЭ) — онкологическое заболевание, при котором опухоли в желудочно-кишечном тракте вызывают повышенное выделение гормона гастрина. Избыточное его количество проявляется признаками паранеоплазии. Более чем в половине случаев заболевание является злокачественным и требует серьезного регулярного контроля. Осуществлять этот контроль вы можете с помощью диагностики в Германии, которую проводит клиника «Нордвест».
К главным симптомам гастриномы можно отнести опухоли поджелудочной железы, а также верхнего отдела тонкого кишечника. Заболевание довольно редкое и проявляется в основном с 30 до 60 лет.
Симптомы
Характерный симптом – боль вверху живота, которая чаще наблюдается у мужчин, чем у женщин. Этот признак гастриномы возникает после приема пищи или на голодный желудок. Она сходна с болью, сопровождающей обычную язву двенадцатиперстной кишки, но выражается более интенсивно, очень упорна и не исчезает после назначения противоязвенной терапии. Боль вверху живота диагностируют половине пациентов с синдромом Золлингера-Эллисона.
Второй характерный признак – непрекращающаяся диарея. Она появляется из-за попадания большого количества соляной кислоты в тонкий кишечник, в результате чего замедляется моторика тонкой кишки и всасывание. В обильном и водянистом стуле наблюдается большое количество жира, частиц непереваренной пищи. Этот симптом больше характерен для женщин.
Среди других признаков:
1. Отрыжка кислым.
2. Постоянная изжога.
3. Незаживающие язвы двенадцатиперстной кишки и желудка, которые проявляются кровотечением.
4. Воспаление слизистой пищевода, сопровождающееся сужением пищевода.
5. Симптом Менделя – болезненность в месте появления язвы.
6. Снижение веса из-за невозможности ЖКТ нормально усвоить пищу.
При появлении злокачественных опухолей двенадцатиперстной кишки возможно увеличение печени в размерах и аналогичные образования.
При назначении противоязвенной терапии лечение не дает результата, поскольку язва желудка и двенадцатиперстной кишки постоянно повторяется.
Запишись на консультацию
Заметили у себя один или несколько симптомов?
Нейроэндокринные опухоли: эпидемиология, общие положения
Нейроэндокринные опухоли (НЭО) являются редкими злокачественными образованиями, происходящими из нейроэндокринных клеток эмбриональной кишки. Характерной особенностью НЭО является способность к синтезу гормонов и биогенных аминов, что и обусловливает их основные клинические проявления.
В последние десятилетия зарегистрирован неуклонный рост заболеваемости НЭО во всем мире, что может быть связано с увеличением доступности высокотехнологичных методов диагностики. По данным Национального института рака США, годовой показатель заболеваемости НЭО с поправкой на возраст увеличился в 6,4 раза — с 1,09 на 100 тыс. населения в 1973 г. до 6,98 на 100 тыс. в 2012 г.; всего за этот период был зарегистрирован 64 971 случай НЭО [1]. Гастроэнтеропанкреатические (ГЭП) НЭО составляют около 70% от всех нейроэндокринных новообразований. В настоящее время заболеваемость ГЭП НЭО оценивается как 3—5,2 на 100 тыс. новых случаев в год, а усредненный показатель распространенности составляет 5,86 на 100 тыс. человек в год. Мужчины болеют несколько чаще женщин: доля мужчин с выявленными НЭО составляет 52% (5,35 на 100 тыс. случаев в год по сравнению с 4,76 на 100 тыс. у женщин) [2].
Наиболее распространенными локализациями НЭО в пищеварительном тракте, по данным M. Cives и J. Strosberg (2018) [1], являются тонкая кишка (30,8%), прямая кишка (26,3%), толстая кишка (17,6%), поджелудочная железа (ПЖ) (12,1%) и аппендикс (5,7%).
В исследовании J. Darbà и A. Marsà (2019) [3] были проанализированы данные о пациентах 192 частных и 313 государственных клиник из разных регионов Испании. Всего за период с 2010 по 2015 г. было зарегистрировано 9120 случаев НЭО. Кроме того, был отмечен 2-кратный рост первичной заболеваемости, при этом доброкачественные НЭО регистрировались только в 18,59% случаев, а у 42,93% пациентов к моменту постановки диагноза имелись метастатические очаги. Наиболее частыми локализациями НЭО, по данным авторов, были система органов дыхания, ПЖ и желудочно-кишечный тракт (ЖКТ). С учетом необходимости проведения обширных оперативных вмешательств и дорогостоящих курсов химиотерапии, стоимость лечения в расчете на одного пациента составила 9092 евро, или 15 373 961 евро в год.
НЭО ПЖ составляют до 10% от всех значимых новообразований органа. Это, как правило, медленно растущие опухоли с показателями общей 5-, 10- и 20-летней выживаемости 33, 17 и 10% соответственно. Панкреатические НЭО могут возникать спорадически (75—80%) или как проявление генетически детерминированных состояний: наследственного синдрома множественных эндокринных неоплазий 1-го типа (МЭН-1), синдрома von Hippel—Lindau, нейрофиброматоза 1-го типа, туберозного склероза. Для НЭО ПЖ характерны специфичные генетические нарушения — мутации генов MEN1, DAXX и ATRX, а также генов сигнального пути mTOR — TSC2, PTEN и PIK3CA. Генетические нарушения при нейроэндокринном раке ПЖ представлены в основном мутациями генов, вовлеченных в клеточный цикл, таких как ТР53, RB1 и CDKN2A (p16) [4].
Большинство НЭО ПЖ являются гормонально неактивными, клиническая симптоматика подобных образований начинает проявляться при локальном распространении опухолевого процесса (симптомы компрессии/стенозирования) или при развитии метастатического поражения печени. Опухоли, ассоциированные с клиническими синдромами, вызванными аномальной продукцией гормонов, рассматривают как функционирующие (синдромальные) НЭО. К ним относятся инсулиномы, гастриномы, глюкагономы, випомы и другие более редкие новообразования [5].
Диагностика
Перед постановкой диагноза эндокринолог совершает следующие действия:
1. Собирает анамнез жизни и болезни пациента, а также его семьи.
2. Делает объективный осмотр.
Инструментальные исследования позволяют:
1. Определить уровень гастрина: в лабораторных условиях удается выявить содержание в крови этого гормона. При синдроме Золлингера-Эллисона гастрин достигает 1000 пг/мл, в то время как при обычной язве его количество равно около 100 пг/мл.
2. Протестировать кислоту желудка.
3. Протестировать пациента на наличие хеликобактер пилори.
4. Исследовать брюшную полость ультразвуковым методом.
5. Провести селективную абдоминальную ангиографию.
6. Протестировать секретин.
7. Получить обязательную консультацию гастроэнтеролога и хирурга.
Наиболее информативными исследованиями являются:
1. Ультразвуковое исследование.
2. Компьютерная томография.
3. Селективная абдоминальная ангиография, при которой берут кровь из панкреатических вен для дальнейшего определения в ней содержания гастрина.
Клиническое наблюдение
Пациент К., 36 лет, госпитализирован 27.08.19 в отделение гастроэнтерологии Клиники Петра Великого при кафедре пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России с жалобами на умеренной интенсивности боль в эпигастральной области перед приемом пищи, чувство переполнения в подложечной области, чувство быстрого насыщения; эпизоды изжоги, отрыжки воздухом, периодически (по 2 раза в месяц в течение предшествующего года) послабление стула (до 2—3 раз в сутки, 5—6-й тип по Бристольской шкале, без патологических примесей), снижение массы тела на 10 кг в течение 3 мес на фоне ограничения простых углеводов (по рекомендации врача), периодически отмечает малой интенсивности боль в поясничном отделе позвоночника.
Из анамнеза известно, что впервые боль в эпигастральной области и диспепсические проявления возникли в июне 2022 г. на фоне приема нестероидных противовоспалительных препаратов (НПВП) — 2 курса в марте и июне 2022 г. по поводу интенсивной боли, обусловленной секвестрацией грыжи межпозвонкового диска поясничного отдела позвоночника. Перед плановым оперативным лечением 24.06.19 пациенту была выполнена эзофагогастродуоденоскопия (ЭГДС), по данным которой выявлены острые эрозии СО желудка. Состояние расценено как НПВП-индуцированная гастропатия, отменен прием НПВП, назначено лечение: висмута трикалия дицитрат (480 мг/сут), ребамипид (300 мг/сут), ИПП в стандартной суточной дозировке, итоприда гидрохлорид (150 мг/сут). Через 2,5 нед приема препаратов на фоне высокой комплаентности пациента значимого клинического и эндоскопического ответа достигнуто не было: сохранялся синдром боли в эпигастрии, при контрольном эндоскопическом исследовании сохранялись острые эрозии в теле и фундальном отделе желудка. Пациенту было рекомендовано продолжить прием висмута трикалия дицитрата, ребамипида, ИПП. Повторная ЭГДС выполнена 05.08.19 (через 6 нед после начала терапии): на фоне сохраняющихся эрозий в теле и фундальном отделе наблюдали появление плоских дефектов СО размером 0,4—0,5 см темно-коричневого цвета в антральном отделе желудка. Продолжен прием ИПП, цитопротекторов. В связи с отсутствием клинического ответа на фоне длительной адекватной терапии пациент госпитализирован для уточнения диагностического представления.
При проведении дообследования исключена патология паращитовидных желез, при рентгенографии пищевода, желудка и ДПК патологии не выявлено. При оценке онкомаркеров: СА 72-4, РЭА, СА 19-9 — в пределах референсных значений. В клиническом и биохимическом анализах крови, общем анализе мочи, копрограмме — без клинически значимых отклонений от нормы. При УЗИ органов брюшной полости органической патологии не выявлено.
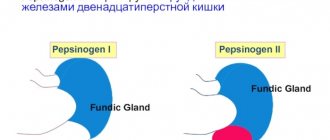
Через 2 нед после отмены ИПП (назначена терапия цитопротекторами и антацидами) пациенту было проведено исследование для определения инфицированности H. pylori (13С уреазный дыхательный тест) — H. pylori-статус отрицательный. При выполнении комплексного исследования «Гастропанель» выявлено 5-кратное повышение базального уровня гастрина-17 (G-17b) до 33,4 пмоль/л (норма 1—7 пмоль/л), увеличение уровня пепсиногена I (PGI) до 196 мкг/л (норма 30—160 мкг/л), пепсиногена II (PGII) до 33,2 мкг/л (норма 3—15 мкг/л), соотношение PGI/PG II, уровень общего гастрина — в пределах референсных значений.
После консультации психотерапевта (хронический психоэмоциональный стресс: руководящая должность, онкопатология у матери, сложные отношения с детьми в семье) пациенту назначена терапия антидепрессантами (амитриптилин 25 мг/сут) для нивелирования психоэмоционального компонента как возможной причины торпидного течения заболевания.
В контрольной ЭГДС №4 (30.08.19) на фоне приема ИПП в двойной дозе вновь зафиксирована отрицательная динамика: увеличение площади эрозий и геморрагий СО желудка, вовлечение в патологический процесс СО пищевода (эрозивный эзофагит степени A по LA) и ДПК (множественные эрозии под фибрином с вкраплением гематина размером 2—5 мм, рис. 1).
Рис. 1. Множественные эрозии двенадцатиперстной кишки под фибрином с вкраплением гематина.
При морфологическом исследовании биоптатов (с целью уточнения диагноза и исключения онкопатологии, в том числе MALT-лимфомы) выявлены фрагменты СО желудка с гиперплазией покровного эпителия, участками эрозий, регенераторными изменениями эпителия желез без очагов кишечной метаплазии, с уменьшением количества желез, отеком, мелкими очагами кровоизлияний в подслизистом слое, полнокровием сосудов, с диффузной слабой инфильтрацией лимфоцитов, участками склероза. При окраске по Романовскому—Гимзе H. pylori не обнаружена. При оценке гистологической картины ДПК выявлены признаки гиперплазии слизепродуцирующих клеток в покровном эпителии желез, диффузная лимфоцитарная инфильтрация, полнокровие сосудов и участки склероза. Заключение морфолога: Хронический гастрит стадия II, степень I по OLGA, H. pylori-статус отрицательный.
При выписке сформулирован диагноз: Хронический гастрит стадия II, степень I по OLGA, H. pylori-статус отрицательный. Множественные эрозии желудка и ДПК, гипергастринемия неуточненного генеза (синдром Золлингера—Эллисона?). Эрозивный эзофагит, стадия A (по LA). Астенический невроз.
Пациенту было рекомендовано продолжить прием ИПП в двойной дозе, цитопротекторов, антидепрессантов, а также дальнейшее обследование.
В ноябре 2022 г. пациент выполнил ЭУС (07.11.19), выявлено подслизистое образование нисходящей ветви ДПК (нейроэндокринная опухоль?). Проведено сканирование выявленного подслизистого образования нисходящей ветви ДПК (рис. 2): образование однородное, гипоэхогенное, исходит из 2-го эхослоя (глубокие слои СО). Размер 7´5 мм. Контуры размытые, неровные. Подслизистый слой под образованием прослеживается, выраженно истончен. Мышечный слой интактен. При эластографии обнаружено образование повышенной плотности. Парагастрально в области 4-й эхогруппы — множественные лимфатические узлы диаметром до 6 мм, округлые. По ходу печеночно-двенадцатиперстной связки — лимфатические узлы до 12 мм, с сохраненной кортико-медуллярной структурой. Заключение: ЭУС-картина, более вероятно соответствует НЭО нисходящей ветви ДПК, T1N0MX. Парагастральная лимфаденопатия. Лимфаденопатия по ходу печеночно-двенадцатиперстной связки.
Рис. 2. Подслизистое образование нисходящей ветви двенадцатиперстной кишки.
При гистологическом исследовании биоптатов ДПК (08.11.19, НМИЦО им. Н.Н. Петрова): фрагменты СО ДПК с сохраненными ворсинками, умеренной хронической воспалительной инфильтрацией, без активности, с очаговой гиперплазией нейроэндокринных клеток. Гистологическое исследование биоптатов желудка: хронический диффузный гастрит со слабым воспалительным компонентом, без активности, H. pylori-обсеменение отсутствует.
По результатам МСКТ с контрастированием (16.11.19, НМИЦО им. Н.Н. Петрова) выявлено гиперваскулярное образование диаметром 5 мм в ДПК. Других гиперваскулярных образований в зоне сканирования не обнаружено.
В декабре 2022 г. пациенту выполнено электрохирургическое удаление опухоли методом ЭПР. При морфологическом исследовании операционного материала выявлена высокодифференцированная НЭО G1 ДПК (7 мм в наибольшем измерении, 0—1 митоз на 2 мм2 опухоли), локализующаяся в собственной и мышечной пластинках СО с инвазией в подслизистый слой на глубину 2300 мкм. Лимфоваскулярная инвазия не выявлена. По данным иммуногистохимического исследования: СК 8, CgA, Synaptophysin — позитивны, Ki-67 — 2%.
Послеоперационный период протекал без осложнений. После выписки у пациента купировались все жалобы, терапия ИПП продолжена в течение 4 нед. Через 4 нед выполнен эндоскопический контроль: состояние после полностенного эндоскопического удаления НЭО D2 порции ДПК (гастринома G1). Эндоскопических данных за постоперационный стеноз ДПК не получено. Выявлена эритематозная антральная гастропатия.
Лечение
Бывает двух видов:
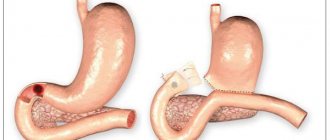
1. Оперативное – заключается в хирургическом удалении злокачественных опухолей – резекции.
2. Консервативное – подразумевает лечение ингибитор-протонной помпой (омепразолом, пантопразолом, лансопразолом), которая снижает секрецию соляной кислоты. Это препараты, устраняющие язвы желудка и двенадцатиперстной кишки.
Получить консультацию врача можно в нашем центре эндокринологии в Самаре можно отправив онлайн заявку с нашего сайта или позвонив. Будьте Здоровы!