Атрофический гастрит или более правильное медицинское название атрофия слизистой оболочки желудка – это необратимый процесс, при котором происходит гибель клеток слизистой желудка, вырабатывающих желудочных сок и соляную кислоту. К атрофии, также относится постепенное замещение клеток желудка соединительной тканью и клетками, сходными по строению с клетками слизистой оболочки кишечника.
Атрофия слизистой оболочки желудка – это опасное для здоровья состояние, так как с течением времени и, особенно, при наличии дополнительных факторов риска, она может привести к развитию рака желудка.
Причины атрофического гастрита
Выделяют более десяти различных причин, каждая из которых способна приводить к атрофии слизистой оболочки желудка. Чаще всего такое состояние является результатом длительного течения воспаления, на фоне хронического гастрита.
Хронический гастрит – это распространенное заболевание (выявляется до 30% населения в различных популяциях), имеющее хроническое и рецидивирующее течение, проявляющееся воспалением слизистой оболочки желудка и подтвержденное морфологическим исследованием.
Причинами развития хронического гастрита являются:
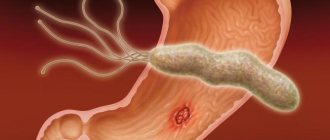
- наличие инфекции Хеликобактер пилори (H. pylory);
- воспаление, вызванное аутоиммунным процессом, когда собственная иммунная система повреждает клетки слизистой желудка;
- длительный прием лекарств, например, нестероидных противовоспалительных препаратов (НПВС);
- доуденогастральный рефлюкс, когда содержимое двенадцатиперстной кишки, в том числе желчь, забрасывается в желудок;
- длительный контакт с вредными веществами во время работы;
- воздействие радиации;
- наличие других хронических заболеваний, например, целиакия, болезнь Крона, саркоидоз;
- пищевая аллергия;
- эндокринные нарушения;
- другие инфекции (кроме Н. рylori), грибы, паразиты.
То есть, в большинстве случаев атрофия слизистой желудка является результатом наиболее часто встречающегося (80%) хронического гастрита, вызванного хеликобактерной инфекцией, или аутоиммунного гастрита, который встречается в 1-2% случаев. В данной статье подробно рассмотрена атрофия, связанная с этими двумя причинами.
О.Я. Бабак, д.м.н., профессор, директор Института терапии им. Л.Т. Малой АМН Украины, г. Харьков
Под атрофическим гастритом понимают прогрессирующий воспалительный процесс слизистой оболочки желудка, характеризующийся утратой желудочных желез. Клинико-морфологической особенностью атрофического гастрита являются уменьшение числа специализированных гландулоцитов, обеспечивающих секреторную функцию желудка, и замещение их клетками более простыми, в том числе вырабатывающими слизь. Обширная атрофия слизистой оболочки тела желудка, как правило, ассоциируется с гипосекрецией соляной кислоты и нарушением выработки пепсиногена.
Что сегодня известно об атрофическом гастрите? Наиболее частыми этиологическими факторами, вызывающими атрофический гастрит, признаны инфекция Helicobacter Pylori (Н.Pylori) и аутоиммунный гастрит. Причем, с Н. pylori связывают возникновение подавляющего большинства атрофических гастритов. Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический. Атрофический гастрит клинически, как правило, в течение длительного времени ничем себя не проявляет, поэтому диагноз хронического гастрита, скорее, морфологический, нежели клинический. Основным методом диагностики атрофического гастрита является эндоскопическое исследование. При эндоскопии производят осмотр пищевода, желудка, двенадцатиперстной кишки. При выраженной атрофии слизистая оболочка желудка имеет характерные отличия в сравнении с таковой при, например, поверхностном гастрите. Окончательный диагноз позволяет установить морфологический анализ биоптатов слизистой оболочки желудка, взятых во время эндоскопии. Морфологически атрофия определяется уменьшением числа функционирующих специализированных клеток желудка. Доказано, что при Н. pylori-ассоциированном гастрите процессы атрофии чаще возникают при инфицировании определенными штаммами (Cag A+ и Vac A+) Н. pylori. Одним из морфологических признаков атрофического гастрита является кишечная метаплазия, которая традиционно рассматривалась как предраковое изменение слизистой оболочки желудка. Другие методы исследования – рентгенография желудка, ультразвуковое исследование брюшной полости и компьютерная томография – в плане диагностики атрофического гастрита неинформативны.
Чего нужно опасаться при атрофическом гастрите? Каков прогноз болезни? Гипотетически наличие атрофического гастрита при естественном течении может иметь два сценария. Первый – длительно существующий хронический гастрит приводит к значительному уменьшению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант – в результате длительного хронического персистирующего воспаления в слизистой оболочке желудка, характерного для Н. pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем – к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим. По определению ВОЗ, под дисплазией понимают такие клеточные изменения, при которых часть эпителия замещена клетками с различной степенью атипии. В международной классификации эпителиальных неоплазий пищеварительного тракта (2000) дисплазия – это неоплазия, другими словами – опухоль. Итак, атрофический гастрит может трансформироваться в рак желудка. Наибольшую опасность в плане развития рака представляет атрофический гастрит с пониженной кислотообразующей функцией желудка (частота возникновения рака – до 13%). Среди известных в настоящее время молекулярных механизмов, лежащих в основе наследственной предрасположенности к раку желудка, выделены: индукция экспрессии TGF-β1, частичный полиморфизм кластера гена IL-1 (IL-1β). В результате развития атрофии слизистой оболочки желудка снижается ее противоопухолевая защита, создаются условия для активного воздействия канцерогенов. При возникновении тяжелой атрофии эпителия тела желудка риск развития рака желудка повышается в 5 раз в сравнении с таковым при неатрофическом гастрите. Бактерии Н. pylori относят к биологическим канцерогенам в отношении рака желудка. Большинство исследователей считают, что Н. pylori – это основной этиологический фактор развития хронического гастрита, который является обязательным звеном в каскаде процессов, приводящих к раку желудка. На основании анализа результатов многоцентровых исследований Международное агенство по изучению рака при ВОЗ еще в 1994 году рекомендовало считать инфекцию Н. pylori абсолютным канцерогеном для человека. В настоящее время рак желудка рассматривается как конечный результат длительного многоступенчатого и многофакторного процесса, в котором клеточные изменения слизистой оболочки желудка обусловлены нарушениями микроокружения. Этот процесс называют именем описавшего его автора – каскадом Корреа (1995). Он включает хронический гастрит, кишечную метаплазию, дисплазию и рак. Н. рylori-ассоциированный желудочный канцерогенез – многоэтапный процесс, характеризующийся развитием хронического гастрита – первой ступени в эволюционном каскаде. Последующие изменения приводят к формированию атрофии, тонкокишечной (I и II типы) и толстокишечной (III тип) метаплазий и дисплазии желудочного эпителия, в итоге – к аденокарциноме желудка. Именно атрофический гастрит занимает срединное положение в цепи вышеперечисленных изменений на пути к раку желудка.
Как избежать трансформации атрофического гастрита в рак желудка? Ответ на данный вопрос состоит из равных по значимости частей: как можно раннее выявление предраковых изменений, их адекватное лечение и предупреждение (профилактика) проявления последних. При наблюдении больных хроническим гастритом важно уловить тот момент, когда возникает и начинает прогрессировать атрофия слизистой оболочки желудка, причем желательно это проводить простым информативным и неинвазивным способом.
Своевременное выявление атрофии слизистой оболочки желудка – первый диагностический этап выявления риска по раку желудка.
Многочисленные исследования последних лет показали, что очаги полной и неполной кишечной метаплазии слизистой оболочки желудка нельзя расценивать в качестве достоверного маркера повышенного риска развития рака желудка. Исследования свидетельствуют, что значительно важнее оценка не типа метаплазии, а ее объема. Так, при большом объеме метаплазии, превышающем 20% поверхности желудочного эпителия, создаются реальные условия для развития дисплазии с последующим образованием аденокарциномы желудка. Следовательно, риск развития рака желудка повышается при тяжелой атрофии желудочного эпителия, характеризующейся обширными очагами кишечной метаплазии. Как же на практике определить площадь такого поражения? Следует помнить, что данные изменения происходят на клеточном уровне, и при обычной эндоскопии их распознать невозможно. Доступным и эффективным способом диагностики метапластических изменений в слизистой оболочке желудка является метод хромогастроскопии – прижизненная окраска слизистой желудка красителем (чаще метиленовым синим), проводимая во время эндоскопического исследования. Данная методика основана на поглощении красителя очагами кишечной метаплазии, что позволяет оценить их размеры, выполнить прицельную биопсию для гистологического анализа биоптата слизистой и выявить возможную дисплазию или метаплазию. Вместе с тем морфологическая диагностика атрофического гастрита сопряжена с рядом трудностей. Сложность постановки диагноза атрофии морфологическим методом обусловлена тем, что на ранних стадиях процесс никогда не бывает диффузным, следовательно, результаты гастробиопсии могут способствовать гипер- и гиподиагностике. При воспалении может изменяться микроскопическая картина и неадекватно оцениваться проявления атрофического гастрита из-за ложного вывода о потере желез. Высока и субъективность методики. Все это заставляет искать другие надежные пути тестирования атрофических изменений слизистой оболочки желудка. Разработан ряд малоинвазивных гематологических тестов (тестовая панель Biohit), позволяющих избежать ошибок диагностики, дать совокупную оценку состояния слизистой оболочки желудка, степени ее атрофии и потери нормальных желез и клеток в антральном отделе и теле желудка. Во время проведения эндоскопического исследования обязательно должна проводиться детекция на наличие Н. pylori. При этом наиболее целесообразным следует признать уреазный или гистологический методы (из гастробиоптатов) исследования. Определение уровня сывороточного пепсиногена (S-PGІ) или соотношения содержания пепсиногена I к пепсиногену II (PGI/PGII) – неэндоскопический метод диагностики атрофического гастрита с поражением тела желудка. С увеличением степени атрофии слизистой оболочки тела желудка (потеря нормальных кислотообразующих желез) уровни S-PGI и PGI/PGII постепенно снижаются. Определение уровня гастрина в сыворотке крови, преимущественно гастрина-17 (S-G-17), может быть использовано в качестве индикатора морфологического состояния слизистой оболочки антрального отдела желудка. То есть снижение S-G-17 является биохимическим маркером атрофического гастрита с поражением антрального отдела желудка (потеря антральных G-клеток). Снижение уровней S-G-17 и S-PGI можно рассматривать как результат прогрессирующего атрофического гастрита с потерей нормальных желез и клеток слизитой оболочки тела и антрального отдела желудка. G-17 практически полностью синтезируются и секретируются G-клетками антрального отдела желудка. Эти клетки являются компонентами нормальных антральных желез, в случае прогрессирования атрофического гастрита их количество уменьшается на фоне поражения антральных желез и появления кишечной метаплазии. При Н. pylori-ассоциированном гастрите имеется тенденция к возрастанию серологических уровней G-17 и PGI. Низкая внутрижелудочная кислотность способствует увеличению серологического уровня G-17, и наоборот. Перманентная длительная гипо- или ахлоргидрия приводят к чрезвычайно высоким уровням G-17 в крови. Особенно часто это наблюдается при пониженной кислотности (атрофический гастрит с поражением тела желудка) в сочетании с сохраненной слизистой оболочкой антрального отдела. Такая клиническая картина наиболее характерна для аутоиммунного атрофического гастрита. Если в антральном отделе имеются сопутствующие признаки атрофии слизистой оболочки (мультифокальный атрофический гастрит), тогда содержание S-G-17 не возрастает, и тестовая панель показывает низкие значения уровней S-PGI и S-G-17. Совокупная точность тестовой панели в диагностике атрофического гастрита – около 80% (при сопоставлении с результатами эндоскопии и биопсии). Данная тестовая панель является малоинвазивной альтернативой первоначального обследования пациентов с подозрением на желудочную атрофию и дисплазию. Она позволяет надежно выявлять пациентов с различными формами гастрита, определять локализацию и этиологию патологического процесса, оценивать вероятность развития рака желудка и выстраивать дальнейшую тактику ведения больного. Учитывая связь возникновения атрофии желудочного эпителия и кишечной метаплазии с инфекцией Н. pylori, становится очевидным выбор метода лечения и профилактики дальнейшего прогрессирования процесса. Методом выбора является антихеликобактерная терапия. В 2002 году японские исследователи убедительно доказали возможность регрессии метапластических изменений слизистой оболочки желудка после успешного уничтожения бактерий Н. pylori. С помощью хромоскопии им удалось установить, что в течение пяти лет после проведения успешной антихеликобактерной терапии размеры очагов кишечной метаплазии уменьшились почти в 2 раза в сравнении с исходными. В последующих исследованиях подтвердилась целесообразность такого терапевтического подхода. В настоящее время не вызывает сомнений необходимость проведения антихеликобактерной терапии пациентам с атрофическим гастритом. Предварительные данные нескольких многоцентровых исследований по мониторингу Н. pylori-ассоциированного предрака и рака желудка свидетельствуют в пользу реверсии воспаления слизистой оболочки желудка и связанных с ней атрофии, кишечной метаплазии и генетической нестабильности. В связи с этим в идеале пациентам с Н. pylori-позитивным хроническим атрофическим гастритом необходимо проводить эрадикационную терапию, а при отсутствии эффекта – исследование с целью выявления маркеров генетической нестабильности и тщательный мониторинг. Данная рекомендация нашла отражение в международных рекомендациях по диагностике и лечению заболеваний, ассоциированных с Н. pylori – Маастрихтском консенсусе 3 (2005). Для уничтожения бактерий Н. pylori, как и в Маастрихтском консенсусе 2 (2000), рекомендованы трех- и четырехкомпонентные схемы антибактериальных препаратов в сочетании с ингибиторами протонной помпы (ИПП) в стандартных дозах: ИПП + кларитромицин + амоксициллин и ИПП + тетрациклин + метронидазол (фуразолидон) + коллоидный висмут. Вместе с тем следует помнить, что полное восстановление структуры слизистой оболочки при тяжелой атрофии до нормы требует длительного времени, и в ряде случаев, по всей видимости, это не возможно. В случаях, когда предопухолевые процессы не подвергаются обратному развитию либо прогрессируют, необходимо применять более радикальные методы лечения, используя арсенал современных эндоскопических операций, вплоть до резекции слизистой оболочки желудка. Главная цель первичной профилактики атрофического гастрита – своевременное и эффективное лечение поверхностного хеликобактерного гастрита. Для этого используют стандартные схемы антихеликобактерной терапии, в соответствии с рекомендациями Маастрихтских консенсусов 2 (2000) и 3 (2005). Важным моментом является последующий контроль за успешностью этой терапии. Контроль необходимо проводить с использованием неинвазивных методов (дыхательного уреазного или стул-теста). При неудачной эрадикации проводить повторные курсы лечения. Кроме того, доказано, что, придерживаясь здорового режима питания, можно снизить онкологический риск (прогрессирование атрофии), что подтверждено в исследованиях, проведенных в ряде стран. Рекомендуется избегать употребления консервированных, маринованных и копченых продуктов, отказаться от курения и употребления крепких спиртных напитков (особенно в сочетании с жирной, жареной, копченой и соленой пищей), исключить переедание. Необходимо контролировать массу тела, выполнять активные физические нагрузки, употреблять больше свежих овощей (в том числе лук и чеснок), фруктов и натуральных соков, витаминов А, С, b-каротина, зелени, круп грубого помола, молочных продуктов. В некоторых развитых странах Европы и США внедрение здорового образа жизни привело к снижению заболеваемости раком желудка в несколько раз, сегодня это заболевание в этих странах считается редким, составляя лишь 3% среди злокачественных новообразований. Мониторирование – постоянное наблюдение с периодическим повторным обследованием – абсолютно обязательно для пациентов с атрофическим гастритом Итак, в настоящее время очевидна необходимость особого внимания к атрофическому гастриту. Комплексное применение современных методов исследования – эндоскопического, морфологического, гематологического (тестовой панели) и других – способствует его точной диагностике. Использование эффективных методов лечения и профилактики атрофического гастрита, устранение условий, которые способствуют его развитию, представляют сегодня реальную возможность улучшить прогноз этого заболевания, устранить риск развития рака желудка.
Литература 1. Е.Г. Бурдина, Е.М. Майорова, Е.В. Григорьева, И.И.Тимофеева, О.Н. Минушкин // Гастрин-17 и пепсиноген І в оценке состояния слизистой оболочки желудка // Российский медицинский журнал, 2006, №2, с. 9-11. 2. Х. Ваананен, М. Ваухконен, Т. Хэлске, И. Каариянен, М. Расмуссен, Х. Тунтури-Хихнала, Дж. Коскенпато, М. Сотка, М. Турунен, Р. Сандстрем, М.Ристиканкаре, А. Юссила, П. Сиппонен // Неэндоскопическая диагностика атрофического гастрита на основании анализа крови: корреляция между результатами гистологического исследования желудка и уровнями гастрина-17 и пепсиногена І в сыворотке // Клинические перспективы гастроэнтерологии, гепатологии, 2003, № 4, с. 26-32. 3. В.Д. Пасечников, С.З. Чуков, С.М. Котелевец / Профилактика рака желудка на основе эрадикационной терапии предопухолевых заболеваний // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2003, № 4, с. 11-19. 4. А.А. Шептулин, В.А. Киприанис / Диагностика и лечение инфекции Helicobacter pylori: основные положения согласительного совещания «Маастрихт – 3» // Российский журнал гастроэнтерологии гепатологии колопроктологии, 2006, № 2, с. 88-91. 5. Kim N., Lim S. H., Lee K.H. et al. Long-term effects of Helicobacter pylori eradication on intestinal metaplasia in patients with duodenal and behign gastric ulcers Dig. Dis. Sci. – 2000. – Vol. 45. – 1754-1762. 6. Malfertheiner P., Megraud F., O’Morain C. еt al. Current concepts in the management of Helicobacter pylori infection – The Maastricht 2 Concensus Report // Aliment. Pharmacol. Ther. – 2002. – Vol. 16. – P. 167-180.
Что происходит с клетками слизистой оболочки при атрофии?
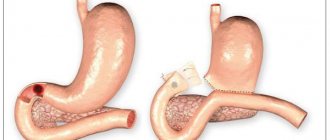
Слизистая оболочка желудка состоит из трех слоев. Верхний слой, покрывающий всю внутреннюю поверхность желудка, образован из клеток, производящих слизь для защиты от агрессивного воздействия желудочного сока. Под ним находится самый важный слой, имеющий название «собственной пластинки желудка». В нем расположены железы желудка, вырабатывающие вещества, образующие желудочный сок — соляную кислоту, пепсин, гормоны (внутренний фактор Кастла). В третьем слое находятся мышечные клетки, главная задача которых, обеспечивать подвижность слизистой желудка для продвижения пищи.
Атрофия слизистой оболочки желудка затрагивает верхний слой и собственную пластинку желудка и является почти необратимым процессом, который можно замедлить, если устранить причины воспаления.
Слизистая желудка находится под действием агрессивной среды, поэтому ее клетки полностью обновляются каждые три дня. Воспалительный процесс, развивающийся вследствие влияния внешних факторов, например, бактериальная инфекция или внутренних причин, например, реакция иммунной системы, нарушает процесс обновления (регенерации) клеток слизистой желудка, в том числе и клеток желез желудка, вырабатывающих желудочный сок. В результате клетки желез желудка погибают и замещаются клетками соединительной ткани, а также клетками по строению схожими с клетками кишечника.
Этот процесс можно диагностировать с помощью гистологического исследования образцов слизистой желудка. Если выявлено только уменьшение количества клеток желудочных желез, то говорят только об атрофии слизистой оболочки желудка. Если же в исследуемом образце будут обнаружены клетки кишечника, то устанавливается диагноз атрофия с кишечной метаплазией. Метаплазия – это появление клеток, нетипичных для данного органа.
Народные средства и диета
Диета — обязательное условие лечение желудка
Диета является неотъемлемой частью лечения. Поскольку страдает слизистая оболочка желудка, вся пища должна быть легкой, приготовленной без использования масла, чтоб снизить нагрузку на больной желудок. Грубые волокна нужно исключить. Желательно, чтобы пища была мелко порублена или перекручена. Необходимо следить за температурой пищи. От всего горячего и холодного придется отказаться. Блюда должны быть только теплыми.
Запрещены все продукты, содержащие специи, приправы, канцерогены, большое количество соли, копчености, газированные и алкогольный напитки, консервы, кремовые торты, шоколад, домашние и покупные соленья. Жареные блюда и жирное мясо также нужно исключить из рациона. Мясные блюда должны быть постными, приготовленными на пару. Овощи лучше отварные. Нежирные и некислые молочные продукты разрешены. Можно употреблять супы-пюре из овощей, без мясных бульонов и зажарки. Из напитков разрешены некислые натуральные муссы и кисели, минеральная вода без газа, некрепкий чай. \
Помните, что лечебную минеральную воду, которую продают в аптеках, нельзя пить безгранично. Это лекарственное средство, содержащее определенное количество веществ и минералов. Дозировку определяет врач.
Старайтесь всеми возможными способами повышать себе аппетит, чтобы не допустить истощения. Пусть блюда будут сервированы красиво, они должны выглядеть привлекательно для вас даже без специй и майонеза. В качестве дополнительного лечения врач может назначить травяной сбор или настойки из трав, улучшающих пищеварение. Так при атрофическом гастрите полезна смесь из корневища аира, меда и коньяка, а также зверобой, подорожник, тысячелистник, перечная мята, тмин, семя льна, шалфей, укроп. Поможет восстановить слизистую оболочку желудка натуральная черника, перетертая с сахаром. Нужно принимать по чайной ложке натощак по утрам. Но ягоды должны быть обязательно свежие. Варенье не даст желаемого эффекта, так как большинство витаминов разрушается при термической обработке.
Как правильно диагностировать атрофию слизистой желудка?
Для диагностики атрофического гастрита используется ФГДС (гастроскопия) с забором не менее 5 биоптатов (небольших фрагментов слизистой) из разных отделов желудка. Количество биоптатов определено строением желудка, так как атрофия в разных отделах развивается разными темпами, и поэтому необходимо произвести забор из всех пяти отделов.
Диагноз устанавливается врачом-морфологом после проведения гистологического исследования. На основании данного исследования подбирается лечение и определяется периодичность обследований для своевременного выявления онкологического процесса.
Также для оценки выраженности атрофии используется определение активности секреторной функции желудка по лабораторному анализу крови – Гастропанель (ссылка).
Диагностику хеликобактерной инфекции проводят с помощью исследования биоптатов и 13С-уреазного дыхательного теста.
При аутоиммунном гастрите проводятся лабораторная диагностика анализа крови на определение антител к клеткам желудка и к внутреннему фактору Кастла.
Несколько слов о сывороточных маркерах
Мы имеем диагностический алгоритм выявления заболеваний желудка, который показано проводить всем пациентам, имеющим боль или дискомфорт в верхних отделах живота.
Пепсиногены
Различают семь изоформ предшественников пепсина, из которых пять обозначают как группу Пепсиноген I главных клеток тела желудка и Пепсиноген II, равномерно секретируемый железами всего желудка и 12-перстной кишки. Образовавшиеся в желудке пепсиногены всасываются в кровь и определение сывороточного уровня их является общепризнанным маркером атрофического гастрита «серологическая биопсия».
Снижение уровня Пепсиногена I говорит о степени выраженности атрофического гастрита тела желудка, а поскольку активизация Пепсиногена I в активный пепсин происходит при участии соляной кислоты, то по уровню Пепсиногена I можно условно представить уровень кислотности желудка. Пепсиноген II вырабатывается во всех отделах желудка и в 12-перстной кишке. По мере увеличения тяжести атрофии уменьшается соотношение сывороточного уровня Пепсиногена I и Пепсиногена II, что свидетельствует о тяжести атрофии и распространении процесса.
Гастрин
Гастрин-17, вырабатываемый в выходном отделе желудка после стимуляции клеток различными факторами (растяжение желудка, белковой пищи). В случае атрофии слизистой антрального отдела желудка секреция Гастрина-17 снижается. Чтобы оценить наличие и тяжесть атрофического процесса в желудке, необходимо проведение пробы со стимуляций белком, снижение которой показывает степень выраженности атрофии, в случае атрофии слизистой антрального отдела желудка секреция Гастрина-17 пропорционально снижается. У пациентов с выраженным атрофическим гастритом в области антрального отдела желудка риск развития рака желудка в 90 раз выше, чем у людей с нормальной слизистой желудка.
Гомоцистеин
Гомоцистеин — ранний маркер клеточного функционального дефицита В12, В6, фолиевой кислоты вследствие развития атрофического гастрита и других причин – возраст, курение, хеликобактерная инфекция и др. При атрофическом гастрите уровень гомоцистеина повышается в крови и становится токсичным для организма. При сдаче крови на гомоцистеин следует отказаться за 1 день до исследования от белковой пищи, витаминов, гормональных контрацептивов. Этот тест может быть дополнением к Гастропанели или самостоятельным тестом при других заболеваниях.
Атрофический гастрит, связанный с хеликобактерной инфекцией
После инфицирования бактерией Helicobacter Pylory, в слизистой желудка развивается воспаление и хронический неатрофический гастрит. Железы желудка в начале заболевания вырабатывают достаточное количество желудочного сока. При отсутствии лечения, воспаление становится более активным и распространяется на все отделы желудка, приводя к атрофии слизистой) и частичному замещению клеток желудка кишечными клетками (кишечная метаплазия).
Симптомы
В начале заболевания гастрит протекает бессимптомно. При прогрессировании атрофии, появляются симптомы, связанные со снижением выработки соляной кислоты и других составляющих желудочного сока:
- ухудшение аппетита,
- отрыжка воздухом или тухлая отрыжка;
- тошнота;
- чувство тяжести и переполнения желудка;
- плохой запах изо рта; слюнотечение, неприятный привкус во рту;
- урчание, вздутие живота;
- непереносимость некоторых продуктов;
- неустойчивый стул;
- тупые, ноющие боли, усиливающиеся после приема пищи;
- похудание.
Лечение
Эрадикация (уничтожение) Helicobacter Pylory является первым этапом лечения при данном варианте атрофического гастрита.
Диагностика
Диагностированием и лечением гастритов с низкой кислотностью занимается гастроэнтеролог и врач-эндоскопист. Специалист проводит осмотр пациента и проводит ряд обследований:
- морфологические исследования;
- рентгенографию желудка;
- эзофагогастродуоденоскопию;
- эндоскопическую биопсию;
- гастроскопию;
- определение уровня пепсиногена;
- зондирование желудка с внутрижелудочной рН-метрией;
- исследование желудочного сока;
- диагностирование pylori с помощью метода ИФА кала, ПЦР-исследования, выявления антител в крови и дыхательного теста на данный микроорганизм.
Цель данных исследований – не спутать заболевание с другими патологиями, и поставить точный диагноз. По результатам обследований гастроэнтеролог назначает схему лечения. Если требуется, лечащий врач направляет на консультацию к диетологу, который составляет соответствующую диету. В отдельных случаях для устранения сопутствующих заболеваний требуется консультация других специалистов узкой направленности (кардиолога, терапевта).
Аутоиммунный атрофический гастрит
При данном типе хронического гастрита клетки желудка повреждаются антителами, которые вырабатывает собственная иммунная система. При этом развивается хроническое воспаление, приводящее к атрофии желез желудка и снижению выработки соляной кислоты и внутреннего фактора Кастла, обеспечивающего усвоение витамина B12. Значительное снижение выработки внутреннего фактора Кастла может вызывать анемию В12-дефицитную анемию (пернициозную анемию) – заболевание, для которого характерно нарушение кроветворения.
Симптомы
Симптомы аутоиммунного атрофического гастрита схожи с симптомами, атрофии, вызванной хеликобактерной инфекцией.
Дополнительно развивается анемия, часто аутоиммунному гастриту могут сопутствовать другие аутоиммунные заболевания.
Лечение
Специфического лечения при аутоиммунном гастрите нет, лечение кортикостероидами используется только в исключительных случаях.
Виды заболевания
В зависимости от локализации и сопутствующих симптомов гастриты бывают следующих видов:
- Атрофический гастрит с пониженной кислотностью. Наблюдается истончение слизистой, ткани отмирают, теряют свою защитную функцию. Подразделяется на антральный, диффузный. Сильное снижение уровня кислоты в желудке – наиболее опасное состояние, поскольку способно провоцировать рак. Точной причины его развития до сих пор не установлено, но не последнюю роль играет переедание, нарушение режима питания, прием гормональных препаратов, антибиотиков в качестве самолечения.
- Хронический гастрит желудка с пониженной кислотностью. Это заболевание, в свою очередь, подразделяют на стадию компенсации, частичной компенсации и декомпенсации. Хронический вариант развивает медленно: вначале кислотность значительно повышается. Если не начать лечение, клетки, производящие кислоту, отмирают и ее вырабатывается мало. Кислотность приходит в норму. При дальнейшем прогрессировании начинается атрофия (отмирание) слизистой желудка, и возникает хронический вариант заболевания. Хронический гастрит с пониженной секрецией часто вызван бактерией H. Pylori.
Симптомы
Отличительной особенностью атрофического гастрита является вероятность развития воспалительного процесса без болевого синдрома. Пациент может ощущать дискомфорт в системе пищеварения под воздействием определенных факторов. При патологии обязательно возникают отклонения в переваривании пищи и опорожнении кишечника.
Острые боли при данном заболевании в большинстве случаев отсутствуют. Выраженный болевой синдром проявляется только при наличии сопутствующих осложнений.
Общие симптомы:
- ноющая боль в зоне органов пищеварения после еды;
- бледность, сухость кожных покровов;
- отсутствие аппетита, снижение массы тела;
- повышенная кровоточивос
- чрезмерная потливость;
- железодефицитная анемия;
- урчание в животе после еды;
- чередование запоров с диареей;
- отрыжка воздухом с неприятным запахом;
- ощущение переполненности кишечника;
- чрезмерная утомляемость организма;
- общая слабость организма.
Профилактика
Атрофический гастрит является хроническим заболеванием пищеварительного тракта. Первичная его профилактика заключается в здоровом питании, соблюдении правил личной гигиены. Вторичные меры предотвращения недуга включают в себя регулярное обследование у гастроэнтеролога. Заболевание может развиваться в бессимптомной форме. Выявить прогрессирование недуга сможет только врач.
Меры профилактики:
- восполнение запаса витаминов в организме;
- укрепление иммунной системы;
- отказ от вредных привычек;
- прием медикаментов согласно инструкциям;
- исключение малоподвижного образа жизни;
- своевременное лечение заболеваний пищеварительной системы;
- соблюдение правил здорового питания;
- исключение пренебрежения правилами личной гигиены.