Видно ли злокачественное образование при эндоскопии?
Важность фиброгастродуоденоскопии для диагностики рака желудка трудно переоценить. Именно это исследование позволяет выявить или подтвердить диагноз злокачественного новообразования, а также определить тип процесса. Это стало возможным благодаря биопсии подозрительных участков слизистой оболочки желудка. Забранные ткани отправляются на цитологическое исследование, которое за 5-10 дней дает заключение о типе ткани.
Важно Международные рекомендации советуют проводить ФГДС всем пациентам старше 45 лет, у которых врач после опроса и обследования подозревает наличие рака желудка.
Это позволяет выявить заболевание на ранней стадии, когда общий прогноз более положительный, а средняя продолжительность жизни составляет 10 и более лет.
Симптомы
Рак желудка – это злокачественное новообразование, которое развивается из эпителия слизистой оболочки органа. Согласно официальной статистике, это заболевание занимает вторую строчку по частоте выявления среди онкологических патологий в России. При этом установлено, что рак желудка чаще встречается у мужчин в возрасте более 45 лет.
Проблема этого заболевания в том, что оно поздно диагностируется. Только в 7% случаев (часто случайно) рак желудка удается обнаружить на первой или второй стадии, когда еще нет отдаленных метастазов, а более половины пациентов полностью выздоравливают.
В остальных больных онкологический процесс успевает метастазировать в лимфатические узлы, органы брюшной полости, кости или головной мозг. Тогда эффективность даже наиболее современного лечения гораздо ниже, и только 5-22% пациентов проживают еще 5 лет после постановки диагноза.
4 стадии рака желудка
Клиническая картина рака желудка часто малозаметная (особенно на первых стадиях). На передний план выходят следующие симптомы:
- снижение аппетита;
- ощущение тяжести в верхнем отделе живота;
- периодические ноющие боли желудка;
- тошнота после приема пищи;
- отрыжка;
- однократная рвота;
- уменьшение массы тела;
- слабость, снижение работоспособности.
Часто заболевание обнаруживают только тогда, когда возникают хирургические осложнения (например, перфорация стенки желудка, желудочное кровотечение, тромбоз печеночных вен).
Иногда случаются ситуации, когда сначала обнаруживают отдаленные метастазы (например, в печени при УЗИ). Тогда проводят дополнительные обследования (ФГДС, компьютерная или магниторезонансная томография), чтобы обнаружить первичную опухоль.
Особенности диагностики
Фиброгастродуоденоскопию проводят в эндоскопическом кабинете на «голодный» желудок пациента. Наиболее часто делают местную анестезию задней стенки ротоглотки, или вводят препарат для седации (медикаментозного сна). Под наркозом или седацией ФГДС проводится в ситуации, если сразу после завершения процедуры планируется неотложное оперативное вмешательство.
Зонд вводится через ротовую полость, проходит через пищевод и попадает в просвет желудка. При подозрении на онкологическую патологию врач проводит тщательный осмотр слизистой оболочки. В норме она должна быть розового цвета, без дефектов, признаков воспалительного процесса или разрастания.
Как делают гастроскопию
Чтобы избежать осложнений после проведения процедуры ФГДС к ней важно не только подготовиться, но и соблюдать диету по ее окончанию. Легче перенести введение зонда поможет эта статья.
Классификация заболевания
Современные рекомендации выделяют три типа раннего рака желудка, которые имеют различные особенности роста:
- Полипозный. При осмотре обнаруживается небольшой полип (разрастание слизистой оболочки). Визуально определить его злокачественность невозможно.
- Поверхностный рак. Характеризуется отличиями в цвете слизистой оболочки, возможен небольшой отек или реактивная воспалительная реакция.
- Язвенный тип. При ФГДС новообразование напоминает эрозию или язву (дефект слизистой оболочки). Необходима дифференциальная диагностика с язвенной болезнью.
Визуальная картина
Если исследование проводится уже на более поздней стадии, то согласно классификации Боррмана возможны 4 варианта визуальной картины:
- Полиповидное новообразование. Эндоскопист видит разрастание слизистой оболочки на широкой ножке. Обнаруживается в трети случаев.
- Полиповидный рак с изъявлением. Новообразование имеет корытовидную форму. С краю видно разрастание эпителия с эрозией или зоной некроза, которые находятся в центре опухоли. Наблюдается приблизительно у 30% пациентов.
- Инфильтративно-язвенный вариант. Разрастание онкологического процесса происходит преимущественно в толщи стенки желудка. На поверхности можно наблюдать язву (иногда до 2-3 см в диаметре), локальный воспалительный процесс и отек без четких границ.
- Диффузно-инфильтративный. Непосредственных признаков при ФГДС можно не обнаружить, поскольку опухоль практически полностью находится в стенке желудка. Однако, обращает на себя наличие уплотнения слизистой оболочки, ригидность и неестественность сладок, нарушение моторики. Частота выявления – 30%. Характеризуется ранним метастазированием и плохим прогнозом.
Отдельный клинический вариант злокачественного новообразования желудка – это лимфома. Как известно, стенка желудка имеет большое количество лимфатической ткани (MALT-система).
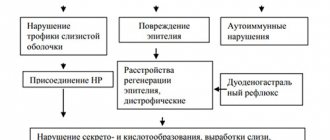
Справка В развитии заболевания играет важную роль хроническая хеликобактерная инфекция, поэтому экспресс-тест на ее наличия практически всегда положительный.
Необходимо выделить следующие ее признаки:
- наиболее частая локализация – антральный отдел желудка;
- слизистая может быть малоизмененной, но можно обнаружить локальную покраснение, неровность поверхности и сглаженность складок;
- разрастания слизистой оболочки;
- отек без четкой границы стенки желудка.
При описании новообразования эндоскопист должен определить характер роста опухоли, наличие дефекта слизистой оболочки, консистенцию измененной ткани, локализацию и размеры новообразования.
Расшифровать заключение врача после ФГДС при распространенных патологиях и узнать, как выглядит протокол в норме поможет эта статья.
Как делается биопсия?
Во время ФГДС при обнаружении участков, которые напоминают злокачественный процесс, обязательно проводится диагностическая биопсия.
При этом забор тканей делается несколько раз. Например, если есть язва, то берут 3-4 образца с ее краевых стенок и дна. При инфильтрационном процессе аккуратно проводится забор глубинных измененных тканей.
После забора образцы тканей отправляются на цитологическое исследование, которое должно определить их тип. Биопсия позволяет поставить окончательный диагноз злокачественного образования желудка, или его опровергнуть. Однако ее одной недостаточно для полной диагностики.
При раке желудка в 85% случаев обнаруживают метастазы в регионарные лимфатические узлы или отдаленные органы. Поэтому используют всевозможные методы визуализации с контрастированием для их обнаружение (КТ, МРТ, ПЭТ).
Формы онкологии
Согласно рекомендациям ВОЗ можно выделить несколько гистологических (по происхождению и типу тканей) форм рака желудка:
- папиллярную аденокарциному (из железистой ткани);
- тубулярную аденокарциному (из железистой ткани);
- плоскоклеточный рак (из эпителия);
- карциносаркому (из соединительной ткани);
- муцинознуюаденокарциному (из железистой ткани, характерна активная продукция слизи);
- хориокарциному (прорастаниеэмбриональной ткани);
- недифференцированный рак (из-за деградации структуры клеток опухоли установить ее тип невозможно);
- низкодифференцированную аденокарциному.
Частая проблема отечественных лабораторий – неточность проведения диагностики из-за низкого уровня квалификации персонала (особенно в небольших провинциальных больницах), или проблем с оборудованием.
Обратите внимание Иногда случаются ложноположительные или ложноотрицательные результаты. Чтобы этого избежать, желательно проводить цитологическое исследование в условиях специализированной онкологической клиники.
Результаты фиброгастродуоденоскопии выдаются на руки пациенту за несколько минут после завершения обследования. В них указываются характер слизистой оболочки, показатели кислотности и обнаруженные отклонения. Выводы цитологического исследования готовы за 5-10 дней.
Несмотря на стабильное снижение заболеваемости и летальности, рак желудка по-прежнему остается актуальной проблемой во всем мире. В мире ежегодно диагностируется около одного миллиона новых случаев рака желудка (952 000 по данным за 2012 г.) [1]. Он занимает 5-е место среди самых распространенных онкологических заболеваний и третье место среди причин смерти от злокачественных новообразований в мире. Прогноз зависит от стадии заболевания: 5-летняя выживаемость больных раком желудка составляет 25—30%, однако этот показатель больных ранним раком желудка после оперативного лечения достигает 95%. К сожалению, более 40% всех случаев рака желудка по-прежнему диагностируется на IV стадии. Ранний рак желудка составляет лишь 5—10% от общего числа больных раком желудка в Европе, США и России, в то время как в Японии этот показатель достигает 50%. В последнее время частота этого заболевания в развитых странах постепенно снижается. Согласно данным Международного агентства исследований рака (проект GLOBOCAN 2012), самые высокие заболеваемость и смертность по-прежнему регистрируются в странах Восточной Азии. В противоположность этому, в США и Западной Европе эти показатели заметно ниже. Россия в структуре мировой заболеваемости и смертности занимает промежуточное положение. В 2012 г. в России зарегистрировано 37 369 новых больных раком желудка, преимущественно мужчин, что определило третье ранговое место в структуре заболеваемости (8,8% у мужчин и 5,7% у женщин) [2].
Диагностика и своевременная терапия предопухолевой патологии — это основной путь к снижению заболеваемости и смертности, а выявление рака желудка на ранних стадиях и его адекватное лечение улучшают прогноз. Поскольку канцерогенез является длительным процессом, это дает возможность выявить ранние формы рака с помощью скрининга. Согласно определению ВОЗ, скрининг — это идентификация заболевания или дефекта с помощью тест-исследований, которые могут проводиться быстро и в массовом порядке. Одна из самых известных программ скрининга рака желудка проводится в Японии. Она является общенациональной программой с 80-х годов прошлого столетия и состоит из трех этапов: крупнокадровая флюорография, эндоскопическое исследование, морфологическое исследование. Результаты этой программы впечатляют: 16 выявленных случаев рака желудка на 1000 бессимптомного населения, а 65% из них — ранний рак [3]. Наиболее изученным методом скрининга рака желудка является фотофлюорография с двойным контрастированием. Методика исследования заключается в следующем: начальное («непрямое исследование») состоит из 8 мелкокадровых рентгенограмм желудка методом двойного контрастирования; при выявлении каких либо изменений выполняется более детальное обследование («прямое исследование»), состоящее из 11 последовательных рентгенограмм. По данным многочисленных исследований, чувствительность и специфичность метода фотофлюорографии с двойным контрастированием составила 89 и 92% соответственно (табл. 1) [4—8]. Применение этого метода позволяет снизить смертность на 40—60%, в связи с чем он может быть рекомендован для популяционного скрининга.
Таблица 1. Показатели чувствительности и специфичности скрининга рака желудка методом фотофлюорографии с двойным контрастированием [4—8]
Однако выявляемость рака желудка при эндоскопическом исследовании в 2,7—4,6 раза выше по сравнению с флюорографией, а применение новых методик позволяет еще больше увеличить чувствительность метода. В настоящее время, эндоскопический метод все чаще используется в программах скрининга. По данным А. Tashiro и соавт. [9], при эндоскопическом исследовании ранний рак желудка был выявлен в 0,87% случаев, что превышало в 2,7 раза количество выявленных ранних форм при флюорографии. К тому же затраты на выявление одного больного были в разы ниже при эндоскопическом скрининге по сравнению с рентгенологическим. Однако, с одной стороны, эндоскопический метод требует высокой квалификации врача, с другой стороны, в настоящее время нет достоверных данных о влиянии этого метода на смертность. Таким образом, гастроскопия может быть рекомендована для программ индивидуального скрининга.
Перспективным неинвазивным методом скрининга является исследование уровня сывороточных пепсиногенов, который отдельно или в сочетании с определением антител к Helicobacter pylori
может быть применим для выявления групп риска [10]. В исследованиях показано, что снижение уровня сывороточных пепсиногенов и уменьшение отношения пепсиноген I/пепсиноген II являются надежными признаками атрофических изменений слизистой оболочки желудка [11]. По данным ряда публикаций, чувствительность и специфичность лабораторного метода в диагностике атрофического гастрита составляют 15—75 и 92,2—97,8% соответственно [12—14].
Эндоскопическое исследование с биопсией является «золотым стандартом» диагностики структурных изменений слизистой оболочки желудка. В клинической практике используются различные эндоскопические методики для поиска раннего рака желудка и уточняющей диагностики неопластических изменений, позволяющие определить их характер и границы, а также оценки глубины поражения. Хромоскопия, окраска слизистой оболочки с помощью красителей — базовая методика диагностики предраковых изменений и раннего рака желудка. В настоящее время наиболее широко применяется 0,2% раствор индигокармина, который позволяет контрастировать рельеф и незначительные изменения слизистой оболочки и является эффективным и недорогим способом оценки границ патологических участков [15]. Узкоспектральная эндоскопия (Narrow band imaging — NBI) — это оптическая диагностическая методика, основанная на использовании специальных оптических фильтров, суживающих спектр световой волны. Обычные эндоскопические системы используют практически весь видимый световой спектр от 400 до 800 нм (рис. 1) [16]. Узкоспектральная система использует преимущества двух световых волн длиной 415 и 445 нм в диагностике сосудистых структур слизистой оболочки пищеварительного тракта, так как эти световые волны хорошо поглощаются гемоглобином [17]. Это позволяет получить детальное изображение сосудистого рисунка ткани, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака. К тому же эта эндоскопическая система повышает контрастность изображения, что создает эффект «виртуальной хромоскопии», который может быть применим для точной оценки границ патологического образования [18].
Рис. 1. Узкоспектральная эндоскопическая система.
Увеличительная эндоскопия позволяет осмотреть патологический участок с оптическим увеличением более чем в 100 крат и детально оценить его структуру и точные границы. Совместное применение увеличительной и узкоспектральной эндоскопии дает возможность более подробно оценить ямочный и сосудистый рисунок исследуемого участка. Высокая специфичность и чувствительность этих методов [19, 20] в диагностике структурных изменений тканей при ранних формах рака и предраковых изменениях эпителия желудка позволяют считать эти методики «оптической биопсией» [21] (табл. 2).
Таблица 2. Показатели чувствительности и специфичности узкоспектральной эндоскопии (в %) в сравнении со стандартным осмотром в белом свете в выявлении раннего рака желудка [19, 20]
При эндоскопическом осмотре с увеличением слизистой оболочки желудка оцениваются два основных компонента [22]: микрососудистый рисунок и микроструктура поверхности эпителия, по характеру изменений которых можно прогнозировать гистологическое строение патологического участка. По данным K. Akisato [23], при развитии рака отмечается существенная перестройка микрососудистого русла в виде изменения концентрации сосудов, типа ветвления, размера сосудов, появления сосудов, специфичных для рака желудка. Как показывают исследования, при анализе морфометрических показателей микрососудов рака желудка с помощью увеличительной эндоскопии, они имеют больше соединительных точек по сравнению с окружающей слизистой оболочкой, больше конечных точек и точек ветвления [24]. Поэтому одним из самых характерных признаков неопластического процесса является изменение микрососудистого рисунка. В соответствии с исследованием японских специалистов [25], выделяются четыре категории патологических изменений микрососудов, достоверно связанных с раком желудка:
1. Дилатация (Dilation): наличие микрососудов, имеющих калибр в 2 раза больший по сравнению с сосудами окружающей области.
2. Резкие изменения калибра (Abrupt caliber alteration): наличие микрососудов, калибр которых либо вдвое меньше, либо вдвое больше по сравнению с оригинальным размером. Разрушение микрососудистой сети также включается в это понятие.
3. Извилистость (Tortuousness): наличие микрососудов, которые вариабельно извиты или закручены.
4. Различие по форме (Heterogeneity in shape): наличие микрососудов, форма которых индивидуальна и вариабельна.
Согласно проспективному исследованию М. Kato и соавт. [26], чувствительность и специфичность таких признаков, как дилатация и гетерогенность формы микрососудов (в сочетании с исчезновением структуры поверхности) в диагностике рака составляет 92,9 и 94,7% соответственно и достоверно выше аналогичных показателей при использовании стандартной эндоскопии в белом свете (42,9 и 61,0% соответственно).
На основе анализа микрососудистого рисунка с помощью увеличительной эндоскопии возможно прогнозирование гистологического строения опухоли, что необходимо для дальнейшего выбора метода резекции опухоли (эндоскопическая резекция или хирургическая операция). Т. Nakayoshi и соавт. [27] выделили два основных типа сосудистого рисунка при раннем раке желудка:
1. Сетчатый рисунок (Fine network pattern): большое количество микрососудов, соединенных между собой в виде тонкой сети. Этот тип сосудистого рисунка определялся в 68,7% случаев дифференцированной аденокарциномы (кишечный тип).
2. Штопорообразный рисунок (Corkscrew pattern): обособленные, извитые микрососуды, имеющие форму «штопора». Этот тип сосудистого рисунка выявлялся в 85,3% случаев недифференцированного рака.
При развитии неопластической трансформации происходят изменения в микроструктуре ямок и борозд. В исследовании Y. Otsuka и соавт. [28] в случае дифференцированной аденокарциномы плотность желудочных желез была достоверно выше по сравнению с нормальной слизистой оболочкой. Как показали исследования K. Yagi и соавт. [29], области неоплазии имеют тенденцию к увеличению плотности желез и, как следствие, уменьшению промежуточной части между устьями желез, что делает так называемую «белую зону», представляющую краевой ямочный эпителий, нечеткой или невидимой. По этой же причине М. Kaise и соавт. [30] изменения структуры поверхности при раке желудка характеризовали гетерогенностью, нерегулярностью эпителиальных структур или ее отсутствием (полным или частичным). Чувствительность, специфичность и точность этих признаков как диагностического критерия раннего рака составила 100, 89,7 и 90,4% соответственно [31].
Увеличительная и узкоспектральная эндоскопия требует от специалиста знаний не только в области гастроэнтерологии, онкологии и морфологии, но и в новых узкоспециализированных дисциплинах, таких как микроанатомия слизистой оболочки органов пищеварительной системы. В эпоху компьютеризации автоматизированные системы, позволяющие анализировать рисунок поверхности эпителия и микрососудистый рисунок, могут помочь специалистам в интерпретации полученных данных, прогнозировании гистологических изменений, и, как следствие, принятии клинического решения при выполнении диагностический эндоскопии [32]. Компьютерные системы, позволяющие прогнозировать патологические состояния и тем самым повышать точность диагностики, получили название автоматизированных систем поддержки принятия решения (computer-aided decision support systems — CADSSs) [33]. Применение автоматизированных систем принятия решения в современной эндоскопии создало новое направление эндоскопической диагностики — автоматизированную эндоскопию (computer-aided endoscopy). В рамках совместного проекта международной научно-исследовательской лаборатории «Дискретная и вычислительная геометрия им. Б.Н. Делоне» Ярославского государственного университета им. П.Г. Демидова и эндоскопического отделения Ярославской областной клинической онкологической больницы разработана комплексная среда поддержки принятия решений при использовании узкоспектральной и увеличительной эндоскопии в желудке. Созданная система позволяет распознать и классифицировать обрабатываемое изображение, при этом, согласно тестированию, среднее значение доли правильно классифицированных точек составило 79%.
Другой новой оптической методикой эндоскопической диагностики является аутофлюоресцентная эндоскопия (Autofluorescence imaging — AFI), основанная на феномене естественной флюоресценции (аутофлюоресценции) эндогенных веществ-флюорофоров слизистой оболочки пищеварительной системы. Организм человека содержит большое число молекул, обладающих феноменом аутофлюоресценции. В аспекте применения этого феномена в эндоскопической диагностике опухолей пищеварительного тракта наиболее важными представляются такие соединения как: коллаген, эластин, восстановленная форма никотинамид-динуклеотидфосфата, флавинадениндинуклеотид-рибофлавин-аденозиндифосфат, порфирины. При применении этого метода в нормальной слизистой оболочке возбуждающий свет с короткой длиной волны достигает подслизистого слоя и вызывает естественное флюоресцентное свечение эндогенных флюорофоров (прежде всего коллагена, обладающего зеленым свечением), которое без значительного поглощения слизистой оболочкой воспринимается матрицей эндоскопа. Участки с утолщенной слизистой оболочкой, прежде всего опухолевая ткань, в значительной степени поглощают естественную флюоресценцию, вследствие чего возникает пурпурная или фиолетовая окраска патологических участков. Углубленные участки с истонченной слизистой оболочкой наоборот усиливают аутофлюоресценцию из-за уменьшения толщины барьерного слоя, вследствие чего появляется зеленый цвет таких образований (рис. 2) [34]. Однако аутофлюоресцентная эндоскопия имеет очень низкую специфичность вследствие большого количества ложноположительных результатов осмотра. Несмотря на это, с помощью этой методики выявлено на 23% больше плоскоприподнятых ранних раков по сравнению с осмотром в белом свете, тем самым определяя место аутофлюоресцентной эндоскопии как технологии «красного флага» для проведения скрининга поверхности слизистой оболочки желудка с целью обнаружения патологических участков, подозрительных в отношении неоплазии [35].
Рис. 2. Принцип получения изображения при осмотре в режиме аутофлюоресценции. а — приподнятый патологический участок: поглощение аутофлюоресценции, появление фиолетового свечения; б — углубленный патологический участок: усиление аутофлюоресценции, появление зеленого свечения.
Тримодальная эндоскопия позволяет сочетать осмотр в белом свете для рутинного осмотра, аутофлюоресцентный режим для поиска патологических очагов и узкоспектральный режим для детального изучения найденных изменений. Осмотр в различных режимах позволяет получить всестороннюю оценку различных характеристик слизистой оболочки и служит удобным инструментом для эндоскопического скрининга рака желудка (рис. 3).
Рис. 3. Различные эндоскопические методики в диагностике раннего рака. а — рутинная эндоскопия в белом свете: плоскоприподнятый участок кардиального отдела желудка; б — хромоскопия с индигокармином; в — аутофлюоресцентная эндоскопия: фиолетовый участок на зеленом фоне; г — узкоспектральная эндоскопия с увеличением: разрушенный рисунок поверхности эпителия с формированием тонкой сети патологических микрососудов; д — анализ эндоскопического изображения с помощью автоматизированной системы поддержки принятия решения: зона коричневого цвета соответствует раку желудка с высокой вероятностью; гистологическая верификация: высокодифференцированная аденокарцинома.
см. рис. 4
Рис. 4. Показания к эндоскопической резекции слизистой оболочки (ЭРС) и расширенные показания к эндоскопической диссекции в подслизистом слое (ЭДПС) (адаптировано из Gotoda T. Endoscopic resection of early gastric cancer. Gastric Cancer 2007; 10 (1): 1—11).
см. рис. 5
Рис. 5. Этапы эндоскопической диссекции в подслизистом слое (схема). а — маркировка границ опухоли; б — инъекция раствора гиалуроновой кислоты; в — выполнение циркулярного разреза; г, д, е — диссекция патологического участка с помощью электрохирургического ножа в подслизистом слое (адаптировано из Asano M. Endoscopic submucosal dissection and surgical treatment for gastrointestinal cancer. World J Gastrointest Endosc 2012; 4 (10): 438—447).
При выявлении диспластических и неопластических изменений слизистой оболочки важным лечебно-диагностическим этапом ведения таких пациентов является эндоскопическая резекция патологического очага. В последние годы отмечается прогресс в развитии различных эндоскопических методик резекции слизистой оболочки желудочно-кишечного тракта [36]. Методика петлевой биопсии (strip biopsy) известна еще с 80-х годов прошлого столетия и выполняется с использованием двухканального эндоскопа. Как и при многих других методиках, предварительно в подслизистый слой вводится физиологический раствор с добавлением небольшого количества адреналина в разведении 1:1 000 000. Далее с помощью захвата, предварительно продетого через эндохирургическую петлю, приподнимается патологический участок, после чего петля затягивается под основание образования и производится резекция. Аспирационные методики стали развиваться в 90-х годах и приобрели очень большую популярность как в Японии, так и в странах Запада. К ним, в частности, относится методика резекции с использованием пластикового колпачка, фиксированного на дистальном конце эндоскопа, и петли, расположенной внутри колпачка. При использовании этой методики патологический участок аспирируется внутрь колпачка и захватывается у основания петлей с дальнейшей резекцией. Также выделяют методики лигирования с применением лигаторов, которые используются для лечения варикозно-расширенных вен, и специальных аспирационных мукосекторов. Особенностью этих методик является выполнение резекции патологического участка не по внутреннему диаметру аспирационного колпачка, а снаружи его.
С начала 2000-х годов стала широко внедряться в практику новая методика — резекция с диссекцией в подслизистом слое. Преимущество этой методики состоит, прежде всего, в том, что выполняется резекция единым блоком, даже в случае больших размеров, сложного месторасположения патологического участка. Это значительно повышает радикальность резекции. К тому же контролируется размер и форма резекции, возможна резекция патологических участков с изъязвлением. Однако по сравнению с обычными методами резекции операция технически сложнее, по времени идет дольше, также имеется высокий риск осложнений, таких как перфорация и кровотечение [37]. Эндоскопическому удалению подлежат патологические участки, при которых риск лимфатического метастазирования незначителен. Согласно Японским рекомендациям, показаниями для резекции слизистой оболочки являются дифференцированный тип аденокарциномы, выступающий тип менее 30 мм в диаметре, углубленный тип менее 20 мм, без изъязвлений, признаков инвазии. При таких условиях риск метастазирования в лимфатические узлы минимальный. Однако при дальнейшем изучении более 5000 случаев рака желудка после гастрэктомии с расширенной лимфодиссекцией японскими учеными во главе с T. Gotoda выявлено отсутствие метастазирования при более прогрессивных формах рака. В связи с этим появились так называемые расширенные показания к резекции методикой диссекцией по подслизистому слою: внутрислизистый рак без изъязвлений вне зависимости от размера, внутрислизистый рак с изъязвлением <30 мм, рак с минимальной подслизистой инвазией (<500 мкм: sm1) <30 мм [38].
Эндоскопическая резекция методикой диссекции в подслизистом слое имеет следующие этапы:
1. Маркировка границ патологического образования, которая проводится непосредственно электрохирургическим ножом. При этом метки ставятся с помощью коагуляции на 0,5 см кнаружи от видимого края патологического участка.
2. Инъекция раствора гиалуроновой кислоты в подслизистый слой. Этот препарат в отличие от физиологического раствора долго поддерживает форму возникающей при инъекции «подушки», что очень важно при таких длительных операциях.
3. Циркулярный разрез. С помощью электрохирургического ножа выполняется сначала инициирующий разрез до подслизистого слоя, далее — циркулярный разрез примерно на 0,5 см кнаружи от меток.
4. Диссекция патологического участка с помощью электрохирургического ножа в подслизистом слое, в результате чего образуется обширный посткоагуляционный язвенный дефект, который полностью эпителизируется за 1—1,5 мес.
В качестве электрохирургических ножей применяет-ся большое количество инструментов (игольчатый нож, IT-нож, двойной нож и т. д.), каждый из которых имеет свои особенности и преимущества. В настоящее время, с возникновением гибридных технологий, объединяющих несколько инструментов в один, для эндоскопической диссекции в подслизистом слое широко применяется гибридный водоструйный нож (HybridKnife, «ERBE», Германия). Этот нож имеет в центральной части маленький канал для подачи физиологического раствора и соединяет в себе функции инъектора и электрохирургического ножа, благодаря чему не требуется смена инструментов при проведении эндоскопической диссекции.
Показатели 3- и 5-летней выживаемости при эндоскопической резекции раннего рака желудка, по различным данным составляет выше 95—100% [39, 40], а при применении методики диссекции по подслизистому слою — до 100% [41], при этом качество жизни во много раз выше, чем после радикального хирургического лечения.
В настоящее время активное развитие получили минимально инвазивные оперативные вмешательства, находящиеся на стыке лапароскопической хирургии и оперативной эндоскопии, — чреспросветные эндоскопические операции через естественные отверстия (NOTES — Natural Orifice Translumenal Endoscopic Surgery). С использованием этих методик возможно проведение малоинвазивного лечения при прогрессивных стадиях рака желудка с высоким риском метастазирования в региональные лимфатические узлы. Операция производится с помощью комбинированного доступа (со стороны желудка и со стороны брюшной полости), сочетая возможности эндоскопии и лапароскопической хирургии [42]. Учитывая тот факт, что значительное число стандартных резекций желудка с лимфодиссекцией не всегда оказывается необходимыми (при отсутствии метастатического поражения лимфатических узлов), для выявления объема лимфогенного метастазирования используется методика так называемого лимфатического картирования рака желудка и биопсии «сторожевого» лимфатического узла, что определяет минимально необходимый объем резекции [43]. Для этого предварительно выполняется эндоскопическое введение в опухоль специального вещества, как правило, являющегося комбинацией красителей (индоцианина зеленого) и радиоизотопных маркеров (коллоид-меченных Tc99 частиц) [44]. Затем посредством транслюминального доступа после осмотра выполняется эксцизионная биопсия «сторожевого» лимфатического узла, т. е. лимфатического узла, накопившего введенное вещество. При отсутствии его метастатического поражения производится эндоскопическая полнослойная резекция опухоли под контролем лапароскопического доступа. Таким образом, возможно выполнение малоинвазивного лечения при наличии опухоли желудка не только с Т1—2N0М0, но и даже при Т3 опухолях, однако в последнем случае проблемным остается вопрос закрытия дефекта желудочной стенки.
Эволюция эндоскопических технологий позволяет не только выполнять точную диагностику ранних форм рака желудка, но и проводить малоинвазивное лечение на более прогрессивных стадиях этого заболевания, увеличивая выживаемость и улучшая прогноз больных после операции.
Альтернативные методики исследования желудка
Кроме ФГДС существует и ряд других методик диагностики, которые помогают обнаружить злокачественное новообразование желудка. Сравнительная их характеристика подана в следующей таблице:
| ФГДС | УЗИ | КТ | МРТ | |
| Описание процедуры | Эндоскопическая диагностика с визуальным осмотром слизистой | Неинвазивная методика с использованием ультразвука | Рентгенологическая методика с компьютерной обработкой полученных изображений | Базируется на использовании магнитного резонанса ядер атомов |
| Информативность при раке желудка | Высокая (позволяет поставить диагноз и определить тип рака) | Низкая (визуализируются только большие опухоли) | Высокая (обнаруживает метастазы в лимфатические узлы и отдаленные органы) | Высокая (обнаруживает метастазы в лимфатические узлы и отдаленные органы) |
| Использование контраста | Не требуется | Не требуется | Повышает информативность методики | Повышает информативность методики |
| Проведение биопсии | Проводится | Не проводится | Не проводится | Не проводится |
| Время проведения | 30-40 минут | 15-20 минут | 10-15 минут | 30-50 минут |
| Побочные эффекты | · Травматизация слизистой желудка · Кровотечение · Попадание содержимого желудка в дыхательные пути | Отсутствуют | При частом проведении повышается риск развития новообразований | Отсутствуют |
| Противопоказания | · Тяжелое состояние больного · Нарушения свертывания крови · Острая стадия инфаркта миокарда или инсульта | Отсутствуют | · Беременность · Выраженное ожирение | · Наличие металлических имплантатов · Выраженное ожирение |
| Цена исследования в Москве | 1200-9700 руб. | 700-4800 руб. | 4000-13500 руб. | 7600-21000 руб. |
Ранняя постановка диагноза в случае с онкологией дает больше шансов на долгосрочную ремиссию. Хотите узнать, видно ли рак желудка на УЗИ? Прочитайте в этой статье.
Что делать, если обнаружили онкологию?
Если фиброгастродуоденоскопия проводилась в обычной больнице или поликлинике, то после получения результатов пациента направляют на консультацию к онкологу.
Он проводит осмотр пациента и выписывает направление на лечение в государственный онкологический стационар.
Если пациент желает, то с результатами ФГДС и направлением онколога (иногда с их переводом) он может обратиться и в частные заграничные онкологические клиники, которые имеют представительства в России. Там обычно требуют повторного проведения эндоскопического исследования желудка с биопсией.
При поступлении пациента в специализированное медицинское учреждение требуется проведение полного комплекса диагностики:
- осмотр гинеколога для женщин и проктолога для мужчин;
- общий анализ крови и мочи;
- биохимический анализ крови;
- специфические онкомаркеры (СА 72-4, РЭА, Са 19-9);
- рентгенография легких;
- электрокардиограмма;
- ультразвуковое исследование или проведения КТ с контрастированием органов брюшной полости;
- УЗИ лимфатических узлов надключичной области;
- колоноскопия;
- ПЭТ-КТ (при возможности).
При обнаружении отдаленных метастазов и их доступности необходимо провести их биопсию под контролем УЗИ.
Как обследовать пищевод в Санкт-Петербурге: преимущества обращения в ICLINIC
Начальные симптомы рака пищевода практически неуловимы, поэтому для ранней диагностики опухоли необходима профилактическая фиброгастроскопия. Однако с целью получения грамотного обследования нужно обращаться только в проверенные временем клиники. В ICLINIC обеспечивают индивидуальный подход к каждому пациенту, работая исключительно в его интересах. Даже малозаметные изменения при фиброгастроскопии не пропускаются, а тщательно анализируются не только визуально, но и посредством биопсии.
Экспертный уровень оборудования позволяет врачам ICLINIC заметить мельчайшие дефекты слизистой, размером чуть больше 1 мм. При обнаружении рака пищевода проводится немедленная прицельная биопсия, что экономит время больного перед началом противоопухолевого лечения. Только доктора с высшей категорией и клиническим опытом допускаются до работы с пациентами в клинике ICLINIC. При появлении даже малозначительных дисфагических расстройств необходимо в кратчайшие сроки провести фиброгастроскопию. Проведенное исследование в нашей клинике полностью безопасно и позволит продлить жизнь человека, даже если симптомы рака пищевода еще не появились. Легкость записи и добродушие персонала дополняют картину великолепного обслуживания в клинике ICLINIC.
Выбор тактики лечения
Согласно национальным рекомендациям онкологов выбор тактики лечения рака желудка зависит от распространенности опухоли. При раннем выявлении заболевания проводится эндоскопическая резекция слизистой оболочки с или без подслизистого слоя.
Возможная также открытая операция на брюшной полости. Ее проводят, если нет отдаленных метастазов, а злокачественный процесс не распространяется далее регионарных лимфатических узлов.
Радикальное удаление опухоли рекомендуется при отсутствии отдаленных метастазов. Обязательно проводится пластика оставшейся части желудка.
В терминальной (последней) стадии рака оперативное вмешательство необходимо только при возникновении осложнений, которые могут угрожать жизни пациента (кровотечение, сужение просвета, нарушение целостности желудка с развитием перитонита). Радикальное удаление органа тогда не улучшает прогноз, поскольку существуют отдаленные метастазы.
Обратите внимание Национальные рекомендации советуют назначать химиотерапию всем пациентам после (а в определенных ситуациях и перед) радикального или эндоскопического вмешательства, в последней стадии заболевания.
Наиболее часто назначаются эпирубицин, цисплатин и оксалиплатин. Только при наличии серьезных сопутствующих заболеваний химиотерапия не проводится, а назначается симптоматическое лечение. Обычно проводят 6-8 курсов до достижения клинической ремиссии.
Когда необходимо проведение ЭГДС (гастроскопии)?
Существуют заболевания, считающиеся предраковыми, при которых необходимо периодическое обследование независимо от наличия симптомов. К ним относят:
- хронический атрофический гастрит с т.н. кишечной метаплазией особенно при наличии хеликобактерной инфекции;
- язвенная болезнь желудка;
- пищевод Баррета;
- дефицит витамина В12 (пернициозная анемия);
- аденоматозные полипы желудка;
- гипертрофическая гастропатия.
Операции на желудке в связи с доброкачественными новообразованиями, перенесенные более 10-лет назад, и отягощенная наследственность также относятся к ситуациям, требующим пристального наблюдения.
Вы должны регулярно наблюдаться с обязательным регулярным проведением ЭГДС, если у ваших родственников диагностировались:
- рак органов желудочно-кишечного тракта,
- семейный аденоматозный полипоз толстой кишки,
- синдром Гарднера,
- синдром Пейтца-Егерса,
- семейный ювенильный полипоз,
- синдром Ли Фраумени.
С развитием генетики стали известны некоторые гены, определенные мутации которых при особых условиях приводят к раку желудка.
Существуют и регионы, в которых, видимо в результате особенностей питания или экологии, заболеваемость существенно выше средних показателей (Япония, некоторые страны Европы, Скандинавия, Южная и Центральная Америка, Китай, Корея, страны бывшего СССР). Людям, длительно живущим в этих районах, надо внимательнее относиться к своему здоровью и периодически проводить ЭГДС. Сигналом к обязательному обследованию может послужить такой показатель как концентрация пепсиногена сыворотки крови (в норме — меньше 70 нг/мл) и соотношение его фракций (ПГ1/ПГ2).
При невозможности проведения ЭГДС, например, из-за сопутствующих заболеваний, может быть проведена полипозиционная рентгенография с двойным контрастированием бариевой взвесью и воздухом. Этот метод обладает, правда, гораздо меньшей чувствительностью при ранних стадиях заболевания и не дает возможности морфологической верификации. Дополнительно используют МСКТ и УЗИ, однако точность последнего исследования даже при опытном исследователе очень зависит от технических возможностей аппарата, особенностей телосложения и правильности подготовки пациента.
Получить программу лечения