Что можно на диете после удаления желчного пузыря взрослым
После холецистэктомии необходимо помнить, что организму особенно важно получать полноценное и сбалансированное питание, чтобы адаптироваться к отсутствию желчного пузыря. В первые дни после операции ограничения довольно строгие, но дальнейшее восстановление не доставит вам серьезных трудностей2.
Ваш рацион должен быть сбалансированным в соотношении 1:1:2. Это значит, что примерно ¼ вашего рациона должна приходиться на качественные растительные жиры и полноценные белки, а половина — отдаваться сложным углеводам. Режим питания после холецистэктомии строится на основе диеты №5, предназначенной для людей с заболеваниями печени и желчевыводящих путей.
Список разрешенных продуктов:
| Овощи | морковь, цветная капуста, брокколи, тыква, свекла, вареный картофель, листовая зелень, огурцы |
| Фрукты | бананы, груши, сладкие яблоки, абрикосы и персики |
| Орехи и сухофрукты | миндаль, грецкий орех, кешью, изюм и курага |
| Мясо | диетическая телятина, кролик, мясо индейки и кур |
| Рыба нежирных сортов | минтай, хек, судак |
| Супы | супы, приготовленные на втором бульоне, овощные супы; |
| Каши | рассыпчатые и полувязкие из гречи, риса и овсяных хлопьев; |
| Морепродукты | до 3-х раз в неделю |
| Хлеб | цельнозерновой и с отрубями – только не свежий, сухари, галеты, хлебцы, крекеры |
| Кисломолочные продукты | творог, ряженка, кефир, простокваша, нежирные и несоленые виды сыра |
| Масло | сливочное — до 30 граммов и все виды растительного — до 15 граммов в сутки |
| Напитки | вода без газа, чай, некрепкий кофе травяные отвары, кисель, морс и компот |
Материал и методы
Исследование базируется на анализе результатов хирургического лечения 431 больного раком желудка, находившегося в клинике онкологии им. В.М. Ефетова и в Крымском государственном медицинском университете им. С.И. Георгиевского с 2006 по 2013 г. Среди больных было 246 (57,1%) мужчин и 185 (42,9%) женщин в возрасте от 25 до 82 лет (средний возраст 60,2±7,9 года). В соответствии с результатами морфологического исследования операционного материала у 410 (95,1%) больных диагностирован рак желудка, у 16 (3,7%) — лимфома желудка и у 5 (1,2%) — гастроинтестинальная стромальная опухоль. Чаще — у 252 (58,5%) больных — опухоль локализовалась в теле желудка, у 118 (27,4%) больных — в проксимальном отделе желудка, реже — у 61 (14,1%) больного — в антральном отделе желудка. У 308 (71,5%) больных опухоль имела эндофитный или смешанный и у 123 (28,5%) больных — экзофитный рост, в связи с чем для этой категории больных гастрэктомия являлась основным видом хирургического вмешательства.
На основании требований седьмой редакции международной классификации злокачественных новообразований TNM (2009 г.) I стадия рака желудка диагностирована у 73 (16,9%) больных, II ста-дия — у 98 (22,7%), III стадия — у 213 (49,4%), IV стадия — у 47 (10,9%) больных. В связи с этим 308 (71,5%) больных были оперированы по поводу местно-распространенного рака желудка (рТ3-рТ4), в 200 (46,4%) наблюдениях выполнена мультивисцеральная резекция с дополнительным удалением или резекцией смежных с желудком органов: в 126 (29,3%) наблюдениях — двух, в 51 (11,8%) — трех, в 17 (3,9%) — четырех и в 6 (1,4%) наблюдениях — пяти. У 384 (89,1%) больных характер выполненных операций соответствовал объему R0 (радикальные операции), у 47 (10,9%) больных — объему R1−2 (паллиативные).
На реконструктивно-восстановительном этапе после гастрэктомии была разработана принципиально новая методика создания пищевого резервуара в начальном отделе тощей кишки, участвующей в формировании пищеводно-кишечного анастомоза как при петлевом варианте реконструкции пищеварительного тракта (Патент Украины № 50085 от 25.05.10), так и при реконструкции на выделенной и пересеченной кишке по Ру (Патент Украины № 75880 от 10.12.12). После этого все больные, которым планировалось выполнение гастрэктомии, были разделены на две сопоставимые репрезентативные группы. Разделение на группы осуществляли слепым методом с помощью конвертов, включавших рекомендации по методике реконструкции пищеварительного тракта. В соответствии с этим в основную группу, в которой предусмотрено выполнение гастрэктомии с созданием пищевого резервуара, вошли 146 больных, в контрольную группу (выполнение гастрэктомии по традиционной методике реконструкции пищеварительного тракта) — 285 больных. Учитывая, что формирование групп осуществляли методом слепого распределения, установили сопоставимость групп перед лечением, а полученные данные рассматривали как исходные. Программа обследования была единой для больных обеих групп и включала проведение клинических, лабораторных и инструментальных методов. Через 12, 24 и 36 мес после операции больных повторно госпитализировали в стационар для обследования. Определяли параметры, характеризующие морфологические изменения слизистой пищевода при различных вариантах реконструкции пищеварительного тракта после гастрэктомии.
В ходе динамического наблюдения фиброэзофагоинтестиноскопия позволяла визуально оценить состояние слизистой пищевода и тонкой кишки, участвующей в формировании анастомоза, диагностировать очаговые и диффузные поверхностно-эрозивные изменения, определить характер смыкания анастомоза, возможный рубцово-воспалительный стеноз, провести контроль степени воспалительных изменений в сформированном пищевом резервуаре. Для оценки степени воспалительных изменений была использована классификация рефлюкс-эзофагитов Savary—Miller (1987 г.).
Основным критерием при постановке диагноза рефлюкс-эзофагита являлись данные морфологического исследования участков слизистой пищевода, взятых при эндоскопическом обследовании. Биопсию производили в непосредственной близости к зоне сформированного пищеводного анастомоза и выше нее. Полученный материал помещали в 2,5% буферный раствор глютарового альдегида и фиксировали 24 ч в формалине. После заливки обработанного материала парафином изготовляли срезы толщиной 4 мкм и окрашивали их гематоксилином и эозином. Все препараты исследовали под световым микроскопом, патологоанатом не имел данных о клинической и эндоскопической картине заболевания.
Сравнение групп больных по каждому из исследуемых факторов проводили на основании качественного анализа таблиц сопряженности с использованием критериев χ2 и Фишера в программе статистических расчетов Excel 2007.
Что нельзя на диете после удаления желчного пузыря взрослым
Под запретом после перенесенной операции остаются продукты с высоким содержанием холестерина, поскольку они провоцируют сгущение и застой желчи. Застой желчи вызывают и простые углеводы, поэтому их употребление сводят к минимуму. Нужно исключить из меню продукты, которые раздражают желудочно-кишечный тракт. В первую очередь это овощи и фрукты с высоким содержанием эфирных масел и щавелевой кислоты: шпинат, щавель, цитрусовые. Под запрет попадают маринованные и копченые продукты, а также все виды солений.
Список запрещенных продуктов:
| Мучное | изделия из муки высшего сорта, сдобная выпечка, промышленные кондитерские изделия |
| Бульоны | наваристые бульоны из мяса и рыбы, супы на их основе |
| Мясо | жирное мясо и птица (гусь, утка, баранина, свинина, сало и мясные консервы) |
| Рыба | жирные сорта (сом, скумбрия, осетр, рыбные консервы) |
| Полуфабрикаты | промышленные колбасы, сосиски, копчености и ливер |
| Овощи | горькие и кислые виды (щавель, шпинат, зеленый лук, чеснок, редис, дайкон) |
| Фрукты и ягоды | кислые (вишня, слива, ананас, все виды цитрусовых, хурма) |
| Яйца | в жареном виде и яичные желтки |
| Крупы | манка, бобовые |
| Молочная продукция | жирные и сладкие молочные продукты (йогурты, творожная масса, сырое молоко, сметана, взбитые сливки и мороженое) |
| Грибы | в любом виде |
| Напитки | газированная минеральная и сладкая вода, крепкий чай и кофе, какао, концентрированные соки, алкоголь |
Меню на неделю для диеты после удаления желчного пузыря взрослым с рецептами
Ежедневное меню после удаления желчного пузыря зависит в первую очередь от того, как давно проводилась операция.
Самая строгая диета ожидает пациентов сразу же после перенесенного вмешательства. В первые часы после проведенной операции прием пищи запрещен. На следующий день после холецистэктомии разрешено пить отвар шиповника без сахара и негазированную воду. Пить нужно небольшими глотками и не более 1-1,5 литров в день. Затем в рацион вводят жидкие каши и протертые супы на воде или овощном бульоне.
Первая неделя после операции является самой строгой, конкретные рекомендации может прописать исключительно лечащий врач. Далее диета становится более разнообразной.
Выбор эксперта
Лучшие препараты для лечения холецистита по версии КП
Постхолецистэктомический синдром: диагностика и лечение
Желчнокаменная болезнь (ЖКБ) чрезвычайно распространена в цивилизованных странах, в том числе и в России. Особенно высока заболеваемость среди женщин в возрасте 35–40 лет и старше. ЖКБ характеризуется образованием желчных камней в билиарной системе, главным образом в желчном пузыре, и осложнениями, возникающими в связи с прогрессированием патологического процесса.
Основным методом лечения данного заболевания является холецистэктомия. У 25% перенесших холецистэктомию больных или сохраняются, или через некоторое время появляются абдоминальные боли и диспепсические расстройства, требующие лечения. Адекватная терапия больных зависит от правильного понимания патогенеза клинических симптомов, развивающихся после холецистэктомии. Особенности их формирования связаны, с одной стороны, с нарушениями в обмене холестерина, присущими желчнокаменной болезни, с другой — тем обстоятельством, что патологический процесс протекает в новых анатомо-физиологических условиях, т. е. при отсутствии желчного пузыря.
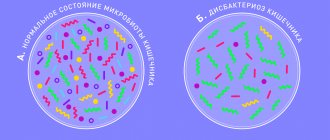
Известно, что удаление желчного пузыря по поводу калькулезного холецистита не избавляет больных от обменных нарушений, в том числе от печеночно-клеточной дисхолии, которая сохраняется и после операции. У большинства больных после холецистэктомии определяется литогенная желчь с низким холатохолестериновым коэффициентом. Выпадение физиологической роли желчного пузыря, а именно концентрация желчи в межпищеварительный период и выброс ее в двенадцатиперстную кишку во время еды, сопровождается нарушением пассажа желчи в кишечник и расстройством пищеварения. Изменение химического состава желчи и хаотическое ее поступление в двенадцатиперстную кишку нарушают переваривание и всасывание жира и других веществ липидной природы, уменьшают бактерицидность дуоденального содержимого, что приводит к микробному обсеменению двенадцатиперстной кишки, ослаблению роста и функционирования нормальной кишечной микрофлоры, расстройству печеночно-кишечной циркуляции и снижению общего пула желчных кислот. Под влиянием микрофлоры желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается повреждением слизистой оболочки двенадцатиперстной, тонкой и толстой кишки с развитием дуоденита, рефлюкс-гастрита, энтерита и колита. Дуоденит сопровождается дуоденальной дискинезией и, в первую очередь, дуоденальной гипертензией с развитием дуодено-гастральных рефлюксов и забросом содержимого в общий желчный проток и проток поджелудочной железы.
В результате формируются дискинезии сфинктера печеночно-поджелудочной ампулы, желчного и панкреатического протоков (сфинктера Одди), а деконъюгированные желчные кислоты обусловливают развитие диареи. Таким образом, у больных с удаленным желчным пузырем имеющиеся клинические проявления могут быть связаны с изменением химического состава желчи, нарушенным пассажем ее в двенадцатиперстную кишку, дискинезией сфинктера Одди, а также с избыточным бактериальным ростом в кишечнике, синдромами мальдигестии и мальабсорбции, дуоденитом и другими патологическими нарушениями в системе пищеварения. Кроме того, у ряда больных могут сохраняться или развиваться вновь органические препятствия для оттока желчи, связанные с проведенной холецистэктомией. Патологические состояния, которые наблюдаются у больных после холецистэктомии, можно разделить на 3 группы.
- Функциональные расстройства сфинктера Одди — повышение тонуса сфинктера холедоха или панкреатического протока либо общего сфинктера в результате потери функционирующего желчного пузыря.
- Билиарная гипертензия с наличием органических препятствий току желчи, при наличии которой у 5–20% больных выявляются рецидивный или резидуальный холедохолитиаз, у 11–14% — стеноз большого дуоденального сосочка, у 6,5–20% — стриктуры желчных протоков и желчеотводящих анастомозов, у 0,1–1,9% — избыточная культя пузырного протока.
- Сопутствующие заболевания, развившиеся до оперативного вмешательства или после него. Основными из них являются хронический панкреатит, дискинезия двенадцатиперстной кишки, синдром раздраженного кишечника, дуодениты, язвенная болезнь, гастроэзофагеальная рефлюксная болезнь, грыжа пищеводного отверстия диафрагмы.
В настоящее время термином «постхолецистэктомический синдром» принято обозначать только дисфункцию сфинктера Одди, обусловленную нарушением его сократительной функции и препятствующую нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку при отсутствии органических препятствий. При этом предлагается, вместо принятых ранее определений «постхолецистэктомический синдром», «билиарная дискинезия» и др., использовать термин «дисфункция сфинктера Одди».
Клинические проявления дисфункции сфинктера Одди зависят, в первую очередь, от вовлечения в процесс той или иной его структуры. При изолированной дисфункции сфинктера холедоха развиваются билиарные, при преимущественном вовлечении в процесс сфинктера панкреатического протока — панкреатические, а при патологии общего сфинктера — сочетанные билиарно-панкреатические боли. Для дисфункции сфинктера Одди характерны рецидивирующие приступы сильных или умеренных болей продолжительностью 20 и более минут, повторяющиеся в течение 3 и более месяцев. При билиарном типе боль локализуется в эпигастрии или правом подреберье с иррадиацией в спину и правую лопатку, при панкреатическом типе — в левом подреберье с иррадиацией в спину уменьшающаяся при наклоне вперед, при сочетанном типе — имеет опоясывающий характер. Боль может сочетаться со следующими признаками: а) начало после приема пищи; б) появление в ночные часы; в) тошнота и/или рвота.
Однако оценка только клинических симптомов недостаточна для исключения органической патологии билиарной системы. С этой целью используются ряд скрининговых и уточняющих методов (табл.).
Неинвазивные методы, позволяющие предположить дисфункцию сфинктера Одди, включают определение в крови уровня билирубина, щелочной фосфатазы, аминотрансфераз, амилазы и липазы. Лабораторные исследования необходимо проводить во время или не позднее 6 ч после окончания болевого приступа, а также в динамике. Транзиторное повышение в 2 и более раз уровня печеночных или панкреатических ферментов в период не менее чем при 2 последовательных приступах болей является важным в подтверждении дисфункции сфинктера Одди.
Аналогичное значение имеет провокационный морфино-простигминовый тест, когда парентеральное введение препаратов провоцирует развитие болевого приступа, чаще смешанного билиарно-панкреатического типа в сочетании с повышением в крови уровня аминотрансфераз, щелочной фосфатазы, панкреатических ферментов. Однако диагностическая ценность данного теста ограничена его низкой чувствительностью и специфичностью.
При УЗИ важное значение придается расширению холедоха и главного панкреатического протока, которое свидетельствует о нарушении тока желчи и панкреатического секрета на уровне сфинктера Одди. В то же время у 3-4% больных, перенесших холецистэктомию и не имеющих симптомов, отмечается расширение общего желчного протока. Определенное значение имеет ультразвуковое исследование диаметра общего желчного протока с использованием жирных завтраков, стимулирующих выработку эндогенного холецистокинина и увеличивающих холерез. После пробного завтрака измерение диаметра холедоха проводится каждые 15 мин в течение 1 ч. Увеличение его диаметра на 2 мм и более по сравнению с исходным позволяет предположить наличие неполной обтурации холедоха как в результате дисфункции сфинктера Одди, так и из-за органической патологии билиарной системы.
Для оценки состояния панкреатических протоков используется проба с введением секретина в дозе 1 мг/кг. В норме после стимуляции панкреатической секреции секретином при УЗИ отмечается расширение панкреатического протока в течение 30 мин с последующим его уменьшением до исходного уровня. Если проток остается расширенным более 30 мин, это свидетельствует о нарушении его проходимости.
При билисцинтиграфии о наличии дисфункции сфинктера Одди свидетельствует увеличение времени транзита радиофармпрепарата от ворот печени до двенадцатиперстной кишки, при этом оно пропорционально уровню базального давления сфинктера Одди. В то же время при расширенном холедохе данное исследование малоинформативно для оценки функции сфинктера Одди.
К инвазивным методам оценки функции сфинктера Одди относится непрямой способ — эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ). Косвенными признаками повышения тонуса сфинктера Одди являются диаметр холедоха более 12 мм, задержка контраста в холедохе свыше 45 мин. О дисфункции сфинктера главного панкреатического протока свидетельствуют расширение последнего до более чем 5 мм и замедление эвакуации контраста из его просвета. Однако аналогичные изменения могут наблюдаться и при наличии органической патологии.
Наиболее точным методом, подтверждающим дисфункцию сфинктера Одди, является манометрия. При этом возможно канюлирование раздельно холедоха и вирсунгова протока с проведением манометрии их сфинктеров, что позволяет выделить преимущественно билиарный или панкреатический тип расстройств, а также установить этиологию рецидивирующих панкреатитов у больных, перенесших холецистэктомию и папиллотомию. Признаками дисфункции сфинктера Одди при манометрическом исследовании являются:
- повышение базального давления в просвете сфинктеров;
- увеличение амплитуды и частоты фазовых сокращений (тахиоддия);
- увеличение частоты ретроградных сокращений;
- парадоксальный ответ на введение аналогов холецистокинина.
Манометрия сфинктера Одди показана далеко не всем больным. Выбор данного исследования основывается на оценке тяжести клинических проявлений и эффективности консервативной терапии.
Таким образом, предположить, что речь идет о дисфункции сфинктера Одди можно в следующих ситуациях:
- наличие болей в эпигастральной области у больных, перенесших холецистэктомию, в случаях, если не выявляются другие причины, способные объяснить их происхождение (сопутствующие заболевания, структурные изменения билиарных и панкреатических протоков);
- наличие идиопатического рецидивирующего панкреатита;
- при рецидивирующих билиарных коликах у больных с наличием неизмененного желчного пузыря и холедоха и при нормальном составе пузырной желчи.
Примерные формулировки диагнозов у больных, перенесших холецистэктомию:
Диагноз: желчнокаменная болезнь, холецистэктомия в 1994 г. (для случаев, при которых отсутствуют клинические симптомы).
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1999 г.
Диагноз: хронический рецидивирующий (обструктивный) панкреатит с внешнесекреторной и инкреторной недостаточностью в фазе обострения.
Сопутствующее заболевание: желчнокаменная болезнь, холецистэктомия в 1994 г.
Диагноз: синдром раздраженного кишечника с преобладанием запоров в фазе обострения.
Сопутствующий диагноз: желчнокаменная болезнь, холецистэктомия в 1994 г.
Ведение больных, перенесших холецистэктомию. Цель лечения: восстановить нормальное поступление желчи и панкреатического секрета из билиарных и панкреатических протоков в двенадцатиперстную кишку. Задачи лечения: нормализовать химический состав желчи; восстановить проходимость сфинктера Одди; восстановить нормальный состав кишечной микрофлоры; нормализовать процессы пищеварения и моторику тонкой кишки для профилактики дуоденальной гипертензии.
Для профилактики образования желчных сладжей или камней во внепеченочной билиарной системе рекомендуется:
- ограничение (но не полное исключение) приема продуктов, содержащих холестерин (жиры животного происхождения) и жирные кислоты (жиры, прошедшие термическую обработку свыше 100°С — жареные продукты);
- регулярный 4–6-кратный прием пищи;
- медленное снижение массы тела. При использовании низкокалорийных диет (2110 кДж/сут и ниже), при голодании, при проведении шунтирующих операций необходимо дополнительное назначение урсодезоксихолевой кислоты в дозе 10 мг/кг/сут;
- добавление в пищевой рацион пищевых волокон, содержащихся в продуктах растительного происхождения или пищевых добавок (отруби и др.). При этом овощи, фрукты, травы лучше использовать после термической обработки (отварные, запеченные). Отруби могут применяться в виде готовых завтраков (каша, хлеб) и патентованных препаратов;
- обеспечение ежедневного стула.
Медикаментозное лечение дисфункции сфинктера Одди направлено на снятие спазма гладкой мускулатуры последнего. С этой целью используется ряд препаратов, обладающих спазмолитическим эффектом. Нитраты: нитроглицерин используется с целью быстрого купирования болей, нитросорбит — для курсового лечения. Механизм действия нитратов сводится к образованию в гладких мышцах свободных радикалов оксида азота (NO), которые активируют гуамилатциклазу и увеличивают содержание цГМФ, что приводит к их расслаблению. Однако выраженные кардиоваскулярные эффекты, побочные действия и развитие толерантности делают их малоприемлемыми для длительной терапии дисфункции сфинктера Одди.
Антихолинергические средства блокируют мускариновые рецепторы на постсинаптических мембранах органов-мишеней. В результате происходит блокада кальциевых каналов, прекращается вход ионов кальция в цитоплазму гладкомышечных клеток и, как следствие, достигается снятие мышечного спазма. В качестве спазмолитиков используются как неселективные (препараты красавки, метацин, платифиллин, бускопан и др.), так и селективные М-холиноблокаторы (гастроцепин и др.). Однако при приеме препаратов данной группы может наблюдаться достаточно широкий спектр побочных эффектов: сухость во рту, задержка мочеиспускания, нарушения зрения, повышение внутриглазного давления, тахикардия, запоры, сонливость. Сочетание довольно низкой эффективности с широким спектром побочных действий ограничивает применение препаратов этой группы при дисфункции сфинктера Одди.
Блокаторы медленных кальциевых каналов — фенилалкиламины (верапамил, галлопамил), 1,4-дигидроперидины (нифедипин, амлодипин) и бензотиазепины (дилтиазем и др.) закрывают кальциевые («медленные») каналы клеточных мембран, препятствуют входу ионов кальция в цитоплазму клеток гладкой мускулатуры и вызывают ее релаксацию. Препараты обладают многочисленными кардиоваскулярными эффектами, в первую очередь вазодилатирующими, в связи с чем не нашли широкого применения при лечении дисфункции сфинктера Одди. Имеются лишь единичные публикации по использованию нифедипина при дисфункции сфинктера Одди, и целесообразность их применения требует дальнейшего изучения.
Миотропные спазмолитики, механизм действия которых сводится к ингибированию фосфодиэстеразы, или к активации аденилатциклазы, или к блокаде аденозиновых рецепторов, что приводит к снижению тонуса и двигательной активности гладкой мускулатуры. Представителями данной группы препаратов являются дротаверин (но-шпа, но-шпа форте), бенциклан (галидор), дицикловерин (триган-Д), альверин (метеоспазмил) и др.
Основными недостатками препаратов всех вышеуказанных групп являются:
- существенные различия в эффективности лечения дисфункции сфинктера Одди в каждом конкретном случае;
- отсутствие селективного эффекта на сфинктер Одди;
- наличие нежелательных эффектов, обусловленных воздействием на гладкую мускулатуру сосудов, мочевыделительной системы и всех отделов пищеварительного тракта.
В отличие от них, гимекромон (одестон) обладает избирательным спазмолитическим действием на сфинктер Одди и сфинктер желчного пузыря. Кроме того, препарат не повышает давление в желчных путях, не оказывает влияния на секреторную функцию пищеварительных желез и процессы кишечной абсорбции.
В восстановлении нормального оттока желчи при отсутствии желчного пузыря, наряду с проходимостью сфинктера Одди, большое значение имеет уровень давления в двенадцатиперстной кишке. Если он превышает секреторное давление желчи и панкреатического сока, они будут депонироваться в билиарных и панкреатических протоках с соответствующими последствиями.
В связи с этим разрешение дуоденальной гипертензии считается непременным условием ведения больных с дисфункцией сфинктера Одди. При выборе тактики лечения следует учитывать, что основным патогенетическим механизмом развития дуоденальной гипертензии является избыточное содержание жидкости и газа в просвете двенадцатиперстной кишки в результате бродильно-гнилостных процессов, обусловленных микробной контаминацией.
Для деконтаминации двенадцатиперстной кишки проводятся 1-2 семидневных курса антибактериальной терапии со сменой препарата при очередном курсовом лечении. Препаратами выбора являются: доксициклин 0,1 г 2 раза в день, тетрациклин 0,25 г 4 раза в день, бисептол 960 мг 2 раза в день, фуразолидон 0,1 г 3 раза в день, эрсефурил 0,2 г 4 раза в день, ципрофлоксацин 250 мг 2 раза в день, метронидазол 0,25 г 4 раза в день, интетрикс 1 капсула 4 раза в сутки, реже — левомицетин 0,25 г 4 раза в день.
Подбор лекарственных средств проводится, как правило, эмпирически. При выраженных симптомах диспепсии назначаются сразу 2 препарата, один из которых должен действовать преимущественно на анаэробную микрофлору (например, метронидазол). Одновременно с приемом кишечных антисептиков в ряде случаев назначаются пребиотики: при наличии поносов — хилак форте 60 капель 3 раза в день в течение 1 нед, затем по 30 капель 3 раза в день в течение 2 нед; в случаях преобладания запоров — лактулоза по 1-2 столовые ложки 1 раз в день до нормализации стула.
После окончания антибактериальной терапии показаны пробиотики (препараты, содержащие нормальные штаммы кишечной флоры). Одним из известных представителей группы пробиотиков является бифиформ, содержащий в одной капсуле, покрытой энтерорастворимой оболочкой, энтерококки 107, бифидумбактерии 107 и питательную среду, способствующую их росту в тонкой и толстой кишке. Назначается препарат по 1 капсуле 2 раза в день в течение 2 нед. В комплексе с антибактериальными средствами необходимо назначать алюминийсодержащие буферные антациды (алюгастрин, алюмаг, маалокс, фосфалюгель, смекта и др.). Любой из препаратов принимается по 1 дозе через 1 ч после завтрака, обеда и ужина и перед сном (не сочетаются с хилаком форте). Продолжительность лечения составляет 5–7 дней. Целесообразность использования данных препаратов обусловлена следующими их способностями:
- связывать органические кислоты, что приводит к уменьшению осмолярности кишечного содержимого и прекращению тока жидкости в просвет кишки;
- повышать интрадуоденальный уровень рН, что создает условия для нормальных процессов пищеварения;
- связывать деконъюгированные желчные кислоты, что уменьшает секреторную диарею и их повреждающее действие на слизистую оболочку;
- уменьшать всасывание антибактериальных препаратов, что повышает их концентрацию в просвете кишки и усиливает антибактериальный эффект, а также уменьшает побочные действия препаратов.
Наличие у большинства больных относительной ферментной недостаточности в результате разрушения пищеварительных ферментов дуоденальной и тонкокишечной микрофлорой, снижения интрадуоденального уровня рН, а также нарушения процесса смешивания их с пищевым химусом является обоснованием назначения ферментных препаратов. При склонности к поносам назначаются препараты панкреатина: мезим форте, креон, ликреаза, панцитрат и другие по 1 дозе 2-3 раза в день в начале еды; при склонности к запорам — комбинированные средства, содержащие панкреатин, желчные кислоты, гемицеллюлозу: фестал, энзистал, дигестал по 1 драже 2-3 раза в день в конце приема еды. Продолжительность лечения индивидуальна и, как правило, не превышает 10 дней.
Приведем ориентировочные схемы ведения больных с дисфункцией сфинктера Одди.
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1996 г.
- Диета с низким содержанием жира (40 г/сут растительных жиров), исключение жареных, острых, кислых продуктов.
- Гимекромон (одестон) 200 мг 3 раза в день за 30 мин до приема пищи в течение 7–14 дней.
- Исключение лекарственных препаратов, обладающих холеретическим и гидрохолеретическим эффектом (желчные кислоты, в том числе и в ферментных препаратах, настои и отвары желчегонных трав, синтетические желчегонные, желудочный сок и др.).
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1989 г. Сопутствующие заболевания: хронический катаральный, преимущественно дистальный дуоденит. Синдром избыточного бактериального роста в тонкой кишке.
- Диета с низким содержанием жира (40 г/сут растительных жиров), исключение жареных, острых, кислых продуктов.
- Гимекромон (одестон) 200–400 мг 3 раза в день за 30 мин. до еды — 1-2 нед.
- Бисептол 480 по 2 таблетки 2 раза в день в течение 5–7 дней, с 6–8-го дня доксициклин 0,1 г 2 раза в день или ципрофлоксацин 250 мг 2 раза в день в течение 5 дней, с последующим приемом бифиформа по 1 капсуле 2 раза в день в течение 2 нед.
- Панкреатин 250–500 мг, или мезим форте, или креон, или ликреаза, или панцитрат по 1 драже либо 1 капсуле 3 раза в день во время еды — до 2 нед, далее — «по требованию».
- Алюмаг (маалокс протаб, фосфалюгель и др.) 1-2 дозы 3 раза в день через 1 ч после еды в течение 1 нед.
Таким образом, своевременная и правильная оценка клинической симптоматики, развивающейся у больных после операции холецистэктомии, дает возможность подобрать адекватную терапию и в результате существенно улучшить качество жизни пациентов с заболеваниями гепатобилиарной системы.
По вопросам литературы обращайтесь в редакцию.
П. Я. Григорьев, доктор медицинских наук, профессор, Э. П. Яковенко, доктор медицинских наук, профессор Н. А. Агафонова, кандидат медицинских наук, А. С. Прянишникова, кандидат медицинских наук И. П. Солуянова, кандидат медицинских наук, З. В. Бекузарова, А. В. Яковенко, кандидат медицинских наук РГМУ, Москва
Примерное меню на 7 дней для первого месяца после операции
День 1
Завтрак: творожная запеканка с изюмом, зеленый чай Перекус: 50 гр. сухарей + стакан компота (без сахара) Обед: тыквенный суп-пюре с сухариками, запеченное в фольге филе индейки Перекус: простокваша с яблоком Ужин: салат с морепродуктами, свежим огурцом и зеленью, заправленный тыквенным маслом, подсушенный хлеб с отрубями
Рецепт тыквенного супа-пюре с сухариками:
- Тыква – 1 кг;
- Картофель – 2-3 шт.;
- Лук репчатый – 1 шт.;
- Морковь – 2-3 шт.;
- Овощной бульон – 1 л.;
- Соль – по вкусу;
- Рубленая зелень – для подачи;
- Оливковое масло – для подачи;
- Сухарики — для подачи.
Готовим:
- Тыкву очистить от семян и кожуры. Нарезать на небольшие кубики.
- Картофель, лук и морковь очистить и нарезать кубиками.
- В кастрюле с толстым дном разогреть овощной бульон и добавить в него подготовленные овощи.
- Готовить овощи на среднем огне до тех пор, пока бульон не закипит. Далее убавить огонь до минимального, накрыть крышкой и довести овощи до готовности.
- Когда овощи будут легко протыкаться вилкой, выключить огонь и дать супу остыть.
- Остывший бульон с овощами превратить в однородное пюре при помощи блендера или кухонного комбайна.
- Готовый суп подавать в порционных тарелках, украсив рубленой зеленью, горстью домашних сухариков и несколькими каплями оливкового масла.
День 2
Завтрак: разваренная гречневая каша со сливочным маслом, галета с нежирным сыром Перекус: запеченная груша с творогом Обед: рис с овощами, запеченная в фольге куриная грудка Перекус: фруктовая пастила, чай Ужин: тефтели из телятины, пюре из цветной капусты
День 3
Завтрак: белковый омлет с овощами, запеченный в духовке, галета со сливочным маслом чай Перекус: банан Обед: филе судака, приготовленное на пару, салат из запеченных овощей Перекус: протертый творог со свежим огурцом и зеленью Ужин: паровые рыбные котлеты, тушеная капуста, галета
Рецепт салата из запеченных овощей:
- Кабачок – 2 шт.;
- Помидор – 3 шт.;
- Перец болгарский – 1 шт.;
- Лук репчатый – 2 шт.;
- Соль – по вкусу;
- Масло оливковое – для заправки.
Готовим:
- Разогреть духовку до 200 градусов.
- Овощи тщательно вымыть и высушить.
- В одну форму для выпекания выкладываем очищенный лук. Время приготовления примерно 45 минут.
- Во вторую форму выкладываем перец, помидоры, кабачки. Время приготовления примерно 25 минут.
- Готовые овощи достать из духовки и дать им остыть.
- Остывшие овощи нарезать и заправить рубленой зеленью, солью и оливковым маслом.
Важно
О чем говорит коричневый налет на языке. Опасно ли это?
День 4
Завтрак: овсяная каша на воде с курагой и дробленым миндалем, крекер, отварное яйцо Перекус: фруктовые чипсы из яблока, груши или банана Обед: рыбный суп, салат из пекинской капусты, огурца и моркови, заправленный кунжутным маслом, галета Перекус: хлебец с овощным соком Ужин: салат из свеклы с черносливом и орехами, фаршированные перцы
День 5
Завтрак: сырники, запеченные в духовке с фруктовым пюре, отвар шиповника Перекус: кефир, горсть фундука Обед: рис с морепродуктами, салат с листовой зеленью и печёной свеклой, заправленный оливковым маслом Перекус: домашний компот с сухариком Ужин: морковные котлеты, паштет из куриной грудки, галета
Рецепт морковных котлет:
- Морковь – 500 гр.;
- Яйцо – 1 шт.;
- Мука зеленой гречки – 3 ст.л.;
- Сушеные травы – по вкусу;
- Соль – по вкусу.
Готовим:
- Морковь вымыть и очистить. Нарезать и отварить до готовности.
- Отварную морковь измельчить удобным способом (терка, блендер).
- К измельченной моркови добавить яйцо и муку зеленой гречки, тщательно перемешать.
- Добавить соль и сушеные травы.
- Морковный «фарш» можно выложить в силиконовые формочки или сформировать котлетки влажными руками и выложить на пергамент.
- В разогретой до 200 градусов духовке выпекать примерно 15-20 минут.
День 6
Завтрак: рисовая каша с запеченной тыквой, крекер с яйцом пашот Перекус: галета с сыром Обед: овощное рагу, запеченный в фольге минтай с травами и сливочным маслом Перекус: домашний кисель с крекером Ужин: мясная запеканка, отварная цветная капуста и брокколи с оливковым маслом
День 7
Завтрак: рисовый пудинг с фруктовым соусом, крекер с паштетом из индейки Перекус: кефир с сухофруктами Обед: щи из говядины на вторичном бульоне, сухарики, салат «летний» с горчичным маслом Перекус: банан, горсть миндаля Ужин: филе щуки, запеченное с овощами под томатным соусом, подсушенный хлеб, нежирный сыр
Рецепт рисового пудинга с фруктовым соусом:
- Рис – 250 гр.;
- Овсяное молоко – 100мл.;
- Яйцо – 2 шт.;
- Персик – 2 шт.;
- Яблоки – 2 шт.;
- Сахар – 3 ст.л.
Готовим:
- Рис отварить согласно указанной инструкции на упаковке.
- В кастрюлю с толстым дном влить молоко и переложить к нему готовый рис. Несколько минут проварить рис в молоке.
- Кастрюлю с рисом снять с огня и дать остыть.
- К остывшему рису добавить желтки и перемешать. Белки взбить до крепких пиков и также добавить к рису.
- Рисовую массу выложить в форму для выпекания. Готовить примерно 30 минут в духовке, разогретой до 180 градусов.
- Фрукты для соуса вымыть и очистить от кожуры. Нарезать кубиками и в сотейнике проварить с сахаром несколько минут. Дать остыть и протереть их через сито.
- Подавать рисовый пудинг порционными кусочками, политыми фруктовым соусом.
Полезно знать
Как оказать первую помощь при приступе холецистита
Популярные вопросы и ответы
Как правильно питаться после удаления желчного пузыря, мы обсудили с врачом-эндокринологом, диетологом Екатериной Казачковой.
Диета после удаления желчного пузыря – это на всю жизнь?
— Строгую диету необходимо держать первые 3-4 месяца после оперативного лечения. В зависимости от темпов восстановления (а они очень индивидуальны), со временем ежедневное меню может постепенно расширяться. Однако нужно помнить, что вводить новые продукты нужно постепенно, в небольшом количестве и обязательно следить за реакцией организма, и только после консультации с лечащим врачом.
К чему может привести отсутствие диеты в первый месяц после проведения операции?
— Если не соблюдать рекомендованную диету, увеличивается риск возникновения послеоперационных осложнений, таких как послеоперационная диарея, дисфункция сфинктера Одди, что приводит к болям и нарушениям пищеварения.
Возможно ли образование камней после удаления желчного пузыря?
— Да, такое бывает, но крайне редко, когда камни могут образовываться в желчных протоках. Для профилактики такой ситуации рекомендуется на постоянной основе придерживаться диеты.
Источники:
- Лапороскопическая холецистэктомия. Кошенов М.Р. Вестник хирургии Казахстана, 2012. https://cyberleninka.ru/article/n/laparoskopicheskaya-holetsistektomiya-1/viewer
- Дисфункция сфинктера Одди в постхолецистэктомическом периоде. Буеверов А.О. Медицинский совет, 2022. https://cyberleninka.ru/article/n/disfunktsiya-sfinktera-oddi-v-postholetsistektomicheskom-periode/viewer
- Современный взгляд на проблему постхолецистэктомического синдрома. Нересов А.В., Кайбулаева Д.А., Васнев О.С., Ташенова Л.К., Сахипов М.М., Берестимов Г.Т. и др. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. https://cyberleninka.ru/article/n/sovremennyy-vzglyad-na-problemu-postholetsistektomicheskogo-sindroma-po-materialam-ekspertnogo-soveta-sostoyavshegosya-4-maya-2019/viewer
Введение
Многочисленными морфологическими исследованиями установлено, что в кардии отсутствует анатомический мышечный сфинктер, аналогичный мышечному сфинктеру привратника. Регуляцию прохождения пищи из пищевода в желудок и предупреждение гастроэзофагеального рефлюкса выполняет так называемый функциональный сфинктер кардии, в который входят угол (20—40˚) перехода пищевода в желудок — угол Гиса, газовый пузырь в дне желудка; пераэзофагеальная связка; слизистая розетка, или клапан Губарева. В функциональном сфинктере определяющая роль принадлежит газовому пузырю [9].
При гастрэктомии удаляют элементы функционального сфинктера кардии, что приводит к свободному поступлению дуоденального содержимого в тонкую кишку и далее через сформированный вертикально расположенный эзофагоеюноанастомоз в пищевод с развитием рефлюкс-эзофагита. Энтероэзофагеальный рефлюкс содержимого тонкой кишки после гастрэктомии является причиной развития и прогрессирования воспаления в слизистой пищевода [10]. Если у больных с неоперированным желудком основным субстратом для развития воспалительных, а в последующем и структурных изменений слизистой пищевода является соляная кислота, содержащаяся в желудочном соке, то после гастрэктомии происходит рефлюкс содержимого тонкой кишки, поступление щелочного содержимого двенадцатиперстной кишки, желчных кислот и панкреатических ферментов. Повреждающее действие желчных кислот зависит от рН среды. При рН от 3,0 до 6,0 повреждающее воздействие желчных кислот максимальное, при рН 2,0 желчные кислоты выпадают в осадок. В связи с этим кислотность желудочного сока рассматривается как своеобразный естественный барьер на пути воздействия желчи на слизистую пищевода, ликвидируемый при гастрэктомии [3].
Существующие на сегодняшний день методы консервативного лечения рефлюкс-эзофагита, возникшего после удаления желудка, малоэффективны [6]. Единственным эффективным способом профилактики развития энтероэзофагеального рефлюкса и рефлюкс-эзофагита после гастрэктомии является предупреждение регургитации содержимого тонкой и двенадцатиперстной кишки в пищевод [7, 8].
Для предупреждения энтероэзофагеального рефлюкса разработаны многочисленные способы формирования арефлюксных эзофагоеюноанастомозов с помощью мышечных манжеток из стенки тонкой кишки, из стенки пищевода, внутрикишечные клапаны по типу чернильницы-невыливайки и др. [1, 2, 5]. Однако, как показывает анализ патогенеза энтероэзофагеального рефлюкса, малая эффективность стандартных и арефлюксных эзофагоеюноанастомозов обусловлена одним — в предлагаемых способах не предусмотрено восстановление определяющих структурных элементов удаляемого функционального сфинктера кардии, в частности газового пузыря, обеспечивающего компрессию абдоминального отдела пищевода и способного восстановить клапанный механизм, действующий только в краниокаудальном направлении.
Основными симптомами энтероэзофагеального рефлюкса являются изжога, преимущественно в ночное время при длительном нахождении больного в горизонтальном положении, срыгивание желчью, отрыжка, боль за грудиной при подъеме тяжести и при наклоне туловища вперед. Большинство исследователей сходятся во мнении, что клинические проявления энтероэзофагеального рефлюкса в виде симптомов регургитации в первые месяцы после гастрэктомии не имеют морфологических признаков эзофагита [4, 8].
Обнаруженный с помощью рентгенологического и радиоизотопного методов исследования энтероэзофагеальный рефлюкс, частота которого после гастрэктомии достигает 30%, не свидетельствует о неизбежном развитии структурных изменений в слизистой пищевода, диагностируемых не более чем у половины больных с энтероэзофагеальным рефлюксом [10]. Как правило, результатом гистологического исследования биоптатов слизистой пищевода является несоответствие эндоскопической картины и морфологических изменений.
Стандартом в диагностике рефлюкс-эзофагита является эзофагоскопия с прицельной биопсией слизистой дистального отдела пищевода в непосредственной близости к пищеводно-кишечному анастомозу с последующим морфологическим исследованием.
Диагностика, основанная на клинических, рентгенологических и эндоскопических исследованиях с прицельной биопсией слизистой дистального отдела пищевода, позволяет не только визуализировать рефлюкс содержимого тонкой кишки через пищеводно-кишечный анастомоз в пищевод, но и верифицировать характерные для эзофагита морфологические изменения.
Цель настоящего исследования — анализ отдаленных результатов гастрэктомии с применением нового варианта реконструкции пищеварительного тракта для профилактики развития рефлюкс-эзофагита.