Липоматоз поджелудочной железы – патология, при которой нормальные клетки заменяются жировыми. Такие изменения негативно сказываются на работоспособности органа. Ситуация усугубляется из-за длительного бессимптомного периода.
По сути, человек начинает лечение тогда, когда уже невозможно что-то изменить в лучшую сторону консервативными способами. В этой статье приводятся советы специалистов, которые помогут своевременно диагностировать болезнь и принять адекватные ответные меры.
Факторы риска
Липоматоз поджелудочной железы — ожирение поджелудочной железы.
Почему у одних людей развивается липоматоз, а других нет, доподлинно неизвестно.
Однако проводимые статистические исследования позволяют выделить некоторые факторы риска, при наличии которых возможно образование нежелательных жировых клеток в поджелудочной железе.
Самые распространенные ситуации, спровоцировавшие развитие липоматоза, приведены ниже:
- наличие острого панкреатита в анамнезе;
- текущий хронический панкреатит;
- частое употребление алкогольных напитков;
- отягощенная наследственность;
- текущий сахарный диабет или хронический гепатит;
- ожирение;
- недостаточное количество тиреоидных гормонов.
То, что названные выше факторы, могут провоцировать развитие липоматоза, не значит, что у тех, кому присущи эти состояния, обязательно разовьется ожирение поджелудочной железы. Однако при отсутствии всех перечисленных факторов болезнь практически никогда не развивается.
Признаки сбоев работы поджелудочной железы
Из-за уменьшения процентного соотношения здоровых, нормально функционирующих тканей по отношении к пораженным, нарушается пищеварение. Особенно тяжело воспринимается белковая пища и все жирное. У человека наблюдаются такие симптомы:
- тошнота;
- боли в животе;
- метеоризм;
- тяжесть, распирающее чувство в животе;
- частый стул, в составе которого появляется жир и прочие примеси.
Из-за болезни происходят сбои в выработке гормонов. В результате развиваются комплексные эндокринологические нарушения. В большей мере это касается углеводного обмена. При этом резко увеличивается уровень глюкозы.
Если не остановить такое патологическое течение, то со временем человек заболевает сахарным диабетом.
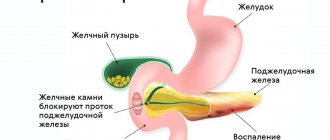
Хронический панкреатит (ХП) — воспалительное заболевание, сопровождающееся прогрессирующими морфологическими повреждениями ткани и функциональной недостаточностью поджелудочной железы (ПЖ). С каждой атакой острого панкреатита паренхима ПЖ необратимо замещается рубцовой фиброзной тканью [31]. Злоупотребление алкоголем продолжает оставаться основной причиной ХП [20]. В мире первичная ежегодная заболеваемость ХП составляет 8 новых пациентов на 100 000 населения [41], общая заболеваемость ХП — 26,4 на 100 000 популяции [52].
Основной морфологической характеристикой ХП является развитие фиброза и фиброзно-кистозное перерождение ПЖ [13]. При этом фиброзные ткани постепенно замещают паренхиму ПЖ, а выраженность и типы фиброзно-рубцовых изменений определяются длительностью воздействия и видом этиологического фактора [31].
В настоящее время для диагностики ХП используется около 90 различных методов исследования, однако большинство из них не позволяет установить диагноз ХП на ранней стадии заболевания [8], что приводит к прогрессированию процесса и необходимости проведения хирургического вмешательства.
Операции при ХП в основном имеют резекционный характер (резекция головки ПЖ, корытообразное иссечение стенок главного панкреатического протока и др.) [56], так как в настоящее время показано, что основная жалоба больных на боли в области ПЖ связана не только с панкреатической протоковой гипертензией, но и с прорастанием нервных путей фиброзной тканью [37]. Выраженность фиброза при таких операциях имеет принципиальное значение, так как вмешательства на «мягкой» железе сопровождаются кровотечением и послеоперационными осложнениями, среди которых панкреонекроз служит одной из причин высокой летальности [27, 28, 47, 54, 57]. В связи с этим сведения о развитии фиброза, его морфогенезе, возможности рассасывания и диагностики приобретают особую значимость.
Морфофиброгенез ПЖ
В развитии фиброза решающую роль играет продукция коллагена. В настоящее время насчитывают 28 типов коллагена, которые различаются аминокислотной последовательностью, органной и тканевой принадлежностью, а также интенсивностью гидроксилирования или гликозилирования. Различают коллаген I типа (в соединительной ткани, костях и других тканях), коллаген II типа (в хрящах, стекловидном теле и роговице глаза), коллаген III типа (в стенках крупных кровеносных сосудов), коллаген IV типа (в базальных мембранах, капсуле хрусталика), коллаген V типа (в хорионе, амнионе, эндо- и перимизии, коже и других тканях), а также коллагены VI—XVI типов — интерстициальные и нефибриллярные коллагены [5]. Основными продуцентами коллагена являются фибробласты, а также звездчатые клетки (pancreatic stellate cells — PSC, клетки Ито), которые мигрируют в область некроза и трансформируются в миофибробласты. Типы коллагена сменяют друг друга, начиная с III и заканчивая I, обусловливая фазы фиброзного процесса [9], при этом коллаген I типа содержит большое число поперечных сшивок. Он характерен для плотной рубцовой соединительной ткани, плохо расщепляющейся протеазами.
При исследовании морфологического состояния нормальной ПЖ фибробласты соединительнотканных междольковых перегородок характеризуются слабой экспрессией коллагена III типа. В состав базальных мембран ацинусов входит коллаген IV типа. Экспрессия гладкомышечного актина-α отмечается только в гладкомышечных оболочках стенок сосудов и полностью отсутствует в строме ПЖ [9].
Фиброз при ХП является, как правило, результатом некроза клеток ПЖ, а также следствием дисбаланса между синтезом и деградацией белкового экстрацеллюлярного матрикса (ЭМ) [49]. Панкреатический фиброз инициируется, как уже было указано, путем активации различными факторами панкреатических матрикспродуцирующих ретиноидсодержащих звездчатых клеток, которые при этом видоизменяют свое морфологическое строение и приобретают способность продуцирования коллагеновых волокон, приводя к избыточному их скоплению в ткани ПЖ [21, 26, 45]. Панкреатические звездчатые клетки (ПЗК), выделенные культурально впервые в 1998 г. [16, 18], являются постоянно присутствующими в ПЖ клетками, которые располагаются в ее периацинарных, перидуктальных и периваскулярных пространствах и составляют около 4—7% клеток этой железы в норме [45].
Введение в культуру этих клеток витамина, А приводит к их дифференцировке в миофибробластоподобные клетки, экспрессирующие мышечный актин-α, коллагены I и III типов, ламинин и фибронектин (рис. 1 и далее) [21, 24].
Рис. 1. Активная форма PSC — миофибробласты. Положительная иммуногистохимическая реакция на α-SMA (α-гладкомышечный актин — стрелки). Ув. 400 [21].
В 2010 г. M. Erkan и соавт. [25] показали, что панкреатические и печеночные звездчатые клетки (ключевые медиаторы фиброза печени) имеют сходный геномный рисунок транскрипции, при этом ПЗК отличаются продукцией специфического коллагена I типа 11α1 — COLL11α1. В исследовании О.В. Паклиной [9] показано, что при прогрессировании фиброза ПЖ у больных ХП происходит накопление во внеклеточном матриксе коллагенов III и V типов и их последующая необратимая трансформация в коллаген I типа, который характерен для цирротических изменений, старых рубцов и плохо расщепляется протеазами. Дисбаланс между продукцией коллагенов и их естественными ингибиторами приводит в итоге к развитию фиброза ПЖ [23, 44].
В исследовании B. Muehling и соавт. [38] при сравнении выраженности фиброза головки и тела ПЖ у оперированных больных с ХП выявлено, что в случае алкогольного ХП выраженность фиброза в головке ПЖ, определяемая компьютерным методом с помощью Adobe Photo Shop, составляла в среднем 64% при 47% в теле ПЖ, при идиопатическом ХП — 40 и 32% соответственно. При этом в головке ПЖ среди компонентов ЭМ, помимо коллагена I, III типов, в большем по сравнению с телом ПЖ количестве присутствует коллаген IV типа (в протоковом эпителии) и ламинин (в базальных мембранах). Авторы подчеркивают, что этот факт также свидетельствует о роли головки ПЖ как «пейсмекера» хронического панкреатита, а коллаген IV типа и ламинин играют важную роль в фиброгенезе хронического панкреатита [38].
После перенесенного острого некротического панкреатита ПЗК и их последующие формы — активированные миофибробласты, как показывают исследования A. Zimmermann и соавт. [58], могут участвовать не только в процессах фиброза ПЖ, но и ее ремоделировании путем формирования регенераторных центров, тубулярных комплексов, исходящих из оставшихся после панкреонекроза долек ПЖ [58]. Это явление представляет собой компенсаторную реакцию на гипоксию и повреждение паренхимы ПЖ в виде метаплазии ацинарной ткани в более примитивный протоковый эпителий [9, 58].
Зависимость между эпизодом острого панкреатита (ОП) и развитием ХП в течение нескольких последних десятилетий является предметом ряда исследований, в которых предпринимались попытки определения возможных патогенетических механизмов такой взаимосвязи [32]. Потенциальная возможность трансформации ОП в ХП впервые была сформулирована еще в 1946 г. М. Comfort и соавт. [19] в виде «теории соотношения некроза и фиброза», которая в настоящее время занимает лидирующую позицию [53]. Механизм развития ХП реализуется посредством повторных эпизодов О.П. Научное обоснование этой теории базируется прежде всего на морфологических исследованиях, проведенных G. Kloppel и B. Maillet [32]. Авторы показали, что перипанкреатические некрозы не являются причиной развития ХП, в то время как интрапанкреатический некроз приводит вначале к перилобулярному фиброзу, а в дальнейшем к интралобулярным протоковым изменениям. В настоящее время теория развития ХП в результате рецидивов ОП находит подтверждение в большинстве клинических и экспериментальных исследований [12]. Важная роль в пусковом механизме необратимых рубцово-фиброзных изменений по-прежнему отводится активации ПЗК [36].
Среди факторов повреждения ПЖ, являющихся триггерными в механизме прямой и опосредованной активации ПЗК с последующей гиперпродукцией ЭМ и развитием фиброза ПЖ, выделяют этанол и его метаболиты (ацетальдегиды), оксидативный стресс, паренхиматозную и протоковую панкреатическую гипертензию, гипергликемию, циклооксигеназу-2, активируемый G-пептидом рецептор-2 и инфекционный фактор [17, 48].
В ряде исследований показано, что прогрессирующее разрушение ткани ПЖ и замещение ее полями фиброза сопровождаются нарастающей функциональной недостаточностью ПЖ [15]. Это подтверждает долгосрочное исследование, проведенное R. Ammann и соавт. [13]. Авторы выявили значимую (р
<0,001) прямую корреляционную связь между степенью выраженности фиброза ПЖ и функциональной экзо- и эндокринной ее недостаточностью. Среди выявленных особенностей в первые 6 лет от начала заболевания отмечено преобладание фокусов некроза по сравнению с полями фиброза у 49% больных и наличие панкреатических псевдокист у 90% больных. Авторы выделяют различные виды фиброза — перилобулярный и интралобулярный, очаговые и диффузные формы. При этом степень выраженности панкреатического фиброза нарастала прямо пропорционально длительности заболевания.
Образование фиброза во многом связано со стволовыми клетками костного мозга, мигрирующими в область повреждения П.Ж. Эти клетки обладают высокой активностью, секретируя в межклеточные пространства фибронектин, коллаген, гиалуроновую кислоту. Наряду с этим они также экспрессируют внеклеточные протеазы, ремоделирующие структуру первичного матрикса, образованного в первую фазу заживления некроза ПЖ (воспаления). В дальнейшем мезенхимальные клетки — стволовые клетки, фибробласты, миофибробласты — секретируют коллаген (в основном III типа) и ремоделируют грануляционную ткань в коллагеновый матрикс [4]. На этой фиброзной стадии репарации зон некроза ПЖ останавливается и восстановления структуры и функции ПЖ не наступает. Каждый приступ ОП создает в ПЖ новое поле фиброза или, если фиброз не развивается, псевдокисту ПЖ.
Ингибиторы морфофиброгенеза ПЖ
Основными ингибиторами морфофиброгенеза являются матриксные металлопротеиназы (ММП). Семейство ММП состоит из 20 энзимов, способных расщеплять почти все компоненты внеклеточного матрикса соединительной ткани. Они играют важную роль во многих нормальных физиологических процессах, таких как эмбриональное развитие, морфогенез, репродукция и ремоделирование ткани, а также в различных патологических процессах: артритах, злокачественном росте и сердечно-сосудистых заболеваниях. Количество вновь синтезируемых MMП регулируется в основном на уровне транскрипции, а протеолитическая активность существующих MMП контролируется как активацией проферментов, так и ингибированием активных ферментов эндогенными ингибиторами, α2-макроглобулином и тканевыми ингибиторами металлопротеиназ (TИMП). По специфичности ММП можно разделить на коллагеназы (ММП-1, ММП-8 и ММП-13), желатиназы (ММП-2 и ММП-9) и стромелизины (ММП-3 и ММП-10). ММП секретируются разными клетками (фибробласты, макрофаги, гладкомышечные клетки сосудистой стенки, нейтрофилы, хондроциты, остеобласты и др.) и гидролизируют все компоненты экстрацеллюлярного матрикса: все коллагены и проколлагены, протеогликаны, эластин, фибронектин, ламинин, а также адгезивные и другие белки соединительной ткани [5, 40]. Экспрессия желатиназы (MMП-9) отмечается не только фибробластами, эндотелиальными клетками, макрофагами, но и эпителием панкреатических протоков, нервными стволами. В норме слабой экспрессией характеризуются коллагеназа ММП-1 и желатиназа ММП-9, а также их ингибитор ТИМП-1. Экспрессия протеаз отмечается в ядрах и цитоплазме ацинарных клеток, фибробластах, эндотелии, макрофагах, клетках нервных стволов и цитоплазме единичных клеток панкреатического протокового эпителия. Экспрессия тканевых ингибиторов ММП наблюдается только в ацинарных и эндокринных клетках. Именно такая картина экспрессии матриксных протеаз и их тканевых ингибиторов в норме, вероятно, отражает тот баланс между ними, при котором не происходит накопления коллагена во внеклеточном матриксе.
Большое значение в резорбции фиброза в настоящее время придается стволовым клеткам, в частности мезенхимальным стромальным клеткам костного мозга. В процессе культивирования in
vitro
можно получить линию стволовых клеток, специфически органонаправленную, которая при трансплантации превращается в функционально активные клетки органа. На этом пути стволовые клетки подавляют главные клеточные источники, экспрессирующие коллаген и матричные белки, а также секретируют ММП, резорбирующие коллагеновые волокна. Имеются экспериментальные и единичные клинические наблюдения, указывающие на возможность резорбции соединительной ткани при циррозе печени и некоторых других органов [7].
Лабораторная диагностика фиброза
Поиск различных лабораторных критериев ранней диагностики фиброза ПЖ привел к изучению семейства металлопротеиназ плазмы крови, а именно MMП-9 (желатиназа В, участвующая в биодеградации коллагена I, III и IV типов во внеклеточном матриксе). A. Venkateshwari и соавт. [55], исследуя 112 больных с ХП, показали достоверную значимость повышения уровня ММП-9, что приводит к активации панкреатических звездчатых клеток, а также к избыточному разрушению коллагена IV типа, участвующего в норме в межклеточных связях.
При исследовании уровня ММП-1 (коллагеназа) и ММП-3 (стромелизин), а также трансформирующего фактора роста β1 (TGF-β1) у 71 больного ХП по сравнению с контрольной группой (100 здоровых) выявлено достоверное повышение уровня ММП-1 и TGF-β1 (р
<0,05), в то время как повышение уровня ММП-3 было незначимым (
р
=0,37) [34]. Таким образом, повышение экспрессии TGF-β1, участвующего в гиперпродукции ЭМ, способствующего миграции ПЗК и их активаторов — моноцитов к зоне фиброгенеза, а также повышение в свою очередь уровня ММП-1 и ММП-9, отвечающих за деградацию различных компонентов ЭМ, свидетельствуют о высокой активности фибропластического процесса с точкой приложения в П.Ж. Это является одним из критериев лабораторной диагностики хронического панкреатита [11, 23, 34, 55]. В исследовании K. Adrych [11] повышение TGF-β1 отмечено наряду с повышением уровня ламинина и гиалуроновой кислоты в сыворотке крови больных ХП — маркеров активности пролиферации внеклеточного матрикса П.Ж. Однако в указанных работах не проводится клинико-морфологических сопоставлений выявленных лабораторных изменений плазмы крови и степени выраженности фиброза ПЖ, как гистологической, так и инструментальной, поэтому в настоящее время рано считать доказанным наличие так называемых лабораторных маркеров степени выраженности фиброза ПЖ.
В исследованиях М.И. Воевода и соавт. [1—3] показана корреляционная связь оптических свойств сыворотки крови, определяемых методами спектральной эллипсометрии и инфракрасной Фурье-спектроскопии, зависящих от ее биоорганического состава, с гистологически определяемой выраженностью фиброза печени. При хроническом панкреатите такое изучение только начато, однако оно может выявить выраженность и характер типов коллагена путем анализа изменений состояния поляризации светового пучка, возникающих в результате отражения пучка от исследуемого образца [6]. Инфракрасная Фурье-спектроскопия позволяет определить как качественный, так и количественный элементный состав исследуемых веществ [1—3].
Инструментальная диагностика фиброза
Известно, что патологические изменения меняют эластичность и плотность тканей [51]. Нередко визуализируемые при УЗИ структуры имеют одинаковую эхогенность, при этом различаются значительно по механическим свойствам [43]. В 1991 г. J. Ophir и соавт. [42] предложили метод ультразвуковой компрессионной эластографии, основанный на измерении жесткости и вязкости тканей. При этом, как правило, отмечается уплотнение тканей при их рубцово-фиброзном или опухолевом поражении, а их жесткость может быть описана с помощью модуля Юнга, представляющего собой отношение силы произведенного давления к величине растяжения [22, 33]. Плотные ткани более устойчивы к сжатию, чем мягкие, и поэтому будут иметь большее значение модуля Юнга [46]. Однако глубина залегания органов, конституция и выраженность подкожной клетчатки, а также наличие свободной жидкости и других физиологических барьеров делают прямую компрессию нерегулируемой и потому нестандартизированной. И здесь важным источником силы, воздействующей на ткани, является энергия акустического импульса, которая прямо пропорциональна поглощению акустической интенсивности и обратно пропорциональна скорости звука (акустическая импульсно-волновая эластометрия) [43]. При этом определяется скорость распространения сдвиговой волны в ткани (shear wave velocity — SWV), измеряемая количественно при ультразвуковой эластометрии в метрах в секунду.
При ультразвуковой эластографии плотность/эластичность тканей отображается в виде цветового кодирования, наложенного на обычное изображение в В-режиме, при этом наиболее плотные структуры кодируются синим цветом, наиболее мягкие — красным цветом либо наоборот в зависимости от выбора цветовой шкалы, а в серой шкале более мягкие структуры визуализируются ближе к белому цвету, плотные — к черному (рис. 2 и 3). Эластография может выполняться также при эндоскопическом УЗИ, является методикой качественной диагностики хронического панкреатита, его дифференциальной диагностики с опухолями ПЖ, может сочетаться с эластометрией. Чувствительность и специфичность этих методик составляет 90—92% [29, 30, 35].
Рис. 2. Эластограммы нормальной ПЖ. a — B-режим, зеленая стрелка — тело нормальной ПЖ; б — цветная шкала, белая стрелка – «мягкое» тело ПЖ (зеленый цвет); в — серая шкала, черная стрелка — «мягкое» тело ПЖ (белый цвет) [35].
Рис. 3. Эластография при хроническом кальцифицирующем панкреатите. a — B-режим, зеленая стрелка — тело ПЖ диффузно неоднородной эхоструктуры с кальцинатами; б — цветная шкала, черная стрелка — «плотное» тело ПЖ (красный цвет) [35].
Среди инструментальных методов определения плотности ткани с 1995 г. применяется МР-эластография, которая включает визуализацию распространения поперечной составляющей колебаний акустического диапазона частот в тканях, что позволяет рассчитать количественные значения для механических параметров ткани [39].
Среди лучевых методов диагностики фиброза ПЖ применяется определение коэффициента соотношения КТ-плотности в разные фазы болюсного контрастирования. При этом Y. Hashimoto и соавт. [28] определяли соотношение L/E ratio — «поздней» (печеночная паренхиматозная фаза на 60—70-й секунде от момента введения контрастного вещества) и «ранней» (панкреатическая паренхиматозная фаза — на 40—45-й секунде) фаз болюсного контрастирования за вычетом из каждого показателя в единицах Хаунсфилда величины плотности каждого из отделов ПЖ в нативную фазу до контрастирования. Авторы показали достоверную положительную корреляцию коэффициента L/E ratio с гистологической степенью фиброза.
Оценка перфузионных свойств ткани ПЖ при хроническом панкреатите в исследовании российского автора Н.И. Яшиной [10] косвенно показала, что при увеличении степени выраженности фиброза ПЖ коэффициент изменения плотности в артериальную фазу снижается, а в отсроченную фазу исследования повышается, однако в данном исследовании статистически достоверный корреляционный анализ гистологических и КТ-данных не проводился.
Предикторы фиброза ПЖ
Существуют различные предикторы наличия фиброзно-измененной ПЖ, косвенно указывающие на выраженность ее фиброза. Так, одним из маркеров выраженности фиброза ПЖ может служить наличие кальцинатов в ее паренхиме. R. Ammann и соавт. [13] и G. Kloppel и соавт. [31] выявляли их у 88,4% больных при выраженном фиброзе по 12-балльной шкале (Fibrosis Scale — FS) более 7 баллов, у 44,5% больных при умеренно выраженном фиброзе менее 6 баллов. Y. Hashimoto и соавт. [28] установили достоверную корреляционную связь между выраженностью фиброза ПЖ и расширением главного панкреатического протока (р
<0,001), наличием сахарного диабета (
р
<0,05), а также мануальными ощущениями плотности ПЖ хирургом во время операции (
р
<0,001).
Для исследования выраженности экзокринной недостаточности, являющейся одним из предикторов фиброза ПЖ [14], помимо общепринятых лабораторных тестов, используется перфузионная компьютерная томография [50]. Arikawa Shunji и соавт. (2012 г.) исследовали 4 параметра — перфузию (PF), пик интенсивности контрастирования (PEI), время наступления пика (TTP) и объем кровотока (BV). У больных ХП с лабораторно доказанной экзокринной недостаточностью отмечено существенное снижение PF, PEI, BV при достоверном повышении TTP (р
<0,05) по сравнению со здоровыми пациентами [50]. Корреляционной связи со степенью выраженности фиброза не прослежено, а приводимые данные, по-видимому, лишь косвенно могут свидетельствовать о наличии фиброза в исследуемой группе больных ХП.
Таким образом, наличие фиброза поджелудочной железы (ПЖ) и степень его выраженности имеют важное значение, так как в значительной степени определяют возможность проведения операции. Среди перспективных направлений исследований следует отметить определение активности панкреатических звездчатых клеток, факторов их активации (TGF-β1), изучение типов коллагена, уровня металлопротеиназ, хемо- и цитокинов сыворотки крови, а также оптических ее свойств. Большие перспективы связаны с использованием стволовых клеток, их способностью к направленной дифференцировке, воздействию на звездчатые клетки и фибробласты с целью снижения продукции коллагена и рассасывания фиброза П.Ж. Для получения критериев ранней инструментальной диагностики фиброза ПЖ большое значение имеет сопоставление данных эластометрии ПЖ (как ультразвуковой, так и магнитно-резонансной), двухфазной компьютерной томографии ПЖ с гистологическими данными о степени выраженности фиброза. Наличие достоверных и ранних сведений о выраженности фиброза ПЖ позволит прогнозировать исход лечения хронического панкреатита и влиять на него, а в случае необходимости оперативного вмешательства максимально предотвратить операционные и послеоперационные осложнения.
Сдавливание окружающих тканей
Боли в животе — признак нарушения работы ЖКТ.
Жировые клетки могут развиваться, заполняя большое пространство. В итоге происходит разрастание жировой ткани, которая занимает гораздо больше места, чем предшествующие ей здоровые клетки.
Если жировые клетки распространены по поджелудочной равномерно, то проблем это не вызовет. Хуже ситуация, когда клетки собирают группами.
Тогда начинают говорить о липоме – доброкачественной опухоли. В ней нет ничего слишком страшного, ведь метастазы она не даст, значит, вреда соседним органам не принесет.
Неприятности наступят тогда, когда опухоль разовьется до таких размеров, что начнет давить на сосуды, протоки поджелудочной железы, нервные окончания. Такое воздействие приведет к болям, тошноте, метеоризму и прочим неприятным симптомам.
О риске развития сахарного диабета и ожирения смотрите в видео:
Как распознать болезнь?
Вначале врач собирает тщательный анамнез и расспрашивает о все заболеваниях, которые раньше были у больного. Для подтверждения диагноза на амбулаторном уровне достаточно УЗИ органов брюшной полости и копрограммы. Первое исследование позволяет четко рассмотреть железу. Она, как правило, становится меньше. На УЗИ можно увидеть участки уплотнения, кисты и другие осложнения некроза. Также этим методом хорошо выявляются опухоли панкреас. Копрограмма – это сложный анализ кала, который исследует наличие в выделениях непереваренной клетчатки и жиров. Это может говорить о нарушенной функции органа.
Для более точной и специфической диагностики применяют КТ, МРТ и биопсию.
Питание при липоматозе
В быту живет мнение, что уменьшение количества жиров в рационе поможет остановить липоматоз. Это в корне неверное утверждение.
Даже полное прекращение приема жиров не остановит перерождение здоровых клеток в жировые. Развитие липоматоза никак не связано с питанием. Однако все же лучше жиры исключить. Это окажет благоприятное влияние на организм:
- облегчение состояния поджелудочной;
- избавление от лишних килограммов.
Уменьшение количества поступающих жиров помогает облегчить состояние, многие признаки заболевания отступают, становятся менее выраженными. При отсутствии внешних проявлений заболевания можно говорить о сохраненной работоспособности поджелудочной.
Значит, все протоки функционируют нормально, они не передавлены жировой тканью. При нормальном функционировании поджелудочной ограничение жиров в пище поможет сбросить вес, а на дальнейшее развитие болезни не повлияет.
Симптомы заболевания
Стеатоз развивается долго, месяцами, а то и годами. Всё зависит от образа жизни человека. Первое время признаки заболевания отсутствуют, но постепенно проблема нарастает и возникают:
- тошнота,
- потеря веса,
- изжога,
- рвота,
- непереносимость жирной пищи, спиртного и никотина,
- давление под рёбрами,
- диарея,
- светлый кал, где могут попадаться частички непереваренной пищи,
- метеоризм,
- внезапная аллергия на некоторые продукты,
- кожный зуд,
- снижение аппетита,
- слабость.
Черепенько Людмила Викентьевна
врач — терапевт • врач – кардиолог
Когда симптомы начали проявляться, значит болезнь уже в запущенной стадии и требует скорейшего лечения. Первоначальную дистанционную консультацию вы можете получить у наших специалистов. Они соберут жалобы, составят клиническую картину и расскажут, какое лечение вам подойдет.
Online консультация
Лечение липоматоза
Ибупрофен — препарат для устранения болей в животе.
Избавиться от липоматоза практически невозможно. Существующая сегодня методика лечения идет в 3-х направлениях:
- Изменение образа жизни.
- Применение медикаментозных средств.
- Хирургическое вмешательство.
Изменение образа жизни в нужном направлении поможет улучшить ситуацию в целом. При настойчивости и упорстве можно добиться многого.
Состояние пациентов, стремящихся к выздоровлению, улучшается даже без дополнительного приема лекарств. Основы избавления от патологии – в отказе от алкоголя, других вредных привычек, в нормализации рациона, избавлении от избыточного веса.
Чтобы добиться хороших результатов, надо вести более активный образ. Второй важный фактор – диета. Следование изложенным ниже принципам питания поможет избавиться от многих проблем. Принципы таковы:
- Дробный прием пищи. Желательное количество приемов пищи – не менее 5, оптимальное – 6.
- Ограничение жирного. Исключение сладких жирных блюд.
- Общее уменьшение калорийности блюд, стремление к снижению суточного объема поступающих калорий.
Лекарствами урегулировать ситуацию почти нереально. Прием медикаментов помогает только избавиться от неприятной симптоматики. Для устранения тяжелых последствий ожирения поджелудочной принимают такие препараты: