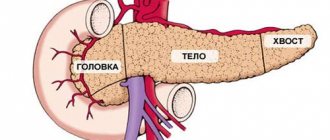
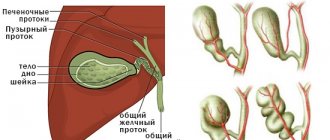
Доброкачественная опухоль желудка – это новообразование, которое не имеет признаков злокачественного процесса. В некоторых случаях остается небольшой риск перерождения при отсутствии соответствующего лечения. Доброкачественные новообразования желудка составляют до 5% от числа всех опухолевых заболеваний желудка, могут развиваться из эпителия, нервной ткани, жировых структур или сосудистых. Рост может быть быстрый или замедленный. По направлению роста выделяют опухоли, движущиеся в сторону просвета желудка, в сторону органов брюшной полости и новообразования, которые разрастаются внутри стенки. По локализации они с одинаковой частотой возникают в теле желудка, антральном отделе или в других местах.
В ЦЭЛТ вы можете получить консультацию хирурга.
- Первичная консультация — 3 000
- Повторная консультация — 2 000
Записаться на прием
Разновидности и особенности желудочных опухолей
По происхождению все новообразования, локализованные в области желудка, разделяют на две большие группы: эпителиальные и неэпителиальные.
Среди первой группы встречаются аденомы и полипы (одиночные или группами). Разница в том, что полипы – это выросты в просвет органа, они обычно округлой формы и имеют широкое основание, могут располагаться на ножке. Развитие полипов ассоциировано с возрастными изменениями – чаще встречаются в возрасте после 40 лет, болезнь поражает мужчин чаще, чем женщин. Гистологически полип представляет собой разросшиеся железистые и эпителиальные ткани с соединительнотканными элементами и развитой сетью сосудов.
Аденомы – это истинные доброкачественные новообразования, состоящие преимущественно из железистой ткани. В отличие от полипов, аденома может чаще перерождаться. Но встречаются реже, чем полипы.
Неэпителиальные опухоли встречаются редко. Они формируются в стенке желудка и могут состоять из самых разных тканей.
К неэпителиальным новообразованиям относят:
- Миому – формируется из мышечной ткани.
- Невриному – формируется из клеток, составляющих миелиновую оболочку нервных волокон.
- Фиброму – развивается из соединительной ткани.
- Липому – состоит из жировой ткани.
- Лимфангиомы – клетки опухоли происходят из стенок лимфатических сосудов.
- Гемангиомы – из клеток, выстилающих кровеносные или лимфатические сосуды.
- и другие варианты, в том числе опухоли смешанной природы.
В отличие от полипов, которые чаще встречаются у мужчин, опухоли неэпителиальной природы чаще диагностируют у женщин. У всех подобных новообразований есть отличительные особенности: как правило, они имеют четкий контур, гладкую поверхность, округлую форму. Могут разрастаться до значительных размеров.
Особо выделяют неэпителиальную опухоль лейомиому – она встречается с более высокой частотой, чем другие новообразования из этой группы. Эта опухоль может вызывать желудочные кровотечения или потенцировать образование язв за счет прорастания в слизистую оболочку желудка. Все неэпителиальные новообразования отличаются достаточно высоким риском онкологического перерождения – малигнизации.
Факторы риска
Опухоли в желудке чаще возникают у людей, которые:
- страдают хроническими заболеваниями пищеварительной системы;
- имеют активную инфекцию Хеликобактер пилори (микроорганизмы приводят к повреждению слизистых оболочек желудочно-кишечного тракта и снижению их защитных свойств);
- не соблюдают принципов рационального сбалансированного питания;
- имеют генетическую предрасположенность к возникновению опухолей;
- проживают в экологически неблагоприятных районах;
- систематически подвергаются воздействию неблагоприятных факторов (химические соединения, стрессы, травмы и т. д.);
- имеют иммунодефицит;
- имеют вредные привычки (алкоголь, курение и т. п.).
В группу риска попадают люди после 40 лет, которые не проходят ежегодные профилактические осмотры с обязательным исследованием желудка.
Симптомы
Симптомы опухоли желудка, как правило, слабо выражены. Если новообразование не растет, то практически не проявляется и никак не наблюдается. Очень часто доброкачественные опухоли определяют по косвенным признакам или выявляют случайно при эндоскопическом обследовании.
Клиническая картина включает в себя:
- Проявления, характерные для гастрита, но без достаточных диагностических признаков для постановки диагноза гастрит.
- Кровоизлияние в желудок.
- Снижение аппетита, утомляемость, колебания веса – общие нарушения, которые можно ассоциировать с болезнями пищеварительной системы.
- Диспепсия.
- При частых кровоизлияниях – анемия.
При абсолютно спокойном течении могут наблюдаться боли тупого и ноющего характера, локализованные, как правило, в эпигастрии. Боль нередко возникает после приема пищи. Достаточно часто больные ассоциируют эти симптомы с гастритом.
При опухолях достаточно большого размера могут наблюдаться более выраженные проявления. Появляется тяжесть, возникают приступы тошноты, появляется частая отрыжка. В рвотных массах и стуле больные обнаруживают примеси крови. В лабораторных анализах определяют пониженный гемоглобин. Пациенты испытывают слабость и головокружения. Вне зависимости от сохранности нормального аппетита начинается потеря веса. Всего различают более сотни видов доброкачественных новообразований – с разным течением и клинической картиной. Выраженность симптомов зависит от локализации, размера и скорости роста опухоли. Классической клинической картиной, позволяющей заподозрить опухоль, считается кровотечение, сопровождаемое общими нарушениями работы ЖКТ.
Собственное клиническое наблюдение ГИСО
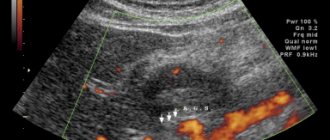
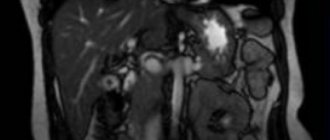
Пациентка Б., 67 лет, в марте 2022 г. обратилась к терапевту по месту жительства с жалобами на боли слабой интенсивности в эпигастрии, эпизоды головокружения на фоне болевого синдрома, тошноту после приема пищи, изжогу, а также боли в гипогастрии, не связанные с актом дефекации и мочеиспусканием. Стул ежедневный, тип 4 по Бристольской шкале, без патологических примесей. Ухудшение самочувствия отмечает в последние 2 мес. В течение длительного времени страдает хроническим гастритом, хроническим некалькулезным холециститом. При физикальном обследовании состояние удовлетворительное; патологических изменений со стороны сердечно-сосудистой и дыхательной систем не выявлено; живот не вздут, мягкий, болезненный при пальпации в эпигастрии, в проекции поперечно-ободочной кишки. Анализы крови в пределах референсных значений. По данным УЗИ органов брюшной полости от 08.04.2019 печень не увеличена, эхогенность ее не изменена, диаметр воротной вены 10 мм, диаметр холедоха 4 мм; желчный пузырь с перегибами, стенки 2 мм, не утолщены, в просвете эхопозитивный подвижный осадок; поджелудочная железа размерами 16×10×14 мм, в области тела лоцируется гипоэхогенное образование 21×20 мм. Для уточнения характера выявленных изменений 23.04.2019 пациентке выполнена КТ органов грудной клетки и брюшной полости с внутривенным контрастированием (йопамидол). На серии снимков легких с двух сторон выявлены очаги с четкими, неровными, бугристыми контурами, накапливающие контрастный препарат с повышением плотности от 13 HU до 93 HU (справа в S3 размерами 8×10 мм, в аксиллярном субсегменте — до 7 мм, слева в S5 — до 3 мм), небольшие участки уплотнения легочной ткани в S6 слева и S9 справа. Увеличенных внутригрудных лимфатических узлов не выявлено. На серии снимков органов брюшной полости по заднемедиальной стенке верхней трети желудка выявлено образование, расположенное кнаружи от желудка, размерами 18×21×13 мм, с четкими контурами, накапливающее контрастный препарат с повышением плотности от 41 HU до 71 HU (рис. 1).
Образование прилежит к стенке желудка на протяжении около 10 мм. Структура паренхимы печени однородная, равномерно накапливает контрастный препарат. Внутри- и внепеченочные желчные протоки не расширены. Желчный пузырь не увеличен, содержимое его однородное, рентгеноконтрастных конкрементов не выявлено, утолщения стенки нет. Воротная и селезеночная вены не расширены, селезенка не увеличена, однородной структуры. Поджелудочная железа не увеличена, однородной структуры, очагов патологического накопления контрастного препарата не выявлено, парапанкреатическая клетчатка не инфильтрирована. Грудной и поясничный отделы позвоночника с дегенеративно-дистрофическими изменениями. Структура тел грудных и поясничных позвонков, а также подвздошных костей неоднородная за счет множественных зон разрежения костной структуры с четкими контурами. Выявляются зоны остеосклероза в теле L4 (4 мм) и в теле левой подвздошной кости (4×6 мм), гемангиома в теле Th9. Для уточнения характера костных изменений выполнена остеосцинтиграфия, убедительных данных за специфическое поражение скелета не получено. С учетом выявленного экзофитного образования, исходящего из желудка, 30.04.2019 пациентке выполнено стандартное эндоскопическое исследование: пищевод свободно проходим, слизистая гиперемирована, на всем протяжении определяется творожистый несмещаемый белесоватый налет. Розетка кардии зияет. Слизистая оболочка желудка пролабирует в пищевод, в области пищеводно-желудочного перехода — кольцо Шацкого с ранимой слизистой в этой области. Форма желудка не изменена. Слизистая диффузно гиперемирована, в антральном отделе 4 острые эрозии под фибрином размерами до 3 мм. По задней стенке желудка визуализируется незначительное сдавление просвета желудка извне на фоне неизмененной слизистой (рис. 2). Для уточнения характера новообразования 17.06.2019 пациентке выполнена ЭУС: в верхней трети тела желудка по малой кривизне, ближе к задней стенке определяется подслизистое образование размером до 15 мм, округлой формы, умеренно выступающее в просвет желудка без его деформации, покрытое неизмененной слизистой. Образование плотное при инструментальной пальпации. При сканировании стенки желудка с частотой 7,5–12 МГц определяется округлой формы, негомогенное, преимущественно гипоэхогенное образование размером до 20 мм, исходящее из мышечной стенки, с преимущественным экстраорганным ростом, с выраженным кровотоком (рис. 3).
После проведения антимикотической терапии (флуконазол 150 мг/сут 14 дней) 10.07.2019 пациентке выполнена энуклеация экстраорганного образования тела желудка с применением эндоскопической видеоассистенции. Гистологическое исследование удаленного образования: округлое, четко инкапсулированное мезенхимальное, диаметром 2,7 см, представлено веретеновидными клетками без клеточного полиморфизма с обильным коллагеновым матриксом. Картина наиболее характерна для склерозирующего варианта ГИСО. Материал был отправлен на дополнительное исследование в ООО «Национальный центр клинической морфологической диагностики», где 10.07.2019 выполнено патогистологическое исследование удаленного образования. Макроописание: округлый плотный узел диаметром 2,7 см с крупнобугристой поверхностью, на разрезе серый, волокнистый, с множественными точечными кровоизлияниями. Микроописание: четко отграниченное мезенхимальное новообразование диаметром 2,7 см представлено веретеновидными клетками с гладкомышечной дифференцировкой, с минимальным клеточно-ядерным полиморфизмом, участками обильной коллагенизации. Картина наиболее характерна для склерозирующего варианта ГИСО (рис. 4). При ИГХ-исследовании в материале определяются структуры веретеноклеточной опухоли, местами с муаровым паттерном, очаговым фиброзом и гиалинозом. Митотическая активность низкая — менее 5 митозов на 5 мм2 при увеличении 400. Опухолевые клетки интенсивно экспрессируют CD34, DOG1, очагово экспрессируют десмин и не экспрессируют S-100 протеин (рис. 5). Индекс пролиферативной активности Ki-67 в пределах 2–5%. Заключение: гистологическая картина и иммунофенотип опухоли соответствуют гастроинтестинальной стромальной опухоли, GIST, 2-я группа. Пациентка была направлена на оперативное лечение.
Причины
На сегодняшний день все причины образования доброкачественных опухолей желудка неизвестны. Поэтому правильно говорить о факторах риска – факторах, которые провоцируют патологические процессы, приводящие к появлению новообразований. В их числе наличие других заболеваний ЖКТ.
Наиболее актуальная теория гласит, что полипы появляются в результате нарушений естественной регенерации слизистой желудка. Поэтому полипы часто развиваются на фоне гастрита. Аденомы чаще сопровождаются атрофическим гастритом. При этом отмечено, что более 70% всех новообразований развивается в нижней трети желудка – то есть в зоне с пониженной концентрацией соляной кислоты.
Причиной развития неэпителиальной опухоли могут быть эмбриональные нарушения или наличие хронических заболеваний. Так как конкретных причин выявить не удается, не существует и специфической профилактики доброкачественных опухолей. Нельзя забывать и о наследственной предрасположенности – пациентам, чьи родственники имели новообразования желудка, необходимо даже при отсутствии каких-либо симптомов заболевания желудка выполнять эндоскопическое исследование. В любом случае, при подозрении на наличие полипа или полиповидного образования желудка следует обратиться к хирургу.
Причины развития неэпителиальных опухолей желудка
Точная причина возникновения опухолей неизвестна, но считается, что предрасполагающими факторами являются:
- хронические гастриты, особенно сопровождающиеся низкой кислотностью желудка;
- понижение иммунитета;
- наследственность — опухоли желудка часто наблюдаются у близких родственников;
- неправильное и нерациональное питание;
- размножение внутри желудка бактерией Helicobacter pylori;
- курение, злоупотребление спиртным; производственный контакт с веществами, стимулирующими опухолевый рост.
Наши врачи
Гордеев Сергей Александрович
Врач-хирург, кандидат медицинских наук, врач высшей категории
Стаж 42 года
Записаться на прием
Прохоров Юрий Анатольевич
Врач-хирург, заведующий хирургической службой ЦЭЛТ, кандидат медицинских наук, врач высшей категории
Стаж 33 года
Записаться на прием
Федорова Елена Владимировна
Врач-хирург, кандидат медицинских наук, врач высшей категории
Стаж 22 года
Записаться на прием
Луцевич Олег Эммануилович
Главный хирург ЦЭЛТ, заслуженный врач РФ, главный специалист ДЗ г. Москвы по эндохирургии и эндоскопии, членкор РАН, заведующий кафедрой факультетской хирургии № 1 ГБОУ БПО МГМСУ, доктор медицинских наук, врач высшей категории, профессор
Стаж 43 года
Записаться на прием
Введение
Нейроэндокринные опухоли (НЭО) желудка составляют 3–6% от всех НЭО и около 2% среди всех опухолей желудка. НЭО желудка чаще встречаются у женщин (64%) [1]. Преобла-дают высокодифференцированные НЭО I типа (см. классификацию). Низкодифференцированные нейроэндокринные карциномы занимают в структуре НЭО желудка не более 6%, однако их истинная распространенность может быть недооценена из-за сложностей морфологической диагностики [2]. Длительное время НЭО желудка относили к крайне редким заболеваниям, однако в последние годы отмечена устойчивая тенденция к росту заболеваемости ими. Так, по данным National Cancer Institute, за период с 1950 по 1999 г. было зарегистрировано всего 562 случая НЭО желудка, а с 2000 по 2004 г. – уже 1043, что составило 11,7% от общего числа гастроэнтеропанкреатических НЭО [3, 4] Причины столь стремительного роста заболеваемости неизвестны. Отчасти рост числа первичных больных может быть следствием широкого внедрения эндоскопического обследования верхних отделов желудочно-кишечного тракта (ЖКТ) и иммуногистохимического исследования биопсийного материала [5]. Также высказывается мнение о роли использования ингибиторов протонной помпы в развитии карциноидов желудка I типа. Длительное (годы) применение препаратов этой группы и вызываемая ими ахлоргидрия сопровождаются выраженным повышением уровня гастрина-17, что является одним из ключевых патогенетических механизмов развития карциноидов желудка [6–8].
НЭО желудка – неоднородная группа, включающая как высокодифференцированные новоообразования, подлежащие эндоскопическому лечению и характеризующиеся благоприятным прогнозом, так и высокозлокачественные низкодифференцированные опухоли, обладающие высоким метастатическим потенциалом, характеризующиеся крайне агрессивным течением и неблагоприятным прогнозом, при которых проводят хирургическое и комбинированное лечение, как при аденокарциномах желудка. Низкая информированность врачей общей практики и онкологов общей лечебной сети о данной проблеме нередко приводит к ошибочному выбору лечебной тактики, в частности к необоснованным операциям у пациентов с карциноидами желудка I–II типов.
Классификация НЭО желудка
Впервые понятие «карциноид» было введено Обердорфером в 1907 г. для описания опухолей ЖКТ, обладающих специфической морфологической структурой, отличной от таковой у эпителиальных новообразований [9]. В 2007 г. Европейское сообщество по нейроэндокринным опухолям (European Neuroendocrine Tumor Society – ENETS) впервые предложило классификацию НЭО, в которой была использована система определения степени дифференциро-вки опухоли, аналогичная таковой для всех злокачественных новообразований ЖКТ [10, 11]. В рекомендациях 2010 г. Американский объединенный онкологический комитет (American Joint Committee on Cancer – AJCC), предложил разделить все НЭО ЖКТ по степени дифференцировки (G) в зависимости от митотического индекса и процента клеток, экспрессирующих антиген Ki-67 [12]. Именно этот подход и стал основанием для создания актуальной на сегодняшний день классификации ВОЗ для НЕО ЖКТ, в соответствии с которой выделяют НЕО G1, G2, нейроэндокринные карциномы G3 (мелко- и крупноклеточные), а также смешанные аденонейроэндокринные карциномы и гиперпластические или предопухолевые изменения [13].
В 1993 г. итальянский патологоанатом G. Rindi предложил классификацию, подразделяющую карциноиды желудка на три основных типа. Карциноиды I типа (до 70–80% от общего числа) [14, 15] развиваются на фоне атрофического аутоиммунного гастрита, в т.ч. при пернициозной анемии [16]. При наличии данного заболевания в качестве ответа на ахлоргидрию происходит значительное повышение уровня гастрина, что в свою очередь приводит к гиперплазии нейроэндокринных клеток желудка и появлению мультифокальных карциноидных опухолей (рис. 1). В пользу данной теории свидетельствуют опыты на животных, в ходе которых было выявлено значительное повышение частоты развития НЭО желудка на фоне высоких доз ингибиторов протонной помпы [8]. По своему клеточному происхождению карциноиды I типа являются ECL-омами, т.е. опухолями из энтерохромофинноподобных (ECL) клеток. Они характеризуются множественностью зачатков, полиповидной формой роста и низким метастатическим потенциалом. Как правило, карциноиды I типа имеют высокую степень дифференцировки G1 (размеры до 1 см) и локализуются в пределах слизисто-подслизистого слоя желудка (рис. 2)
Карциноиды II типа (около 5%) также являются ECL-омами и возникают вследствие повышения уровня гастрина, но в отличие от I типа причиной гипергастринемии является функционирующая НЕО – гастринома (синдром Золингера–Элисона; рис. 3). Гастринома может возникать спорадически (до 70%) или развиваться в рамках синдрома множественной эндокринной неоплазии I типа (MEN-I) [17]. В патогенезе таких опухолей имеет значение не только гипергастринемия, но и инактивация гена MEN1. Им также свойственны множественность зачатков, полиповидная форма роста и поверхностная локализация, однако эти опухоли чаще имеют умеренную дифференцировку G2 и обладают более высоким метастатическим потенциалом (до 10%; рис. 4).
Для НЭО III типа, составляющих до 20% среди всех карциноидов желудка, характерно спорадическое возникновение в отсутствие гипергастринемии и атрофического гастрита (рис. 5). Эти опухоли, как правило, одиночные размером более 2 см, склонны к инвазивному росту и отличаются более агрессивным течением с высоким потенциалом к регионарному и отдаленному метастазированию [18]. По степени дифференцировки они всегда G2.
Отдельным типом НЕО желудка являются низкодифференцированные нейроэндокринные карциномы (НЭК), некоторые авторы обозначают их как 4-й тип по Rindi (рис. 6). Эта группа включает только опухоли с низкой степенью дифференцировки (G3), высоким Ki-67, не имеет связи с фоновыми состояниями и характеризуется крайне неблагоприятным прогнозом (медиана выживаемости около 12 месяцев). Различают мелкоклеточный и крупноклеточный варианты. Особые трудности возникают при попытке классифицировать опухоли с дифференцированной морфологией, но высоким митотическим индексом и Ki-67 >20%, но <50%. По классификации ВОЗ, эти опухоли должны быть отнесены к НЭК желудка G3 (4-й тип), однако по своей биологии, клиническому течению и ответу на химиотерапию они более соответствуют карциноидам желудка III типа. Единого мнения на этот счет в настоящее время нет. В ближайшие годы предполагается пересмотр классификации ВОЗ с выделением дифференцированных НЭК в отдельную группу. Сравнительные характеристики представленных групп НЭО приведены в табл. 1.
Классификации ВОЗ и G. Rindi не противоречат друг другу и могут быть совмещены в одной таблице (табл. 2).
Диагностика
Мультимодальная эзофагогастродуоденоскопия
Наибольшее значение в диагностике НЭО желудка имеет эндоскопический метод исследования, однако эндоскопия в белом свете (WLI) зачастую не позволяет дифференцировать НЭО и доброкачественные полиповидные образования желудка. В настоящее время для уточняющей диагностики НЭО желудка применяется мультимодальное эндоскопическое исследование, включающее осмотр слизистой оболочки в белом свете с высоким разрешением (WLI-HD), узкоспектральную эндоскопию (NBI), в т.ч. с близким фокусом (NBI-CF) и оптическим увеличением изображения (NBI-ME) [19–22]. Обязательным методом обследования при НЭО желудка является эндоскопическая ультрасонография (EUS), выполняемая с целью оценки глубины инвазии опухоли в стенку желудка и выявления возможного метастатического поражения регионарных лимфатических узлов [23, 24].
Нередко НЭО желудка ошибочно принимают за гиперпластические полипы, полипы фундальных желез, хронические эрозии и даже подслизистые новообразования [25], однако к настоящему времени разработаны патогномоничные эндоскопические критерии для дифференциальной диагностики НЭО желудка всех типов. Так, при эндоскопическом исследовании в белом свете НЭО желудка I типа в подавляющем большинстве наблюдений визуализируются как множественные ярко-гиперемированные плоские образования размером от 0,2 до 0,5 см, локализующиеся в теле и проксимальных отделах желудка. На этом фоне четко определяется выраженная атрофия слизистой оболочки, характеризующаяся истончением слизистой оболочки и ее белесостью, обусловленной фиброзными изменениями (рис. 2А) [21, 22, 26]. Реже при I типе НЭО наблюдается полиповидная форма роста, однако в отличие от гиперпластических полипов НЭО I типа не имеют «ножек» и аналогично плоским вариантам характеризуются выраженной гиперемией, что обусловлено значительной их неоваскуляризацией. При использовании NBI НЭО I типа характеризуются точечной или извитой архитектоникой ямок, а также патологической извитостью, расширением и избыточным количеством собирательных венул слизистой оболочки (рис. 2B) [19–22]. В подавляющем большинстве случаев НЭО I типа локализуются в пределах слизистой оболочки и при EUS визуализируются как гипоэхогенные образования, исходящие из глубоких ее отделов [21]. Сходная эндоскопическая картина отмечается и при карциноидах желудка II типа (рис. 4).
НЭО III типа чаще всего ошибочно принимаются за гиперпластические полипы, т.к. всегда имеют полипо- или бляшковидную форму и широкие основания (рис. 5А) [27]. При узкоспектральном эндоскопическом исследовании NBI НЭО III типа характеризуются извитой или нерегулярной архитектоникой ямок и, как и НЭО I типа, – патологически извитыми расширенными собирательными венулами слизистой оболочки (рис. 5B) [27]. В отличие от НЭО I–II типов карциноиды желудка III типа часто прорастают в подслизистый слой, что можно отчетливо определить при EUS (рис. 5C) [23, 24].
При низкодифференцированных НЭК эндоскопическая картина в целом аналогична раку желудка диффузного типа. Дифференциальный диагноз проводится на основании результатов биопсии и иммуногистохимического исследования (рис. 6).
Таким образом, комплексное мультимодальное эндоскопическое исследование, включающее WLI-HD, NBI и эндосонографию (EUS) [21, 22], позволяют с высокой точностью определить тип НЭО желудка.
Лучевые методы визуализации
Ультразвуковое исследование, компьютерная (КТ) и магнитно-резонансная томография (МРТ) применяются для определения локализации, распространенности и глубины инвазии первичной опухоли (карциноиды III типа и НЭК), а также для выявления регионарных и отдаленных метастазов. Стандартным объемом исследования для НЭО желудка является спиральная КТ с внутривенным контрастированием. Наилучшей визуализации при внутривенном контрастировании удается добиться в раннюю артериальную фазу [28, 29]. Альтернативным методом служит МРТ, который позволяет визуализировать опухоль без контрастирования. Ряд исследований продемонстрировал более высокую эффективность МРТ для выявления метастатического поражения печени при НЭО по сравнению со сцинтиграфией с мечеными аналогами соматостатина и стандартной спиральной КТ [30]. Именно по этой причине МРТ в соответствии с рекомендациями ENETS является предпочтительной методикой для обнаружения и контроля метастазов НЭО в печени [31]. При низкодифференцированных НЭК G3 для оценки распространенности процесса рекомендуется выполнение спиральной КТ трех зон: грудной клетки, брюшной полости и малого таза [31].
Октреотид, 111In
Сцинтиграфия с меченым (111In) аналогом соматостатина применяют для диагностики распространенных форм высокодифференцированных НЭО желудка, главным образом III типа (G2). Поскольку при карциноидах I–II типов частота регионарных и отдаленных метастазов крайне низкая, показаний к выполнению радиоизотопной сцинтиграфии, как правило, не возникает [32–34]. При низкодифференцированных НЭК данный метод неэффективен и не должен рутинно применяться для диагностики.
Рентгенография желудка в условиях двойного контрастирования
Рентгенографическое исследование с двойным контрастированием является рутинным методом обследования для пациентов со злокачественными опухолями желудка, позволяющим определить локализацию, протяженность и характер роста образования. Какие-либо патогномоничные признаки НЭО отсутствуют, а рентгенографическая картина зависит исключительно от типа роста опухоли и аналогична таковой, наблюдаемой при других эпителиальных новообразованиях. При плоских НЭО I–II типов рентгенография желудка с двойным контрастированием не позволяет визуализировать даже множественные опухоли и рутинно не применяется.
Биохимические маркеры
Измерение концентрации гастрина в сыворотке крови натощак является ключевым методом дифференциальной диагностики при НЭО I, II и III типов. Как было отмечено ранее, повышение уровня гастрина является главным патогенетическим фактором развития карциноидов желудка I–II типов и их патогномоничным признаком [16]. Нормальным считается показатель <40 iii=»» 2-=»» 2=»» 35=»» p=»»>
Хромогранин А (ХгА) – универсальный маркер НЭО. Измерение концентрации ХгА в сыворотке крови является чувствительным, но низкоспецифичным методом диагностики и мониторинга при НЭО, в т.ч. гормонально неактивных [36, 37]. При НЭО желудка I–II типов ХгА всегда повышен, но причиной этого является не появление карциноидов, а хроническая гипергастринемия с гиперплазией нейроэндокринного аппарата желудка. Поэтому данный маркер имеет клиническое значение только при карциноидах желудка III типа. Также на корректность измерения ХгА влияет прием блокаторов протонной помпы и наличие почечной или печеночной недостаточности. В первом случае для получения корректного результата следует прекратить прием препарата перед забором крови или заменить его на блокатор Н2-гистаминовых рецепторов [38]. Мониторинг ХгА неэффективен и не должен применяться при НЭК G3 желудка.
Классический или атипичный (обусловлен гиперпродукцией гистамина) карциноидный синдром крайне редко наблюдается при НЭО желудка, главным образом при опухоли III типа [39]. В этом случае определяют суточное количество 5-ГИУК (5-гидроксииндолуксусная кислота) в моче, обладающей высокой специфичностью для диагностики и мониторинга серотонин-продуцирующих НЭО. Нормальным считается показатель 2–8 мг/сут. Клиническая значимость данного теста ограничивается возможностью ложноположительных результатов. Повышение уровня 5-ГИУК до 30 мг/сут может быть следствием синдрома мальабсорбции, употребления пищи, богатой триптофаном и серотонином, или приема ряда лекарственных препаратов (например, ацетаминофена, барбитуратов, эфедрина, никотина, кофеина и др.) [40].
Лечение
Локализованные НЭО
Выбор метода лечения НЭО зависит от их типа и степени дифференцировки. «Золотым» стандартом лечения пациентов с НЭО I и III типов является внутрипросветное эндоскопическое лечение [16, 41]. Поскольку большинство НЭО I типа имеют инвазию в пределах слизистой оболочки, наиболее часто для лечения таких больных применяются методы эндоскопической резекции слизистой оболочки или аргоноплазменной коагуляции. При полиповидных НЭО I типа оптимальным методом лечения является резекция слизистой оболочки (ЭРС) [21]. Первым этапом осуществляют формирование гидравлической подушки под опухолью с целью отделения последней от подслизистого слоя. Затем производят отсечение фрагмента слизистой оболочки с НЭО в пределах здоровых тканей с применением электрохирургического блока и диатермической петли [42]. Критерием радикальности подобного эндоскопического вмешательства является отсутствие опухолевых клеток в краях удаленного фрагмента слизистой оболочки [42]. ЭРС обеспечивает высокую степень радикализма и безрецидивное течение заболевания [22]. При множественных плоских НЭО I типа наиболее эффективным методом лечения признается эндоскопическая аргоноплазменная коагуляция с применением специализированных электрохирургических блоков и катетеров подачи аргона, вводимых в инструментальный канал эндоскопа. Такой подход обеспечивает глубокий, вплоть до собственной пластинки, сухой некроз слизистой оболочки в зоне опухоли, что позволяет достигать высокой степени радикальности вмешательства [22, 43].
При невозможности выполнения радикального эндоскопического лечения или достижения адекватного безрецидивного периода на фоне проводимого лечения рядом авторов предлагается выполнять антрумэктомию. Данное вмешательство приводит к значительному уменьшению числа гастрин-продуцирующих клеток, расположенных в антральном отделе желудка, и как следствие – снижению уровня гастрина с последующим регрессом опухолевой ткани [14, 16, 44, 45]. Показанием к применению более агрессивных методов хирургического лечения являются инвазия мышечного слоя стенки желудка [46]; размер опухоли >2 см, что значительно повышает риск регионарного метастазирования [17]; невозможность выполнения радикального эндоскопического лечения [35]; а также желудочно-кишечное кровотечение при условии невозможности выполнения адекватного эндоскопического гемостаза [47]. Вопрос о применении консервативных методов лечения при НЭО I типа, таких как прием разбавленной соляной кислоты или применение аналогов соматостатина, остается дискуссионным. Поэтому данные подходы могут быть рекомендованы только в случаях, когда проведение эндоскопического или хирургического лечения невозможно [45, 48–50].
При НЭО II типа, как и при I типе, применяют эндоскопические методы лечения, а также аналоги соматостатина, однако прогноз для таких больных в значительной степени определяется успехом лечения основного заболевания, т.е. гастриномы [16, 39, 51].
Основной метод лечения НЭО желудка III типа и низкодифференцированных НЭК G3 – это хирургическое вмешательство в объеме гастрэктомии или резекции желудка с регионарной лимфаденэктомией [48, 52, 53]. При инвазии высокодифференцированной опухоли III типа в пределах слизистой оболочки или подслизистого слоя возможно выполнение и внутрипросветного эндоскопического лечения в объеме эндоскопической резекции слизистой оболочки с диссекцией в подслизистом слое [54].
При мелкоклеточном раке желудка возможно проведение самостоятельной консервативной терапии (химиотерапия, химиолучевая терапия), поскольку результаты хирургического лечения неудовлетворительны и мало отличаются от таковых при консервативном лечении [55, 56].
Метастатические НЭО
Высокодифференцированные НЭО.
В случае метастатических НЭО желудка хирургическое вмешательство в отношении первичного очага и отдаленных метастазов, в частности в печени, оправданно при наличии атипичного карциноидного синдрома или в случае возможности выполнения циторедукции в объеме R0 [57–59]. Более того, выполнение полной циторедукции значительно улучшает показатели общей выживаемости [57–64]. Во всех остальных случаях оптимальным методом остается консервативное лечение.
По данным исследований PROMID и CLARINET, применение аналогов соматостатина при метастатических нерезектабельных НЭО оказывает антипролиферативный эффект, увеличивая время до прогрессирования и показатели общей выживаемости независимо от гормональной активности опухоли [31, 65, 66]. На основании полученных данных терапия высокими дозами аналогов соматостатина (октреотид от 30 мг каждые 28 дней, ланреотид 120 мг каждые 28 дней) является стандартом лечения метастатических форм высокодифференцированных НЭО желудка, главным образом при III типе. В качестве второй линии терапии возможно применение таргетной терапии (эверолимус) и химиотерапии, однако эффективность подобного лечения для НЭО желудка не подтверждена серьезными исследованиями.
Низкодифференцированные НЭО.
В случае генерализованных НЭО G3 схемой терапии первой линии является комбинация цисплатина и этапозида [67], в то время как терапия второй линии в данный момент отсутствует [31]. В проведенном недавно ретроспективном исследовании применение темозоломида и капецитабина данной группой больных позволило добиться частичного ответа от 33% участников, что требует дальнейшего изучения этой комбинации препаратов [68]. Также довольно оптимистичные предварительные результаты были получены при использовании фторурацила или капецитабина в сочетании с оксалиплатином или иринотеканом [69, 70]. В отношении применения лекарственной терапии в адъювантном режиме проведено лишь одно небольшое (n=52) исследование в группе пациентов после резекции печени, которые получали комбинацию фторурацила и стрептозотоцина. Не было отмечено никаких статистически значимых различий в показателях выживаемости между основной и контрольной группами, а также группой исторического контроля [71].
Выводы
НЭО желудка представляют собой неоднородную группу заболеваний, различающихся по клиническому течению, подходам к терапии и прогнозу. В основе правильного выбора лечебной тактики лежит определение нейроэндокринной природы опухоли и ее типа по существующим классификациям. Лечение пациентов с НЭО желудка может варьироваться от малоинвазивных эндоскопических методик (карциноиды I, II типов) до агрессивных программ комбинированного и комплексного лечения (НЭК G3), потому информированность о различиях между разными типами НЭО желудка служит ключевым фактором при выборе лечебной тактики.
Диагностика
Диагностика опухолей желудка состоит из трех основных этапов: сбор анамнеза, осмотр, рентгенографическое и эндоскопическое исследование. Также назначают анализ крови, который позволяет выявить снижение уровня гемоглобина, то есть анемию, характерную для опухолей, вызывающих кровотечение. Доброкачественность новообразования определяют по таким признакам: размер, наличие перистальтики (при инструментальном исследовании), форма. Нечеткие контуры, быстрый рост и отсутствие перистальтики свидетельствуют о том, что полип малигнизируется.
Для уточнения диагноза используют ЭГДС – эзофагогастродуоденоскопию, которая позволяет визуально оценить состояние слизистой и в режиме реального времени увидеть форму и размер опухолей, локализованных на слизистой. Этот метод позволяет оценить риск малигнизации – визуально невозможно отличить злокачественную опухоль ранней стадии от доброкачественной, требуется биопсия. При подозрении на онкологию при проведении ФГДС берут пробу для гистологического исследования в лаборатории – биопсия позволяет точно определить характер новообразования.
Так как неэпителиальные опухоли бывают самые разнообразные, то нередко поставить окончательный диагноз удается только после операции.
Исследование опухолей, расположенных вне слизистой, возможно теми же средствами: на рентгенографии видны контуры, а эндоскопическое исследование в сочетании с ультразвуковым метолом (эндо-УЗИ) позволяет определить зоны сдавливания, которые появляются при росте опухолей внутри стенок желудка или в сторону внутренних органов.
Толстая кишка
Визуализация патологического очага в толстом кишечнике обуславливает необходимость его патогистологической оценки. При слишком большом, для единовременного удаления, количестве полипов должен осуществляться забор репрезентативного количества кусочков. Мельчайшие полипы, выявляемые при скрининговой сигмоскопии, должны подвергаться биопсии, более крупные полипы следует удалять целиком при последующей колоноскопии. Морфологическая констатация наличия аденомы или аденокарциномы должна служить поводом для исследования всей толстой кишки. Опубликованные данные о значении выявления гиперпластических полипов во время сигмоскопии остаются спорными. Многие гастроэнтерологи США не считают, что эти полипы несут в себе повышенный риск тяжелой проксимальной неоплазии.
При колитах эндоскопическое исследование с биопсией помогает в установлении протяженности процесса, дифференциальной диагностике и планировании лечения. Биопсийное исследование в остром периоде у пациента с кровянистой диареей позволяет отличить самопроизвольно излечивающийся острый колит от первичной или рецидивной атаки хронического язвенного колита или ишемического колита. Биопсия терминального отдела подвздошной кишки может быть полезной в диагностике болезни Крона, инфекционного илеита и лимфоидной нодулярной гиперплазии. Как болезнь Крона, так и язвенный колит связаны с повышенным риском развития колоректального рака. При этих заболеваниях с целью выявления дисплазии рекомендуется проведение эндоскопического исследования через 8 лет после первичной диагностики, если процесс носил правосторонний характер. У пациентов с левосторонней локализацией патологических изменений угроза развития рака возрастает к 15 году от начала заболевания. У больных с панколитом наиболее часто используемым подходом является 4-квадрантный забор материала через каждые 10 см (через 5 см на протяжении 25 см дистального отдела). При левостороннем колите биопсия из проксимальных отделов толстой кишки также должна выполняться для уточнения распространенности процесса.
Тактические подходы к очагам дисплазии у пациентов с хроническим колитом продолжают развиваться. Если участок слизистой оболочки с диспластическими изменениями крупный, с неровной поверхностью или сочетается со стриктурой, требуется хирургическое лечение. Однако аденому типичного вида, развившуюся на участке толстой кишки с признаками хронического колита, следует удалить с забором биопсийного материала из соседних участков слизистой оболочки. Если аденоматозный полип удален целиком и в окружающей слизистой оболочке нет признаков дисплазии, можно считать что проведено адекватное лечебное мероприятие при доброкачественной спорадической аденоме и продолжать наблюдение за больным с повторными эндоскопическими исследованиями.
Остается неясным, сколько кусочков и в каком месте следует забирать при хронической диарее и эндоскопически нормальной толстой кишке. Диагноз микроскопического колита устанавливается после выявления соответствующих гистологических признаков у больных с хронической водной диареей, при наличии нормальной эндоскопической картины и отсутствии дисбиоза. Биопсийные фрагменты, получаемые при сигмоскопии гибкой волоконной оптикой могут быть адекватны для диагностики данного состояния.
Лечение
Лечение доброкачественной опухоли желудка бывает только хирургическое. Консервативные методы неэффективны. Операцию могут отложить при небольшом размере опухоли и отсутствии опасности озлокачествления. Но в большинстве случаев показано хирургическое удаление – с помощью современных технологий операция безопасна. Раннее удаление особенно важно провести в случае, когда не удается достоверно определить характер опухоли – злокачественные новообразования необходимо убрать на ранней стадии.
Существует несколько методов удаления доброкачественной опухоли, которые применяются в настоящее время:
- Эндоскопическая электроэксцизия – так называется малоинвазивная операция, которая подразумевает электрокоагуляцию через эндоскопический доступ. Таким способом удаляют полипы.
- Энуклеация – позволяет снизить кровопотерю, выполняется через эндоскопический или лапароскопический доступ (в зависимости от локализации образования).
- Лапароскопическая резекция желудка – операция с доступом через проколы передней брюшной стенки и разрез стенки желудка, при которой часть желудка удаляют, а затем восстанавливают непрерывный пищеварительный тракт с помощью аппаратного шва.
- Гастрэктомия – полное удаление желудка. Практически не применяют при доброкачественных опухолях.
Эндоскопическая операция показана при обнаружении полипов, которые видны при диагностике и расположены одиночно. Если полип небольшой, достаточно коагуляции. Для новообразований размером более 5 мм применяют электроэксцизию – полип затягивают за ножку, а затем удаляют электрокоагулятором. При полипах более крупного размера проводят подслизистую резекцию образования (через эндоскоп).
Резекцию желудка проводят при множественных полипах или при высоком риске озлокачествления. Гастрэктомию проводят при некоторых случаях диффузного полипоза.
В клинике ЦЭЛТ можно пройти обследование и начать лечение – современные технологии на страже крепкого здоровья.
Введение
Гастроинтестинальные стромальные опухоли (ГИСО) считаются редкими мезенхимальными новообразованиями, первичная заболеваемость оценивается от 7 до 20 слу-чаев на 1 млн человек в год. Однако среди злокачественных подслизистых образований желудочно-кишечного тракта именно ГИСО являются наиболее распространенными. Диагностируют заболевание, как правило, у пациентов старше 60 лет, без выраженного полового диморфизма. ГИСО могут обнаруживаться на всем протяжении пищеварительной трубки, чаще всего они локализуются в желудке (50–60%) или в тонкой кишке (25–35%), также могут встречаться в толстой (<7%) или прямой (<5%) кишке, очень редко в пищеводе (1%). Встречаются первичные ГИСО, локализующиеся вне полых органов, например в сальнике или забрюшинном пространстве [1, 2].
Гистологическими вариантами ГИСО являются веретеноклеточный (70%), эпителиоидноклеточный (20%) или смешанный типы (10%). Могут присутствовать клеточноядерный полиморфизм, участки склероза и гиалиноза (склерозирующий тип), миксоидной трансформации стромы. Встречаются палисадоподобные и гиперклеточные субтипы; первый, как правило, выявляется в ГИСО по ходу тонкой кишки, последний нередко сопровождается высокой митотической активностью [3].
Ранее считалось, что ГИСО происходят из гастроинтестинальных стромальных клеток, однако в настоящее время установлено, что ГИСО развиваются из интерстициальных клеток Кахаля, в результате онкогенных мутаций в рецепторе тирозинкиназы (KIT
) или в α-рецепторе фактора роста тромбоцитов (Platelet Derived Growth Factor Receptor α, PDGFR-α). Мутации
KIT
имеют 56–92% больных ГИСО, у 5–10% пациентов обнаруживают мутации PDGFR-α, при этом мутации
KIT
и PDGFR-α являются взаимоисключающими. Мутации
KIT
чаще локализуются в 11 (70%) и 9 (10%) экзонах, реже в экзонах 13 (1%) или 17 (1%). Мутации PDGFR-α локализуются в экзонах 18 (5%), 12 (1%), или 14 (<1%). ГИСО с мутациями PDGFR-α чаще всего исходят из желудка (90–93%). Выделяют также дикий тип ГИСО (12–15%), без мутаций в рецепторах
KIT
и PDGFR-α, который может быть классифицирован на группы в зависимости от наличия или отсутствия дефицита сукцинатдегидрогеназы (СДГ). Группа дефицита СДГ включает триаду Carney и синдром Carney — Stratakis, группа без дефицита СДГ включает нейрофиброматоз 1 типа и ГИСО с
BRAF
-,
KRAS
-,
PIK3CA-
мутациями. Считается, что дикий тип ГИСО обладает более низким потенциалом малигнизации [4–6].
Наши услуги
Администрация АО «ЦЭЛТ» регулярно обновляет размещенный на сайте клиники прейскурант. Однако во избежание возможных недоразумений, просим вас уточнять стоимость услуг по телефону: +7
| Название услуги | Цена в рублях |
| Прием врача хирургического профиля (первичный, для комплексных программ) | 3 000 |
| Рентгеноскопия и рентгенография желудка | 4 800 |
| Гастроскопия (видеоэзофагогастродуоденоскопия) | 6 000 |
Все услуги
Запишитесь на прием через заявку или по телефону +7 +7 Мы работаем каждый день:
- Понедельник—пятница: 8.00—20.00
- Суббота: 8.00—18.00
- Воскресенье: выходной
Ближайшие к клинике станции метро и МЦК:
- Шоссе энтузиастов или Перово
- Партизанская
- Шоссе энтузиастов
Схема проезда
Какой метод применяется для удаления полипов больших размеров?
Для удаления гигантских образований единым блоком используют метод диссекции в подслизистом слое. Операция выполняется под общим наркозом и может занять несколько часов. После нее пребывание в стационаре занимает от одного до трех дней.
!!! Независимо от того, какой способ был выбран для удаления полипа, он направляется после извлечения на гистологическое исследование с целью определения характера новообразования и исключения онкологии.
Вероятность рецидива (повторного появления) гиперпластических полипов в желудке достаточно высока, в то время как в толстой кишке подобные явления носят единичный характер.