NB Бужирование – метод диагностики и лечения, применяемый при заболеваниях полых органов, выполняется специальными инструментами (бужами), позволяющими расширить просвет органа.
NB Буж – инструмент для исследования и расширения просвета полого органа. Бужи известны с глубокой древности. Бронзовые бужи для расширения мочевых путей, похожие на современные, были найдены при раскопках Помпеи, города, разрушенного в 79 году нашей эры, почти две тысячи лет тому назад!
Что такое бужирование пищевода?
Бужирование выполняется как в хирургических стационарах, под контролем рентгеноскопии, так и в эндоскопических отделениях. Применение последовательно бужей все возрастающего диаметра позволяет существенно расширить пищевод и восстановить нормальное питание через рот. Бужи различного диаметра
На рентгенограмме – буж, введенный в просвет пищевода.
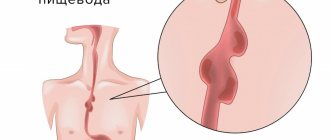
Высока ли эффективность бужирования пищевода у больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА?
Бужирование пищевода – высокоэффективный метод лечения больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА. Хороших результатов у этих больных можно добиться, по данным различных исследователей, можно добиться в 75 – 85% случаев. Иное дело, что такие результаты можно получить не во всех группах больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА. В частности, при протяженных стриктурах этот метод гораздо менее эффективен, чем при коротких сужениях. Кроме того, стойкий эффект во многих случаях достигается лишь после нескольких курсов бужирования. Тем не менее – бужирование, это метод выбора, позволяющий избежать операции у значительной части больных со стриктурами пищевода.
Показано ли хирургическое лечение больным с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА?
Как и во многих других ситуациях показания к операциям у больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА возникают, когда менее травматичные и доступные виды лечения оказываются неэффективными. В частности, таковыми являются невозможность проведения бужирования, или неэффективность бужирования с быстрым возвращением проявлений заболевания (рецидив стриктуры).
В чем заключается хирургическое лечение больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА?
У больных с пептической стриктурой пищевода (ссылка на раздел – «Что такое ПЕПТИЧЕСКАЯ СТРИКТУРА ПИЩЕВОДА …») возможен вариант органосохраняющей операции, когда после бужирования выполняется так называемая фундопликация, то есть специальная манжетка предотвращающая заброс желудочного содержимого в пищевод. Пр этом создаются условия для стихания воспаления в пищеводе и для предотвращения дальнейшего развития стриктуры. Впервые антирефлюксная операция — фундопликация — была проведена Рудольфом Ниссеном (Rudolph Nissen, 1896 –1981) в 1955 году.
NB Фундопликация – антирефлюксная операция, заключающаяся в том, что дно желудка обворачивают вокруг пищевода, создавая манжетку, препятствующая забросу желудочного содержимого в пищевод.
NB Рефлюкс – (лат. refluo — течь назад) — обратный ток содержимого полых органов по сравнению с нормальным его движением. Антирефлюксный – препятствующий рефлюксу.
Тем не менее, основным способом лечения больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА является так называемая эзофагопластика, то есть вмешательство, при котором содается новый пищевод. Материалом для создания пищевода служит, обычно, собственные желудок или кишка больного, из которых формируется трубка необходимого диаметра. Собственный пищевод больного, в зависимости от показаний, может быть удален или сохранен, с формированием нового пищевода в обход старого (так называемая, шунтирующая пластика пищевода). Сегодня эти вмешательства становяться малотравматичными и выполняются с использованием эндоскопической техники (ссылка – раздел «Специалистам» — «Видеоматериалы»).
Перспективные методы лечения больных с РУБЦОВЫМИ СТРИКТУРАМИ ПИЩЕВОДА?
Таким методом следует считать стентирование пищевода, то есть помещение в просвет пищевода специального трубчатого протеза, который не позволит рубцам суживать пищевод. На сегодняшний день эти стенты только разрабатываются и испытываются, но преспективным это направление, безусловно, является. Несомненно актуальным является использование эндоскопической техники при выполнении операций как на грудной клетке, так и на брюшной полости. Наконец, важным и перспективным направлением работы отделения является выполнение повторных операций на пищеводе, после неудачных попыток вмешательства, а также с использованием рианее травмированных или поврежденных органов (т.н. патологически-измененных). Например, как было сказано ранее, ожогом может быть поврежден не только пищевод больного, но и его желудок. Тем не менее, в отделении разработаны технологии использования такого желудка для выполнения операции, что можно продемонстрировать описанием клинического наблюдения.
Клинические случаи
Для ознакомления с клиническими случаями пациентов cо стриктурой пищевода нажмите на ссылку ниже. Обращаем Ваше внимание, что эта информация предназначена для специалистов и содержит натуралистические фото и видео материалы.
- Торакоскопическая субтотальная резекция пищевода с одномоментной лапароскопически ассиcтированной пластикой желудочной трубкой
- Экстирпация пищевода с одномоментной пластикой патологически-изменённым желудком
Читайте информацию про особенности проведения торакоскопических операций.
Хирургическое лечение стриктур пищевода может проводиться в рамках оказания ВМП. Подробнее о бесплатной высокотехнологической медицинской помощи.
Как попасть на лечение в Отделение хирургии желудка и пищевода РНЦХ.
Для записи на консультацию позвоните по телефонам:
+7 (499) 248 13 91 +7 (903) 728 24 52 +7 (499) 248 15 55
Отправьте заявку на консультацию, заполнив форму на нашем сайте и прикрепив необходимые документы.
Эндопротезирование пищевода саморасширяющимися стентами
Одной из проблем при неоперабельном раке пищевода, рецидиве опухоли в области анастомозов, сдавлении просвета пищевода, является устранение дисфагии и восстановление энтерального питания и пассажа по пищеводу. С этой целью, как правило, у данной категории больных выполняют гастро- или энтеростомию. Однако наличие различных стом способствует не только усилению психологической травмы у пациентов, но сопряжено с определенным риском и развитием осложнений у ослабленных больных вне зависимости от способа (хирургического, лапароскопического, эндоскопического) ее наложения. Эндоскопические методы реканализации просвета пищевода — электро-, лазерная, аргоноплазменная коагуляция, бужирование или баллонная дилатация позволяют восстановить просвет в большинстве случаев, но эффект чаще всего бывает непродолжительным и обычно требуются повторные вмешательства. В связи с этим у неоперабельных больных со стенозирующими опухолями пищевода все шире применяется эндоскопическое стентирование, как один из наиболее безопасных, малоинвазивных и эффективных способов лечения. За рубежом эндопротезирование саморасправляющимися металлическими стентами, быстро пришедшими на смену пластиковым трубчатым эндопротезам, применяется уже достаточно давно, особенно при раке пищевода, и к настоящему времени исследователями накоплен уже большой опыт. В России И. Х. Рабкин и соавт. (1989) выполнили рентгеноэндоэзофагеальное протезирование нитиноловым протезом при раке пищевода у 3 больных еще в феврале 1988 г. , однако же эта методика стала применяться более широко только в последние годы.
Основной целью стентирования пищевода является улучшение качества жизни неоперабельных больных.
Перед постановкой стента проводится тщательное обследование пациента. Для установления диагноза, уточнения протяженности опухоли выполняется рентгеноскопия с бариевой взвесью или водорастворимым контрастным веществом и эндоскопическое исследование с биопсией. Для стадирования опухоли и оценки операбельности больного используются УЗИ, КТ и МРТ. Для эндопротезирования применяются саморасправляющиеся стенты таких , Ю. Корея, FerX-ELLA Boubella, Чехия и др.
Стентирование выполняется под рентгенологическим контролем, в положении пациента на левом боку, под внутривенной седацией с помощью эндоскопов. При возможности прохождения эндоскопа через сужение, можно осуществлять только эндоскопический контроль. При эзофагогастродуоденоскопии определяли диаметр просвета и протяженность стеноза для подбора эндопротеза. Верхний и нижний край стента должны находиться как минимум на 2 см выше и ниже границ стенозированного участка, кроме того, необходимо учитывать факт небольшого укорочения стента при его расправлении. Поэтому длина эндопротеза должна на 5-6 см превышать протяженность поражения.
При необходимости маркировка границ стеноза осуществляется несколькими способами. Под рентгенологическим контролем, ориентируясь на изображение дистального конца эндоскопа, на уровне верхнего и нижнего краев сужения на коже устанавливали рентгеноконтрастные метки, которые фиксировали лейкопластырем. Границы опухоли можно промаркировать клипсами с помощью эндоскопического клипатора или путем введения в подслизистый слой 1 мл водорастворимого контрастного вещества. Наиболее удобно и надежно маркировать границы поражения, если это необходимо, путем клипирования или инъекционным методом, поскольку метки на коже легко смещаются даже при небольшом изменении положения тела больного, а при локализации поражения в кишке по ним вообще очень трудно ориентироваться. После маркировки границ под визуальным контролем устанавливали направляющую струну ниже зоны поражения. С этой целью в ряде случаев использовали малокалиберные эндоскопы. При поражениях пищевода, кардии, пищеводного анастомоза эндоскоп извлекали, оставляя проводник. Дальнейшие манипуляции выполняются под рентгенологическим или эндоскопическим контролем. Стент поставляется фирмой-производителем в комплекте со специальным устройством для его введения. Это устройство со сжатым металлическим сетчатым стентом внутри вводится в зону поражения по направляющей струне, ориентируясь на ранее установленные метки. После этого постепенно, очень медленно стягивается оболочка, удерживающая стент в собранном состоянии, контролируя рентгенологически или визуально положение стента и степень его раскрытия. Помимо меток, маркирующих границы опухоли, в самом стенте также имеются рентгеноконтрастные метки, что существенно облегчает контроль положения эндопротеза. Рука, удерживающая доставочное устройство, должна быть плотно прижата к телу, то есть ее положение обязательно следует зафиксировать, иначе при стягивании наружной оболочки стент может быть смещен. Допускается коррекция положения стента вместе с доставочным устройством путем подтягивания, однако смещать уже частично раскрытый стент вперед нельзя из-за опасности его повреждения. Если возникает необходимость в перемещении стента вперед, то следует вначале вновь убрать стент в наружный футляр. Это возможно сделать в том случае, если стент был раскрыт менее чем наполовину (до прохождения контрольной метки на доставочном устройстве). В непораженной части пищеварительной трубки стент раскрывался полностью, в зоне стеноза — частично, ориентировочно на 60‑80%. После полного раскрытия стента наружную оболочку, доставочное устройство с оливой на дистальном конце и струну извлекали. Затем эндоскопически контролируется положение эндопротеза.
Спустя 2-3 часа после вмешательства больным разрешается холодное питье. Полное раскрытие протеза наступает через 24-72 часа, что определяется при обзорной рентгеноскопии, эвакуация оценивается при рентгенографии с водорастворимым контрастным веществом или жидкой бариевой взвесью.
В случае адекватного положения протеза больному разрешали прием полужидкой и кашицеобразной пищи. В последующем больным рекомендовали дробное питание кашицеобразной пищей, заканчивая каждый прием пищи несколькими глотками теплой воды для промывания стента.
В ближайшем периоде после протезирования практически у всех больных возникают боли в грудной клетке, однако постоянные боли сохраняются менее чем у 10 — 15% пациентов. Наиболее интенсивные боли бывают при стентировании высоких стриктур и при использовании стентов большого диаметра. Практически все пациенты отмечают дискомфорт и чувство давления за грудиной после установки протеза, в связи с чем, в первые 3 суток им назначаются ненаркотические анальгетики. Такие ранние осложнения, как кровотечение, перфорация, аспирация, лихорадка и свищи развиваются у 10-20% больных. Летальные исходы, связанные с процедурой установки стента, редки и чаще связаны с профузным кровотечением или аспирацией.
Частота миграции непокрытых стентов составляет 0-3% и повышается до 6% при стентировании зоны кардии. Частота миграции покрытых стентов колеблется от 10% до 30%, повышается при стентировании пищеводно-желудочного перехода. Отмечены редкие случаи компрессии трахеи после стентирования стриктур верхней трети пищевода. Если произошла миграция, то коррекцию положения стента можно выполнить при эзофагоскопии: с помощью биопсийных щипцов протез за лассо подтягивается в адекватную позицию.
Повторные вмешательства (эндоскопическая реканализация при рестентировании) нередки (8-35%) и в первую очередь выполняются при прорастании опухолью непокрытых стентов. Ретроспективные исследования показали, что рецидив дисфагии в результате прорастания опухолью непокрытых стентов развивается в 60% случаев. При покрытых протезах повторная дисфагия развивается из-за обрастания опухолью проксимального или дистального краев стента, а в половине случаев за счет роста неопухолевой ткани (гиперплазия слизистой оболочки, грануляции, фиброз). Такие осложнения, как эрозивное кровотечение встречаются в 3‑10% наблюдений, язвенный эзофагит — в 7%, перфорация или свищи — в 5%, перелом или разрушение конструкции стента — в 2%. M. Q. Wang с соавт. установили, что опасные для жизни осложнения (массивное кровотечение, перфорация, свищи, компрессия трахеи) наиболее часто развиваются при стентировании проксимальной трети пищевода. Для лечения рецидивного стеноза пищевода могут быть использованы Nd: YAG лазерная деструкция, ФДТ, аргоно-плазменная коагуляция, инъекция этанола или повторное стентирование.
Эндопротезирование саморасправляющимися стентами обеспечивает достаточно широкий просвет пищевода, полноценное питание, как правило, не требует повторных лечебных вмешательств, сопровождается умеренным болевым синдромом, благодаря чему повышается качество жизни этой категории больных.