Аденокарцинома пищевода – форма рака, при которой раковые клетки развиваются из железистых, продуцирующих слизь клеток. Болезнь обычно развивается в нижней трети, в области желудочно-пищеводного перехода.
Рак пищевода является одним из самых агрессивных злокачественных новообразований и занимает восьмое место в структуре смертности в мире. Наиболее частыми морфологическими формами являются плоскоклеточный рак (95%) и аденокарцинома (3%). Крайне редко встречаются, карциносаркома, мелкоклеточный рак и меланома. По расчётам Росстата Минздрава РФ заболеваемость среди мужчин и женщин составляет 7.6 и 2.4 случая на 100 тыс. населения соответственно.
- Факторы риска
- Классификация
- Клиническая картина и симптомы
- Диагностика
- Лечение
- После лечения
- Прогноз
Аденокарцинома считается одной из быстро распространяющихся форм рака пищевода в странах Северной Америки и Европы, в то время как плоскоклеточный рак преобладает в развивающихся странах. Это связано с реализацией факторов риска развития данных форм рака пищевода.
Факторы риска
- Пищевод Барретта – заболевание, при котором нормальный плоскоклеточный эпителий пищевода замещается железистыми клетками. Этот процесс называется кишечная метаплазия и развивается в результате хронического агрессивного воздействия желудочного сока на слизистую пищевода у пациентов с гастроэзофагеальной рефлюксной болезнью и грыжами пищеводного отверстия диафрагмы.
- Ожирение.
- Ахалазия кардии и кардиоспазм.
Фото. Эндоскопическая картина при пищеводе Барретта
Классификация
Классификация аденокарциномы пищевода проводится по критериям международной классификации злокачественных новообразований TNM (8-ой пересмотр):
T
- Tis карцинома in situ/дисплазия высокой степени;
- Т1 прорастание опухоли в собственную пластинку или подслизистый слой: Т1а собственная пластинка или мышечная пластинка слизистой оболочки;
- Т1b подслизистый слой.
- Т4аплевра, брюшина, перикард, диафрагма;
N
- N0 нет метастазов в регионарных лимфоузлах;
- N1 поражение 1-2 регионарных лимфоузлов;
- N2 поражение 3-6 регионарных лимфоузлов;
- N3 поражение 7 и свыше регионарных лимфоузлов.
М
- М1 наличие отдаленных метастазов.
Регионарными являются следующие группы лимфатических узлов:
- прескаленные,
- внутренние яремные,
- верхние и нижние шейные,
- шейные околопищеводные,
- надключичные (билатеральные),
- претрахеальные (билатеральные),
- лифоузлы корня легкого (билатеральные),
- верхние параэзофагеальные (выше v. azygos),
- бифуркационные,
- нижние параэзофагеальные (ниже v. azygos),
- задние медиастинальные,
- диафрагмальные,
- перигастральные (правые и левые кардиальные, лимфоузлы вдоль малой кривизны желудка, вдоль большой кривизны желудка, супрапилорические, инфрапилорические, лимфоузлы вдоль левой желудочной артерии).
Поражение чревных лимфоузлов не является противопоказанием к проведению химиолучевой терапии и решению вопроса об оперативном лечении.
Степень дифференцировки опухоли
GX – степень дифференцировки опухоли не может быть определена;
G1 – высокодифференцированная опухоль;
G2 – умеренно дифференцированная опухоль;
G3 – низкодифференцированная опухоль;
G4 – недифференцированная опухоль.
В классификации аденокарциномы пищевода выделяют кардиоэзофагеальный рак, т.е. рак, развивающийся в области пищеводно-желудочного перехода и кардии.
Классификация Зиверта
Аденокарцинома пищеводно-желудочного перехода, согласно классификации Зиверта, подразделяется на 3 типа:
I тип – аденокарцинома дистального отдела пищевода (часто ассоциируется с пищеводом Баррета), центр опухоли расположен в пределах 1–5 см выше кардии (зубчатой линии);
II тип – истинная аденокарцинома зоны пищеводно-желудочного пере хода (истинный рак кардии), центр опухоли расположен в пределах 1 см выше и 2 см ниже кардии (зубчатой линии);
III тип – рак с локализацией основного массива опухоли в субкардиальном отделе желудка в пределах 2–5 см ниже зубчатой линии и возможным вовлечением дистальных отделов пищевода.
Опухоли пищеводно-желудочного перехода I и II типа подлежат лечению согласно алгоритмам, соответствующим РП. Опухоли III типа подлежат лечению согласно алгоритмам, соответствующим раку желудка.
Классификация рака пищеводно-желудочного перехода по Siewert
Классификация аденокарциномы пищевода по стадиям
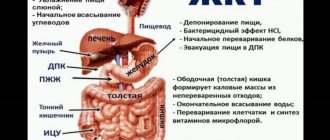
Пищевод
| Схематическое изображениепищевода. 1 – глотка, 2 – верхнее сужение пищевода, 3 – шейный отдел пищевода, 4 – аортальное сужение пищевода, 5 – грудной отдел пищевода, 6 – диафрагмальное сужение пищевода, 7 – диафрагма, 8 – кардиальный отдел желудка, 9 – брюшной отдел пищевода (Шишко В.И., Петрулевич Ю.Я.) |
Пищевод
(лат.
œsóphagus
) — часть пищеварительного канала, расположенного между глоткой и желудком. По форме пищевод представляет собой полую мышечную трубку, сплющенную в переднезаднем направлении.
Длина пищевода взрослого человека примерно 25–30 см. Пищевод начинается в области шеи на уровне VI–VII шейного позвонка, затем проходит через грудную полость в средостении и заканчивается в брюшной полости, на уровне X–XI грудных позвонков.
На границе глотки и пищевода расположен верхний пищеводный сфинктер. Его основная функция заключается в пропускании комков пищи и жидкости из глотки в пищевод, при этом не допуская их обратного перемещения и защищая пищевод от поступления воздуха во время дыхания и трахею от попадания пищи. Представляет собой утолщение циркулярного слоя поперечно-полосатых мышц, волокна которых имеют толщину 2,3–3 мм и которые расположены под углом 33–45° по отношению к продольной оси пищевода. Протяжённость утолщения по передней стороне — 25–30 мм, по задней 20–25 мм. Размеры верхнего пищеводного сфинктера: около 23 мм в поперечнике и 17 мм в переднезаднем направлении. Расстояние от резцов до верхней границы верхнего пищеводного сфинктера у мужчин 16 см и 14 см у женщин.
Масса пищевода «условного человека» (с массой тела 70 кг) в норме — 40 г.
От желудка пищевод отделяется нижним пищеводным сфинктером (синоним кардиальный сфинктер). Нижний пищеводный сфинктер является клапаном, обеспечивающим, с одной стороны, пропуск комков пищи и жидкости из пищевода в желудок, а с другой стороны, не допускающим попадание агрессивного содержимого желудка в пищевод.
Пищевод имеет три постоянных сужения:
- верхнее
или
глоточно-пищеводное
(лат.
constrictio pharyngoesophagealis
) - аортальное
или
бронхоаортальное
(лат.
constrictio bronhoaortica
) - диафрагмальное
(лат.
constrictio diaphragmatica
)
Верхняя часть пищевода (приблизительно одна треть) образована поперечно-полосатой произвольной мышечной тканью, которая ниже постепенно заменяется гладкомышечной, непроизвольной. Гладкие мышцы пищевода имеют два слоя: внешний — продольный и внутренний — циркулярный.
Нормальная кислотность в пищеводе слабокислая и находится в пределах 6,0–7,0 рН.
Кровоснабжение пищевода артериальной кровью происходит от ветвей подключичной артерии, артерии щитовидной железы, межреберных артерий, пищеводных ветвей аорты, бронхиальных артерий, ветвей диафрагмальной и желудочной артерии. Венозный отток происходит по венам — нижним щитовидным, перикардиальным, заднего средостения и диафрагмальным. Вены брюшной части пищевода непосредственно связаны с венами желудка и воротной вены, ими осуществляется анастомоз между системой воротной и полой вен.
Лимфатические сосуды пищевода впадают в глубокие лимфатические узлы шеи, заднего средостения и лимфатические узлы желудка. Часть лимфатических сосудов пищевода открывается непосредственно в грудной проток.
Иннервация пищевода обеспечивается парасимпатической и симпатической нервной системой. Нервные волокна обеих систем на поверхности пищевода образуют переднее и заднее сплетение. Шейная часть пищевода иннервируется возвратными нервами (Ионов А.Ю. и др.).
Топография пищевода
На рисунке ниже (а — вид пищевода спереди, б — вид сзади) изображены: 1 — pars cervicalis oesophagi; 2 — n. laryngeus recurrens sin.; 3 — trachea; 4 — n. vagus sin.; 5 — arcus aortae; 6 — bronchus principatis sin.; 7 — aorta thoracica; 8 — pars thoracica oesophagi; 9 — pars abdominalis oesophagi; 10 — ventriculus; 11 — diaphragma; 12 — v. azygos; 13 — plexus oesophageus;14 — n. vagus dext.; 15 — n. laryngeus recurrens dext. et rami oesophagei; 16 — tunica mucosa (Сторонова О.А., Трухманов А.С.).
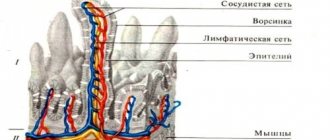
Строение стенки пищевода
На поперечном разрезе просвет пищевода представляется в виде поперечной щели в шейной части (вследствие давления со стороны трахеи), в грудной части просвет имеет кругловатую или звёздчатую форму. Стенка пищевода состоит из адвентиции, мышечного, подслизистого слоев и слизистой оболочки.
При нерастянутом состоянии слизистая собирается в продольные складки. Продольная складчатость способствует продвижению жидкости вдоль пищевода по желобкам между складками и растяжению пищевода при прохождении плотных комков пищи. Этому способствует также рыхлый подслизистый слой, благодаря которому слизистая приобретает большую подвижность. В образовании складок участвует слой гладких мышечных волокон самой слизистой.
| Поперечный срез пищевода. 1 – слизистая оболочка пищевода (а – эпителий, б – мышечная пластинка слизистой, в – собственная пластинка слизистой), 2 – подслизистая основа, 3 – железы пищевода, 4 – мышечная оболочка пищевода (а – циркулярный слой, б – продольный слой), 5 – адвентиция (Шишко В.И., Петрулевич Ю.Я.) |
Эпителий слизистой — многослойный плоский неороговевающий, в пожилом возрасте его поверхностные клетки могут подвергаться ороговению. В составе эпителиального пласта имеется 20-25 клеточных слоёв. В нём содержатся также интраэпителиальные лимфоциты, дендритные антиген-представляющие клетки. Собственная пластинка слизистой образована рыхлой волокнистой соединительной тканью, вдающейся в эпителий высокими сосочками. Она содержит скопление лимфоцитов, лимфатические узелки и концевые отделы кардиальных желез пищевода (сходны с кардиальными железами желудка). Железы — простые трубчатые, разветвлённые, в их концевых отделах — клетки, вырабатывающие муцины, париетальные клетки, эндокринные (энтерохромаффинные и энтерохромаффиноподобные) клетки, синтезирующие серотонин. Кардиальные железы пищевода представлены двумя группами. Одна группа желез залегает на уровне перстневидного хряща гортани и пятого кольца трахеи, вторая группа – в нижней части пищевода. Строение и функция кардиальных желез пищевода представляют интерес, потому что именно в местах их расположения часто образуются дивертикулы, кисты, язвы и опухоли пищевода. Мышечная пластинка слизистой оболочки пищевода состоит из расположенных вдоль него пучков гладких мышечных клеток, окружённых сетью эластических волокон. Она играет большую роль в проведении пищи по пищеводу и в защите внутренней его поверхности от повреждения острыми телами в случае их попадания в пищевод.
Подслизистая основа образована волокнистой соединительной тканью с высоким содержанием эластических волокон, обеспечивает подвижность слизистой оболочки. В ней располагаются лимфоциты, лимфатические узелки, элементы подслизистого нервного сплетения и концевые отделы альвеолярно-трубчатых собственных желез пищевода. Их ампулообразно расширенные протоки выводят на поверхность эпителия слизь, способствующую продвижению пищевого комка и содержащую антибактериальное вещество – лизоцим, а также бикарбонатные ионы, которые защищают эпителий от кислот.
Мышцы пищевода состоят из наружного продольного (расширяющего) и внутреннего циркулярного (суживающего) слоев. В пищеводе расположено межмышечное вегетативное сплетение. В верхней трети пищевода имеется поперечнополосатая мускулатура, в нижней трети – гладкие мышцы, в средней части происходит постепенное замещение поперечнополосатых мышечных волокон гладкими. Эти особенности могут служить ориентирами для определения уровня пищевода на гистологическом срезе. Утолщение внутреннего слоя мышечной оболочки на уровне перстневидного хряща образует верхний сфинктер пищевода, а утолщение этого слоя на уровне перехода пищевода в желудок – нижний сфинктер. При его спазме может возникнуть непроходимость пищевода, при рвоте сфинктер зияет.
Адвентиция, окружающая пищевод снаружи, состоит из рыхлой соединительной ткани, с помощью которой пищевод соединяется с окружающими органами. Рыхлость этой оболочки позволяет пищеводу изменять величину своего поперечного диаметра при прохождении пищи. Брюшной отдел пищевода покрыт брюшиной (Шишко В.И., Петрулевич Ю.Я.).
Фактора агрессии и защиты слизистой оболочки пищевода
При гастроэзофагеальных рефлюксах, как физиологических, так и патологических рефлюктат, содержащий соляную кислоту, пепсин, желчные кислоты, лизолицетин, попадая в просвет пищевода, оказывает повреждающее действие на его слизистую оболочку. Целость слизистой оболочки пищевода обусловлена равновесием между факторами агрессии и способностью слизистой оболочки противостоять повреждающему действию забрасываемого содержимого желудка. Первым барьером, оказывающим цитопротективный эффект, является слой слизи, покрывающий эпителий пищевода и содержащий муцин.
Устойчивость слизистой оболочки к повреждению определяется предэпителиальными, эпителиальными и постэпителиальными факторами защиты, причем in vivo
у пациентов можно оценить состояние только предэпителиальных факторов защиты, включающих секрет слюнных желез, слой слизи и секрет желез подслизистой основы пищевода.
Собственные глубокие железы пищевода секретируют муцины, немуциновые протеины, бикарбонаты и небикарбонатные буферы, простагландин Е2, эпидермальный фактор роста, трансформирующий фактор роста альфа и, частично, серозный секрет. Основной компонент, входящий в состав секретов всех слизистых желёз, — муцины (от лат. mucus
— слизь), представляет собой мукопротеин, относящийся к семейству высокомолекулярных гликопротеинов, содержащих кислые полисахариды. Муцины имеют гелеобразную консистенцию.
Эпителиальный уровень защиты складывается из структурного (клеточные мембраны, межклеточные соединительные комплексы) и функционального (эпителиальный транспорт Na+/H+, Na +-зависимый CI-/HLO-3; внутриклеточные и внеклеточные буферные системы; клеточная пролиферация и дифференцировка) компонентов. Эпителий пищевода и наддиафрагмальной части нижнего пищеводного сфинктера многослойный, плоский, неороговевающий. Постэпителиальными защитными механизмами являются кровоснабжение слизистой оболочки и кислотноосновное состояние ткани.
Интегративный показатель, объединяющий все механизмы восстановления внутрипищеводного рН, называется клиренсом пищевода, который определяют как время элиминации химического раздражителя из полости пищевода. Он осуществляется благодаря комбинации 4 факторов. Первый — двигательная активность пищевода, представленная первичной (акт глотания инициирует возникновение перистальтической волны) и вторичной перистальтикой, наблюдающейся в отсутствие глотания, которая развивается в ответ на растяжение пищевода и/или смещение показателей внутрипросветного рН в сторону низких значений. Второй — сила гравитации, которая ускоряет возврат рефлюктата в желудок в вертикальном положении пациента. Третий — адекватная продукция слюны, в которой содержатся бикарбонаты, нейтрализующие кислое содержимое. Наконец, четвертый, чрезвычайно важный, фактор клиренса пищевода — синтез муцина железами подслизистой основы слизистой оболочки пищевода (Сторонова О.А. и др.).
Пищевод у детей
В начале внутриутробного развития пищевод имеет вид трубки, просвет которой вследствие пролиферации клеточной массы заполнен. На 3–4 месяце существования плода наблюдается закладка желёз, которые начинают активно секретировать. Это способствует образованию просвета в пищеводе. Нарушение процесса реканализации является причиной врожденных сужений и стриктур развития пищевода.
У новорожденных пищевод представляет собой мышечную трубку веретенообразной формы, выстланной изнутри слизистой оболочкой. Вход в пищевод расположен на уровне диска между III и IV шейными позвонками, к 2 годам — на уровне IV–V шейных позвонков, в 12 лет — на уровне VI–VII позвонков. Длина пищевода у новорожденного 10–12 см, в возрасте 5 лет — 16 см; ширина его у новорожденного 7–8 мм, к 1 году — 1 см и к 12 годам — 1,5 см (Боконбаева С.Д. и др.).
У новорожденных детей длина равна 10 см пищевода составляет около половины длины туловища (у взрослых — примерно четверть). У пятилетних длина пищевода 16 см, у десятилетних — 18 см. Форма пищевода у детей раннего возраста воронкообразная, его слизистая оболочка богата кровеносными сосудами, мышечная ткань, железы слизистой оболочки и эластичная ткань недостаточно развиты.
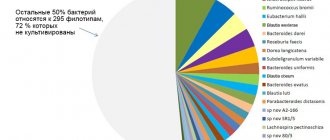
Микробиота пищевода
В пищевод микробиота попадает, в основном, со слюной. При биопсии пищевода наиболее часто выделяются представители следующих родов и семейств: Streptococcus, Rothia, Veillonellaceae, Granulicatella, Prevotella
.
Спектр и частота встречаемости микроорганизмов слизистых оболочек пищевода, желудка и 12-перстной кишки здоровых людей (Джулай Г.С. и др.)
Некоторые болезни и состояния пищевода
Некоторые болезни желудка и синдромы (см.):
| Заброс содержимого желудка в пищевод (гастроэзофагеальный рефлюкс) — причина многих болезней пищевода |
- гастроэзофагеальная рефлюксная болезнь (ГЭРБ)
- рефлюкс-эзофагит
- эзофагит
- эозинофильный эзофагит
- пищевод Барретта
- фукциональная изжога
- гиперсенситивный пищевод (гиперчувствительность пищевода к рефлюксу)
- рак пищевода
- грыжа пищеводного отверстия диафрагмы (ГПОД)
- эзофагоспазм
- «пищевод щелкунчика» (сегментарный спазм пищевода)
Некоторые симптомы, которые могут быть связаны с болезнями пищевода:
- изжога
- боли за грудиной
- дисфагия
- одинофагия
- globus pharyngeus («ком в горле»)
Публикации для профессионалов здравоохранения
- Рапопорт С.И., Лакшин А.А., Ракитин Б.В., Трифонов М.М. рН-метрия пищевода и желудка при заболеваниях верхних отделов пищеварительного тракта / Под ред. академика РАМН Ф.И. Комарова. – М.: ИД МЕДПРАКТИКА-М. — 2005. – с. 208.
- Бордин Д.С., Валитова Э.Р. Методика проведения и клиническое значение манометрии пищевода (Методические рекомендации № 50) / Под ред. д.м.н., проф. Л.Б. Лазебника. – М.: ИД «Медпрактика-М». — 2009. – 24 с.
- Голочевская В.С. Пищеводные боли: умеем ли мы их распознавать?
- Сторонова О.А., Трухманов А.С. Методика изучения двигательной функции пищевода. Пособие для последипломного образования / Под ред. Акад. РАМН, проф. В.Т. Ивашкина. – М. – 2011. – 36 с.
- Трухманов А.С., Кайбышева В.О. рН-импедансометрия пищевода. Пособие для врачей / Под ред. акад. РАМН, проф. В.Т. Ивашкина — М.: ИД «Медпрактика-М», 2013. 32 с.
- Бордин Д.С., Янова О.Б., Валитова Э.Р. Методика проведения и клиническое значение импеданс-рН-мониторинга. Методические рекомендации. – М.: ИД «Медпрактика-М». 2013. 27 c.
- Шишко В.И., Петрулевич Ю.Я. ГЭРБ: анатомо-физиологические особенности пищевода, факторы риска и механизмы развития (обзор литературы, часть 1) // Журнал Гродненского государственного медицинского университета. 2015 г. № 1. С. 19–25.
- Сторонова О.А., Трухманов А.С. 24-часовая рН-импедансометрия. Дифференциальный диагноз функциональных заболеваний пищевода. Пособие для врачей / Под ред. акад. РАН, проф. В.Т. Ивашкина – М.: ИД «МЕДПРАКТИКА-М», 2022. 32 с.
На сайте в разделе «Литература» имеется подраздел «Заболевания пищевода», содержащий большое число публикаций для профессионалов здравоохранения, посвященных болезням пищевода, их диагностике и лечению.
Лекция для студентов медицинского университета, в которой затрагиваются вопросы анатомии пищевода (видео)
Лебедева А.В. Кислотозависимые заболевания желудочно-кишечного тракта
Материалы для пациентов
На сайте GastroScan.ru имеются материалы для пациентов по различным аспектам гастроэнтерологии:
- «Советы врачей» в разделе сайта «Пациентам»
- «Популярная гастроэнтерология» в разделе «Литература»
- «Популярная гастроэнтерология» в разделе «Видео»
Назад в раздел
Клиническая картина и симптомы
Ранние стадии аденокарциномы пищевода при отсутствии сужения просвета пищевода часто протекают бессимптомно и являются случайной находкой при проведении эндоскопического исследования в связи с другими заболеваниями пищевода или обследовании. Отдельно следует обратить внимание на проведение планового динамического эндоскопического исследования у пациентов с гастроэзофагеальной рефлюксной болезнью и пищеводом Барретта, входящими в группу риска по развитию аденокарциномы пищевода.
При развитии опухоли, суживающей просвет пищевода (обычно, при сужении менее 15 мм), основным клиническим проявлением является синдром дисфагии, который включает в себя:
- Затруднение при проглатывании пищи, застревание пищи в пищеводе (дисфагия);
- Немотивированное снижение массы тела на фоне уменьшения питания;
- Срыгивание (регургитация) съеденной пищей;
- Чувство давления и дискомфорта в грудной клетке;
- Боли при проглатывании пищи (редко);
- Слюнотечение (редко).
К признакам распространенного заболевания относятся:
- Прогрессирующая дисфагия (от затруднения при проглатывании твердой пищи до невозможности проглотить жидкости и слюну);
- Значительное снижение массы тела вплоть до развития кахексии (крайнего истощения);
- Лихорадка;
- Боли в костях;
- Одышка;
- Загрудинная боль или боль в спине;
- Признаки кровотечения из желудочно-кишечного тракта (рвота с кровью, черный стул (мелена), анемия в общем анализе крови).
Картина УЗИ желудка и пищевода
Чтобы хорошо ориентироваться в результатах УЗИ желудка и пищевода, необходимо, в первую очередь, знать анатомию этих органов, которую мы в краткой форме приведем ниже.
Анатомия желудка и пищевода
Пищевод представляет собой полую трубку, продолжающуюся от глотки до желудка. Пищевод условно делится на три части – верхнюю, среднюю и нижнюю трети, причем границами каждой части являются физиологические сужения органа. Так, верхняя треть пищевода начинается от глотки и продолжается до уровня второго физиологического сужения, которое лежит на уровне разделения трахеи на правый и левый главный бронх. Средняя треть пищевода (грудная часть) продолжается от второго физиологического сужения до уровня диафрагмы. Наконец, нижняя треть пищевода (брюшная часть) протягивается от уровня диафрагмы и до его соединения с желудком.
Желудок располагается в верхней часть брюшной полости между пищеводом и двенадцатиперстной кишкой (см. рисунок 1). Область соединения желудка с пищеводом называется кардиальной частью (или просто кардией), верхняя часть – дном желудка. Ниже дна расположено тело желудка, которое переходит в пилорическую (привратниковую) часть. Пилорическая часть, в свою очередь, состоит из привратниковой пещеры (синуса) и канала привратника. Кардия, дно и тело желудка образуют пищеварительный мешок, а пещера и канал привратника – эвакуаторный канал.
В самом желудке выделяют переднюю и заднюю стенки. Передняя стенка желудка контактирует с диафрагмой, передней брюшной стенкой и нижней частью печени. Задняя стенка желудка прилежит к аорте, поджелудочной железе, селезенке, верхнему полюсу левой почки и левому надпочечнику, частично к диафрагме и поперечной ободочной кишке. На передней стенке желудка расположена малая кривизна, а на задней – большая кривизна. Форма желудка бывает различной в зависимости от возраста, пола, его расположения, наполнения, функционального состояния. Однако в норме желудок чаще всего имеет форму либо рога, либо крючка.Размеры желудка также варьируют – его длина в норме составляет 20 – 25 см, ширина – 12 – 14 см, длина малой кривизны – 18 – 19 см, длина большой кривизны – 45 – 56 см, толщина стенки – 2 – 5 см, а емкость – 1,5 – 3 литра.
Показатели УЗИ желудка и пищевода
Пищевод виден в форме трубки с характерными физиологическими сужениями. В норме трубка должна быть с равномерной стенкой, без выбуханий, скоплений жидкости, утолщений и т.д. Стенка пищевода имеет толщину около 6 мм.Хорошо визуализируется брюшной отдел пищевода, видимый в качестве трубки с наружным гипоэхогенным мышечным слоем и внутренней гиперэхогенной слизистой оболочкой. Обязательно измеряется диаметр брюшного отдела пищевода, который в норме составляет 5 – 10 мм у детей и подростков, а у взрослых более 10,5 мм. При прохождении перистальтической волны или пищи просвет пищевода раскрывается на 1 – 2 мм. Желудок начинают сканировать натощак, без водно-сифонной пробы. В ходе сканирования обязательно определяют положение и форму желудка, содержание жидкости натощак, состояние стенок, перистальтику и эвакуаторную способность. Следует знать, что в положении лежа полностью увидеть весь желудок удается только у худых пациентов, а у людей плотного телосложения или с лишним весом возможно визуализировать только выходной отдел желудка и его соединение с двенадцатиперстной кишкой. Соединение желудка с кишкой имеет характерный вид «песочных часов».
В положении больного на боку можно также рассмотреть малую и большую кривизну, пилорическую часть желудка, дно желудка.В норме желудок располагается под нижним краем печени. Положение желудка определяют по нижней границе большой кривизны и привратника, который хорошо видим на УЗИ и может иметь различное положение, в зависимости от позы и телосложения пациента. У людей с нормальным (нормостеническим) телосложением в положении лежа привратник обычно расположен выше пупка, а в положении стоя опускается примерно на 3 – 5 см. Привратник обычно на УЗИ виден в форме округлого образования диаметром 2 – 2,5 см со стенками толщиной 4 – 5 мм, с гипоэхогенным периферическим ободком и эхогенной центральной частью. Периферический ободок отражает стенку желудка, а центральная часть – складки слизистой оболочки. В процессе проведения исследованиявследствие перистальтических сокращений форма желудка и толщина его стенок постоянно меняются.В процессе УЗИ измеряются различные параметры пустого желудка, которые в норме следующие:
- наружный диаметр поперечного сечения выходного отдела желудка – 14 – 21 мм;
- толщина стенки выходного отдела желудка – 4 – 5 мм;
- расстояние между стенками выходного отдела желудка – 5 – 10 мм;
- длина выходного отдела желудка – 42,8 ± 1,9 мм;
- коэффициент изображения (соотношение толщины стенки к минимальному расстоянию между стенками) – 0,4 – 1,0;
- нижняя граница большой кривизны желудка в положении лежа – выше пупка на 63,7 ± 3,9 мм;
- привратник желудка в положении лежа – выше пупка на 67,5 ± 5,4 мм;
- привратник желудка в положении стоя и сидя – выше пупка на 46,2 ± 3,6 мм;
- нижняя граница большой кривизны желудка в положении стоя и сидя – выше пупка на 37,6 ± 2,9 мм;
- привратник в положении лежа, стоя и сидя – на 30 – 40 мм правее средней линии живота;
- угол желудка – 45 – 70 o.
В норме натощак в желудке может содержаться до 40 мл жидкости, что свидетельствует о нормальной эвакуаторной функции. Если жидкости в желудке содержится более 40 мл, то это свидетельствует о нарушении эвакуаторной функции, что может быть обусловлено атонией желудка, пилоростенозом, пилороспазмом.После заполнения желудка водой при выполнении УЗИ с водно-сифонной пробой орган принимает овально-удлиненную или грушевидную форму. Растяжение желудка водой позволяет более детально изучить равномерность и толщину стенок, а также оценить перистальтику. При этом обращают внимание на величину и форму полости желудка, следят за глубиной, частотой и периодичностью волн перистальтики. После приема жидкости на УЗИ в желудке видны анэхогенная вода, гиперэхогенные подвижные пузырьки воздуха в ней, а также три слоя стенки органа. Внутренняя слизистая и наружная серозные оболочки образуют как бы две гиперэхогенные линии, между которыми заключено гипоэхогенное содержимое мышечного слоя.Нормальные параметры заполненного водой желудка, измеряемые в ходе УЗИ, следующие:
- нижняя граница большой кривизны желудка в положении лежа – выше пупка на 33,1 ± 3,5 мм;
- привратник желудка в положении лежа – выше пупка на 45,6 ± 3,8 мм;
- привратник желудка в положении стоя и сидя – выше пупка на 24,7 ± 3,1 мм;
- привратник в положении лежа, стоя и сидя – на 40 – 50 мм правее средней линии живота.
Если по данным УЗИ выявляется утолщение стенки пустого или наполненного водой желудка более 5 мм, то обязательно определяют локализацию такого участка, его максимальную толщину, форму и очертание наружных и внутренних контуров, расстояние между стенками в области этого участка, наличие слоистости стенки, ее равномерность и эхогенность. Также обязательно определяют наличие свободной или осумкованной жидкости, газа рядом с пораженным участком, болезненность или чувствительность при надавливании датчиком на кожу над патологическим очагом.
Норма УЗИ желудка
В заключении УЗИ нормального непораженного желудка обязательно указывается, что патологический симптом пораженного органа отсутствует, скопление свободной жидкости не выявляется.В заключении УЗИ нормального пищевода указывается толщина его стенок, отсутствие выбуханий, новообразований и признаков воспалительного процесса.
Диагностика заболевания
Оптимальный план обследования для постановки диагноза, определения клинической стадии и выработки лечебного плана должен включать в себя следующие процедуры:
- Основным методом диагностики является эзофагогастродуоденоскопия. Она позволяет получить материал для морфологического подтверждения диагноза, а также оценить распространенность первичной опухоли по пищеводу. С целью повышения информативности метода в настоящее время могут применяться такие методики, как хромоэндоскопия, эндоскопия в узко-спектральном пучке света, аутофлюоресценция.
- Эндосонография (Эндо-УЗИ) является наиболее информативным методом в оценке глубины инвазии опухоли в стенку пищевода (символ Т). Также она позволяет с высокой точностью (чувствительность 0,8 и специфичность 0,7) оценить состояние регионарных лимфоколлекторов. Для более точного предоперационного стадирования и определения тактики лечения возможно выполнение пункционной биопсии медиастинальных лимфатических узлов.
- Рентгеноконтрастное исследование пищевода.
Рентгенография пищевода с барием у больного раком пищевода
- КТ органов грудной клетки и брюшной полости с внутривенным контрастированием. Выполняется для оценки состояния регионарных лимфоузлов и исключения отдаленных метастазов. По сравнению с эндо-УЗИ она обладает меньшей чувствительностью (0,5), но большей специфичностью (0,83) в диагностике регионарных метастазов. Для отдаленных метастазов этот показатель составляет 0,52 и 0,91 соответственно.
- Совмещенная позитронно-эмиссионная компьютерная томография с 18F дезоксиглюкозой (ПЭТ/КТ) малоинформативна для определения T и N-статуса. Но она демонстрирует более высокую чувствительность и специфичность в обнаружении отдаленных метастазов по сравнению с КТ. ПЭТ/КТ рекомендуется выполнять в случае, если у пациента по данным КТ нет отдаленных метастазов (М1).
- Фибробронхоскопия выполняется для исключения инвазии в трахею и главные бронхи при опухолях пищевода, расположенных на уровне или выше ее бифуркации.
При подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям проводят дополнительные функциональные тесты: эхокардиографию, холтеровское мониторирование, исследование функции внешнего дыхания, УЗДГ сосудов, исследование свёртывающей системы крови, анализы мочи, консультации врачей-специалистов (кардиолога, эндокринолога, невропатолога и т.п.).
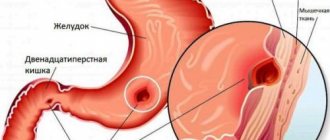
Стриктуры пищевода
Стриктура пищевода — это патологическое сужение просвета пищевода в результате воспаления, фиброзных или диспластических изменений в области собственно сужения.
Глобально стриктуры пищевода делят на доброкачественные (80 %) и злокачественные (20 %). Доброкачественные стриктуры в подавляющем своем большинстве являются результатом гастроэзофагеальной рефлюксной болезни (ГЭРБ) с развитием рефлюкс-эзофагита и последующими рубцовыми изменениями. Такие стриктуры обычно возникают в дистальном отделе пищевода в пределах 4 см от пищеводно-желудочного перехода. Сопутствующее воспаление слизистой оболочки и подслизистый фиброз создают видимость воспаления и плавного сужения просвета.
Наиболее частой причиной злокачественной стриктуры пищевода является пищевод Барретта с последующим злокачественным перерождением, чаще всего в аденокарциному.
1. По природе:
- Доброкачественные: пептические, ожоговые (термические и химические), травматические;
- Злокачественные.
2. По протяженности стриктуры пищевода делят на:
- короткие (протяженность составляет менее 5 см);
- протяженные (протяженность составляет более 5 см);
- субтотальные (поражен только грудной отдел пищевода);
- тотальные (поражены все отделы пищевода).
3. Эндоскопическая классификация сужений пищевода:
- I степень — сужение просвета пищевода до 9–11 мм;
- II степень — сужение просвета до 6–8 мм;
- III степень — сужение просвета 3–5 мм;
- IV степень — просвет пищевода сужен до 1–2 мм или полностью заблокирован.
4. По степени химического ожога пищевода:
- Легкая степень — поражение поверхностных слоев эпителия слизистой оболочки с последующим воспалением. Полностью обратимый процесс;
- Средняя степень — поражение всей толщи слизистой с захватом подслизистого слоя. Развивается некротически-язвенный эзофагит с формированием рубцовой стриктуры пищевода;
- Тяжелая степень — стенка пищевода поражается на всю глубину, возможно нарушение целостности стенки пищевода (перфорация) с вовлечением параэзофагеальной клетчатки и соседних структур (плевра, перикард).
Независимо от характера стриктуры клиническая картина обычно включает в себя один или несколько сочетающихся симптомов:
- дисфагия,
- нарушение аппетита и питания,
- одинофагия,
- боль в груди,
- снижение массы тела.
Из всех вышеперечисленных признаков наиболее часто встречается прогрессирующая дисфагия. При доброкачественных стриктурах дисфагия развивается медленно и малозаметно в течение нескольких лет, в то время как при злокачественной стриктуре дисфагия прогрессирует в течение недель или месяцев. Тщательный сбор анамнеза может помочь определить причину дисфагии, но нужно учитывать, что у 25 % пациентов с пептическими стриктурами ранее не было изжоги или других симптомов гастроэзофагеальной рефлюксной болезни (ГЭРБ).
Эзофагогастродуоденоскопия и рентгеноскопия пищевода и пищеводно-желудочного перехода с использованием водорастворимого контраста являются основой первоначального обследования и диагностики стриктуры пищевода.
Эзофагогастродуоденоскопия дает возможность не только установить факт сужения пищевода, но также позволяет визуализировать слизистую пищевода и осуществить забор материала для дальнейшего гистологического исследования. Последнее особенно важно при определении характера стриктуры. Рентгеноскопия же, в свою очередь, нужна для определения общей анатомии пищевода и выявления других патологий данного органа (перфорации, дивертикул пищевода).
Помимо вышеперечисленных исследований также проводятся:
- Эндоскопическая рН-метрия (для подтверждения диагноза ГЭРБ);
- Эзофагоманометрия (в случае подозрения на нарушения моторной функции пищевода);
- КТ органов грудной клетки и живота (когда стриктура определяется как злокачественная или считается, что причиной сужения пищевода является внешняя патология);
- Эндоскопическая ультрасонография (для оценки характера стриктуры, стадии и степени тяжести злокачественного процесса).
Тактика лечения отличается в зависимости от характера стриктуры пищевода.
Лечение доброкачественной стриктуры заключается в восстановлении проходимости просвета пищевода в сочетании с консервативной терапией для устранения основного заболевания. Основой последней является курсовой прием ингибиторов протонной помпы с последующим эндоскопическим контролем и коррекцией терапии гастроэнтерологом.
Восстановление проходимости просвета пищевода может достигаться при помощи баллонной дилатации в сочетании с местными инъекциями стероидов вокруг стриктуры.
Также при доброкачественных стриктурах возможно выполнение хирургического пособия:
- антирефлюксные операции: фундопликации в различных модификациях в сочетании с крурораффией. Выполняются для устранения грыж пищеводного отверстия диафрагмы, которые способствуют развитию ГЭРБ и рефлюкс-эзофагита.
- эндоскопическая резекция (в случаях повторной стриктуры пищевода и неэффективности баллонной дилатации);
- эзофагоеюностомия (в случаях язвенной стриктуры и отсутствия эффекта от консервативной терапии).
Помимо перечисленных операций в литературе указываются сегментарная резекция дистального отдела пищевода и эзофагогастростомия, однако к подобным операциям стоит прибегать с осторожностью, т. к. они вызывают после себя тяжелую форму ГЭРБ, в результате чего у пациента сохраняются проблемы с язвенным поражением пищевода.
Лечение злокачественной стриктуры пищевода зависит от локализации и операбельности образования. В данной ситуации дилатация играет временную роль, поэтому рассматривается в качестве подготовительной процедуры для установки стента или резекции.
В случае неоперабельной опухоли или когда больному необходимо завершить неоадъювантную терапию до проведения резекции образования возможно проведение стентирования.
В случае операбельного рака дистального отдела пищевода показано хирургическое лечение по всем правилам онкологической хирургии. Подробнее об этом расскажем в статье, посвященной раку пищевода.
Источники:
- Pregun I, Hritz I, Tulassay Z, et al. Peptic esophageal stricture: medical treatment. Dig Dis 2009;27:31–7.
- Pace F, Antinori S, Repici A. What is new in esophageal injury (infection, druginduced, caustic, stricture, perforation)? Curr Opin Gastroenterol 2009;25:372–9.
- Guda NM, Vakil N. Proton pump inhibitors and the time trends for esophageal dilation. Am J Gastroenterol 2004;99:797–800.
- Marks RD, Richter JE, Rizzo J, et al. Omeprazole versus H2-receptor antagonists in treating patients with peptic stricture and esophagitis. Gastroenterology 1994; 106:907–15.
- Dakkak M, Hoare RC, Maslin SC, et al. Oesophagitis is as important as oesophageal stricture diameter in determining dysphagia. Gut 1993;34:152–5.
- Patterson DJ, Graham DY, Smith JL, et al. Natural history of benign esophageal stricture treated by dilatation. Gastroenterology 1983;85:346–50.
- Smith CD. Antireflux surgery. Surg Clin North Am 2008;88:943–58.
Хирургическое лечение
Показаниями к проведению хирургического лечения являются локализованные (ранние) формы рака пищевода без поражения окружающих структур: I-IIA (Т1-3N0M0). Также операция показана с высокой степенью дисплазии при пищеводе Барретта, которая рассматривается как cr in situ.
Хирургическое лечение включает проведение:
- Эндоскопической мукозэктомии (удаление слизистой пищевода) при расположении злокачественных клеток в пределах слизистой. Эндоскопическая резекция является методом выбора при carcinoma in situ и при тяжелой дисплазии. Кроме того, метод успешно применяется при опухолях пищевода, не выходящих за пределы слизистой, у больных, имеющих значительный риск хирургических осложнений. При этом 5-летняя выживаемость достигает 85-100%.
- Субтотальную резекцию пищевода с одномоментной пластикой желудочной трубкой или сегментом толстой кишки.
Основным видом операции является трансторакальная субтотальная резекция пищевода с одномоментной внутриплевральной пластикой стеблем желудка или сегментом толстой кишки с билатеральной двухзональной медиастинальной лимфодиссекцией из комбинированного лапаротомного и правостороннего торакотомного доступов (типа Льюиса).
В некоторых клиниках в качестве альтернативы выполняются трансхиатальные резекции пищевода, которые не могут претендовать на радикальность. Они не должны применяться у пациентов раком грудного отдела пищевода, поскольку из лапаротомного доступа невозможна адекватная медиастинальная лимфодиссекция выше бифуркации трахеи.
Другим путем уменьшения числа хирургических осложнений является минимально инвазивная (торако-лапароскопическая) или гибридная (торакотомия+лапаросокопия или торакоскопия + лапаротомия) эзофагэктомия или робот-ассистированная резекция пищевода.
Подробнее про операцию читайте по ссылке. Предупреждаем, что материалы содержат изображения натуралистического характера.
Анатомия Пищевода человека – информация:
Esophagus, пищевод, представляет узкую и длинную активно действующую трубку, вставленную между глоткой и желудком и способствующую продвижению пищи в желудок. Он начинается на уровне VI шейного позвонка, что соответствует нижнему краю перстневидного хряща гортани, и оканчивается на уровне XI грудного позвонка.
Так как пищевод, начавшись в области шеи, проходит дальше в грудную полость и, прободая диафрагму, входит в брюшную полость, то в нем различают части: partes cervicalis, thoracica et abdominalis. Длина пищевода 23-25 см. Общая длина пути от передних зубов, включая сюда полость рта, глотку и пищевод, равняется 40-42 см (на такое расстояние от зубов, прибавив 3,5 см, надо продвинуть в пищевод желудочный резиновый зонд для взятия желудочного сока на исследование).
Топография пищевода. Шейная часть пищевода проецируется в пределах от VI шейного до II грудного позвонка. Спереди от него лежит трахея, сбоку проходят возвратные нервы и общие сонные артерии.
Синтопия грудной части пищевода различна на разных уровнях его: верхняя треть грудного отдела пищевода лежит позади и левее трахеи, спереди к ней прилежат левый возвратный нерв и левая a. carotis communis, сзади — позвоночный столб, справа — медиастинальная плевра. В средней трети к пищеводу прилежит спереди и слева на уровне IV грудного позвонка дуга аорты, несколько ниже (V грудной позвонок) — бифуркация трахеи и левый бронх; сзади от пищевода лежит грудной проток; слева и несколько кзади к пищеводу примыкает нисходящая часть аорты, справа — правый блуждающий нерв, справа и сзади — v. azygos. В нижней трети грудного отдела пищевода сзади и справа от него лежит аорта, кпереди — перикард и левый блуждающий нерв, справа — правый блуждающий нерв, который внизу смещается на заднюю поверхность; несколько кзади лежит v. azygos; слева — левая медиастинальная плевра.
Брюшная часть пищевода спереди и с боков покрыта брюшиной; спереди и справа к нему прилежит левая доля печени, слева — верхний полюс селезенки, у места перехода пищевода в желудок располагается группа лимфатических узлов.
Строение. На поперечном разрезе просвет пищевода представляется в виде поперечной щели в шейной части (вследствие давления со стороны трахеи), в грудной же части просвет имеет кругловатую или звездчатую форму.
Стенка пищевода состоит из следующих слоев: самый внутренний — слизистая оболочка, tunica mucosa, средний — tunica muscularis и наружный — соединительнотканного характера — tunica adventitia.
Tunica mucosa содержит слизистые железы, облегчающие своим секретом скольжение пищи при глотании. Кроме слизистых желез, встречаются еще в нижнем и, реже, в верхнем отделе пищевода маленькие железки, сходные по своему строению с кардиальными железами желудка. При нерастянутом состоянии слизистая собирается в продольные складки. Продольная складчатость есть функциональное приспособление пищевода, способствующее продвижению жидкостей вдоль пищевода по желобкам между складками и растяжению пищевода при прохождении плотных комков пищи. Этому содействует рыхлая tela submucosa, благодаря которой слизистая оболочка приобретает большую подвижность, а ее складки легко то возникают, то сглаживаются. В образовании этих складок участвует и слой неисчерченных волокон самой слизистой оболочки, lamina muscularis mucosae. В подслизистой основе есть лимфатические фолликулы.
Tunica muscularis, соответственно трубчатой форме пищевода, который при выполнении своей функции проведения пищи должен расширяться и сжиматься, располагается в два слоя — наружный, продольный (расширяющий пищевод), и внутренний, циркулярный (суживающий). В верхней трети пищевода оба слоя складываются из исчерченных волокон, ниже они постепенно замещаются неисчерченными миоцитами, так что мышечные слои нижней половины пищевода состоят почти исключительно из непроизвольных мышц.
Tunica adventitia, окружающая пищевод снаружи, состоит из рыхлой соединительной ткани, с помощью которой пищевод соединяется с окружающими органами. Рыхлость этой оболочки позволяет пищеводу изменять величину своего поперечного диаметра при прохождении пищи.
Pars abdominalis пищевода покрыта брюшиной.
Рентгенологическое исследование пищеварительной трубки производится при помощи метода создания искусственных контрастов, так как без применения контрастных сред она не видна. Для этого исследуемому дается «контрастная пища» — взвесь вещества с большой атомной массой, лучше всего нерастворимый сульфат бария. Эта контрастная пища задерживает рентгеновские лучи и дает на пленке или экране тень, соответствующую полости наполненного ею органа. Наблюдая при помощи рентгеноскопии или рентгенографии за движением таких контрастных пищевых масс, можно изучать рентгенологическую картину всего пищеварительного канала. При полном или, как говорят, «тугом» заполнении контрастной массой желудка и кишок рентгенологическая картина этих органов имеет характер силуэта или как бы слепка их; при небольшом заполнении контрастная масса распределяется между складками слизистой оболочки и дает изображение рельефа ее.
Рентгеноанатомия пищевода. Пищевод исследуется в косых положениях — в правом сосковом или левом лопаточном. При рентгенологическом исследовании содержащий контрастную массу пищевод имеет вид интенсивной продольной тени, ясно заметной на светлом фоне легочного поля, расположенного между сердцем и позвоночным столбом. Эта тень является как бы силуэтом пищевода. Если основная масса контрастной пищи проходит в желудок, а в пищеводе остается проглоченный воздух, то в этих случаях можно видеть контуры стенок пищевода, просветление на месте полости его и рельеф продольных складок слизистой оболочки. На основании данных рентгенологического исследования можно заметить, что пищевод живого человека отличается от пищевода трупа рядом особенностей, обусловленных наличием у живого прижизненного мышечного тонуса. Это прежде всего касается положения пищевода. На трупе он образует изгибы: в шейной части пищевод сначала идет по средней линии, затем слегка отклоняется от нее влево, на уровне V грудного позвонка он возвращается к средней линии, а ниже вновь отклоняется влево и вперед к hiatus esophageus диафрагмы. На живом изгибы пищевода в шейном и грудном отделах меньше выражены.
Просвет пищевода имеет ряд сужений и расширений, имеющих значение при диагностике патологических процессов:
- фарингеальное (у начала пищевода),
- бронхиальное (на уровне бифуркации трахеи)
- диафрагмальное (при прохождении пищевода сквозь диафрагму).
Это анатомические сужения, сохраняющиеся на трупе. Но имеются еще два сужения — аортальное (у начала аорты) и кардиальное (при переходе пищевода в желудок), которые бывают выражены только у живого человека. Выше и ниже диафрагмального сужения имеются два расширения. Нижнее расширение можно рассматривать как своего рода преддверие желудка. Рентгеноскопия пищевода живого человека и серийные снимки, сделанные с промежутками в 0,5-1 с, позволяют исследовать акт глотания и перистальтику пищевода.
Эндоскопия пищевода. При эзофагоскопии (т. е. при осмотре пищевода больного человека с помощью особого прибора — эзофагоскопа) слизистая оболочка гладкая, бархатистая, влажная. Продольные складки мягкие, пластичные. Вдоль них идут продольные сосуды с разветвлениями.
Питание пищевода осуществляется из нескольких источников, причем питающие его артерии образуют между собой обильные анастомозы. Аа. esophageae к pars cervicalis пищевода происходят из a. thyroidea inferior. Pars thoracica получает несколько веточек непосредственно из aorta thoracica, pars abdominalis питается из аа. phrenicae inferiores et gastrica sinistra. Венозный отток из шейной части пищевода происходит в v. brachiocephalica, из грудного отдела — в vv. azygos et hemiazygos, из брюшного — в притоки воротной вены. От шейного и верхней трети грудного отдела пищевода лимфатические сосуды идут к глубоким шейным узлам, предтрахеальным и паратрахеальным, трахеобронхиальным и задним средостенным узлам. От средней трети грудного отдела восходящие сосуды достигают названных узлов грудной клетки и шеи, а нисходящие (через hiatus esophageus) — узлов брюшной полости: желудочных, пилорических и панкреато дуоденальных. В названные узлы впадают сосуды, идущие и от остальной части пищевода (наддиафрагмального и брюшного отделов его).
Иннервируется пищевод из n. vagus et tr. sympathicus. По ветвям tr. sympathicus передается чувство боли; симпатическая иннервация уменьшает перистальтику пищевода. Парасимпатическая иннервация усиливает перистальтику и секрецию желез.
Комбинированное лечение. Химио- и лучевая терапия
Результаты одного хирургического лечения более распространенных стадий остаются неудовлетворительными, 5 лет переживают лишь около 20% больных. В целях улучшения результатов используются различные сочетания лекарственной и лучевой терапий (предоперационная химиотерапия, предоперационная химиолучевая терапия, самостоятельная химиолучевая терапия).
Химиотерапия
А. Предоперационная (неоадъювантная) химиотерапия;
Б. Послеоперационная (адъювантная) химиотерапия.
При аденокарциноме нижнегрудного отдела пищевода или пищеводно-желудочного перехода наиболее оправдано проведение периоперационной химиотерапии, когда 2-3 курса химиотерапии назначаются до операции, а 3-4 курса – после нее. При выявлении гиперэкспрессии HER 2neu в режимы терапии включается трастузумаб в стандартных дозах.
При аденокарциноме нижнегрудного отдела пищевода или пищеводно-желудочного перехода послеоперационная химиотерапия показана, если она проводилась и предоперационно. Адъювантная химиотерапия в самостоятельном виде при аденокарциноме пищевода в настоящее время не рекомендуется.
Лучевая терапия
Проведение одной лучевой терапии (без химиотерапии) до или после хирургического лечения не показано по причине малой эффективности.
А. Предоперационная химиолучевая терапия
Перед химиолучевой терапией возможно проведение 1-2 курсов химиотерапии, что позволяет у большинства больных уменьшить дисфагию и заранее запланировать лучевую терапию.
Крайне желательно проведение дистанционной лучевой терапии на линейных ускорителях. Разовая очаговая доза составляет 1,8-2 Гр, суммарная – до 44-45 Гр. Во время лучевой терапии проводится химиотерапия на основе цисплатина или карбоплатина. При наличии выраженной дисфагии перед началом облучения производят эндоскопическую электрореканализацию/ аргонно-плазменную реканализацию пищевода или пункционную гастростомию.
Хирургическое вмешательство обычно производится через 6-8 недель после завершения химиолучевой терапии.
Оптимальным режимом химиолучевой терапии представляется еженедельное введение паклитаксела и карбоплатина на фоне 5 недель лучевой терапии. Такой предоперационный режим (по сравнению с только хирургией) позволяет достигнуть полного патоморфоза у 23% больных аденокарциномой. Послеоперационная летальность составляет 4%, а 5-летняя выживаемость улучшена с 34% до 47%.
Б. Послеоперационная химиолучевая терапия
Послеоперационная химиолучевая терапия может быть проведена пациентам в удовлетворительном состоянии при наличии микро или макроскопической резидуальной опухоли (после R1 или R2-резекции). Режимы и дозы аналогичные предоперационным.
Ахалазия кардии
Главная угроза ахалазии – критическое увеличение размеров пищевода, приводящее к полной потере функции глотания. В этом случае пациенту требуется сложная и травматичная операция – экстирпация (удаление) пищевода и создание нового пищевода из части желудка.
- Что такое ахалазия кардии
Нижний пищеводный сфинктер (кардиальный сфинктер) располагается в месте перехода пищевода в желудок. При нормальном акте глотания пища перемещается вниз по пищеводу и подходит к области нижнего пищеводного сфинктера, его мышечные волокна рефлекторно расслабляются, и пища попадает в желудок. При ахалазии мышечные циркулярные волокна, из которых состоит нижний пищеводный сфинктер, пропускающий пищу в желудок, не расслабляются или расслабляются с трудом. Пища не имеет возможности свободно поступать в желудок. Она скапливается в пищеводе, вызывая его тракционное расширение.
- Причины возникновения
Основная причина возникновения ахалазии – психоэмоциональный фактор. Эмоциональная среда в крупных городах неблагоприятна, пациенты испытывают стресс на работе и дома, поэтому в наше время ахалазия – довольно распространённое заболевание. Если пациент приходит на консультацию и говорит: «Доктор, я сильно понервничал, и после этого начало ломить за грудиной. Я плохо глотаю пищу, как комок в горле стоит…» — в первую очередь врач предполагает ахалазию. Если с вами происходит нечто похожее – не тяните с визитом к врачу. Чем дольше у пациента существует ахалазия, тем более выраженными становятся клинические проявления ахалазии.
- Симптомы и осложнения
Главным симптомом ахалазии является дисфагия – нарушение глотания. На начальных стадиях ахалазии жидкость проглатывается хуже, чем твёрдая пища. Если в пищевод попадает твёрдая пища, то перистальтика пищевода проталкивает её в желудок через напряженный кардиальный сфинктер. На жидкость перистальтика пищевода практически не влияет. Жидкость задерживается в пищеводе и проглатывается хуже. Ещё один важный симптомом ахалазии — боль в конце акта глотания. Пища проходит по пищеводу до нижнего сфинктера. Перистальтические движения пищевода пытаются протолкнуть её через сжатый сфинктер, в результате возникает достаточно интенсивная боль.
Кроме дисфагии и боли, существуют внепищеводные проявления ахалазии – аспирационные бронхиты и аспирационные пневмонии. Если пища не прошла в желудок – она осталась в пищеводе. Пациент принимает горизонтальное положение и засыпает – содержимое пищевода вытекает в ротовую полость и проникает в бронхи и лёгкие во время вдоха (аспирация). В результате развиваются аспирационные бронхиты и пневмонии. Кроме того, при аспирации пищи существует риск рефлекторной остановки дыхания.
Повышенное давление в пищеводе может приводить к развитию дивертикулов, которые со временем увеличиваются в размерах. Дивертикулам пищевода посвящена отдельная статья. Но чаще у пациента с ахалазией возникает расширение просвета пищевода. И чем дольше существует ахалазия, тем больше в диаметре его пищевод. На поздней стадии ахалазии расширение пищевода становится необратимым.
Ахалазия кардии
Источник изображения: Timonina/Shutterstock
- Стадии ахалазии
Для диагностики и определения стадии ахалазии в Ильинской больнице применяются рентгенологическое исследование с водорастворимым контрастном (в некоторых случаях КТ с контрастом) и эндоскопическое исследование. Различают 4 стадии ахалазии. Чем больше расширение пищевода, тем выше стадия ахалазии. На 1 и 2 стадиях просвет пищевода увеличен. На 3 и 4 стадиях пищевод меняет свою анатомическую конфигурацию, стремясь к S-образной форме. На 4 стадии размер пищевода может превысить размер желудка.
- Малотравматичная эндоскопическая операция
Пациентам с 1, 2 и 3 стадиями ахалазии хирурги Ильинской больницы выполняют малоинвазивную эндоскопическую операцию — пероральную эзофагокардиомиотомию — POEM (peroral esophageal myotomy). Операция проводится без внешних разрезов. Специальный тонкий эндоскоп вводится в пищевод, через инструментальный канал эндоскопа проводятся микроминиатюрные хирургические инструменты. Отступив порядка 10 см от нижнего пищеводного сфинктера, хирург отслаивает слизистую оболочку пищевода от мышечного слоя, создавая «туннель». Эндоскоп вводится в подслизистый слой и постепенно продвигается в сторону сфинктера. Задача эндоскопического хирурга – рассечь мышечные волокна пищевода в зоне около 7 см от сфинктера, дойти до циркулярных мышечных волокон сфинктера и полностью их пересечь. После рассечения мышечных волокон эндоскоп извлекается, место доступа закрывается с помощью специальных клипс, операция завершается. Проведение пероральной эзофагокардиомиотомии возможно на 1, 2 и 3 стадии ахалазии. Однако есть научные данные, говорящие о том, что и при 4 стадии эта операция дает хороший эффект.
- Лапароскопическая операция
3 стадия ахалазии не всегда позволяет выполнить эндоскопическую операцию. В этом случае хирурги Ильинской больницы проводят лапароскопическую эзофагокардиомиотомию, так называемую операцию Геллера. На передней брюшной стенке производятся пять небольших разреза, через которые в брюшную полость проводятся лапароскоп и хирургические манипуляторы. Хирург проходит к области нижнего пищевого сфинктера и очень точно пересекает его циркулярные мышечные волокна. Затем производится фундопликация по Дору — часть желудка заворачивается вокруг пищеводно-желудочного перехода и берет на себя функцию сфинктера, что позволяет избежать развития гастро-эзофагиального рефлюкса (заброса кислоты из желудка в пищевод).
- Экстирпация пищевода
У пациентов с 4 стадией ахалазии пищевод S-образно изменён и максимально расширен, его просвет может превышать 10 см. Перистальтика такого пищевода либо неэффективна, либо её вообще нет — пищевод не выполняет свою функцию. Таким пациентам может помочь только экстирпация пищевода – операция по полному удалению пищевода. Неработающий пищевод практически полностью удаляется. Часть стенки желудка забирается и из нее формируется новый пищевод. Операция длится около 10 часов.
- Ускоренная реабилитация
В Ильинской больнице реализована концепция хирургии ускоренной реабилитации (fast track хирургия). Эта идеология основана на результатах многолетних международных клинических исследований, признана и внедрена во всех развитых странах. Она включает в себя упрощенную подготовку к операции, выполнение операции в день госпитализации, минимизацию хирургического доступа (лапароскопия и эндоскопия), максимальные усилия по сохранению пораженного органа (вместо удаления органа), раннее пробуждение пациента после наркоза, раннюю мобилизацию пациента (можно вставать на ноги вскоре после операции), раннюю алиментацию (можно начинать есть и пить вскоре после операции). Этот комплекс мер направлен на максимально быструю реабилитацию пациента после хирургического вмешательства и восстановление качества его жизни.
- Служба лечения боли
Пациенты Ильинской больницы не испытывают боли – за этим следит специальный общегоспитальный сервис – Служба лечения боли. В арсенале наших специалистов полный спектр анальгетиков, включая мощные опиодные препараты, и высокотехнологичные инструментальные методики, которые хорошо себя зарекомендовали на западе, но редко применяются в нашей стране.
- Стационар на дому
Для наиболее тяжелых пациентов, прошедших лечение в условиях нашего стационара, мы готовы организовать «стационар на дому». Даже после проведения самой сложной и тяжелой хирургической операции, больной может быть переведен домой достаточно быстро. Домашняя среда и близость семьи способствуют скорейшему выздоровлению. Мы обеспечиваем постоянное наблюдение за пациентом с помощью специально подобранного набора мониторов, контролируем лекарственную терапию и организуем регулярные занятия с инструктором-реабилитологом. В домашних условиях с успехом могут проводиться внутривенные вливания, масочная вентиляция легких и другие процедуры и манипуляции.
Самостоятельная химиолучевая терапия
Альтернативой хирургическому лечению операбельных местно-распространенных форм рака пищевода является химиолучевая терапия, которая позволяет достичь сравнимой 5-летней общей выживаемости 20-27%. В прямом сравнительном исследовании самостоятельной химиолучевой терапии на основе цисплатина и инфузии 5-фторурацила и одной операции не было достигнуто достоверных различий в отдаленных результатах, а токсичность и летальность консервативного лечения были значительно ниже.
Крайне желательно проведение конформной 3D CRT дистанционной лучевой терапии на линейных ускорителях энергией 6-18 Мев, а также на протонных комплексах работающих с энергией70-250 Мев. Разовая очаговая доза составляет 1,8-2 Гр, суммарная – до 50-55 Гр. Увеличение СОД не приводит к улучшению результатов, повышая лишь летальность.
Во время лучевой терапии проводится химиотерапия, чаще на основе цисплатина и инфузий 5-фторурацила. При наличии выраженной дисфагии, перед началом облучения производят эндоскопическую электрореканализацию пищевода или пункционную микрогастростомию. Химиолучевая терапия нередко осложняется развитием лучевых эзофагитов и усилением степени выраженности дисфагии, что усугубляет нутритивный дефицит пациента и ухудшает переносимость лечения. В таких ситуациях возможен частичный или полный переход на парентеральное питание, постановка временной пункционной микрогастростомы.
Выбор между самостоятельной химиолучевой терапией или хирургическим лечением (с или без предоперационной химиолучевой терапией) зависит от локализации первичной опухоли, функционального состояния больного и опыта хирурга. Так, у сохранных пациентов с локализацией опухоли в средней или нижней трети пищевода предпочтительнее включение в план лечения операции.
При сохранении жизнеспособной опухоли после химиолучевого лечения или местном рецидиве возможно выполнение так называемой «спасительной эзофагэктомии».
Паллиативное лечение неоперабельных больных
Основными задачами лечения пациентов с метастатическим раком пищевода являются устранение болезненных симптомов, увеличение продолжительности жизни.
Оценка эффективности различных режимов химиотерапии рака пищевода затруднена отсутствием рандомизированных исследований. По этой причине даже сложно оценить и тот выигрыш, который дает химиотерапия по сравнению с поддерживающей терапией.
Проведение химиотерапии рекомендуется пациентам в удовлетворительном состоянии и отсутствием выраженной (III-IV) дисфагии, затрудняющей адекватное питание пациента. В последнем случае на первом этапе показано восстановление проходимости пищевода (стентирование, реканализация). При дисфагии I-II степени начало химиотерапии позволяет добиться уменьшения степени ее выраженности у ряда больных уже к концу первого курса.
Стентирование пищевода при раке
Наиболее активными препаратами при обоих гистологических вариантах являются цисплатин, фторпиримидины, таксаны. Кроме того, при аденокарциномах также эффективны оксалиплатин, иринотекан, трастузумаб (при гиперэкспрессии HER-2 neu).
После лечения
Осмотр
Пациенты после радикального лечения (хирургия или химиолучевая терапия) должны осматриваться каждые 3-6 мес. в первые 2 года, далее каждые 6-12 мес. в последующие 3-5 лет, затем ежегодно.
Анализы
Анализы крови и инструментальные обследования назначаются только по клиническим показаниям (появление жалоб или симптомов прогрессирования).
ЭГДС
Пациенты с ранним раком, которые подверглись эндоскопической резекции слизистой, должны выполнять ЭГДС каждые 3 мес. в первый год, каждые 6 мес. на второй и третий годы, далее – ежегодно.
Прогноз
Прогноз при аденокарциноме пищевода определяется стадией заболевания. К сожалению, особенности строения пищевода, высокий риск метастазирования, отсутствие специфической клинической картина на ранних стадиях заболевания, приводят к тому, что 2/3 пациентов к моменту установки диагноза имеют 3 или 4 стадию. Это либо местно-распространенный неоперабельный процесс либо отдаленные метастазы в легких, печени, костях. В данном случае 12-месячная выживаемость составляет лишь 38%.
При локализованных стадиях 5-летняя выживаемость может достигать 47%, при поражении регионарных лимфоузлов – 25%, при наличии отдаленных местастазов не превышает 5%.
Хирургическое лечение в отделении торакоабдоминальной хирургии и онкологии РНЦХ
Лечение в отделении проводится по программам ОМС, ДМС, ВМП, а также на коммерческой основе. Читайте, как попасть на лечение в отделение торакоабдоминальной хирургии и онкологии РНЦХ.
Для записи на консультацию позвоните по телефонам:
+7 (499) 248 13 91 +7 (903) 728 24 52 +7 (499) 248 15 55
Отправьте заявку на консультацию, заполнив форму на нашем сайте и прикрепив необходимые документы.