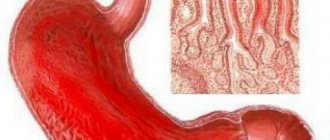
Парез кишечника – состояние, которое сопровождает многие тяжёлые заболевания и характеризуется постепенным уменьшением тонуса кишечной стенки, параличом гладких мышц кишечника. Среди хирургических пациентов всех профилей парез кишечника диагностируется у 0,2% прооперированных больных. Послеоперационный парез требует своевременного лечения, при отсутствии которого могут развиться осложнения.
Специалисты Юсуповской больницы разрабатывают для пациентов программы терапии пареза, в которые включены эффективные методы. Современное оснащение центра реабилитации Юсуповской больницы и профессионализм специалистов позволяют пациентам с данной патологией в минимальные сроки возвращаться к полноценной жизни.
Причины
Парез кишечника может быть обусловлен переломом нижнегрудного и поясничного отделов позвоночника с повреждением и без нарушения целостности спинного мозга. Он развивается при наличии забрюшинной гематомы, сдавливающей сосуды и нервы брыжейки. Врачи клиники неврологии проводят консервативную терапию пареза кишечника у пациентов с заболеваниями нервной системы с помощью эффективных препаратов, зарегистрированных в РФ.
Парез кишечника является довольно распространенным проявлением заболеваний внутренних органов. Паралич мышц кишечной стенки в 25% случаев развивается на фоне острой патологии органов брюшной полости, реже – при тяжелых заболеваниях легочной и сердечно-сосудистой систем, эндогенной интоксикации, генерализованной инфекции.
Более 70% пациентов, страдающих парезом кишечника, находятся в возрасте старше 60 лет, поэтому кишечный паралич считают заболеванием лиц пожилого возраста. Парез кишечника может встречаться у новорожденных, детей разного возраста, беременных. Одной из причин развития заболевания считается формирование воспалительного процесса, локализованного внутри или за пределами брюшной полости (при перитоните, забрюшинных флегмонах и других заболеваниях).
Причиной паретической кишечной непроходимости могут быть:
- нарушение кровоснабжения кишечника с развитием ишемии (при необратимой ишемии миокарда, разрыве аневризмы брюшного отдела аорты, острой коронарной недостаточности);
- нарушение иннервации (при опухолевом или травматическом повреждении спинного мозга, приеме блокаторов кальциевых каналов, угнетении синтеза ацетилхолина в нервных окончаниях).
Рефлекторный парез развивается при осложненном течении пневмонии, почечной колике. Также возможно нарушение моторики при экзогенных и эндогенных интоксикациях.
Этиология, патогенез моторно-эвакуаторных нарушений желудочно-кишечного тракта после операций на органах брюшной полости
Парез желудочно-кишечного тракта является вторым по частоте среди наблюдаемых послеоперационных осложнений [7, 34, 38]. Его патогенез весьма сложен и, по-видимому, имеет не одну, а несколько причин развития [38, 43, 49, 55, 64, 66]. Чаще всего парез желудочно-кишечного тракта встречается после обширных абдоминальных операций [15, 61, 64, 72]. Многие авторы объясняют это тем, что при подобных оперативных вмешательствах травмируется богатая рецепторами брюшина, вследствие чего развиваются циркуляторные расстройства в стенке органов желудочно-кишечного тракта, повышается тонус симпатической нервной системы с выбросом в кровь большого количества катехоламинов [5, 44, 50, 64, 75, 76]. В связи с этим многие авторы оценивают развитие послеоперационного пареза желудочно-кишечного тракта как защитную реакцию на операционную травму в ближайшие 2-3 дня после операции [38, 54].
Нарушение функции желудочно-кишечного тракта является наиболее частым и тяжелым осложнением перитонита. По мнению большинства исследователей, в патогенезе перитонита одним из ключевых факторов прогрессирования заболевания является синдром энтеральной недостаточности. Он рассматривается в качестве патологического симптомокомплекса, возникающего при остром хирургическом заболевании и травмах органов брюшной полости и сопровождающегося нарушением всех функций пищеварительного тракта, когда кишечник становится основным источником интоксикации и развития полиорганной недостаточности [6, 10, 17, 21, 52, 74].
При развитии воспаления в брюшной полости одним из патогенетических механизмов, определяющих изменение моторной функции желудочно-кишечного тракта, является нарушение взаимоотношения между симпатической и парасимпатической нервной системой. Гипертонус симпатической нервной системы распространяется не только на гладкие мышцы кишечной стенки, но и на снабжающие их сосуды, что приводит, с одной стороны, к угнетению моторики кишечника, с другой (в результате нарастающего артериального спазма) — к резкому снижению регионарного кровотока [6, 60, 78].
В начале развития парез желудочно-кишечного тракта может быть обусловлен дисфункцией эндокринных механизмов регуляции: 1) выбросом катехоламинов; 2) активацией калликреин-кининовой системы с избыточным поступлением в кровоток гистамина, брадикинина, протеолитических ферментов и других биологически активных веществ; 3) снижением биологической активности клеток APUD-системы (серотонина [субстанции Р] и мотилина), участвующих в работе мигрирующего миоэлектрического комплекса кишки и периферической гемоциркуляции [3, 36, 53]; 4) дисрегуляторным поступлением секретина, холецистокинина и энтероглюкагона [21]. На основе данных экспериментальных и клинических исследований сформулирована концепция, касающаяся роли серотонина и серотониновых рецепторов в генезе дисфункции гладкой мускулатуры, являющейся составной частью клинического синдрома серотониновой недостаточности. В настоящее время известно, что серотонин играет важную роль в регуляции функций желудочно-кишечного тракта. Наибольший запас серотонина в организме находится в желудочно-кишечном тракте, что составляет более чем 95% содержания серотонина во всем организме [16, 28, 30].
Основная часть серотонина содержится в энтерохроматофинных клетках эпителия, в пределах которого серотонин синтезируется из L-триптофана и хранится в секреторных гранулах. Энтерохроматофинные клетки вкраплены в кишечном эпителии главным образом в области крипты [68, 70]. Серотонин также присутствует в серотонинергических нейронах тонкокишечной нервной системы. Некоторые функции «тонкокишечного» серотонина уже изучены.
Во-первых, серотонин действует как медиатор межнейрональных связей в мышечной оболочке тонкой кишки [77].
Во-вторых, серотонин, выделяемый из энтерохроматофинных клеток в ответ на химическую или механическую стимуляцию, воздействует на желудочно-кишечную моторику и кишечный транспорт электролитов [59, 69]. Перистальтика различных отделов кишечника координируется нейронами тонкокишечной нервной системы, которые после активации серотониновых механизмов выпускают другие медиаторы [57]. Кроме того, внешние сенсорные нейроны, активируемые серотонином, инициируют физические восприятия от кишечника, которые могут включать в себя ощущение тошноты, метеоризм и боли [56].
Серотонин, находящийся в энтерохроматофинных клетках, регулирует также рост соседних эпителиоцитов [73] и может замедлять кишечное поглощение сахара [37] и L-альфа-аминоизокапроновой кислоты [71]. В основе дисфункции гладкой мускулатуры лежит нарушение взаимодействия серотонина с серотониновыми рецепторами гладкой мускулатуры [28]. По-видимому, при перитоните нарушается его синтез [58] и, как следствие, возникает серотониновая недостаточность, приводящая к гладкомышечной недостаточности. Установлено, что при перитоните уровень эндогенного серотонина снижен в 2,5 раза по сравнению с нормальными показателями [29].
Согласно данной концепции, дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и регионарной гипоксии, повреждению и некрозу тканей. На основе экспериментальных и клинических исследований [27, 30] установлено, что при патологических состояниях в организме увеличивается количество лигандов серотониновых рецепторов. Лиганды серотониновых рецепторов подразделяются на агонисты и антагонисты. Антагонисты серотонина при взаимодействии с серотониновыми рецепторами вызывают паралич гладкой мускулатуры. Агонисты, напротив, вызывают спазм гладкой мускулатуры. В дальнейшем миоциты оказываются неспособными к восприятию нервных импульсов ввиду выраженных метаболических сдвигов и внутриклеточных электролитных нарушений. Все это ведет к растяжению кишечных петель и повышению внутриполостного давления и способствует повреждению как всей пищеварительной системы, так и других функциональных систем гомеостаза [27, 28].
Возникающий застой сопровождается местным повышением венозного давления, приводит к угнетению резорбции газов и дальнейшему увеличению внутрикишечного давления. Когда величина последнего достигает уровня диастолического давления, прекращается всасывание жидкости, что в свою очередь обусловливает еще более выраженное растяжение тонкой кишки и нарушение питания кишечной стенки [21, 38].
Эти процессы усугубляются прогрессирующей эндогенной интоксикацией, которая увеличивает степень гипоксии кишечной стенки, формируя «порочный круг». Токсическое действие на кишечную стенку прямо и косвенно оказывают экзо- и эндотоксины, а также «факторы агрессии» и продукты метаболизма непрерывно размножающейся микрофлоры, колонизирующей проксимальные отделы [52]. Когда к угнетению моторики кишечника присоединяется снижение интрамурального кровотока, интенсивность процессов переваривания и всасывания резко снижается, достигая критического уровня. Объем нарушения местного кровотока в первую очередь зависит от степени дилатации петли кишечника и силы сдавления сосудов в ее стенке. При уровне давления в просвете кишки выше 100 мм рт.ст. наблюдается глубокое нарушение фильтрационной функции капилляров с резким ограничением потребления кислорода тканями и нарастанием ишемии кишечной стенки, развивающейся при снижении кровотока в ней на 50% должного [48].
В условиях кишечной ишемии происходит уменьшение содержания в тканях кислорода и питательных веществ (при увеличении концентрации активных токсичных окислителей), развивается тканевый ацидоз, возникает гиперпродукция паракринных субстратов (гистамина, серотонина, брадикинина, оксида азота, лейкотриенов, тромбоксанов, интерлейкинов-1, 2, 4, 6, 8, 10, эндотелинов, комплемента и тромбина) [9, 18, 33]. При этом, на наш взгляд, происходит истощение запасов этих веществ, что в конце концов может приводить к их стойкому дефициту.
С развитием пареза кишечника и, как следствие, задержкой пассажа кишечного содержимого происходят интенсивный рост и изменения микрофлоры тонкой кишки. В условиях воспаления брюшины развивается дисбаланс между различными видами микроорганизмов и их распределением по различным отделам кишечника. Усиленное размножение патогенной аллохтонной (чужеродной, не из данного участка желудочно-кишечного тракта) микрофлоры ослабляет местную иммунную защиту слизистой оболочки, приводя к снижению ее барьерной функции, угнетению функциональной активности лимфатической и ретикулоэндотелиальной систем, потере антагонистических свойств нормальной микрофлоры кишечника по отношению к патогенным и гнилостным микробам, падению витаминообразующей и ферментной функций [18].
Это в значительной мере сказывается на эффективности противоинфекционной защиты в целом. Выделяемые патогенными микроорганизмами капсульные антигены белковой и полисахаридной природы обеспечивают избирательную возможность их адгезии к поверхности энтероцитов. После фиксации микробных клеток наблюдается их пролиферация. Выделяющийся при этом энтеротоксин (эндотоксин) вызывает нарушение транспорта электролитов, что вызывает усиленную секрецию в просвет кишки, водный дисбаланс и выраженную дегидратацию организма. Образованные аллохтонными патогенными микроорганизмами экзотоксины приводят к метаболической дисфункции покровных клеток, нарушению соотношения между секрецией и абсорбцией жидкости, дают цитотоксический эффект, сопровождающийся разрушением клеточных мембран эпителиоцитов [6, 9, 52].
Разнонаправленное воздействие этих многочисленных патогенных факторов на структурные образования слизистой оболочки кишечника приводит к резкому изменению ее свойств (особенно барьерных) и «прорыву» патогенной микрофлоры в лимфатическое русло, портальный кровоток и даже в свободную брюшную полость. Этот процесс получил название «бактериальной транслокации» [18, 21, 74].
В настоящее время именно этому синдрому отводят ведущую роль в насыщении организма эндотоксином (с включением липополисахаридного комплекса), являющимся основным индуктором развития синдрома системного воспалительного ответа, абдоминального сепсиса и полиорганной недостаточности. Именно с интенсивностью бактериальной транслокации связывают характер и выраженность эндогенной интоксикации, развитие и прогрессирование синдрома полиорганной дисфункции [6, 9, 18, 21, 52, 74].
Таким образом, патогенетические причины послеоперационного пареза кишечника разнообразны, но в нашем понимании заслуживает внимания теория серотониновой недостаточности, предложенная А.П. Симоненковым [27, 28].
Диагностика пареза кишечника в раннем послеоперационном периоде
До настоящего времени объективные методы контроля за деятельностью органов желудочно-кишечного тракта недостаточно внедрены в клиническую практику. Многие авторы ограничиваются лишь показателями сроков отхождения газов и появления первого стула [40, 62, 67]. В то же время ранняя диагностика послеоперационного пареза могла бы быть существенным дополнением к рутинным физикальным методам исследования больного: общего осмотра пациента, аускультации перистальтических шумов.
Некоторые предлагаемые методы диагностики послеоперационных нарушений моторно-эвакуаторной функции желудочно-кишечного тракта (баллонография, иономанометрия, прямая миография и др.) малопригодны из-за тяжести состояния больных в раннем послеоперационном периоде [28].
Некоторыми авторами [25, 34] доказана практическая ценность фоноэнтерографического исследования органов брюшной полости.
Графическое изображение кишечных шумов позволяет достоверно диагностировать угнетение моторики в послеоперационном периоде.
В течение последних десятилетий при изучении деятельности органов желудочно-кишечного тракта используется графическая запись электрической активности гладких мышц — электрогастроэнтерограмма [7, 11, 19, 35].
Необходимо учитывать, что электрические потенциалы органов брюшной полости очень малы и существующая электрофизиологическая аппаратура для исследования таких низкоамплитудных биопотенциалов должна иметь тракты усиления, которые в свою очередь могут давать искажение сигналов.
К тому же исследователи подчеркивают трудоемкость математической и графической обработки записей, что также ограничивает использование подобных методик в клинике [19, 46].
В дальнейшем с целью упрощения методики и получения более объективных данных предложили располагать кожные электроды не в проекции желудка и кишечника, а на конечностях, как при электрокардиографии, доказав диагностическую ценность этого метода и выявив четкую корреляцию между получаемыми в ходе исследования сигналами с конечностей и брюшной стенки. Внедрение такой периферической электрографии в клиническую практику позволило оценить состояние моторной деятельности желудка и кишечника при ряде заболеваний [12, 22].
Возможность регистрации биопотенциалов с поверхности тела избавляет исследователей и клиницистов от технически сложных и не всегда безопасных инвазивных методов изучения моторики желудочно-кишечного тракта [2, 3, 5]. Однако, по мнению J. Chen [46], электрогастроэнтерограмма не дает полезной информации, так как ее трудно стандартизировать.
Имеются попытки анализа электрогастроэнтерографической кривой с помощью введения полученной информации в ЭВМ. Решение этой задачи отражено в большинстве работ как отечественных, так и зарубежных ученых [4, 14, 47].
Представляя данные электрогастроэнтерограмм с последующей компьютерной обработкой, исследователи сдержанно высказываются о клинической значимости электрогастроэнтерографии, подчеркивая недостатки метода [39, 47].
Другие авторы [1, 20, 31] в ходе выполнения исследования выявили информативность периферической компьютерной электрогастроэнтерографии в объективной диагностике моторно-эвакуаторных нарушений желудочно-кишечного тракта у больных с распространенным перитонитом.
Таким образом, наиболее перспективным, обоснованным и неинвазивным методом оценки моторно-эвакуаторной функции всех отделов желудочно-кишечного тракта является периферическая электрогастроинтестинография.
Современные принципы лечения больных с послеоперационным парезом кишечника
Нормальная моторика является результатом координированной контрактильной активности гладких мышц на всем протяжении желудочно-кишечного тракта. Эта активность регулируется местными факторами, моделирующими деятельность гладких мышц, рефлексами, пути которых замыкаются в пределах вегетативной нервной системы, гормонами и влиянием центральной нервной системы. По данным многих исследователей, каждая из этих систем играет, возможно, независимую патогенетическую роль в развитии послеоперационного пареза, поэтому лечение должно быть многокомпонентным.
С учетом перечисленных выше звеньев патогенеза строится примерная программа лечебных мероприятий, направленных на разрешение послеоперационного пареза и связанных с ним метаболических нарушений. В каждом конкретном наблюдении проводится индивидуальная коррекция, каждый пункт которой выполняет задачи не одного, а нескольких патогенетически обоснованных лечебных направлений.
Неудовлетворительные результаты лечения больных с последующим послеоперационным парезом желудочно-кишечного тракта клиницисты связывают с двумя основными причинами. Во-первых, в широкой клинической практике доминирует стандартный подход врачей к выбору лечебных мероприятий без учета патогенеза заболевания [34]. Во-вторых, практический опыт лечения послеоперационных парезов свидетельствует о том, что борьба с ним начинается лишь тогда, когда он уже развивается. Между тем мероприятия, направленные на профилактику пареза, должны проводиться в раннем послеоперационном периоде, до появления клинических признаков пареза [7, 8, 11, 14].
Что касается методов лечения на современном этапе, то большинство авторов склоняются к комплексной терапии с учетом патогенеза заболевания. Во многих хирургических клиниках лечение послеоперационного пареза желудочно-кишечного тракта остается рутинным и порой односторонним [5, 13, 15, 33].
По мнению E. Livingston [64], назоинтестинальная интубация является единственным эффективным средством при лечении пареза.
В последнее время рекомендуется также раннее начало энтерального (зондового) питания, которое способствует более быстрому восстановлению функциональной активности желудочно-кишечного тракта [13]. Ряд авторов отмечают положительное влияние на моторику кишечника в послеоперационном периоде применения жевательной резинки при наличии послеоперационного пареза [51]. Имеются сведения о положительном влиянии на моторику желудочно-кишечного тракта использования пробиотиков в пред- и послеоперационном периоде у хирургических больных [42].
Многие авторы предлагают различные схемы медикаментозного воздействия для разрешения послеоперационного пареза [13, 18, 24].
При оценке лекарственной терапии, направленной на стабилизацию желудочно-кишечной моторики в условиях пареза, замечено, что многие препараты малоэффективны и оказывают побочное действие [34]. В клинической практике для лечения парезов основными остаются антихолинэстеразные препараты (прозерин, убретид и др.). Эффективность их не всегда однозначна, а побочные эффекты выражены. Так, прозерин и его аналоги оказывают отрицательное инотропное и хронотропное действие на сердце и в связи с этим противопоказаны при бронхиальной астме, стенокардии, брадикардии. Кроме того, действие прозерина на гладкую мускулатуру желудка и тонкой кишки кратковременно, а на толстую кишку он не оказывает никакого действия [14, 41]. Д.Б. Закиров [14] отмечает, что прозерин не координирует нарушенную моторику кишечника в отличие от убретида, который значительно повышает электрическую активность всех отделов желудочно-кишечного тракта и улучшает их ритмичность. Также имеются сведения о положительном влиянии на моторику желудочно-кишечного тракта применения бесакодила у пациентов, перенесших операцию на толстой кишке.
Обширные реконструктивные операции на органах брюшной полости неизбежно приводят к раздражению интерорецепторов, поэтому патогенетически оправдано применение ганглиоблокаторов [17, 24]. Применение временной ганглиоплегии пентамином [25] в сочетании с традиционными методами лечения пареза кишечника у больных с распространенным гнойным перитонитом позволяет улучшить микроциркуляцию за счет восстановления симпатических влияний и повысить эффективность центральной гемодинамики. За счет нормализации парасимпатических воздействий вегетативной нервной системы возможно раньше восстановить моторно-эвакуаторную функцию желудочно-кишечного тракта и в результате этого уменьшить выраженность синдрома системного воспалительного ответа и болевого абдоминального синдрома. Следует отметить, что выраженный вазоплегический эффект этих препаратов является препятствием для использования их у тяжелобольных, имеющих склонность к гипотонии. Для лечения послеоперационного пареза широко используется метоклопрамид (церукал), но после углубленного изучения оказалось, что он снижает суммарную электрическую активность в основном желудка и тонкой кишки, угнетая их сократительную активность и способствуя восстановлению сокращений двенадцатиперстной кишки [14].
Анализ результатов фармакологического лечения послеоперационного пареза показал, что положительного действия адреноблокаторов, холиномиметиков и антихолинэстеразных препаратов на моторику желудочно-кишечного тракта можно ожидать лишь при парезах легкой и средней степени.
Много работ посвящено влиянию серотонина на моторно-эвакуаторную функцию желудочно-кишечного тракта. П.К. Климов [15] установил, что серотонин в дозе 0,1 мг/кг вызывает сильную перистальтическую деятельность желудка и тонкой кишки. Результаты были подтверждены электрофизиологическими и рентгенологическими исследованиями.
В работе А.П. Симоненкова [26] предложен способ лечения послеоперационного пареза желудочно-кишечного тракта серотонина адипинатом, который представляет собой естественное биологически активное вещество, способствующее сокращению мышечных клеток, минуя вегетативную нервную систему. По данным автора, после внутримышечного введения серотонина адипината в дозе 0,2-0,3 мг/кг усиливается электрическая активность тощей кишки и наблюдается более упорядоченный и стабильный ритм сократительной активности тонкой кишки.
Под воздействием серотонина активируется перистальтика кишечника. Н.С. Тропская и соавт. [32] после введения серотонина адипината в полость тонкой кишки в ранние сроки после операций на органах брюшной полости наблюдали распространение сократительной активности от желудка к тощей кишке, при этом период нормализации всех параметров моторики желудочно-кишечного тракта сокращался с 7 до 4 сут.
В клинических наблюдениях описан положительный опыт применения серотонина адипината при внутривенном капельном введении в количестве 20-60 мг/сутки в ранние сроки послеоперационного периода для восстановления перистальтики при функциональной кишечной непроходимости. При этом продолжительность введения препарата составила от 2 до 5 сут, получены удовлетворительные клинические результаты, связанные с быстрой нормализацией кишечной перистальтики [28, 30].
В последние годы особый интерес вызывает электростимуляция желудочно-кишечного тракта [23, 63, 65]. Основанием для ее применения стали фундаментальные физиологические исследования, которые доказали, что гладкомышечные клетки являются электровозбудимыми и обладают электрическим ритмом [15], которым можно управлять [7, 11, 19]. Вместе с тем некоторые авторы считают, что данные литературы, касающиеся применения электростимуляции для лечения послеоперационного пареза пока не очень обнадеживают [46].
Установлены соответствия периодичности изменений биоэлектрической активности и ритма перистальтической деятельности желудка человека. Показано, что каждому отделу желудочно-кишечного тракта соответствует свой электрический ритм, который в норме является постоянной величиной и может изменяться при патологических состояниях [35, 47].
Таким образом, применяемые физические и лекарственные методы консервативного лечения больных с послеоперационным парезом кишечника не всегда эффективны. По-видимому, причиной этого является необоснованно выбранные препараты с точки зрения патогенеза или препараты, дающие положительный эффект в течение короткого промежутка времени и способные иногда только усугубить состояние больного. На наш взгляд, применение серотонина при послеоперационном парезе кишечника является наиболее патогенетически обоснованным и может способствовать улучшению результатов лечения.
Симптомы
Симптомы пареза кишечника схожи с отравлениями и проявлениями заболеваний желудочно-кишечного тракта. Боли при парезе кишечника имеют коликообразный характер, повышенное газообразование приводит к усилению интенсивности болевого синдрома, не имеющего четкой локализации. Характерным симптомом данного патологического состояния является отхождение небольшого количества каловых масс жидкой консистенции.
Основными проявлениями пареза кишечника после операции являются:
- равномерное вздутие живота;
- тошнота;
- рвота;
- отсутствие кишечных шумов;
- эксикоз (обезвоживание);
- тахикардия (учащенное сердцебиение);
- вторичная дыхательная недостаточность.
В начале заболевания в рвотных массах содержится съеденная пища, желудочный сок. Со временем рвотные массы приобретают каловый характер. Около 40% пациентов жалуются на запоры и отсутствие отхождения газов. У другой половины газы и кал могут отходить даже после развития клиники пареза кишечника. Субфебрильная лихорадка (повышение температуры тела до 37,0-37,1 градусов) отмечается не более чем у половины больных. Чаще всего это говорит о наличии осложнений (перфорации кишечной стенки, перитонита).
Значительное вздутие живота на фоне пареза кишечника приводит к смещению диафрагмы и сдавлению органов грудной полости. Клинически это проявляется следующими симптомами:
- одышкой;
- поверхностным дыханием;
- тахикардией;
- снижением артериального давления.
Длительная рвота на фоне пареза кишечника может приводить к обезвоживанию, которое проявляется сухостью слизистых и кожи, снижением темпа диуреза. У пациентов увеличивается окружность живота. При пальпации живот умеренно болезненный, при выслушивании определяется значительное уменьшение интенсивности или полное отсутствие кишечных шумов. На фоне полной тишины в брюшной полости выслушиваются дыхательные шумы, сердечные тоны. Пальцевое исследование прямой кишки выявляет расширенную и пустую ректальную ампулу.
При появлении данной симптоматики следует обратиться к врачу-гастроэнтерологу или хирургу Юсуповской больницы для прохождения диагностики.
Записаться на приём
Диагностика
Клинические проявления послеоперационного пареза устанавливаются врачом-хирургом и гастроэнтерологом. При диагностике патологии используются различные методы, к числу которых относится рентгеновское исследование органов брюшной полости. Результаты исследования отражаются на снимке. Парез кишечника характеризуется отсутствием механических причин непроходимости, одноуровневым расположением жидкости, а также скоплением газов в толстом кишечнике.
Наиболее информативными методами диагностики заболевания считаются:
- мультиспиральная компьютерная томография;
- УЗИ.
Данные процедуры позволяют определить горизонтальный уровень жидкости, а также растянутые петли кишечника за счет того, что органы сканируются устройством в двух- и трехмерном изображении. Юсуповская больница оснащена высокоточным европейским оборудованием, позволяющим выявлять нарушения перистальтики кишечника.
Лечение
Лечение пациентов с парезом кишечника проводится в отделении реанимации и интенсивной терапии Юсуповской больницы. Начинают терапию с консервативных мероприятий:
- разгрузки кишечника путем выведения газов с помощью газоотводной прямокишечной трубки и толстого желудочного зонда;
- отмены энтеральной нагрузки;
- лечения основного заболевания (причины развития пареза кишечника);
- коррекции водно-электролитных и метаболических нарушений.
В качестве мероприятий, которые улучшают состояние пациента и ускоряют разрешение пареза, используют жевательную резинку (существует ряд научных работ в области гастроэнтерологии, которые указывают на стимуляцию перистальтики при жевании), колено-локтевое положение пациента, умеренную физическую активность.
Консервативная терапия включает медикаментозную стимуляцию перистальтики неостигмином. Существуют три методики нехирургической декомпрессии кишечника:
- введение толстого зонда под рентгенологическим контролем;
- чрескожная пункция слепой кишки и цекостомия;
- колоноскопия с последующим введением дренажа.
Эти методики применяют при наличии следующих показаний:
- увеличение диаметра толстого кишечника более 100 мм;
- длительность пареза кишечника более трех суток в сочетании с отсутствием эффекта от консервативной терапии на протяжении 48 часов;
- отсутствие положительной динамики от лечения неостигмином или наличие противопоказаний к его назначению.
Методом выбора при парезе кишечника является колоноскопия. Процедуру не проводят при перитоните, перфорации кишки. Изолированная колоноскопия эффективна у 25% пациентов, в то время как сочетание колоноскопии с введением дренажных трубок – практически в 90% случаев. Чрескожную цекостомию выполняют пациентам с высоким риском осложнений во время операции, при неэффективности консервативной терапии и колоноскопии с декомпрессией кишечника.
Открытое оперативное вмешательство используют при отсутствии эффекта всех перечисленных выше мероприятий, наличии прободения кишки и перитонита. Хирурги выполняют открытую цекостомию, резекцию пораженного отдела кишечника. После хирургического лечения наркотические анальгетики не назначают, так как они способны угнетать моторику кишечной трубки.
1.Что такое гастропарез и его причины?
После еды желудок в норме опустошается через полтора-два часа. Но у людей с гастропарезом этот процесс занимает гораздо больше времени. Режим переваривания пищи меняется, и это может вызвать неприятные, а порой и очень серьезные симптомы. Одно из самых серьезных осложнений гастропареза – это безоар
. Состояние, когда из-за гастропареза пища остается в желудке в течение очень долгого времени и формируется в жесткий комок, который застревает в желудке. Впрочем, настолько серьезной ситуация становится очень редко.
Причины гастропареза желудка
Гастропарез случается, когда нервы в области желудка повреждены или не работают по каким-то другим причинам. Диабет
– одна из самых распространенных причин гастропареза. Другими факторами развития гастропареза могут быть некоторые
расстройства нервной системы
(болезнь Паркинсона и инсульт) и
лекарства
(такие как циклические антидепрессанты, антагонисты кальция, обезболивающие на основе опиатов). Гастропарез может стать следствием осложнений после хирургической операции на желудке.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Реабилитация
При работе с пациентами, у которых диагностирован парез кишечника, врачи Юсуповской больницы разрабатывают не только терапевтический комплекс, но и программу реабилитации. Опытные реабилитологи стимулируют активность кишечника с помощью массажа живота. Кроме этого, пациенту в период восстановления показана специальная диета, позволяющая снизить нагрузку на кишечник.
В Юсуповской больнице осуществляется качественное медицинское обслуживание, а также поддерживается высокий уровень сервиса. Современное оборудование и высокая квалификация специалистов обеспечивают оперативную диагностику нарушения и определение наиболее рациональных методов терапии. Важным преимуществом многопрофильной клиники является отсутствие очередей и быстрая запись на прием по телефону.
Записаться на приём
Выводы
1. Применение домперидона в виде препарата Брюлиум Лингватабс в течение 5 суток для профилактического лечения послеоперационного пареза кишечника в гинекологической практике достоверно способствует быстрому купированию симптоматики и улучшению общего самочувствия пациенток.
2. Упреждающий характер предложенной патогенетически обоснованной программы профилактики и лечения парезов кишечника способствует раннему восстановлению функций желудочнокишечного тракта и предупреждает развитие осложнений в оперативной гинекологии.
3. Проведенное исследование позволяет рекомендовать препарат Брюлиум Лингватабс для рутинного использования в профилактике ППК в раннем послеоперационном периоде.