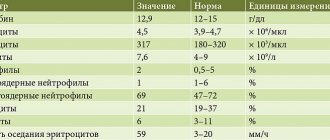
Билиарный панкреатит
Термином «хронический панкреатит» (ХП) обозначают группу хронических заболеваний поджелудочной железы (ПЖ) различной этиологии, преимущественно воспалительной природы, с фазово–прогрессирующими очаговыми, сегментарными или диффузными дегенеративными или деструктивными изменениями ее экзокринной ткани, атрофией железистых элементов (панкреоцитов) и замещением их соединительной (фиброзной) тканью; изменениями в протоковой системе ПЖ с образованием кист и конкрементов, с различной степенью нарушения экзокринной и эндокринной функций [1]. Во всем мире за последние 30 лет наблюдается увеличение заболеваемости острым и хроническим панкреатитом более чем в 2 раза. В России отмечен более интенсивный рост заболеваемости ХП. Так, распространенность заболеваний ПЖ среди взрослых за последние 10 лет увеличилась в 3 раза, а среди подростков – более чем в 4 раза [2]. Билиарная патология – наиболее частая причина развития острого и обострения хронического панкреатита. Одной из причин формирования билиарного (билиарнозависимого) панкреатита (БП) является желчнокаменная болезнь (ЖКБ). Частота выявления панкреатита у больных ЖКБ, по разным оценкам, составляет 25–90% и более. Причины формирования билиарного панкреатита Причинно–следственные взаимоотношения между ЖКБ и панкреатитом общеизвестны. Главными механизмами формирования БП являются заброс и задержка желчи в протоках ПЖ, она взаимодействует с панкреатическими ферментами и бактериями. В связи с этим происходят высвобождение связанных желчных кислот, активация панкреатических ферментов в протоковой системе ПЖ. В результате этого повреждается ее защитный барьер, поражается паренхима ПЖ аналогично патологическим процессам, развивающимся при панкреато–билиарных рефлюксах и сопровождающимся формированием ферментативного холецистита [3]. Как известно, препятствием для развития билиарно–панкреатического рефлюкса является более высокое секреторное давление в главном панкреатическом протоке по сравнению с общим желчным протоком. Поэтому пусковым механизмом развития БП является повышение давления в протоковой системе желчных путей, которое может быть обусловлено как функциональной (диссинергизм в работе сфинктерного аппарата дистальных отделов желчных путей и главного панкреатического протока, гипертонус сфинктера Одди), так и органической патологией (мелкие конкременты, сгустки замазкообразной желчи, стриктуры в терминальном отделе общего желчного протока, высокое панкреато–билиарное соустье, стенозирующий папиллит и др.), часто сопровождающей течение ЖКБ. Следует отметить, что билиарные дисфункции и, в частности, дисфункции сфинктера Одди являются неотъемлемым атрибутом ЖКБ. Функциональные нарушения при дисфункции сфинктера Одди способствуют развитию билиарно–панкреатического рефлюкса в результате разницы давления в общем желчном и панкреатическом протоках. Даже при небольшой билиарной гипертензии сфинктер главного панкреатического протока не способен предохранить протоковую систему ПЖ от патологического рефлюкса [4]. При ЖКБ билиарный сладж либо конкременты из желчного пузыря или общего желчного протока, попадая в ампулу фатерова сосочка, также могут быть причиной развития БП в связи с созданием препятствия для оттока желчи и панкреатического секрета. Характер клинических проявлений и степень функциональных нарушений со стороны ПЖ при этом могут существенно различаться. В случае быстрого прохождения камня в двенадцатиперстную кишку (ДПК) воспалительные явления в ПЖ достаточно быстро стихают. При ущемлении конкремента в ампуле большого дуоденального сосочка признаки обострения панкреатита нарастают. Развивающийся вокруг камня спазм гладкой мускулатуры усугубляет степень билиарной гипертензии и, как следствие, течение панкреатита. Нередко в таких случаях появляются признаки механической желтухи – за счет нарушения проходимости вследствие обтурации камнем протоковой системы и сдавления общего желчного протока увеличенной головкой ПЖ. В последние годы все большее значение в развитии БП придают билиарному сладжу (БС). В результате дестабилизации физико–химического состояния желчи происходят преципитация ее основных компонентов и формирование БС в желчном пузыре. Важными факторами, способствующими персистенции БС, являются гипотония желчного пузыря и гипертонус сфинктера Одди. Постоянный пассаж БС по желчным путям приводит к повреждению слизистой оболочки, главным образом в области сфинктера Одди. Травматизация слизистой оболочки происходит микролитами, составляющими основную часть БС. В результате этого вначале развивается вторичная дисфункция сфинктера Одди, а в последующем формируется стенозирующий папиллит. Благоприятные условия для возникновения билиарно–панкреатического рефлюкса при дисфункции сфинктера Одди возникают при высоком соединении общего желчного и панкреатического протоков или аномалиях их слияния [4]. Риск возникновения панкреатита значительно выше у пациентов с длинным и широким общим желчным протоком, диаметром дистального отдела главного панкреатического протока более 2,5 мм, а также при наличии кист в общем желчном протоке. Учитывая тесную связь между БС и развитием острого панкреатита, в настоящее время принято считать, что диагноз идиопатического панкреатита может быть поставлен только после исключения микролитиаза в билиарном тракте [5]. Частота выявления БС у больных с так называемым идиопатическим панкреатитом составляет 30–75%. При исследовании желчи в течение первых суток от начала панкреатической атаки частота обнаружения БС достигает 80% [6]. Рецидивам БП способствует не только миграция мелких камней и БС по общему желчному протоку, но и обострение заболеваний гастродуоденальной зоны, часто сопутствующих ЖКБ. Так, частота сочетания ЖКБ и эрозивно–язвенных поражений гастродуоденальной зоны, по нашим данным, достигает 25–27%. В этих ситуациях гиперацидность желудочного сока, обусловленная гипергастринемией, является чрезмерным стимулом для ПЖ, что в условиях затрудненного оттока ее секрета приводит к внутрипротоковой гипертензии и обострению патологического процесса [7,8]. Особенностью БП, отличающего его от других форм панкреатита, является сочетание экзокринной недостаточности ПЖ с хронической билиарной недостаточностью, что отражается на качестве пищеварительного процесса. Клиника Клиническая картина требует в первую очередь исключения синдромосходных заболеваний, таких как гастродуоденальные язвы, карциномы желудка и ободочной кишки, хронический антральный гастрит, хроническая артериомезентериальная компрессия, острый вирусный гепатит и обострение хронического вирусного гепатита, обострение хронического холецистита, опухоль ПЖ, которая может вызывать острый панкреатит и поддерживать течение ХП на неопределенный период, и др. В этой связи необходимы обследование больных для исключения перечисленных заболеваний и воздействие на них как на фактор, поддерживающий течение ХП [1]. Клинические проявления БП включают в себя абдоминальный болевой синдром, симптомы внешнесекреторной и инкреторной недостаточности ПЖ, билиарной недостаточности. Болевой синдром является доминирующим в клинической картине заболевания в 80–90% случаев. Клинические признаки обострения БП характеризуются появлением болей в эпигастрии с иррадиацией в спину, правое или левое подреберье. Боли могут быть связаны с перееданием, приемом острой, жирной, жареной пищи, появляются обычно через 1,5–2 ч после еды или возникают спонтанно ночью. Реже боли возникают сразу после приема пищи, особенно холодных шипучих напитков и, как правило, связаны со спазмом сфинктера Одди. В период приступа возможна умеренная лихорадка. Из диспепсических расстройств наиболее часто встречаются тошнота, рвота, а также горечь во рту. Выраженная клиника острого панкреатита развивается при ущемлении конкремента в ампуле большого дуоденального сосочка с нарушением оттока панкреатического секрета и присоединением клинических симптомов механической желтухи. Диагностика Диагностика носит комплексный характер и включает в себя анализ жалоб, данных анамнеза, объективный осмотр, лабораторные и инструментальные методы исследования. В клиническом анализе крови выявляют лейкоцитоз, при биохимическом исследовании отмечаются изменение функциональных проб печени (повышение активности трансаминаз, ЩФ, ГГТП), а также повышение уровня сывороточной амилазы и липазы. Следует отметить, что изменения печеночных функциональных тестов при БП более выражены, чем при панкреатите алкогольной или другой этиологии [9]. Наиболее ранним проявлением внешнесекреторной недостаточности ПЖ является наличие эластазы в кале в сочетании со стеатореей, нейтральным жиром и мылами. Основным инструментальным методом диагностики является УЗИ. При трансабдоминальной ультрасонографии (ТУС) выявляют конкременты и/или различные варианты БС в желчном пузыре и общем желчном протоке. Следует отметить, что чувствительность и специфичность ТУС в выявлении патологии общего желчного протока не превышают 60%. В случаях плохой визуализации общего желчного протока при ТУС (выраженный метеоризм, тучность больного и др.) применяют эндоскопическую ультрасонографию (ЭУС). Общий желчный проток может быть нормальных размеров, расширение его происходит при ущемлении камня в терминальном отделе или ампуле большого дуоденального сосочка. Вирсунгов проток нормальных размеров или умеренно расширен. Изменения в паренхиме ПЖ зависят от стадии процесса. На ранних этапах изменений в ПЖ выявить не удается. В дальнейшем при УЗИ определяются неоднородность ее структуры, неровность контуров. При обострении панкреатита выявляются ультразвуковые признаки отека ПЖ. Для определения проходимости желчных путей показана динамическая холесцинтиграфия, которая позволяет проследить весь процесс перераспределения желчи в билиарной системе, время поступления ее в ДПК, а также дать оценку функционального состояния печени [10]. Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) позволяет выявить патологические изменения в большом дуоденальном сосочке, общем желчном и панкреатическом протоках. При необходимости во время исследования одновременно выполняется папиллотомия или папиллосфинктеротомия. ЭРХПГ неэффективна при наличии конкрементов в общем желчном протоке менее 5 мм в диаметре, замазкообразной желчи. У 1/3 пациентов исследование может вызвать ЭРХПГ–индуцированный панкреатит [11], поэтому у больных с подозрением на БП данное исследование должно применяться с большой осторожностью, с диагностическими целями чаще следует использовать ЭУС. При наличии стенозирующего папиллита или билиарных стриктур во время ЭРХПГ восстанавливают желчеотток с помощью сфинктеротомии или стентирования. Эндоскопическое дренирование с помощью стентов дает хорошие ближайшие результаты, однако у пациентов с кальцификатами головки ПЖ эффективность его в 17 раз ниже [12]. В последнее время в клиническую практику внедряется магнитно–резонансная холангиопанкреатикография, позволяющая одновременно оценить состояние желчных и панкреатического протоков. При эзофагогастродуоденоскопии (ЭГДС) оцениваются изменения со стороны слизистой оболочки верхнего отдела пищеварительного тракта, в особенности характер патологических изменений парафатериальной зоны и непосредственно большого дуоденального сосочка. Чрескожная чреспеченочная холангиография применяется в случаях неинформативности других методов визуализации и невозможности выполнения ЭРХПГ. Для подбора адекватной кислотосупрессивной терапии и определения продолжительности курса лечения показана компьютерная рН–метрия желудка. Лечение Важную роль в лечении больных БП играет диетотерапия. Строгое соблюдение диеты приводит к снижению функциональной нагрузки на желчный пузырь и сфинктерный аппарат желчных путей, создает условия для максимального функционального покоя ПЖ. При выраженном обострении в первые 3 дня пациенту назначается полный голод с употреблением щелочных минеральных вод без газа. В дальнейшем пациент переходит на диету № 5. Необходимо ограничение жиров до 60–70 г/сут., белка – до 100–110 г/сут. При тяжелых обострениях панкреатита, сопровождающихся рвотой, целесообразно прибегнуть к голоданию в течение 1–3 сут. и коррекции водно–электролитного баланса парентеральным введением раствора Рингера, глюкозы и др. После уменьшения болей и прекращения рвоты возвращаются к пероральному питанию, которое должно быть не менее 5–6 раз/сут. Медикаментозная терапия не отличается от лечения других форм панкреатита и должна преследовать следующие цели [13]: • купирование боли, уменьшение и снятие интоксикации, которая переводит процесс из локально–органного в мультиорганный – распространенный; • купирование прогрессирования отечно–интерстициальной стадии панкреатита с целью предотвращения развития «хирургических» осложнений при неосложненном и ограниченном неинфицированном панкреонекрозе; • стабилизация клинической ситуации, которая достигается созданием функционального покоя ПЖ с постепенным переходом к функциональным нагрузкам; • лечение осложнений острого периода – несостоятельности внешне– и внутрисекреторной недостаточности функций ПЖ; • лечение хирургических осложнений и предотвращение рецидивирования при сохраняющемся причинном факторе; • реабилитация больных ХП. Основной причиной боли при БП является гипертензия в протоковой системе ПЖ. При этом боль может быть купирована мероприятиями, направленными на снижение давления в протоках и уменьшение отека и воспалительной инфильтрации ПЖ, без применения анальгетиков. Для подавления секреции ПЖ назначают ранитидин, фамотидин, омепразол, октреотид. Лечение целесообразно начинать с октреотида по 100 мгк 3 раза/сут. подкожно. Средний курс лечения составляет 5 дней. При недостаточном клиническом эффекте суточную дозу препарата увеличивают до 600 мкг (по 200 мкг через каждые 8 ч). Синтетические аналоги октреотида подавляют экзокринную функцию ПЖ, секрецию гастрина, соляной кислоты, секретина и других биологически активных веществ гастропанкреатической системы. Продолжительность курса лечения определяют в зависимости от распространенности патологического процесса, вовлечения клетчатки забрюшинного пространства, тяжести состояния больного. Одновременно больным показано назначение блокаторов желудочной секреции (Н2–блокаторы гистаминовых рецепторов, ингибиторы протонной помпы) парентерально 3–5 дней, затем per os до восстановления структурно–функциональной активности ПЖ, в общей сложности – 3–4 мес. Показаны антациды с высокой кислото–нейтрализующей активностью через каждые 2–3 ч. Однако следует учитывать, что применение антацидов в высоких дозах уменьшает биодоступность целого ряда препаратов, например, снижается абсорбция антибиотиков группы тетрациклина, блокаторов гистаминовых Н2–рецепторов и других препаратов, с которыми антациды образуют нерастворимые соединения. Уменьшают тяжесть течения панкреатита низкомолекулярные гепарины, гепариноиды, реополиглюкин и др. Эффект обусловлен улучшением микроциркуляции, а в 70% случаев – и рассасыванием микротромбов. Следует иметь в виду и тот факт, что билиарная гипертензия и воспаление уменьшают доставку лекарственных средств в патологический очаг. В связи с этим гепаринизация низкомолекулярными гепаринами за счет улучшения микроциркуляции повышает эффективность лекарственной терапии. Для купирования болей применяют дротаверин, папаверин, платифиллин и др. Хорошо зарекомендовал себя как средство для снятия болей парацетамол. Однако максимальная доза парацетамола не должна превышать 4 г/сут. Из ненаркотических анальгетиков применяют трамадол по 1–2 ампулы (по 50 мг) внутримышечно или внутривенно (медленно) или по 1–2 капсулы (по 50 мг) внутрь 1–3 раза/сут. Используют также бупренорфин в дозе 300 мкг в ампуле и 200 мкг в таблетке. При выраженной и резистентной боли назначают наркотические анальгетики: 1 мл 1–2% раствора промедола подкожно или внутримышечно 1–3 раза/сут., обычно в течение не более 3 дней. Последние исследования показали, что при дисфункции сфинктера Одди и дискинетических расстройствах кишечника, вносящих свою лепту в формирование болевого абдоминального синдрома при ХП, хороший эффект оказывает селективный миотропный спазмолитик мебеверин (Дюспаталин). По показаниям назначают полиглюкин 400 мл/сут., гемодез 300 мл/сут., 10% раствор альбумина 100 мл/сут., 5–10% раствор глюкозы 500 мл/сут. с адекватным количеством инсулина внутривенно. При тяжелых атаках необходимы коррекция гемодинамических нарушений, борьба с эндотоксикозом. Для создания длительного функционального покоя ПЖ целесообразно в течение 3 мес. продолжать прием ингибиторов желудочной секреции. При этом препаратами выбора являются блокаторы протонной помпы, которые максимально и на длительный срок подавляют продукцию соляной кислоты, что приводит к снижению синтеза холецистокинина–панкреозимина и секретина, обеспечивая тем самым необходимый функциональный покой ПЖ. По последним данным, у больных после холецистэктомии для купирования обострения билиарнозависимого панкреатита рекомендуется длительная (на протяжении 48 нед.) кислотосупрессивная терапия эзомепразолом – 40 мг/сут. [14]. При наличии БС показана литолитическая терапия препаратами урсодеоксихолевой кислоты. Дозу подбирают в зависимости от массы тела, курс лечения – до 3 мес. Диету расширяют постепенно, «под прикрытием» ферментных препаратов, которые играют важную роль в терапии БП. Одним из патогенетических обоснований применения заместительной ферментной терапии при ХП является установленный факт, свидетельствующий о том, что у больных ХП сниженная секреция панкреатических ферментов при внешнесекреторной недостаточности является причиной гиперстимуляции ПЖ высокими уровнями холецистокинина–панкреозимина в плазме крови и, как следствие, способствует усилению болевого абдоминального синдрома. Терапия ферментными препаратами при ХП имеет большую историю. За это время апробировано множество различных по фармацевтической форме и составу ферментных препаратов, что позволило сформулировать наиболее важные требования к ним [15]: • иметь оптимальный состав ферментов в физиологической пропорции; • быть кислотоустойчивым в отношении желудочного сока; • равномерно и быстро перемешиваться с пищей; • одновременно с пищей поступать через привратник в ДПК; • оказывать оптимальное действие в интервале рН 4–7; • быстро и полно высвобождать ферменты в ДПК; • не оказывать побочных эффектов. Одним из факторов, снижающих эффективность заместительной ферментной терапии, является асинхронное поступление из желудка пищевого комка и ферментных препаратов в виде драже или таблеток в кишечнорастворимых оболочках, размер которых составляет 5 мм и более. Экспериментальными исследованиями установлено, что лучше перемешиваются с пищей в желудке и одновременно покидают его частицы диаметром 1–1,5 мм, т.е. эффективность ферментного препарата определяется не только содержанием ферментов в одной таблетке или капсуле, но и его лекарственной формой. Изложенным требованиям наиболее полно отвечает Креон. По данным многочисленных международных исследований, двухоболочечный препарат Креон обладает свойством осуществлять пассаж вместе с пищей, так как капсулы, содержащие мини–микросферы, покрытые кишечнорастворимой оболочкой, быстро растворяются в желудке, высвобождая сотни мини–микросфер (от 280 до 500 частиц диаметром 1,0–1,2 мм), которые более равномерно распределяют ферменты после их высвобождения внутри кишечного содержимого. Когда мини–микросферы достигают ДПК, кишечнорастворимая оболочка разрушается, происходит высвобождение ферментов с липолитической, амилолитической и протеолитической активностью, приводящей к дезинтеграции жиров, крахмала и липидов. Таким образом, Креон благодаря особой лекарственной форме создает наиболее оптимальные условия для полостного пищеварения. Второе преимущество Креона перед другими ферментными препаратами заключается в его высокой ферментативной активности, что особенно важно при БП, течение которого сопровождается дефицитом желчных кислот, принимающих непосредственное участие в активации ферментов ПЖ. Ферментный состав Креона оптимально сбалансирован для замещения экзокринной недостаточности ПЖ. Как известно, при заместительной ферментной терапии главное значение имеет липазная активность препаратов. Поэтому при подборе ферментного препарата для заместительной терапии определяющим свойством является активность липазы. Это связано с тем, что при БП продукция и секреция липазы нарушаются раньше, чем у амилолитических и протеолитических ферментов; липаза быстрее и более выраженно инактивируется при закислении ДПК из–за снижения продукции панкреатических бикарбонатов; при снижении рН в ДПК происходит преципитация желчных кислот, что усугубляет нарушение всасывания жира [16]. Креон выпускается в различных вариантах: Креон 10000, Креон 25000 и Креон 40000, которые содержат 10000, 25000 и 40000 ЕД липазы соответственно, что позволяет индивидуально подбирать дозу препарата в зависимости от степени внешнесекреторной недостаточности ПЖ. Адекватно подобранные дозы Креона обеспечивают полноценное полостное пищеварение, что сопровождается уменьшением давления в ДПК и тем самым способствует улучшению оттока желчи и панкреатического секрета и уменьшению болей. Кроме того, Креон у больных БП, сопровождающимся панкреатической недостаточностью, уменьшает болевой синдром по типу обратной связи. Назначение ферментных препаратов для купирования боли считается ранним показанием, так как ферментная недостаточность проявляется только после длительного течения ХП (например, при длительном камненосительстве, особенно у лиц с множественными мелкими конкрементами в желчном пузыре), а боль возникает сразу. Антиболевой эффект Креона связан с высоким содержанием протеаз (трипсина) в составе ферментного препарата. Протеазы разрушают рилизингпептиды (холецистокинин–панкреозимин и секретин), высвобождающиеся в начальных отделах ДПК и стимулирующие панкреатическую секрецию. Таким образом, протеазы вызывают уменьшение панкреатической секреции и обеспечивают функциональный покой ПЖ. Креон обладает самой высокой активностью трипсина: Креон 10000 содержит 600 F. I. P. протеаз, Креон 25000 – 1000 F. I. P. протеаз. Последними исследованиями показано, что Креон способен подавлять воспалительный процесс в ПЖ. Это подтверждается снижением в крови уровня провоспалительных (IL–8, TNFα) и повышением уровня противовоспалительных (IL–10) цитокинов, а также снижением показателей TGF–β, отражающего процессы фиброгенеза. Длительный прием Креона достигает не только заместительной цели, но и замедляет прогрессирование развития соединительной ткани в паренхиме ПЖ при БП [17]. Подбор доз панкреатических ферментов проводится индивидуально. При тяжелой степени панкреатической недостаточности рекомендуется принимать во время основного приема пищи препарат с содержанием липазы не менее 25 000–40 000 ЕД, в промежуточные приемы пищи – дополнительно 10 000– 5 000 ЕД [18]. Креон обладает высоким индексом безопасности, что позволяет применять его в педиатрической практике, в том числе у детей грудного возраста. Препарат разрешен к применению у лиц, исповедующих ислам. Таким образом, многочисленные наблюдения демонстрируют разнообразные клинические эффекты Креона, что позволяет считать его «золотым стандартом» при лечении больных БП. Для профилактики холангита и абсцессов ПЖ применяют антибиотики широкого спектра действия. Кроме того, антибактериальная терапия способствует восстановлению нарушенного при ЖКБ кишечного микробиоценоза, а также препятствует обострению хронического калькулезного холецистита. Показаны ципрофлоксацин, имипенем, цефуроксим, цефотаксим и др. Ограничением для применения цефтриаксона является образование БС при его приеме. Следует учитывать, что ряд антибактериальных препаратов токсически действуют на ацинарные клетки ПЖ (тетрациклин, рифампицин, изониазид, амфотерицин). У пациентов с ЖКБ, а также после холецистэктомии выявляется синдром избыточного бактериального роста (СИБР) в тонкой кишке. По нашим данным, в группе больных, перенесших холецистэктомию, СИБР выявлен в 58%, а среди пациентов с ЖКБ – в 28% случаев. Полученные результаты можно объяснить тем, что после холецистэктомии снижаются концентрация желчных кислот в желчи и ее бактерицидные свойства [19]. По данным А.И. Пастухова, у больных с хроническим билиарнозависимым панкреатитом после холецистэктомии СИБР выявлялся в 33% случаев [14]. Наши исследования показывают, что наилучшим клиническим эффектом в этих ситуациях обладает рифаксимин в суточной дозе 800–1200 мг, продолжительность приема – 7 дней. Доза и длительность антибактериальной терапии определяются тяжестью состояния больного, лабораторными показателями и данными инструментальных методов исследования. При дисфункции сфинктерного аппарата желчных путей показаны гимекромон или мебеверин в обычных дозировках (курс лечения – 2–4 нед.); при наличии холедохолитиаза – баллонная дилатация, папиллосфинктеротомия с извлечением камней. Восстановление оттока желчи и панкреатического сока – одно из главных и непременных условий при терапии БП. С целью профилактики БП необходимо проведение адекватной терапии ЖКБ на ранних стадиях, а на стадии калькулезного холецистита – своевременной холецистэктомии. Литература 1. Минушкин О.Н. Хронический панкреатит: некоторые аспекты патогенеза, диагностики и лечения // Consilium Medicum. 2002. Т. 4. № 1. С. 23–26. 2. Маев И.В., Казюлин А.Н., Кучерявый Ю.А. и др. Некоторые вопросы эпидемиологии хронического панкреатита // Клинико–эпидемиологические и этно–экологические проблемы заболеваний органов пищеварения: Материалы III Восточно–Сибирской гастроэнтерологической конференции / Под ред. проф. В.В. Цуканова. Красноярск, 2003. С. 9–52. 3. Ильченко А.А. Ферментативный холецистит // Экспериментальная и клиническая гастроэнтерология. 2009. № 7. С. 70–73. 4. Ильченко А.А. Болезни желчного пузыря и желчных путей: Рук–во для врачей. 2–е изд., перераб. и доп. М.: ООО «Издательство «Медицинское информационное агентство», 2011. 880 с. 5. Сhebli J.M., Ferrari Junior A.P., Silva M.R. et al. Biliary microcristals in idiopathicacute pancreatitis: clue for occult underlying biliary etiology // Arg. Gastroenterol. 2002. Apr–Jun. Vol. 37 (2). Р. 93–101. 6. Ильченко А.А. Диагностика билиарного сладжа в практике врача–терапевта поликлиники. Справочник поликлинического врача. 2009. № 10. С. 59–63. 7. Селезнева Э.Я., Ильченко А.А. Клинические особенности течения желчнокаменной болезни, сочетающейся с язвенной болезнью двенадцатиперстной кишки и патогенетические особенности их развития // Экспериментальная и клиническая гастроэнтерология. 2011. № 4. С. 31–36. 8. Селезнева Э.Я., Ильченко А.А. Желчнокаменная болезнь, сочетающаяся с язвенной болезнью двенадцатиперстной кишки. Обзор литературы // Экспериментальная и клиническая гастроэнтерология. 2008. № 2. С. 48–55. 9. Болезни печени и желчных путей. Рук–во для врачей / Под. ред. В.Т. Ивашкина. М.: ООО «Издательский дом «М–Вести», 2002. 416 с. 10. Ильченко А.А., Шибаева Л.О., Ходарев Н.Н. и др. Значение динамической холесцинтиграфии при желчнокаменной болезни // Российский гастроэнтерологический журнал. 2000. № 2. C. 13–20. 11. Ильченко А.А. Эндоскопическая ретроградная холангиопанкреатикография: возможна ли эффективная профилактика ЭРХПГ–индуцированного панкреатита? // Экспериментальная и клиническая гастроэнтерология. 2008. № 3. С. 62–71. 12. Khal S., Zimmermann S., Genz I. et al. Risk factors for failure of endoscopic stenting of biliary strictures in chronic pancreatitis: a prospective follow–up study // Am. J. Gastroenterol. 2003. Vol. 98. P. 2448–2453. 13. Минушкин О.Н. Хронический панкреатит: вопросы патогенеза, диагностики и лечения // Трудный пациент. 2003. Т. 1. № 3. С. 26–30. 14. Пастухов А.И. Результаты комплексного лечения хронического билиарнозависимого панкреатита после холецистэктомии: Автореф. дисс. … канд. мед. наук. М., 2010. 23 с. 15. Ильченко А.А. Билиарный панкреатит // Экспериментальная и клиническая гастроэнтерология. 2005. № 5. С. 10–16. 16. Маев И.В. Болезни двенадцатиперстной кишки / И.В. Маев, А.А. Самсонов. М.: МЕДпресс, 2005. 511 с. 17. Маев И.В., Кучерявый Ю.А. Болезни поджелудочной железы. В 2 т. Т. 2. / И.В. Маев, Ю.А. Кучерявый. М.: Медицина, 2008. 558 с. 18. Рекомендации Научного общества гастроэнтерологов России по диагностике и лечению хронического панкреатита // Экспериментальная и клиническая гастроэнтерология. 2011. № 7. С. 122–129. 19. Мечетина Т.А., Ильченко А.А. Эффективность рифаксимина (Альфа Нормикса) при синдроме избыточного бактериального роста у больных после холецистэктомии // Экспериментальная и клиническая гастроэнтерология. 2010. № 4. С. 100–104.
Cochrane
Вопрос обзора
Вопрос о том, сколько времени должно пройти после внезапного приступа острого панкреатита на фоне желчнокаменной болезни до удаления желчного пузыря, является объектом множества споров.
Мы решили ответить на этот вопрос путем проведения тщательного поиска медицинской литературы с исследованиями, в которых сравнивали, в какое время была проведена лапароскопическая холецистэктомия. Мы включили только рандомизированные контролируемые испытания (исследования, которые могут помочь нам избежать неправильных выводов, в случае, если они разработаны и проведены надлежащим образом). Мы искали данные об исследованиях по январь 2013 года в соответствующей литературе. Два автора независимо друг от друга оценили, какие исследования следует включить, и извлекли данные для минимизации ошибок. Лапароскопическая холецистэктомия считалась «ранней», если она проводилась в течение трех дней с момента внезапного появления симптомов. Лапароскопическая холецистэктомия считалась «поздней», если она была проведена по прошествии трех дней после появления симптомов. Для тяжелого острого панкреатита лапароскопическая холецистэктомия считалась «ранней», если была проведена сразу же после поступления пациента с внезапным приступом панкреатита в больницу. Если лапароскопическая холецистэктомия была проведена при следующем поступлении в больницу, она считалась «поздней».
Актуальность
Поджелудочная железа является органом брюшной полости, который выделяет пищеварительные соки, помогающие переваривать пищу. Она также содержит выделяющие инсулин клетки, которые поддерживают уровень сахара в крови. Острый панкреатит — это внезапный воспалительный процесс в поджелудочной железе, который может затрагивать соседние органы или повлиять на другие системы организма, включая систему кровообращения. В зависимости от наличия недостаточности органов (например, почек, легких или системы кровообращения), а также наличия местных осложнений, таких как скопление жидкости вокруг поджелудочной железы, панкреатит может быть классифицирован как тяжелый острый панкреатит и легкий острый панкреатит. У пациентов с тяжелым панкреатитом наблюдаются органная недостаточность, или местные осложнения, или и то, и другое. У пациентов с легкой формой панкреатита таких признаков не наблюдается. Две основные причины острого панкреатита, зафиксированные в более 80% случаев, — это камни в желчном пузыре и алкоголь. Удаление желчного пузыря (холецистэктомия) является окончательным методом лечения, проводится для предотвращения дальнейших приступов острого желчнокаменного панкреатита и только в том случае, если пациенту не противопоказана операция. Лапароскопическое удаление (хирургическая операция минимального доступа) желчного пузыря является предпочтительным в настоящее время методом холецистэктомии, более 99% пациентов полностью восстанавливаются после процедуры без каких-либо серьезных последствий для здоровья.
Характеристика исследований
Мы выявили одно испытание, в котором сравнивали раннюю лапароскопическую холецистэктомию с поздней у пациентов с легким острым панкреатитом. Из 50 участников этого испытания, у 25 была проведена ранняя лапароскопическая холецистэктомия, в то время как остальным 25 — поздняя. Все 50 участников были живы в конце испытания. Не было выявлено существенных различий между двумя группами в отношении осложнений у участников исследования. О качестве жизни, связанном со здоровьем, не сообщалось в этом испытании. Не было трансформации в открытую холецистэктомию в каждой из групп. Общая продолжительность госпитализации при ранней лапароскопической холецистэктомии была примерно на два дня меньше, чем в группе с поздней лапароскопической холецистэктомией. В испытании не сообщалось о продолжительности периода временной нетрудоспособности и стоимости. Мы не рассматривали испытания, в которых сравнивались ранняя и поздняя лапароскопическая холецистэктомия у пациентов с тяжелым острым панкреатитом.
Основные результаты
На основе результатов наблюдений одного испытания, по-видимому, нет доказательств повышенного риска осложнений после ранней лапароскопической холецистэктомии. Ранняя лапароскопическая холецистэктомия может сократить общее время пребывания в стационаре у людей с легким острым панкреатитом. При легком остром панкреатите в случае доступности соответствующего оборудования и специалистов с нужными навыками, ранняя лапароскопическая холецистэктомия предпочтительнее поздней. В настоящее время нет доказательств, подтверждающих или опровергающих эффективность ранней лапароскопической холецистэктомии при тяжелым остром панкреатите. Необходимы дальнейшие хорошо разработанные рандомизированные контролируемые испытания среди людей с тяжелой и легкой формами острого панкреатита.
Качество доказательств
Одно рассмотренное испытание подвержено высокому риску смещения, то есть существует вероятность ошибочности его выводов, что является следствием того, как исследование было спланировано и проведено.
В хирургической практике острый послеоперационный панкреатит (ОПП) является одним из наиболее опасных и часто встречающихся осложнений после операции на органах брюшной полости и забрюшинного пространства [15]. Летальность при возникновении ОПП варьирует в пределах от 19,5 до 80% и зависит от тяжести течения процесса. При деструктивных формах ОПП вероятность летального исхода достигает 100% [23, 28, 32].
Оценка частоты возникновения ОПП противоречива, поскольку одни хирурги считают достаточным для установления этого осложнения отклонение от нормы лабораторных показателей (таких, как повышение уровня диастазы мочи, амилазы крови), а другие учитывают только тяжелые его формы с яркой клинической картиной. Кроме того, продолжительность послеоперационного периода в каждом конкретном случае точно не определена [30].
Именно поэтому частота развития ОПП, по разным данным [15, 17, 32, 40, 74], колеблется в широких пределах от 0,08 до 100%.
Чаще всего ОПП развивается после хирургических вмешательств на самой поджелудочной железе (ПЖ) и составляет, по данным разных авторов [11, 15, 34, 40, 67], от 1,9 до 100%.
Кроме того, высокая частота развития данного осложнения отмечается после операций на органах, имеющих анатомическую и функциональную связь с поджелудочной железой. После резекции желудка по поводу язвенной болезни двенадцатиперстной кишки ОПП был отмечен у 7,9 -31,4% больных, после операции по поводу рака желудка — 1,8 — 21,8% случаев [37, 39, 62]. Дуоденопластика (ДП) осложняется ОПП с частотой 12-35% [6, 7], а операции на желчном пузыре и внепеченочных желчных протоках приводят к ОПП у 0,2-9,6% пациентов [15, 26, 40, 55]. Лапароскопическая холецистэктомия сопровождается развитием ОПП не более, чем в 1,8% случаев [2, 55].
Хирургические вмешательства с наложением билиодигестивного соустья, эндоскопической ретроградной холангиопанкреатографией (ЭРХПГ) и сопряженными с ней лечебными манипуляциями приводят к ОПП у 0,5-40,5% больных [19, 32, 58, 71].
В работе T. White и соавт. [74] указано, что у 10 из 70 наблюдавшихся ими больных ОПП развился, когда непосредственная травма ПЖ была исключена, т.е. после ортопедических и сосудистых операций. По данным L. Hashimoto и соавт. [59] и G. Sakorafas и соавт. [70], кардиохирургические операции и операции на крупных сосудах сопровождаются развитием ОПП в 0,06-27% случаев. Кроме того, описаны случаи ОПП после иссечения меланосаркомы шеи, струмэктомии, пневмонэктомии, цистостомии, кесарева сечения, геморроидэктомии, удаления катаракты, радикальной мастэктомии, тонзилэктомии, а также протезирования бедренного сустава [60, 64]. Описан случай развития тяжелого панкреатита у пациента, которому был выполнен сеанс литотрипсии по поводу мочекаменной болезни [48].
Приведенные цифры указывают прежде всего на высокую распространенность данного послеоперационного осложнения, актуальность вопроса его диагностики, лечения и профилактики.
Этиология
ОПП является полиэтиологичным заболеванием. Существует множество механизмов повреждения паренхимы поджелудочной железы, которые могут привести к развитию этого осложнения сами по себе или при их сочетании. И.В. Маев, Ю.А. Кучеряевый [22] выделяют наиболее значимые из них:
— прямая травма ПЖ при мобилизации желудка, спленэктомии и др.;
— дуоденальная гипертензия, связанная с особенностями вмешательства или течения послеоперационного периода;
— билиарная гипертензия, возникающая при операциях на желчевыводящих путях;
— ишемия ПЖ вследствие посттравматических системных и регионарных расстройств кровообращения и микроциркуляции;
— гиперстимуляция внешнесекреторного аппарата ПЖ после длительного голодания.
Основной причиной послеоперационных осложнений многие авторы [9, 27, 41] считают травматизацию органа во время хирургических манипуляций. Вследствие этого возникает ишемия ткани, стаз и гипертензия протоковой системы, истечение и действие панкреатического сока на раневую поверхность [41]. А.А. Шелагуров в 1970 г. [45] сформулировал «травматическую теорию» возникновения ОПП, согласно которой при повреждении ткани ПЖ выделяется цитокиназа, активирующая панкреатические ферменты.
Однако описаны случаи, когда оперативное вмешательство производилось вне брюшной полости, и травма ПЖ отсутствовала, и тем не менее в послеоперационном периоде развивался панкреатит [3]. Этиопатогенез ОПП в таких ситуациях связывают с нарушением микроциркуляции, которая возникает вследствие экстраваскулярной и транскапиллярной транслокации жидкости, агрегации тромбоцитов, тромбозов мелких сосудов ПЖ, приводящих к ее ишемии. Также немаловажным фактором может послужить массивная кровопотеря с переливанием больших доз консервированной крови [71].
Повреждение ацинарной ткани ПЖ приводит к излиянию панкреатического сока, однако для активации процессов аутолиза необходима энтерокиназа, т.е. контакт сока с желчью и кишечным содержимым, что бывает далеко не всегда. Поэтому по современным представлениям об этиологии ОПП, кроме травмы паренхимы ПЖ, необходимым условием его возникновения считают наличие панкреатической гипертензии, поскольку в этих условиях происходит заброс кишечного содержимого и желчи в протоки ПЖ, что приводит к активации панкреатических ферментов [18, 26, 61, 67]. Из этого следует, что дуоденальная гипертензия также является важным этиологическим фактором развития ОПП.
Еще одним этиологическим фактором считается повышение давления в протоковой системе ПЖ и внепеченочных желчных протоках вследствие посттравматического отека области большого сосочка двенадцатиперстной кишки (БСДПК), возникающего из-за его рефлекторных реакций при операциях на желчевыводящих путях [18, 26, 63]. Это в известной мере подтверждается тем, что у основной массы больных ОПП развивается после операций на внепеченочных желчных протоках, особенно после прямых вмешательств на БСДПК (при его бужировании, проведении папиллосфинктеропластики), форсированном зондировании желчных протоков жесткими металлическими инструментами, нередко с образованием «ложного хода», затруднениях при извлечении фиксированных в БСДПК конкрементов [19, 46].
По мнению некоторых авторов [15, 18, 70], одной из основных причин ОПП становится ишемия ПЖ вследствие системных или регионарных расстройств кровообращения, возникающая во время операции или в раннем послеоперационном периоде. Е.С. Катанов [15] в этиологии ишемической формы ОПП наиболее значимыми факторами считает нарушение системного кровообращения, рефлекторные нарушения органной гемодинамики и нарушения кровотока в магистральных артериальных и венозных сосудах при их перевязке и пр.
Существует также мнение, что причиной развития ОПП может явиться инфекционный агент, попавший в железу при непосредственном интраоперационном контакте [30]. В клинической медицине важное значение имеют результаты работ М.Н. Молоденкова [23], Н.Н. Кореневич [16], которые в эксперименте показали возможность развития бурно протекающего геморрагического панкреонекроза под действием овальбумина и токсинов Escherichia coli
и
Salmonella abortis
— микроорганизмов, которые часто обнаруживаются в желчи.
Согласно «аллергической теории», ОПП развивается в результате сенсибилизации организма экзо- и эндогенными факторами, что приводит к повреждению ацинарных клеток и поступлению антигенов в кровоток с последующим образованием антител к ним [16]. Справедливость «аллергической теории» подтверждается данными [51] о повышении уровня циркулирующих в крови иммунных комплексов, снижении абсолютного и процентного содержания Т-активных и Т-общих лимфоцитов.
И все же ведущую роль в генезе ОПП играет исходное состояние поджелудочной железы, готовность к развитию воспалительно-деструктивных процессов в ней в раннем послеоперационном периоде. По данным многих авторов [38, 46], от 7,1 до 63,8% больных, у которых развилось это осложнение, страдали хроническим панкреатитом.
Перечисленные выше этиологические факторы запускают процессы активации ферментов поджелудочной железы и аутокаталитические реакции, определяя дальнейший патогенез развития ОПП, не отличающийся от такового при любой другой форме острого панкреатита.
Диагностика
Следует выделить несколько факторов, резко усложняющих диагностику ОПП. Во-первых, клинические проявления ОПП развиваются на фоне исходно тяжелого общего состояния больного, обусловленного сопутствующими заболеваниями, а также тяжестью самого оперативного вмешательства [26]. Во-вторых, клиническая картина этого осложнения проявляется на фоне симптомов послеоперационного периода и сглаживается проводимой терапией, включающей обезболивающие средства. В-третьих, у 25-30% больных тяжесть состояния расценивается как проявление другого послеоперационного осложнения [42]. Нередко заболевание протекает под маской пареза кишечника, анастомозита, остаточных явлений перитонита и т.д. [27]
ОПП очень часто приводит к тяжелому нарушению моторной функции двенадцатиперстной кишки, о чем свидетельствует плохо купируемая обычными анальгетиками тупая боль в эпигастральной области или левом подреберье, сопровождающаяся стойкой тошнотой и повторной рвотой желудочным содержимым с примесью желчи.
Весьма характерным для панкреатита является вздутие в эпигастральной области, которое не уменьшается при декомпрессии и промывании желудка — симптом Гобье. Это связано с изолированным парезом поперечной ободочной кишки и выявляется при обзорной рентгенографии органов брюшной полости.
Перкуторно отмечается тимпанит, особенно высокий в эпигастрии и в проекции боковых каналов живота. Может выявляться притупление в отлогих местах брюшной полости, меняющееся от положения тела больного (свободная жидкость в брюшной полости). При этом по дренажам начинает выделяться экссудат, часто геморрагического характера, с высокими значениями амилазы.
Наиболее распространенным, простым и дешевым биохимическим методом диагностики ОПП является определение активности амилазы в крови и моче. Однако чувствительность и специфичность этого метода составляют от 30 до 92% и от 20 до 60% соответственно [22]. К тому же, на сегодняшний день нет единого мнения относительно пороговых величин, подтверждающих диагноз «острый панкреатит». Некоторые авторы ориентируются на верхнюю границу нормы [68], другие на величины, в 3-6 раз ее превышающие [65]. В отечественной медицине обычно учитывают величины в 2-4 раза выше нормы, т.е. амилаза выше 60-120 г/ч·л [36, 47].
Некоторые авторы [52] с целью повышения точности диагностики ОП предлагают определять активность альфа-амилазы не в сыворотке крови, а в слезе. По их мнению, это технически значительно проще и быстрее, поскольку не требует взятия крови из вены и получения сыворотки. Кроме того, определение амилазы в слезе точнее, так как активность амилазы в слезе значительно выше, чем в крови (в 4 раза) и сохраняется в течение 7 дней. Активность амилазы в слезе здоровых людей колеблется в пределах 193,5±20,9 Е/л (130-250 Е/л). При повышении амилазы более 300 Е/л диагностируют ОП. Однако этот метод еще не нашел своего широкого применения в практике.
Более специфичным для острого панкреатита показателем является повышение активности липазы крови [22, 47]. Липаза дольше, чем амилаза, персистирует в крови, поэтому с помощью этого теста острый панкреатит можно диагностировать даже спустя несколько суток от начала заболевания [68]. Тем не менее гиперлипаземия, так же как и повышение активности амилазы крови, не обладает высокой специфичностью для заболеваний ПЖ, так как она выявляется и при других заболеваниях ЖКТ [9, 22, 47]. Ее регистрируют у 60% больных с заболеваниями гепатобилиарной системы, при острой кишечной непроходимости, почечной недостаточности, раке предстательной железы и других непанкреатических заболеваниях.
Согласно результатам исследования S. Raty и соавт. [68], достаточной информативностью для ранней диагностики послеоперационного панкреатита после резекций поджелудочной железы обладает тест определения содержания трипсиногена в моче. Чувствительность и специфичность теста трипсиногена в моче оценивались как 100 и 92% соответственно. По данным отечественной литературы [22], чувствительность и специфичность определения уровня трипсиногена-2 в моче при дифференциальной диагностике ОПП и острых заболеваний органов брюшной полости непанкреатического происхождения достигают 91-95% и 95-99% соответственно.
На основании этого авторы предлагают этот тест в качестве метода ранней диагностики послеоперационного панкреатита.
В последние годы большое значение в диагностике панкреатита, а также в определении прогноза и вероятности развития осложнений придают исследованию активности в крови и моче фосфолипазы А2 и определение сывороточной эластазы-1. При панкреатите чувствительность и специфичность определения активности в крови фосфолипазы А2 составляют 100 и 90% соответственно [22]. Определение активности эластазы первого типа в крови считают тестом для поздней диагностики панкреатита, поскольку повышенный ее уровень сохраняется в течение 8-10 дней после приступа. Однако при попытке диагностировать острый панкреатит в группе пациентов с различными заболеваниями поджелудочной железы эти показатели демонстрируют низкую специфичность, поскольку почти у половины больных с хроническим панкреатитом и раком поджелудочной железы их содержание превышает нормальной уровень и в ряде случаев достигает величин, характерных для больных острым панкреатитом [8, 25, 52].
Тем не менее из всех лабораторных показателей трудно выделить тот, который можно было бы назвать «золотым стандартом». Многие из них высокочувствительны, однако они не обладают достаточной специфичностью для достоверной диагностики ОПП.
Среди инструментальных методов диагностики ОПП выделяют рентгенологичекое исследование, УЗИ поджелудочной железы, а также КТ и МРТ органов брюшной полости.
Рентгенологическими признаками ОПП являются: ограниченная подвижность куполов диафрагмы, пневматоз поперечноободочной кишки и левосторонний плеврит [3]. Обычные рентгенологические признаки первичного острого панкреатита, такие как пневмотизация тонкой кишки, регионарный спазм поперечноободочной кишки, смазанность контуров левой почки и другие, редко встречаются при ОПП, что связано с послеоперационной травмой [17].
Ультразвуковое исследование считают одним из наиболее значимых в ранней диагностике ОПП [33]. Среди наиболее значимых УЗ-признаков острого панкреатита выделяют увеличение размеров поджелудочной железы, нечеткость ее контуров, увеличение расстояния между задней стенкой желудка и передней поверхностью поджелудочной железы, а также изменение ее эхогенности. Динамический контроль с помощью УЗИ за состоянием всей билиопанкреатической системы позволяет оценить эффективность проводимой консервативной терапии этого осложнения. Важно то, что этот метод не имеет противопоказаний, а безвредность и безболезненность его проведения обусловливают возможность многократных исследований непосредственно у постели больного.
Однако по данным А.Л. Костюченко и соавт. [17] быстрое развитие пареза кишечника и неизбежный пневмоперитонеум после лапоротомий могут приводить к малоинформативности ультразвукового сканирования при ОПП.
Применение эндоскопической ультрасонографии у больных ОПП позволяет провести объективную оценку состояния поджелудочной железы, дифференцировать осложненные формы ОПП, а также следить за динамикой патологического процесса в поджелудочной железе и окружающих органах и тканях. По мнению М.В. Данилова и соавт. [9], малая травматичность эндоскопической ультрасонографии позволяет использовать ее в раннем и позднем периоде после операций на поджелудочной железе и для выявления послеоперационных осложнений. Однако стоит отметить, что данный метод недоступен для большинства российских клиник.
В качестве «золотого стандарта» для оценки степени тяжести и распространения воспалительного процесса у пациентов с ОП, а также определения показаний к оперативному лечению в настоящее время зарекомендовала себя КТ с болюсным контрастным усилением [33]. При этом методе пневмотизированные петли кишечника и желудок не мешают оценке изменений забрюшинной клетчатки и ткани самой железы [22].
МРТ также является перспективным методом диагностики и оценки динамики развития ОПП [74]. Высокопольная МРТ в полной степени отображает морфологические изменения при остром деструктивном панкреатите [43]. Основными МРТ признаками острого панкреатита являются отек, увеличение ПЖ, некроз паренхимы и окружающей жировой клетчатки, скопления свободной жидкости в брюшной полости, наличие геморрагического компонента, инфильтрация жировой капсулы почки.
Компьютерная томография и МРТ позволяют провести точную дифференциальную диагностику ОПП с другими послеоперационными состояниями, обусловливающими тяжесть состояния больного. К сожалению, эти высокоинформативные и точные методы не находят широкого применения в клинической практике из-за своей дороговизны.
Профилактика
Профилактика ОПП осуществляется как хирургическими, так и медикаментозными путями.
Хирургический путь профилактики ОПП заключается в использовании щадящих методов оперативной техники, позволяющих уменьшить травматичность и длительность оперативного вмешательства [1, 18]. Кроме того, возможно выполнение симультантных оперативных вмешательств, направленных на предупреждение развития ОПП [44], среди которых особенно выделяют билиарное дренирование как наиболее эффективную процедуру, препятствующую развитию постманипуляционного панкреатита [22].
Несмотря на это, более распространенной и перспективной является медикаментозная профилактика ОПП, которая может быть разделена на специфическую и неспецифическую. Среди неспецифических факторов важная роль отводится проведению профилактической терапии в процессе предоперационной подготовки больного, включающей диету, использование ферментных препаратов, стабилизацию водно-электролитного и белкового обменов [26]. Кроме того, немаловажным компонентом неспецифической профилактики развития послеоперационных осложнений, в том числе и панкреатита, является оптимизация анестезиологического обеспечения операций [12].
Специфические методы профилактики острого послеоперационного панкреатита заключаются в использовании препаратов, действие которых направлено непосредственно на звенья его патогенеза. Среди них выделяют:
— ингибиторы протеаз;
— ингибиторы экзокринной секреции;
— антиоксиданты;
— цитостатики.
Ингибиторы протеаз (препараты апротинина — контрикал, трасилол и гордокс) представляют собой белки, обладающие свойством инактивации протеолитических ферментов эндогенного и экзогенного происхождения. Установлено, что действие этих препаратов основано на инактивации трипсина, химотрипсина, плазмина, калликреина; при этом они практически не влияют на их синтез. Взаимодействие между активными ферментами поджелудочной железы и антипротеолитическими препаратами происходит в основном в плазме крови, однако не исключено, что это возможно и в ткани железы [18].
Большие надежды возлагали на низкомолекулярный ингибитор протеаз — габексат мезилата, обладающий, в отличие от препаратов группы апротинина, способностью проникать внутрь панкреоцита. Эксперименты J. Wisner и соавт. [75] на животных дали убедительные доказательства эффективности его профилактического введения. Позднее C. Cavallini и соавт. [54] продемонстрировали достоверное снижение частоты возникновения острого панкреатита и понижение уровня амилазы крови в группе пациентов, получавших лекарственный препарат при проведении ЭРХПГ. Другие авторы [50] отмечают неэффективность введения габексата мезилата у больных с высокой степенью риска развития панкреатита после ЭРХПГ.
В настоящее время наибольшие перспективы в профилактике и лечении острого послеоперационного панкреатита связаны с применением синтетических аналогов соматостатина: октреотида, стиламина, сандостатина и октреотида-депо [10, 24, 26].
По мнению ряда авторов [56, 66, 67, 76], превентивное введение аналогов соматостатина достаточно эффективно, однако положительный эффект достигался не во всех исследованиях, выполненных по правилам доказательной медицины. Это, в частности, было продемонстрировано на группе пациентов с высоким риском развития панкреатита после ЭРХПГ. По данным A. Andruilli и соавт. [50], профилактическое применение препаратов соматостатина не снизило частоту развития острого послеоперационного панкреатита.
В последние годы в России в профилактике острого деструктивного панкреатита, в том числе и послеоперационного, широко стал применяться препарат отечественного производства октреотид [13, 14, 36].
Результаты исследований [14, 35, 36] показали, что в плане снижения экзокринной функции поджелудочной железы октреотид обладает спектром действия, практически идентичным спектру действия природного соматостатина, и не уступает по данному критерию другому синтетическому аналогу зарубежного производства — сандостатину, в течение длительного времени широко используемому в клинической практике.
Механизм действия октреотида основан на подавлении аденилатциклазы и связанном с этим уменьшением циклического аденозинмонофосфата (цАМФ) в клетке.
Ингибирующий эффект октреотида на G-клетки желудка ведет к торможению выработки гастрина, что приводит к снижению секреции пепсина и соляной кислоты, а также основных стимуляторов пищеварительных ферментов и бикарбонатов в поджелудочной железе — холецистокинина, секретина и вазоинтестинального пептида. Уменьшение образования мотилина ведет к снижению двигательной активности желудочно-кишечного тракта [49, 65, 75].
Авторы [53] предлагают вводить октреотид подкожно, первую дозу 200 мкг за 1 ч до операции, после операции — по 100 мкг 3 раза в сутки на протяжении 7 последующих дней, однако существуют и другие схемы его использования. Так, при прогнозировании значительной травмы ПЖ и, как следствие, возможного развития тяжелых форм ОПП дозировку препарата увеличивают в 2 раза и она составляет 600 мкг в сутки.
Е.С. Сирота [29] с целью профилактики послеоперационного панкреатита предлагает вводить октреотид подкожно или внутривенно по 0,1 мг 3 раза в сутки в течение 3 дней после операции.
Однако некоторые зарубежные авторы [49, 57] указывают на то, что производные соматостатина недостаточно эффективны для лечения ОПП и снижения летальных исходов у больных с данным осложнением. При этом в профилактических целях (например, в плановой хирургии на органах верхнего этажа брюшной полости) ингибирование экзокринной секреции поджелудочной железы с помощью этих препаратов достоверно снижает количество осложнений.
В последнее время появились работы [10, 13], сообщающие об эффективном снижении частоты развития послеоперационного панкреатита при назначении пролонгированных форм синтетических аналогов соматостатина (10 мг октреотида-депо за 7 дней до операции) у больных, оперированных по поводу рака желудка. По данным Ю.С. Полушина и соавт. [26], использование октреотида-депо по вышеуказанной схеме позволило снизить частоту панкреатита в 4,5 раза и предотвратить тяжелые формы этого послеоперационного осложнения.
Н.Н. Крылов и соавт. [20] проводили оценку эффективности медикаментозной профилактики острого послеоперационного панкреатита октреотидом, октреотидом-депо, 5-фторурацилом (5-ФУ) в сочетании с даларгином у 325 больных, оперированных по поводу рака желудка. В 1-й группе пациентов с целью профилактики ОПП использовали октреотид по схеме: 200 мг до операции, по 100 мг 3 раза в день после операции в течение 6 дней. Во 2-й группе профилактику ОПП проводили октреотидом-депо, который вводили в дозировке 0,01 г за 7 дней до операции. В 3-й группе применяли 5-ФУ с даларгином и контрикалом по схеме: 5-форурацил — 500 мг интраоперационно, по 500 мг в течение 3 дней после операции; даларгин — 5,0 мл интраоперационно и по 5,0 мл в течение 6 дней; контрикал вводили по 20 000 ЕД внутривенно в течение 6 дней. Согласно результатам исследования, при применении октреотида острый панкреатит отмечался у 13% больных, использование октреотида-депо было самым эффективным и не позволило избежать развития ОПП только у 4,2% больных, а в группе, в которой с целью профилактикаи ОПП использовали 5-ФУ, контрикал и даларгин, это осложнение развилось у 20% пациентов.
Из антиоксидантных препаратов для профилактики ОПП В.В. Шабанов [40] предлагает внутривенное использование тиоктацида и убихинона-композитум. По данным автора, эти препараты снижают тяжесть течения послеоперационного периода, а также абсолютный и относительный риск развития данного осложнения на 11,4 и 100% соответственно у больных раком желудка и пищевода.
Среди препаратов, подавляющих секреторную активность панкреацитов, в течение длительного времени особое внимание уделяли цитостатикам — производным пиримидина — 5-ФТУ и фторафура. Эти соединения считаются наиболее эффективными ингибиторами ферментопродуцирующей активности панкреацитов, поскольку избирательно накапливаются в поджелудочной железе, угнетая в ней синтез белков [17]. Доказано, что синтез амилазы и трипсина снижается через 15 мин от начала внутривенной инфузии препарата. Кроме того, при его распаде освобаждается фторуксусная кислота, способная ингибировать липазу [26].
Ряд авторов предлагают комбинированные схемы профилактики ОПП. Е.С. Сирота [29] с целью профилактики послеоперационного панкреатита у больных с абдоминальными, торакальными и торакоабдоминальными травмами использовал антиметаболиты (5-фторурацил; сандостатин), антиоксиданты (мексидол, витамин Е), парентеральное питание с последующим переводом на энтеральный путь приема пищи, а также антибиотикотерапию на весь период проводимого лечения. Предложенная схема профилактики ОПП была использована у 51 больного, и ни в одном из случаев не наблюдалось развитие этого осложнения.
Учитывая значительную роль нарушения микроциркуляции в поджелудочной железе в патогенезе острого панкреатита, В.И. Лупальцов [21] сообщает о целесообразности предотвращения микроциркуляторных расстройств в ткани органа при операциях в панкреатодуоденальной зоне, что может оказаться эффективным в профилактике осложнений. Для этого автор предлагает внутривенное введение реополиглюкин-компламин-тренталовой смеси, что, по его данным, снизило частоту возникновения острого панкреатита в группе больных оперированных с 35 до 12%.
Из приведенных данных следует, что в настоящее время до конца не разработаны вопросы оценки вероятности развития ОПП, не существует четких рекомендаций по методике проведения профилактики панкреатита в интраоперационном периоде, исходя из степени выраженности тех или иных прогностических факторов риска [53]. Кроме того, экономические затраты на профилактику ОПП не всегда оправдывают возлагаемые на нее надежды. Поэтому вопрос клинико-экономической эффективности профилактики послеоперационного панкреатита до настоящего времени остается актуальным. Какой препарат наиболее эффективен, следует ли проводить профилактическое лечение всем больным или относящимся только к группе риска, необходима ли комплексная терапия или достаточно ограничиться препаратами одного механизма действия, — эти и множество других проблем все еще являются нерешенными.