Общие сведения
Атрезия пищевода – патология пищеварительного тракта, относящаяся к тяжелым порокам развития. Она заключается в слепом окончании верхнего (орального) либо разобщенности с нижним (абдоминальным) сегментом пищевода (МКБ-10: Q39.0), а также его сообщения с трахеей – при наличии так называемого трахеально-пищеводного свища (МКБ-10: Q39.1).
Аномалия развития обнаруживается у 1 новорожденного на 1-5 тыс детей вне зависимости от пола. Выявление изолированного врожденного трахеопищеводного свища происходит примерно в 3-4% случаев врожденных отклонений развития пищевода. У детей с атрезией пищевода достаточно часто наблюдаются прочие аномалии развития и врождённые пороки сердца, мочеполовой системы, ЖКТ, а также аномалии конечностей и хромосомные нарушения, что существенно снижает их выживаемость.
1.Общие сведения
В медицине существует множество синонимов для обозначения патологического сужения, закупорки или перекрытия просвета, – обструкция, обтурация, эмболия, стриктура, облитерация и т.д. Термин «атрезия» означает нечто иное: природный канал в организме заращен полностью и отсутствует как таковой. Чаще всего атрезия бывает врожденной: на этапе внутриутробного развития какое-либо отверстие или проток не открываются, не формируются и к моменту рождения остаются слепым «тупиком». Любая аномалия такого рода является тяжелой, и зачастую уже в первые дни или даже часы после рождения она создает прямую угрозу жизни.
К атрезии пищевода вышесказанное относится в полной мере. Это один из тяжелейших вариантов пренатального дизонтогенеза, при котором пищевод на уровне десяти-двенадцати сантиметров ниже гортани перекрывается зарощенным тупиком.
Атрезия пищевода встречается в одном случае на 3-5 тыс новорожденных, и такая частота не позволяет отнести эту аномалию к очень редким болезням, да и просто к редким: в отечественной медицине редкими обычно считают болезни с частотой встречаемости 1:10000 и ниже.
От пола и расы риск пищеводной атрезии не зависит.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
Патогенез
В основе данной аномалии строения пищевода лежит нарушение внутриутробных ранних стадий развития эмбриона. Зачатком трахеи и пищевода является головной конец передней кишки и изначально они имеют между собой широкое сообщение. Процесс разделения обычно происходит примерно на 5 неделе беременности.
Процессы вакуолизации на солидном этапе, несоответствие скорости и направления роста трахеи с пищеводом и другими образованиями пищеварительной трубки с 20 по 40 сутки эмбриогенеза приводят к такой тяжелой несовместимой с жизнью аномалии. Угроза существованию начинается сразу с рождения, так как при попадании в трахею содержимого из желудка, слизи или молока с кормлением развивается аспирационная пневмония и дыхательная недостаточность, а слепое окончание пищевода приводит к истощению. Поэтому выявление порока в первые часы жизни и восстановление нормального хода пищевой трубки требует неотлагательного хирургического вмешательства и дает наилучший прогноз.
Типичными нарушениями беременности является многоводие и риск выкидыша, особенно — в первый триместр.
Дискуссия
Трахеомаляция — распространенная причина нарушения дыхания среди пациентов с А.П. Одно из недавних исследований сообщает о развитии трахеомаляции у 87% пациентов с АП [3]. Данные, полученные из более ранних научных работ, свидетельствуют о распространенности трахеомаляции у 11—33% пациентов с АП и, вероятно, недооценивают это заболевание, учитывая широкий спектр клинических проявлений этой аномалии [1, 5, 13—18]. Определенную роль в неправильной постановке диагноза, возможно, играет неправильная оценка результатов трахеобронхоскопии. Ранний и точный диагноз трахеомаляции очень важен, особенно с позиций того, что обструкция просвета трахеи приводит к неэффективности самостоятельного дыхания и плохому очищению трахеобронхиального дерева от секретов, которые способствуют возникновению хронического воспалительного процесса в легких у 27% пациентов с АП [4, 16, 18—20]. Эффективное лечение трахеомаляции остается сложной задачей и не находит в настоящее время консенсуса в области ее диагностики, оценки степени тяжести и выбора хирургической тактики [3, 4, 6, 21].
Стандартизировать диагностику трахеомаляции достаточно сложно, так как степень и протяженность спадения просвета трахеи до настоящего времени остаются субъективными критериями. До- и послеоперационная эндоскопическая оценка дыхательных путей у пациентов с АП необходима для достоверного диагноза трахеомаляции. Диагностическая ларингоскопия и бронхоскопия, которые проводятся под общей анестезией на фоне спонтанного дыхания пациентов, необходимы для оценки состояния голосовой щели в целях поиска ларингеальной расщелины, дистальной и проксимальной трахеопищеводной фистулы, а также динамического исследования состояния просвета трахеи в течение всего дыхательного цикла. R. Jennings предложил шкалу оценки тяжести трахеомаляции, основанную на определении степени сужения просвета трахеи и бронхов, измеренных в нескольких областях трахеи [6, 9, 20]. Чем больше тяжесть обструкции дыхательных путей, тем меньше оценка, которая в сочетании с клиническими симп-томами будет являться показанием к хирургической коррекции. Стандартизованная система подсчета очков, основанная на динамической оценке дыхательных путей, используется для определения до- и послеоперационных показателей тяжести трахеомаляции [6, 9, 20].
Другая дискутируемая сторона диагностики трахеомаляции у больных с АП касается выполнения трахеобронхоскопии в дооперационном периоде. Рутинное использование предоперационной трахеобронхоскопии в качестве дополнения к предоперационной оценке комплекса пороков развития, встречающихся при АП, является спорным, и только 21,5—60% хирургов выполняют трахеобронхоскопию до операции [22—24].
Хирургические варианты лечения трахеомаляции включают процедуры передней (восходящая аорта) или задней (нисходящая аорта) аортопексии, передней или задней трахеопексии, резекции трахеи с анастомозом или наружной стабилизации [3—4, 6—7, 9, 25—27]. Передняя аортопексия с фиксацией к грудине восходящей аорты — наиболее часто используемый метод лечения трахеомаляции. Однако данные литературы сообщают о неэффективности этой процедуры у 10—25% пациентов [25—27].
Интересно, что задняя трахеопексия к передней продольной спинальной связке была первоначально разработана для предупреждения рецидива трахеопищеводной фистулы [28]. Однако при последующей трахеобронхоскопии было обнаружено, что задняя трахеопексия также оказалась довольно эффективной для лечения трахеомаляции [3, 6, 9]. Большая часть этих операций выполняется во время повторных операций после первичной реконструкции пищевода.
Совсем недавно было продемонстрировано, что задняя трахеопексия может быть выполнена одновременно с конструированием анастомоза пищевода. H. Shieh продемонстрировал, что задняя трахеопексия была выполнена в 28% первичных случаев и 10% вторичных случаев лечения АП.
Если задняя трахеопексия используется для первичного лечения трахеомаляции, диагностированной сразу после рождения, проследить естественную эволюцию этих случаев аномалии трахеи не представляется возможным. Существуют, однако, свидетельства того, что у ¼ пациентов с сохраняющейся трахеомаляцией к 8 годам развиваются необратимые бронхоэктазы [18]. Поэтому современный взгляд на эту проблему подразумевает, что задняя трахеопексия может быть безопасно выполнена во время первоначальной реконструкции АП без дополнительного риска осложнений и значительного удлинения времени операции. Эта совершенно новая процедура, предназначенная для раскрытия просвета трахеи у больных с трахеомаляцией, может предотвратить в будущем развитие хронических бронхолегочных заболеваний и проведение повторной операции, необходимой для коррекции трахеомаляции.
Классификация
В основе классификаций атрезии пищевода обычно лежат анатомические особенности строения, выделяют 5 типов:
- у детей полностью отсутствует пищевод и он заменен соединительнотканным тяжем, при этом наблюдается отсутствие просвета и сочленения с трахеей в виде полной аплазии пищеводной трубки;
- пищевод сформирован двумя изолированно расположенными слепыми мешками, которые могут соприкасаться или заходить друг за друга, основной признак такого состояния – визуализация во время контрастной рентгенографии орального слепого мешка и отсутствие газа в ЖКТ;
- окончание верхнего сегмента пищевода слепое, а нижнего — соединенное с трахеей при помощи свищевого хода несколько выше или в месте бифуркации (раздвоения) трахеи, может даже открываться в правый бронх;
- есть сообщение оральной части пищевода с трахеей, а нижний конец заканчивается слепо;
- наличие двойных свищей, при этом верхний сегмент пищевода может быть больше нижнего в диаметре и гипертрофирован, а второй – истончен.
Типы атрезии пищевода
Размеры и расположение свищевых ходов могут быть различные. Они, как правило, располагаются на уровне второго-третьего грудного позвонка, соединяясь с задне-боковой частью стенки трахеи либо бронхов на уровне первого грудного позвонка и выше, второго-третьего грудного позвонка и даже ниже третьего грудного позвонка, что наблюдается чаще всего. Диастаз между оральным и абдоминальным концом может быть от нескольких миллиметров до нескольких сантиметров.
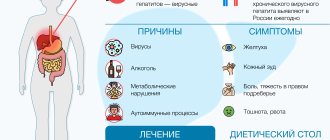
Симптомы
Клиническая картина при атрезии пищевода ярко выраженная и разворачивается в первые минуты жизни новорожденного, при этом наблюдается:
- наличие непрекращающихся обильных выделений и пенистой слюны со рта и из носа, то есть ложной гиперсаливации;
- при попадании слюны в дыхательные пути наблюдаются признаки нарушения дыхания в виде околоротового цианоза, хрипов, кашля, тахипноэ, одышки, аритмии, асфиксии и пр., добиться временного улучшения удается лишь путем отсасывания слизи из верхних воздухоносных ходов, которая может иметь желтоватый оттенок из-за примесей желчных кислот;
- первое кормление сопровождается попаданием молока в дыхательные пути, при этом возникает препятствие попаданию воздуха в легкие и возникает цианоз, ребенок может поперхнуться и закашляться, а в дальнейшем состояние осложняется рвотой неизменёнными массами;
- вздутие живота, вызванное проникновением воздуха через трахею в желудок;
- развитие дыхательной недостаточности, аспирационной пневмонии и дистресс-синдрома в результате рефлюкса желудочного содержимого в просвет трахеи при трахеопищеводном свище;
- полная атрезия ведет к обезвоживанию и истощению;
- состояние может осложняться респираторным ацидозом, полицитемией и повышением гематокрита.
Другие аномалии и пороки развития, встречающиеся у детей с атрезией пищевода
- трахеопищеводный свищ – основное отклонение развития, встречающееся в 80-90% случаев;
- атрезия хоан;
- стеноз пилорического отдела полости желудка;
- билиарная агенезия;
- врожденные пороки сердца;
- атрезия тощей кишки;
- микрогнатия;
- гипертелоризм;
- микроцефалия;
- гидроцефалия;
- гипоплазия лицевых костей черепа, характерная для трисомии хромосом 21, 18, 13-15.
Можно ли поставить диагноз малышу в утробе матери?
Диагностика патологии у плода называется пренатальной. Она может основываться на следующих косвенных признаках, которые выявляются при ультразвуковом исследовании:
- многоводие — при значительном прибавлении веса беременной, в данном случае его связывают со сниженным оборотом околоплодных вод из-за неспособности плода к глотанию амниотической жидкости;
- отсутствие изображения контуров желудка или его слишком маленькие размеры в динамике при наблюдении.
Вероятность подтверждения патологии по этим признакам доходит до 50%. Во II и III триместрах опытный врач замечает периоды наполнение и опустошения слепого конца пищевода. Имеются сообщения о важном значении определения содержания фермента ацетилхолинэстеразы в амниотической жидкости плода, если в период беременности возникает подозрение на врожденную патологию.
Анализы и диагностика
Для исключения атрезии пищевода в стенах родильного зала:
- проводят пробу Элефанта — при помощи шприца и зонда, установленного в слепой конец пищевода, начинают подавать воздух, признаком нарушения считается, если он с шумом выходит изо рта и носовых ходов;
- через нос в пищевод вводят рентгеноконтрастный зонд с нетравматичным концом, в случае аномалии пищевода по ходу резинового катетера встречается препятствие в виде слепого конца, поэтому он заворачивается и возвращается в ротовую полость ребенка.
Для определения особенностей порока развития проводится рентгенологическое исследование области грудной клетки и органов брюшной полости в прямой и боковой проекции. Оно может быть выполнено без использования контрастного вещества, что также при аномальном развитии пищевода отличается «возвращением» свернутого рентгеноконтрастного зонда. При использовании контраста происходит его затекание в трахею или отчетливая демонстрация слепого конца. Если есть трахиально-пищеводный свищ, то наблюдается проникновение воздуха в желудок, в противном случае – видна картина полного затмения брюшной полости у детей с запавшим животом.
Для определения особенностей трахопищеводного свища наиболее показательной является эзофагоскопия и трахеобронхоскопия.
Чтобы исключить сопутствующие аномалии рекомендовано провести УЗИ выделительной системы, нейросонографию и ЭХО-КГ.
Наложение анастомоза требует ушивания над пищеводом медиастинальной плевры и закрытия грудной клетки послойно наглухо, одновременного расправления легких при помощи аппарата для эндотрахеонаркоза. Кроме того, проводится контрольная рентгенограмма для выяснения степени расправленности легкого. Катетер из пищевода можно осторожно удалить по прошествии суток.
Результаты
В ходе операции не было отмечено осложнений в виде кровотечения, нарушения невральных структур (блуждающего или возвратного нерва), повреждения задней стенки трахеи. Задняя трахеопексия не вызвала дополнительных трудностей при наложении анастомоза пищевода. Продолжительность хирургического вмешательства составила 85 мин. Длительность искусственной вентиляции легких после операции 1 сут. Деканюляция трахеи была выполнена на 3-и сутки. Самостоятельное дыхание было эффективно и обеспечивало эффективный газообмен. Тахипноэ, втяжения уступчивых мест грудной клетки отсутствовали. Контрастное исследование пищевода было выполнено на 7-е сутки после операции и демонстрировало хорошую проходимость пищевода без признаков несостоятельности. Желудочный зонд и дренажная трубка, находящаяся в заднем средостении, были извлечены в этот же день, и в этот же день стартовало питание через рот. На 10-е сутки жизни выполнена трахеобронхоскопия, которая демонстрировала полное открытие просвета трахеи с умеренным пролапсом мембранозной части во втором сегменте трахеи. Оценка степени проходимости трахеи по шкале тяжести трахеомаляции R. Jennings составила 480 баллов. В ходе наблюдения за пациентом на протяжении 5 мес не обнаружено нарастания симптомов дыхательных расстройств. Пациент демонстрировал прекрасные весо-ростовые показатели, свойственные его возрасту.
Процедуры и операции
Решить проблему атрезии пищевода можно при помощи торакотомии – открытого оперативного вмешательства либо выполнив одноэтапную торатоскопическую процедуру. Основной целью которых является разделение трахеально-пищеводного свища с дальнейшим наложением прямого анастомоза соединяющего концы пищевода. Такие манипуляции выполнимы, если размер диастаза не превышает 1,5-2 см. В других случаях накладывают шейную эзофагостому и гастростому по Кадеру, а после прошествия 2-3 мес. детям до 3 лет проводят пластику пищевода с использованием толстокишечного трансплантата.
Первая успешная реконструкция пищевода была проведена в 1939 году, за все последующие годы было разработано множество способов наложения анастомозов в зависимости от особенностей пороков пищевода:
- Haight and Towsley в 1943 году предложили осуществлять наложение первичного анастомоза, соединяя сегменты пищевода «конец к концу», однако такая методика подходит лишь при незначительных размерах диастаза;
- Daniel годом позднее использовал для создания анастомоза катетер, которой ввел в пищевод назально до начала оперативного вмешательства и удалил его во время прорезывания нити, фиксирующей дистальный сегмент пищевода с катетером, но этот способ грозит риском возникновения сужения в месте расположения анастомоза;
- хирургом Ladd была предложена идея соединения обоих концов пищевода при помощи специальных обвивных швов, что дает возможность рекоснтрукции при натяжении и снижает риск прорезать нитями нежные ткани тела ребенка;
- Gross and Scott в 1946 году удалось разработать метод косого анастомоза восстановления трубки пищевода, помимо его уникального способа накладывания швов Ladd конструкция укрепляется при помощи отельных шелковых нитей, что дало возможность значительно снизить риски стриктур в местах сшивания;
- Ten Kate в 1952 голу предложит уникальное дополнение к технике воспроизведения анастомозов путем удлинения орального отрезка и уменьшения натяжения в случае диастаза между сегментами пищевода, но оно влекло за собой риск рубцовых изменений и нарушение проходимости в послеоперационный период;
- техника «конец в бок» применяется в наиболее простых случаях захождения слепых концов пищевода «один за» и их соприкосновения без натяжения;
- механическое сшивание сегментов пищевода при помощи аппаратного механического шва позволяет значительно сократить время операции, но у него есть свои противопоказания: значительный диастаз более 1,5 см и существенное недоразвитие дальнего сегмента пищевода.
Атрезия пищевода у новорожденных
У новорожденных аномалии нередко развиваются в комплексе с врожденными пороками других органов и систем. Атрезия пищевода считается одним из наиболее тяжелых видов нарушений, ведь у ребенка практически нет шансов выжить без раннего оперативного хирургического вмешательства.
Подготовка к операции должна начинаться незамедлительно и сопровождаться постоянной аспирацией содержимого рото- и носоглотки каждые 15-20 минут. Кроме того необходима подача увлажненного кислорода, согревания в условиях кувеза и полное исключение перорального кормления. Для стабилизации состояния может понадобиться инфузионная, антибактериальная (препаратами широкого спектра действия) и симптоматическая терапия для борьбы с нарушениями гомеостаза, гемодинамики, дыхательной недостаточности и дегидратацией.
4.Лечение
Очевидно, что фактор времени является жизненно важным: в перинатальном периоде смерть от истощения и дыхательных нарушений наступает весьма быстро, – если диагноз устанавливается запоздало или неверно, вследствие чего не производится срочное хирургическое вмешательство (единственный жизнесохраняющий способ лечения).
Необходима интенсивная предоперационная подготовка, – влажная оксигенация легких, дренаж слизи и слюны, бронхоскопия, назначение антибиотического прикрытия, – и чем больше времени прошло от рождения, тем дольше приходится готовить пациента к операции. Иногда вмешательство становится двухэтапным (сначала устраняется свищ и формируется гастростома для обеспечения питания, затем восстанавливается проходимость пищевода). Вообще, открытые полостные операции такого рода всегда сложны и рискованны, методику нередко приходится корригировать уже на операционном столе; прогноз дополнительно (и существенно) ухудшается наличием сопутствующих аномалий в других системах организма. Не менее сложен и опасен послеоперационный период.
В литературе приводятся данные о том, что при изолированной (без свища и других осложнений) атрезии пищевода выживаемость прооперированных новорожденных колеблется между 90% и 100%; наличие же сопутствующих врожденных аномалий в жизненно важных органах (сердце, почки и т.д.) снижает этот показатель до уровня 30-50%.
Атрезия пищевода у детей до 3 лет в послеоперационный период
Послеоперационное состояние может осложняться множеством различных тяжелых побочных проявлений, что требует постоянного диспансерного наблюдения и контрольных фиброэзофагогастроскопий, а в некоторых случаях – и скорой медицинской помощи. К ним относится:
- дисфагия (расстройство способности глотания);
- недостаточность кардии;
- желудочно-пищевой рефлюкс, вызывающий ночные регургитации и срыгивания;
- повторные пневмонии;
- сужение анастомозов, при котором встает вопрос о необходимости бужирования;
- у многих детей послеоперационная травмой гортанного возвратного нерва в течение 6-12 месяцев вызывает осиплость голоса.
Диета при атрезии пищевода
Послеоперационная диета
- Эффективность: лечебный эффект через 21 день
- Сроки: 1-6 месяцев
- Стоимость продуктов: 1300-1500 руб. в неделю
Так как малышу не может помочь никакое консервативное лечение, а только незамедлительное оперативное вмешательство, то молодым родителям очень важно ознакомиться с перечнем рекомендаций по питанию в послеоперационный период. К ним относится:
- кормление гомогенизированными пищевыми массами;
- постоянное диспансерное наблюдение, в случае дисфагии или непроходимости необходима срочная эзофагоскопия;
- у достаточно взрослых детей в меню могут быть введены супы, бульоны и жидкие каши.