Введение
В настоящее время врачам-интернистам все чаще приходится сталкиваться с проблемой коморбидности и необходимостью назначения массы лекарственных препаратов. С одной стороны, коморбидность сама по себе является независимым фактором риска летального исхода и неблагоприятного прогноза для заболевания и жизни [1]. С другой стороны, неизбежная полипрагмазия при коморбидной патологии сопряжена с многочисленными неблагоприятными последствиями, что требует тщательного анализа рисков межлекарственных взаимодействий, а также риска поражения других органов и систем. Наиболее часто в клинической практике встречаются лекарственное поражение печени и повреждение слизистых оболочек пищеварительного тракта.
Хорошо известен негативный эффект нестероидных противовоспалительных препаратов (НПВП) и антиагрегантов на верхние отделы желудочно-кишечного тракта. Кроме того, не только НПВП, но и ряд других препаратов, таких как антикоагулянты, антибиотики, химиотерапевтические средства, ингибиторы протонной помпы, блокаторы рецепторов к ангиотензину II, могут вызывать повреждение слизистых оболочек пищеварительного тракта.
Целью данного обзора является систематизация и актуализация сведений о поражениях кишечника, связанных с приемом вышеуказанных лекарственных средств.
Истинная распространенность поражений кишечника на фоне приема лекарственных препаратов не известна. Данные отдельных эпидемиологических исследований довольно разнородны и колеблются в пределах 3–22% от всех случаев обращений за медицинской помощью по поводу кишечных симптомов [2]. Пожилой возраст, наличие сопутствующих заболеваний и количество принимаемых пациентом препаратов служат основными факторами, связанными с повышением риска развития лекарственно-индуцированного поражения кишечника [3].
Поражение кишечника на фоне приема лекарственных средств может сопровождаться различными морфологическими и функциональными изменениями. В большинстве случаев клинические проявления лекарственно-индуцированного поражения кишечника включают вздутие, абдоминальную боль и диарею, сохраняющиеся в ночные часы. Иногда могут отмечаться лихорадка и появление крови в кале. Выраженность симптомов может широко варьироваться от невыраженных до интенсивных, имитирующих картину острого живота. Данные физикального обследования также достаточно вариабельны и неспецифичны. Важным диагностическим критерием лекарственно-индуцированного колита является то, что отмена препарата быстро приводит к улучшению самочувствия пациента [4].
Необходимо отметить, что некоторые лекарственные препараты в силу своего фармакологического действия могут обусловливать различные нарушения функции кишечника, не вызывая при этом поражения слизистой оболочки кишки. Так, сердечный гликозид дигоксин, ингибируя Na+/K+ обмен, может стать причиной потери натрия на уровне кишки и развития секреторной диареи. Осмотическая диарея без признаков стеатореи может возникать при использовании осмотических слабительных, таких как лактулоза или макрогол (полиэтиленгликоль), с наличием признаков стеатореи — на фоне применения ингибитора липазы орлистата или секвестранта желчных кислот холестирамина. Диарею вследствие повышенной моторной активности кишечника вызывают препараты с прокинетическим действием, которые повышают активность мигрирующего моторного комплекса желудка и кишечника (макролиды, агонисты рецепторов серотонина 5-НТ4). Напротив, замедление моторики кишечника и как следствие – запоры могут возникать в результате применения блокаторов кальциевых каналов, антихолинергических препаратов, трициклических антидепрессантов, препаратов висмута, железа, опиоидных анальгетиков [2, 5, 6].
Патогенетические механизмы, лежащие в основе развития поражения слизистой оболочки кишечника вследствие воздействия лекарственных средств, до конца не раскрыты. Общеизвестно, что заболевания пищеварительного тракта формируются в результате дисбаланса между факторами защиты и агрессии по отношению к слизистой оболочке. В последнее десятилетие появились новые представления о патофизиологии заболеваний пищеварительного тракта с позиции участия в их формировании повреждения мукозального барьера. Неотъемлемой частью и центральным регулятором мукозального барьера является микробиота [7]. Установлено, что нарушение целостности мукозального барьера и изменение состава кишечной микробиоты повышают восприимчивость слизистой оболочки кишечника к повреждающему действию различных агрессивных факторов, в т.ч. лекарственных препаратов [2, 8].
Нестероидные противовоспалительные препараты, антиагреганты и антикоагулянты
Среди всего многообразия лекарственных препаратов, которые могут вызывать поражение органов пищеварительного тракта, лидирующее место занимают НПВП.
Нестероидные противовоспалительные препараты были и остаются самым популярным классом обезболивающих средств. На российском фармакологическом рынке имеется широкий выбор НПВП – порядка 30 лекарственных молекул, многие из которых представлены десятками генериков. При этом ряд НПВП относятся к безрецептурным, а следовательно, доступны массе лиц, о чем можно судить по объему их реализации. Так, по данным Росстата, только за 2022 г. в России было продано 125 млн упаковок различных НПВП [9].
Анальгетический и противовоспалительный эффект НПВП реализуется за счет ингибирования фермента циклооксигеназы (ЦОГ), участвующей в распаде арахидоновой кислоты до простагландинов, простациклина и тромбоксана. Известно две изоформы фермента ЦОГ: ЦОГ-1 и ЦОГ-2. Поражение слизистых оболочек пищеварительного тракта объясняется блокадой ЦОГ-1 и снижением синтеза защитных простагландинов (простагландин Е2, простациклин) [10]. Большинство НПВП являются неселективными ингибиторами как ЦОГ-1, так и ЦОГ-2. Считается, что селективные ингибиторы ЦОГ-2 (целекоксиб, эторикоксиб) в меньшей степени вызывают поражение слизистых оболочек. Однако следует отметить, что селективность в отношении ЦОГ-2 не есть понятие абсолютное и не исключает повреждающего действия даже «высокоселективных» препаратов.
Широкий спектр побочных эффектов, характерный для НПВП, особенно при бесконтрольном их применении, побудил экспертов Ассоциации ревматологов России, Российского общества по изучению боли, Российской гастроэнтерологической ассоциации, Российского научного медицинского общества терапевтов, Ассоциации травматологов-ортопедов России, Российской ассоциации паллиативной медицины к созданию клинических рекомендаций по рациональному использованию НПВП с целью снижения частоты потенциально опасных «класс-специфичных» осложнений [9].
Наиболее изученным НПВП-индуцированным поражением пищеварительного тракта является поражение слизистой оболочки желудка и двенадцатиперстной кишки. Показано, что длительный прием НПВП повышает риск развития язвы желудка в 3–4 раза и с ним связаны не менее 40–50% кровотечений из верхних отделов желудочно-кишечного тракта, требующих хирургического или эндоскопического гемостаза [9–12]. При этом установлено, что частота НПВП-индуцированного поражения кишечника сопоставима с частотой гастропатии (см. таблицу) [9]. Тем не менее осведомленность врачей об НПВП-индуцированной энтеро- и колопатии остается крайне низкой, и на практике при необходимости назначения НПВП все сводится лишь к профилактике поражения гастродуоденальной зоны.
Основными критериями НПВП-гастропатии являются хронологическая связь с приемом препарата, зачастую отсутствие клинических проявлений и манифестация язвенным кровотечением, наличие острых множественных эрозий, как правило в антральном отделе желудка, фовеолярная гиперплазия слизистой оболочки, отсутствие воспалительного вала вокруг язвенного дефекта, быстрое заживление после отмены препарата [13].
К сожалению, при приеме НПВП имеется риск повреждения не только слизистой оболочки верхних отделов пищеварительного тракта, но и кишечника, что было показано в ряде крупных рандомизированных клинических исследований, проведенных после появления метода капсульной эндоскопии [10, 14, 15].
Механизмы, посредством которых НПВП повреждают кишечник, не совсем понятны. Безусловно, они отличаются от тех, которые реализуются в верхних отделах пищеварительного тракта. Повреждающее действие НПВП на слизистую оболочку кишечника может быть опосредовано прямым токсическим эффектом после перорального приема, рецидивирующим токсическим эффектом, обусловленным энтерогепатической рециркуляцией препарата, и системным эффектом после этапа кишечной абсорбции. Известно, что НПВП увеличивают проницаемость кишечника, вызывая развитие т.н. феномена дырявой кишки, в результате чего токсины, бактерии, желчные кислоты, секрет поджелудочной железы из просвета кишки могут проникать под слизистую оболочку и вызывать воспалительные реакции с формированием эрозивно-язвенных дефектов (см. рисунок) [10, 13].
Предполагается участие кишечной микробиоты в появлении повреждений слизистой оболочки кишечника. В эксперименте введение Lactobacillus acidophilus и Bifidobacteria adolescentis уменьшает вызванное НПВП изъязвление подвздошной кишки, а пробиотическая смесь VSL#3 поддерживает нормальные уровни кальпротектина у здоровых добровольцев, получающих индометацин [16]. Также у пациентов, получающих Lactobacillus casei и низкие дозы аспирина, были отмечены значительно меньшие размеры эрозий слизистой оболочки тонкой кишки [17].
Морфологическая картина и степень выраженности поражения кишечника зависят как от самой молекулы НПВП, так и от состояния пациента: возраста, сопутствующей патологии, приема других лекарственных препаратов [14, 15, 18].
Несмотря на то что НПВП-индуцированным поражениям кишечника клиницистами не уделяется должного внимания, они могут стать причиной острых и жизнеугрожающих осложнений, таких как кровотечение, перфорация или кишечная непроходимость [9–12].
Отсутствие должной осведомленности врачей о поражении кишечника на фоне приема НПВП связано прежде всего с тем, что ни НПВП-энтеро-, ни НПВП-колопатия не имеют характерных клинических или эндоскопических признаков. Наиболее часто НПВП-энтеропатия сопровождается скрытой кровопотерей и развитием хронической железодефицитной анемии, которая усугубляет течение кардиоваскулярных заболеваний, бронхолегочной патологии, повышает риск тромбоэмболических осложнений. Реже встречается НПВП-энтеропатия, сопровождающаяся потерей белка и гипоальбуминемией [9, 10]. Иногда первым проявлением НПВП-энтеропатии становится кровотечение или перфорация тонкой кишки [2, 9, 10].
По данным видеокапсульной эндоскопии, в большинстве случаев НПВП-энтеропатия проявляется наличием геморрагий, эрозий на слизистой и небольших (до 3–5 мм в диаметре) неглубоких язв [9, 13]. Единственным патогномоничным признаком поражения тонкой (реже толстой) кишки, ассоциированным с длительным применением НПВП, считается формирование циркулярных, диафрагмоподобных стриктур в исходе хронического воспалительного процесса с выраженной лимфогистиоцитарной инфильтрацией и фиброзом. Данные стриктуры чаще локализуются в подвздошной кишке и могут стать причиной кишечной непроходимости [9, 10, 19].
При НПВП-индуцированной колопатии в патологический процесс обычно вовлекаются правые отделы толстой кишки. Проявления НПВП-индуцированной колопатии могут варьироваться от острого воспаления и эрозивно-язвенных дефектов до хронического колита с развитием фиброза и стриктур [2, 3]. Показано, что приблизительно 3–10% вновь диагностированных колитов ассоциированы с применением НПВП [20]. Тяжесть поражения слизистой оболочки толстой кишки безусловно зависит от длительности приема препарата, при этом НПВП-индуцированный колит может развиваться уже через несколько дней от начала приема [21]. Установлено, что развитие эрозивно-язвенных поражений толстой кишки одинаково часто встречается как при пероральном, так и при парентеральном способе введения НПВП. Использование ректальных суппозиториев нередко сопровождается поражением слизистой оболочки прямой кишки [2, 20, 21]. В литературе описано даже формирование стриктур прямой кишки в результате длительного использования ректальных свечей с ибупрофеном [22].
В ряде исследований показано, что НПВП повышают риск развития кровотечения и перфорации толстой кишки на фоне уже имеющейся дивертикулярной болезни [2, 3, 23]. К тому же НПВП могут играть роль триггера при лимфоцитарном и коллагенозном колите, а также провоцировать дебют или обострение ишемического колита и воспалительных заболеваний кишечника (ВЗК) [2, 13, 18]. Последнее особо актуально для пациентов, у которых ВЗК сочетаются с ревматологическими заболеваниями, такими как анкилозирующий спондилоартрит или ревматоидный артрит, часто требующими длительной противовоспалительной терапии.
Увеличение продолжительности жизни пациентов, появление новых интервенционных и хирургических методов лечения сердечно-сосудистых заболеваний (стентирование, аортокоронарное шунтирование, радиочастотная аблация, протезирование клапанов и т.д.) привело к повышению числа лиц, которым показан длительный прием антиагрегантов (ацетилсалициловая кислота) или антикоагулянтов (клопидогрел, прасугрел, тикагрелол, варфарин, ривароксабан, апиксабан, эндоксабан, дабигатран), а нередко их комбинации — двойной и тройной антитромботической терапии. Одним из главных и самых грозных побочных эффектов этих препаратов является риск возникновения гастроинтестинальных кровотечений [24]. При этом механизм поражения слизистых оболочек пищеварительного тракта на фоне приема ацетилсалициловой кислоты более понятен и сопоставим с таковым при терапии НПВП, тогда как механизм повреждающего действия антикоагулянтов в настоящее время не изучен.
Химиотерапевтические средства
Частота развития поражений кишечника на фоне проведения химиотерапии достигает 50–80% при некоторых режимах [2, 3]. Тонкая кишка более уязвима к повреждающему действию химиотерапевтических агентов, поскольку именно в ее слизистой сосредоточено наибольшее количество быстропролиферирующих клеток. Как правило, поражение кишечника, связанное с приемом химиотерапевтических средств, клинически проявляется диареей и признаками синдрома мальабсорбции.
Учитывая иммунносупрессивный механизм действия химиотерапевтических средств, нередко на фоне их применения развивается диффузный или сегментарный колит, требующий назначения глюкокортикостероидов [3, 25].
Для колита данной этиологии характерными эндоскопическими признаками являются отек, эритема, экссудация и эрозии. В некоторых случаях на фоне изъязвления может возникать перфорация толстой кишки. При морфологическом исследовании в собственной пластинке слизистой чаще всего обнаруживаются лимфоцитарные инфильтраты, богатые Т-клетками, эозинофилами и плазматическими клетками, а также нейтрофильные инфильтраты с криптитом и формированием крипт-абсцессов [25].
Риск развития и тяжесть поражения кишечника при проведении химиотерапии зависят от молекулы препарата, его дозы и схемы назначения. Наиболее часто развитие лекарственно-индуцированного поражения кишечника отмечается на фоне применения 5-фторурацила и иринотекана, широко используемых для лечения колоректального рака, а также ипилимумаба – в химиотерапии меланомы [2, 25].
Антибиотики
Известно, что антибиотики оказывают огромное влияние на качественный и количественный состав микробиоты кишечника независимо от частоты и длительности приема [26]. Многочисленные исследования подтвердили, что терапия антибактериальными препаратами у10–20% пациентов сопровождается развитием диареи вследствие снижения количества сахаролитических бактерий на фоне размножения условно-патогенных и патогенных штаммов, в т.ч. устойчивых к антибиотикам [26, 27]. Так, антимикробные агенты могут способствовать пролиферации Clostridium difficile, токсины которой оказывают прямое повреждающее воздействие на эпителиальные клетки кишечника вплоть до развития фульминантного колита и токсической дилатации толстой кишки. Как правило, инфекция Clostridium difficile возникает у пожилых пациентов, находящихся на стационарном лечении и принимающих помимо антибиотиков ингибиторы протонной помпы, иммуносупрессивные средства.
Наиболее часто развитие инфекции Clostridium difficile ассоциировано с приемом цефалоспоринов, фторхинолонов, нитрофуранов. Клинически заподозрить развитие инфекции Clostridium difficile можно по появлению абдоминальной боли и диареи, сопровождающихся выраженными симптомами интоксикации и лейкоцитозом, на фоне антибактериальной терапии или после ее завершения [28]. Диагностика колита, ассоциированного с Clostridium difficile, основывается на характерных эндоскопических и морфологических признаках (эрозивно-геморрагическое поражение, чаще локализующееся в прямой или сигмовидной кишке, формирование фибринозных пленок — псевдомембран) и выявлении токсинов Clostridium difficile А и В в кале [28, 29].
Необходимо еще раз подчеркнуть, что некоторые антибиотики, например макролиды, а также клавулановая кислота в составе бета-лактамных антибиотиков обладают способностью стимулировать мотилиновые рецепторы кишечника и приводить к диарее, не вызывая при этом поражения слизистой оболочки [2, 3].
Ингибиторы протонной помпы (ИПП)
Препараты данной группы представляют собой производные бензимидазола, оказывающие мощное ингибирующее действие на секрецию соляной кислоты париетальными клетками желудка посредством блокады фермента H+/K+-АТФазы [29].
Важно отметить, что ИПП, широко используемые для лечения и профилактики НПВП-гастропатии, напротив, повышают риск поражения нижележащих отделов пищеварительного тракта. Изменение кислотности желудочного сока при длительном приеме ИПП способствует чрезмерной бактериальной колонизации тонкой кишки с последующим развитием синдрома избыточного бактериального роста, а также нарушению состава микробиоты толстой кишки [30]. В эксперименте кислотосупрессупрессивная терапия ИПП ассоциировалась со снижением представительства актинобактерий в толстой кишке и увеличением частоты НПВП-энтеропатии [31].
Кроме того, длительное применение ИПП может приводить к изменению состава анаэробов толстой кишки и возникновению инфекции Clostridium difficile, которая ассоциируется с высокой смертностью [28]. По данным мета-анализа с включением более 300 тыс. пациентов показано увеличение относительного риска инфекции Clostridium difficile при длительном назначении ИПП в 2,79 раза, а при сочетании ИПП с антибиотиками — до 5 раз [32].
Блокаторы рецепторов ангиотензина II
В 2012 г. впервые появились данные о том, что антигипертензивный препарат олмесартан, относящийся к группе блокаторов рецепторов ангиотензина II, способен вызывать поражения кишечника, сходные с таковыми при целиакии [33]. Энтеропатия, связанная с приемом олмесартана, клинически проявляется диареей, прогрессирующим снижением массы тела, нормохромной анемией и гипоальбуминемией. Морфологическим признаком поражения кишечника данной этиологии является атрофия ворсинок тонкой кишки.
В качестве возможного механизма данного эффекта рассматривается клеточно-опосредованный иммунный ответ: олмесартан повышает уровень ангиотензина II, который способствует повышению экспрессии трансформирующего фактора роста (TGF-β), ответственного за активацию иммунной системы и повреждение слизистой оболочки кишки [34].
Диагностика и лечение поражений кишечника, связанных с приемом лекарственных средств
Клинические проявления лекарственно-индуцированного поражения кишечника нередко могут имитировать другие заболевания пищеварительного тракта – целиакию, непереносимость углеводов, функциональные гастроинтестинальные расстройства, хронический панкреатит, воспалительные заболевания кишечника, злокачественные новообразования. Учитывая это, поражения кишечника, связанные с приемом лекарственных средств, по сути являются диагнозом исключения, что требует назначения массы обследований.
Тактика ведения пациентов с лекарственно-индуцированным поражением кишечника в настоящее время не определена. При наличии выраженных клинических проявлений рекомендуются щадящая диета с ограничением или полным исключением пищевых волокон, регидратация, назначение спазмолитиков, месалазина, кишечных антисептиков, пробиотиков [2, 3]. Если это возможно, то необходимо прекратить прием препарата с потенциально повреждающим действием и назначить альтернативную молекулу. В том случае, когда отмена препарата невозможна, следует попробовать снизить дозу.
Заключение
Поражение кишечника, ассоциированное с приемом лекарственных средств, представляет собой спектр различных морфологических и функциональных изменений в результате применения тех или иных фармакологически активных соединений. Чаще всего повреждение кишечника вызывают НПВП, антибиотики, химиотерапевтические средства, ИПП, блокаторы рецепторов к ангиотензину II.
Риск развития лекарственно-индуцированного поражения кишечника и степень его повреждения определяются рядом факторов: возрастом пациента, сопутствующими заболеваниями, целостностью кишечного барьера, составом кишечной микробиоты, дозой лекарства, временем воздействия, межлекарственным взаимодействием. Отсутствие специфических симптомов и маркеров затрудняет диагностику заболевания. Постановка диагноза должна прежде всего основываться на тщательном сборе лекарственного анамнеза и исключении альтернативных причин. Ключевым диагностическим признаком лекарственно-индуцированного поражения кишечника является хронологическая связь симптомов с началом приема препарата и его отменой.
К сожалению, в настоящее время медикаментозные средства для лечения лекарственно-индуцированных поражений кишечника с доказанной эффективностью отсутствуют, также не определена тактика ведения данной когорты больных. В связи с этим особенно актуальным представляется тщательная оценка рисков развития поражений кишечника и их профилактика до начала терапии.
Источник финансирования
Статья подготовлена в рамках выполнения работ по государственному заданию Минздрава России № 056-00096-20-00.
Псевдомембранозный колит — симптомы и лечение
В основе патогенеза ПМК лежит чрезмерное размножение бактерий C. diff на фоне уменьшения или гибели нормальной микробиоты толстого кишечника. C. diff вырабатывает токсины А и В, которые вызывают воспаление в кишечной стенке. На течение заболевания влияет состояние иммунной системы пациента и патогенные свойства бактерий, такие как вирулентность, наличие токсинов А и В.
Основной путь передачи инфекции — фекально-оральный. Бактерии попадают в организм с загрязнённых поверхностей, например с дверных ручек, смесителей, ручек смыва сливного бачка, мебели или медицинского инвентаря. Также переносить инфекцию может персонал больницы и заражённые пациенты.
Бактерии C.diff образуют споры, которые устойчивы к действию антибиотиков и могут длительно сохраняться в желудочно-кишечном тракте человека, заражая окружающих и вызывая рецидивы заболевания у самого пациента [12].
Для некоторых людей C.diff — это часть нормальной микрофлоры ЖКТ, но в таком случае численность бактерий контролируется за счёт других микроорганизмов и работы иммунной системы.
Основные поражающие факторы C.diff — это выделяемые ею токсины [1]. Токсин А (энтеротоксин, белковая молекула с массой 308 кДа) влияет на секрецию жидкости, приводит к повреждению слизистой оболочки кишечника (мембран клеток) и вызывает воспалительный ответ со стороны иммунной системы.
Токсин В (цитотоксин, белковая молекула с массой от 250 до 270 кДа) в 1000 раз более цитотоксичен по сравнению с токсином А. Он вызывает распад филаментного актина — белка, поддерживающего целостность клеток. В результате клетки слизистой разрушаются и гибнут. Токсин В опасен для человека, но не приводит к воспалению и повреждению слизистой оболочки кишечника у животных.
Под действием токсинов в кишечной стенке развивается специфическое воспаление с характерными изменениями на поверхности слизистой. Она становится отёчной, разрыхляется, приобретает ярко-красный цвет, на ней исчезает сосудистый рисунок. При контакте эндоскопа со слизистой капельки крови не появляются. Наблюдается множество желтовато-белых бляшек диаметром 3–5 мм, которые плотно фиксированы к слизистой оболочке. При взятии биопсии они отрываются с трудом, торцом эндоскопа не снимаются. Преобладает два типа воспалительных реакций: диффузно-катаральное воспаление слизистой и очаги фибриноидного некроза — бело-жёлтые бляшки, или псевдомембраны, поэтому такой тип колита называется псевдомембранозным.
В биоптатах, полученных из воспалительно-изменённых участков слизистой, выявляют скопление иммунных клеток крови и слизистой, расширение капилляров и некроз клеток покровного эпителия [1].
В биоптатах, взятых из бляшек, присутствует фибрин, обрывки некротизированного покровного эпителия, слизь, лейкоциты, плазматические клетки и колонии бактерий.
Чтобы определить патогенность клостридий, нужно выявить их токсины. Посев биоптатов на питательные среды удовлетворительных результатов не даёт. Метод в данном случае затратен и неинформативен, поэтому токсины C. diff определяют в кале.
Воспалительный процесс, как правило, захватывает несколько отделов толстого кишечника, но чаще поражена его прямая и сигмовидная часть, реже вовлекается вся толстая кишка. Протяжённость её поражения связана с тяжестью течения заболевания: чем больше толстого кишечника вовлечено в воспалительный процесс, тем тяжелее протекает колит и ярче симптомы.
Продолжительное воспаление в кишечной стенке приводит к следующим нарушениям:
- не всасывается жидкость, из-за чего развивается обезвоживание;
- потери крови из образующихся эрозий и язв приводят к анемии;
- кишечная стенка становится проницаемой для токсинов возбудителя и продуктов его жизнедеятельности, находящихся в просвете кишки, из-за чего нарастает общая интоксикация.
При тяжёлом течении прекращается перистальтика толстого кишечника, развивается токсический мегаколон и возникает полиорганная недостаточность, из-за чего пациент может погибнуть.
ГАСТРОЭНТЕРОЛОГИЯ
W. Hart
К
олит может быть одним из побочных проявлений лечения антибиотиками. Однако показано, что лечение с помощью иммуноподавляющих средств, таких как золото, нестероидные противовоспалительные средства и нейролептики, также способно вызвать это заболевание. Острота колита может меняться от слабой диареи до тяжелой формы фибринозного колита. Часто главной причиной этого заболевания оказывается Clostridium difficile. D. Zehnder и соавт. исследовали частоту возникновения колита, связанного с антибиотиками, в 3 отделениях внутренних болезней в госпитале St. Gallen, Берн, Швейцария. За период с 1974 по 1991 г. они провели ретроспективное изучение медицинских данных 31 367 пациентов (42920 обращений) в связи с побочными реакциями на лекарственные препараты. Исследователи проанализировали данные по этим пациентам, отбирая все диагнозы колита, связанного с антибиотиками: фибринозный колит, геморрагический колит и более мягкая форма колита. Из этой группы пациентов 38% (16 150 пациентов) получили во время пребывания в госпитале по меньшей мере одно систематически вводимое антибактериальное лекарство. Были обнаружены только 9 пациентов с одним периодом колита, вероятно, связанным с приемом антибиотика. Из них в 5 случаях только одно лекарство, применяемое во время пребывания в госпитале, могло иметь к этому отношение. У 2 пациентов был фибринозный колит, 2 пациента страдали от геморрагического колита после лечения антибиотиками и у 5 была мягкая форма колита. В 4 случаях был проведен поиск токсина Clostridium difficile, который обнаружили у 2 пациентов. У одного пациента была получена культура C. difficile. У 4 пациентов при эндоскопии наблюдали типичную картину колита, связанного с применением антибиотиков. Одному пациенту пришлось выполнить гемиколэктомию в связи с перфорацией. Один больной умер из-за основной болезни, остальные 8 пациентов выздоровели. Кроме того, в госпиталь поступили еще 32 пациента с колитом, вызванным антибиотиками, из-за лечения такими же группами лекарств до поступления в госпиталь. Учитывая особенности воздействия антибиотиков, у 9 пациентов с колитом, вызванным антибиотиками, и сравнивая с другими пациентами, получавшими антибиотики во время пребывания в госпитале, была проведена оценка частоты возникновения колита в зависимости от группы антибиотиков, у 1000 пациентов, которая составила:
- для всех антибактериальных химиотерапевтических препаратов 0,6%o;
- для всех пенициллинов 0,6%o;
- для аминопенициллина или его аналогов с добавлением clavulanic acid или без нее 0,6%o;
- для цефалоспоринов 1,4%o;
- при применении сульфаниламидов в сочетании с триметропримом или связанным с ним веществами (получали 5077 пациентов) и фторхинолонов (получали 1043 пациента) не наблюдалось ни одного случая колита;
- при применении аминогликозидов (получали 1864 пациента) наблюдали только 1 случай колита, связанного с антибиотиком, но были еще 2 других антибиотика, с которыми также мог бы быть связан колит.
Частота диареи, продолжающейся по меньшей мере 2 дня, составила от 2 до 12% у пациентов, получавших одни и те же группы лекарств во время пребывания в госпитале. Авторы рекомендуют прекращать лечение антибиотиками у пациентов с колитом, вызванным антибиотиками, и лечить таких пациентов метронидазолом или ванкомицином. Для пациентов, которым невозможно прекратить лечение антибиотиками, необходимо подобрать антибактериальное химиотерапевтическое средство с минимальным риском вызвать колит.
Литература:
Zehnder D, KЯnzi UP, Maibach R, Zoppi M, Halter F, Neftel KA, et al. Die HКufigkeit der Antibiotika-assoziierten Kolitis bei Hospitalisierten Patienten der Jahre 1974-1991 in «Comprehensive Hospital Drug Monitoring» Bern/St Gallen. Schweiz Med Wochenschr 1995;125:676-83.
ВЛИЯНИЕ ПОДАВЛЕНИЯ КИСЛОТЫ НА ЭФФЕКТИВНОСТЬ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ HELICOBACTER PYLORI
E. Bosch
А
нтибактериальная терапия Helicobacter pylori (H. pylory) является главным методом лечения пептической язвы. Существуют разные способы эффективного лечения: десятидневный курс применения одного антибиотика (amoxycillin или clarithromycin) или сочетание антибиотиков (тетрациклин, амоксициллин, метронидазол) с цитратом коллодийного висмута или без него. Поскольку расположение H. pylori под слизистой желудка препятствует необходимому доступу антибиотиков, другой подход, облегчающий доступ к бактериям, состоит из сочетания двух антибиотиков с протоно-насосным ингибитором (омепразолом) или антагонистами H2-рецепторов, которые подавляют секрецию кислоты. Омепразол, вероятно, воздействует на распределение H. pylori внутри желудка. В связи с различиями в побочных действиях, резистентности к антибиотикам, безопасности, эффективности и в зависимости от соблюдения пациентами режима возникают разногласия относительно наиболее эффективного лечения. De Boer и соавт. исследовали возможность сочетания антибиотиков с омепразолом улучшить результаты тройной терапии. Между июнем 1993 г. и апрелем 1994 г. 108 последовательно поступавшим в один центр пациентам с пептической язвой и инфекцией H. pylori, подтвержденной биопсией, по случайной выборке провели семидневную тройную терапию омепразолом (20 мг 2 раза в день) или без него. Омепразол давали с 1-го по 10-й день; тройная терапия проводилась с 4-го по 10-й день: субцитрат коллодийного висмута (120 мг 4 раза в день), тетрациклин (500 мг 4 раза в день) и метронидазол (500 мг 3 раза в день); такая же тройная терапия, но без омепразола, проводилась с 1-го по 7-й день. Всего у 98 (90,7%) из 108 пациентов H. pylori были уничтожены, что определялось с помощью 10 эндоскопических биопсий для мочевинного теста, гистологии и 4-6- недельной культуры после лечения. Резистентность к предварительному лечению метронидазолом была довольно редкой (7,7%). Различие в эффективности между двумя группами составило 14,8%; с омепразолом были излечены 98,1%, без омепразола — 83,3% пациентов. Терапия была единственным фактором, связанным с излечением пациентов; курение или пол не влияли на успех лечения. Три пациента прекратили прием омепразола из-за тошноты и рвоты. У 16 и 54 пациентов в группе, принимавшей омепразол, а также у 14 из 54 больных из другой группы не было побочных проявлений. Рвота случалась гораздо реже в группе, получавшей омепразол. Другими побочными проявлениями в группе, получавшей омепразол, были головная боль, жжение во рту, озноб, усталость и вагинальный монилиаз; в другой группе было больше пациентов, жалующихся на кожные высыпания, повышенное потоотделение, эпигастральную насыщенность и изжогу. Оказалось, что добавление омепразола повышает эффективность борьбы с метронидазолрезистентными штаммами, ослабляет побочные проявления и приводит к высокому уровню излечивания. Такая высокая эффективность лечения предполагает отсутствие необходимости в диагностическом тесте излечения.
Литература:
De Boer W, Driessen W, Jansz A, Tytgat G. Effect of acid suppression on efficacy of treatment for Helicobacter pylori infection. Lancet 1995;345:817-20.
ЛИКВИДАЦИЯ HELICOBACTER PYLORI С ПОМОЩЬЮ ОМЕПРАЗОЛА В СОЧЕТАНИИ С ДВУМЯ АНТИБИОТИКАМИ
W. Hart
P
orro и соавт. исследовали синергическое воздействие омепразола в сочетании с амоксициллином и метронидазолом на H. pylori, рецидивы язвы двенадцатиперстной кишки и развитие гастрита за 1 год наблюдения. Критерием включения в исследование служила по крайней мере одна активная, эндоскопически доказанная язва двенадцатиперстной кишки и обнаружение H. pylori при исследовании биоптата с помощью теста на уреазу и гистологии. Исследование проводили в течение 4 нед лечения и 1 года наблюдения с применением двойного слепого метода, плацебоконтролированного метода параллельно основной группе. После эндоскопии пациентов лечили только омепразолом (по 20мг/сут) в течение 1 нед. Затем 91 пациенту (группа А) назначали омепразол и метронидазол (250 мг 4 раза в день) + амоксициллин (1 г 3 раза в день) или омепразол + плацебо (92 пациента, группа Б). Затем лечили только омепразолом в течение еще 1 нед. Эндоскопию проводили при поступлении и после 1 мес терапии. Вылеченные пациенты проходили эндоскопию через 2, 6 и 12 мес после терапии или при появлении признаков рецидива. С точки зрения демографических характеристик обе группы были одинаковые (возраст, пол, курение, употребление алкоголя, продолжительность язвенной болезни). 86 пациентов из двух групп завершили исследование на 29-й день. Язва зажила у 97,6% пациентов группы А и у 93,0% группы Б (различие незначительное). Гистологическое обследование, направленное на определение H. pylori, проводилось через 2 мес после окончания лечения у 79 пациентов группы А и у 72 пациентов группы Б. H. pylori не обнаружены у 89,8% пациентов группы А и у 1,4% — группы Б (p < 0,001). В течение 12 мес наблюдения рецидивы язвы двенадцатиперстной кишки возникли у 4 (6%) из 63 пациентов группы А , у которых H. pylori были ликвидированы, у 4 (50%) из 8 пациентов группы А, у которых H. pylori сохранялись, и у 52 (80%) из 65 пациентов группы Б постоянно положительных в отношении H. pylori. Многовариантный анализ, проведенный у 164 пациентов с язвой двенадцатиперстной кишки, зажившей в конце лечения, показал, что риск рецидива был в 9,4 раза выше у пациентов, которых лечили одним омепразолом, по сравнению с леченными омепразолом в сочетании с антибиотиками. Возраст, пол, курение, употребление алкоголя, продолжительность язвенной болезни и предшествующие осложнения не оказывали значительного влияния на заживление язвы или ее рецидив. Быстрое, полное и устойчивое подавление активности гастродуоденита и поражений эпителия желудка наблюдалось у большинства пациентов группы А, у которых ликвидировали H. pylori. У пациентов группы Б наблюдалось временное снижение бактериальной колонизации и воспаления в полости и обострение гастрита. У 11 пациентов группы А и 7 пациентов группы Б имели место побочные эффекты. Это исследование, несомненно, доказывает, что сочетание омепразола с амоксициллином и метронидазолом является высокоэффективным методом лечения H. pylori и предотвращения рецидивов язвы.
Литература:
Porro GB, Lazzaroni M, Bargiggia S, Maconi G, Trespi E, Pereego M, et al. Omeprazole coupled with two antibiotics for Helicobacter pylori eradication and prevention of ulcer recurrence. Am J Gastroenterol 1996;91:695-700.
Антибиотики
Медикаментозное лечение болезни Крона и язвенного колита (являющихся частью группы воспалительных заболеваний кишечника – ВЗК) преследует две основные цели:
- Достижение ремиссии (отстутствие симптомов и воспаления в пораженной части желудочно-кишечного тракта)
- Поддержание ремиссии (предупреждение обострений).
Эти цели необходимо достичь с минимальным количеством побочных эффектов и с наименьшим возможным риском. Для этого задачей лечения является контроль воспаления в кишечнике – причины симптомов ВЗК.
Для лечения обострений ВЗК часто применяются антибиотики, хотя не было обнаружено инфекционных агентов, являющихся причиной этих заболеваний. По мнению многих исследователей, антибиотики помогают контролировать симптомы ВЗК, ослабляя кишечные бактерии и непосредственно подавляя иммунную систему кишечника. Также антибиотики могут быть эффективны при долгосрочном лечении пациентов(ок) с ВЗК (причем, это относится в большей степени к пациентам с болезнью Крона, нежели чем к больным язвенным колитом), особенно, если у них образовались свищи (каналы, соединяющие прилежащие петли кишку или кишку с другим органом, например, с кожей) или рецидивирующие асбцессы (скопления гноя).
Симптомы инфекций могут быть очень похожи на симптомы обострения, поэтому необходимо сделать анализ кала паразитов, в частности, на наличие кишечной лямблии, и на дисбактериоз, в особенности на наличие бактерии Clostridium difficile (с.diff), которая чаще возникает у больных ВЗК. Такие инфекции быстро лечатся с помощью антибиотиков, в состав которых входит метронидазол или ванкомицин. Новым антибиотиком для лечения c.diff является фидаксомицин.
Пероральные препараты
Хотя многие антибиотики являются эффективными при борьбе с ВЗК, чаще всего выписывают:
- Метронидазол (Флагил®)
- Ципрофлоксацин (Ципро®)
- Рифаксимин (Ксифаксан®)
И метронидазол, и ципрофлоксацин являются антибиотиками широкого спектра действия, направленные на большой диапазон бактерий как внутри, так и снаружи кишок. Рифаксимин же не всасывается и поэтому оказывает непосредственное влияние только на бактерии желудочно-кишечного тракта. Метронидазол является самым активно изучаемым антибиотиком при лечении ВЗК. Являясь основным медикаментом при лечении обострений болезни Крона, действие этого препарата сильнее действия плацебо (пустышек) и соответствует сульфасалазину – особенно, когда болезнь поражает толстую кишку.
Метронидазол также снижает риск рецидива в течение первых трех месяцев после резекции подвздошной кишки. Метронидазол эффективен при лечении болезни Крона с поражением области промежности, как было выявлено у 50% пациентов.
Антибиотики часто нахначают пациентам, у которых возникает резервуарит (паушит) – воспаление сформированного из подвздошной кишки резервуара – при операции по формированию тонкокишечного резервуара с илеоанальным анастомозом. При такой операции, после удаления толстой кишки, из подвздошной кишки (нижнего отдела тонкой кишки) пациента(ки) формируют внутренний резервуар, предотвращая необходимость использования внешнего приспособлений (калоприемника). Иногда резервуар сильно воспаляется – такое воспаление и называется резервуарит. Ципрофлоксацин, метронидазол и рифаксимин успешно применяются в лечении резервуарита. Согласно общепризнанным исследованиям, предотвращению рецидива резервуарита способствует прием пробиотика VSL#3 после курса лечения рифаксимином.
Альтернативые способы применения
И метронидазол, и ципрофлоксацин могут при необходимости вводиться внутривенно, и продаются в ампулах. Рифаксимин применяется только перорально.
Побочные эффекты
Метронидазол: распространенными побочными эффектами являются тошнота, рвота, потеря аппетита, появление «металлического» привкуса во рту, диарея, головокружение, головные боли, окрашивание мочи (в темно-коричневый или красно-коричневый цвет). Другим побочным эффектом, возникающим вследствие долгосрочного приема медикамента, является дрожь в руках и ногах, которая может продолжаться даже после отмены препарата.
Ципрофлоксацин: побочные действия включают головные боли, тошноту, рвоту, диарею, боль в животе, сыпь, беспокойство – и являются редкими. Также наблюдались случаи тендинита (боли и воспаления сухожилий), в частности, поражающего ахиллово сухожилие (соединяющее икроножную мышцу с пяточной костью) и разрыва сухожилий.
Рифаксимин: побочные эффекты проявляются редко, но могут включать тошноту, боль в животе, головокружения, усталость, головные боли, напряженность мышц и боль в суставах.
Взаимодействие с другими препаратами
Пациентам, принимающим одновременно несколько препаратов (по рецепту или безрецептурных) нужно внимательно изучить взаимодействие медикаментов между собой. Такое взаимодействие может уменьшить эффективность лекарственных средств, усилить действие препарата или спровоцировать необычные побочные эффекты. Перед приемом любых препаратов, необходимо тщательно ознакомиться с инструкцией. Необходимо поставиьт врача в известность обо всех принимаемых средствах (включая безрецептурные препараты, добавки и альтернативные лекарственные средства), а также обо всех имеющихся у пациента(ки) заболеваниях.
Дополнительная информация
Метронидазол ослабляет распад спирта в организме, и это может привести к тошноте и рвоте. Поэтому необходимо избегать алкоголь в любой форме во время курса лечения этим препаратом, а также как минимум в течение как минимум двух дней после принятия последней дозы.
Ципрофлоксацин может взаимодействовать с антацидами (например, Ролаид, Тамс), что снижает его эффективность. Скорее всего, врач порекомендует не принимать эти два медикамента одновременно. Аналогичное взаимодействие наблюдается с витаминными и минеральными добавками, содержащими кальций, железо или цинк.
Если вы беременны, сообщите об этом врачу перед тем, как принимать метронидазол или ципрофлоксацин. Их часто прописывают беременным пациенткам, но все же рекомендуется сначала проконсультироваться с врачом. Несмотря на то, что рифаксимин плохо всасывается, его обычно не выписывают беременным.
Во время лечения ципрофлоксацином избегайте нахождения на солнце. Пользуйтесь солнцезащитным кремом днем и воздержитесь от посещения солярия.
Антибиотики плохо взаимодействуют с антикоагулянтами, такими как варфарин (Кумадин®), чрезмерно уменьшая свертываемость крови и увеличивая риск возникновения кровотечения. Может потребоваться изменение дозы варфарина. О том, что вы принимаете варфарин, необходимо сообщить врачу, который прописывает вам антибиотики.
Узнавайте как можно больше информации от врачей. Также можно воспользоваться достоверными интернет-ресурсами, веб-сайтами фармацевтических компаний.
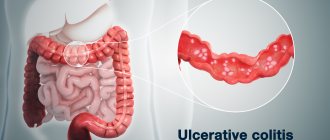
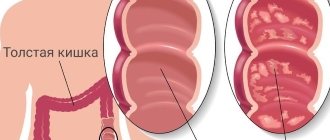
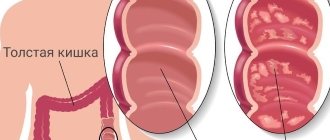
Язвенный колит
- Назад в раздел «Проктология и колопроктология»
Язвенный колит или неспецифический язвенный колит (НЯК)
– хроническое заболевание толстой кишки, характеризующееся иммунным воспалением ее слизистой оболочки. При язвенном колите поражается только толстая кишка, а воспаление никогда не распространяется на тонкую.
Причины заболевания
Причины заболевания до сих пор не выяснены. Ученые предполагают, что различные факторы вызывают нарушение иммунного ответа, что и приводит к заболеванию.
Из разнообразия причин, которые могут вызвать болезнь, выделяются самые распространенные:
- употребление пищи богатой углеводами и бедной пищевыми волокнами;
- психические травмы и стрессы;
- малоподвижность; дисбактериоз.
ВАЖНО!
При жидком стуле с примесью крови, гноя и слизи, при сильной боли в животе (чаще слева), при снижении аппетита, потере веса, слабости, болях в суставах необходимо
СРОЧНО!
обратиться к
врачу-колопроктологу
и
гастроинтерологу!
Симптомы
Язвенный колит может протекать с периодами обострения и ремиссией. Его тяжесть варьируется от легкой до средней степени тяжести и тяжелой.
Легкая и средняя степень
тяжести обозначена общими симптомами:
- слабостью;
- недомоганием;
- повышением температуры;
- частым стулом со сгустками крови;
- в животе отмечаются схваткообразные боли.
При тяжелом течении болезни
температура повышается до 38 и выше градусов. При этом:
- бледнеют кожные покровы,
- развивается анемия;
- появляется тахикардия;
- часто кружится голова;
- усиливается слабость;
- отмечается частый стул (более 6 раз за сутки) с кровью;
- кровь выделяется сгустками; перед дефекацией сильные боли схваткообразного характера.
Виды язвенного колита
- При спастическом колите
наблюдается вздутие живота, спазмы, работа кишечника нарушается. Это не тяжелое заболевание, а больше функциональное расстройство, которое может случиться вследствие стресса, нервного перевозбуждения и усталости. - При хроническом колите
кишечника происходят воспалительные процессы, со строфическими и дистрофическими изменениями слизистой оболочки в толстой кишке. Они могут сопровождаться нарушениями секреторного и моторного типа. Причины болезни известны – это инфекционные заболевания, такие как дизентерия (сальмонеллы и шигеллы), токсические вещества, воздействие лекарственных препаратов. - Колит острый
, когда воспаляется слизистая оболочка тонкой кишки или желудка. Причинами могут являться вирусные инфекции, пищевые небактериальные отравления, токсические вещества. Возбудителями острого колита считается бактериальная дизентерия (шигеллы, сальмонеллы). - Псевдомембранозный колит —
острое заболевание толстой кишки, считается тяжелым заболеванием. Оно может развиться вследствие осложнения антибактериальной терапии. Больные в 10-20% имеют резистентность Clostridium difficile к антибиотикам, которая и подавляет кишечную микрофлору. Своевременное диагностирование позволит вовремя отменить антибиотик, вызывающий диарею. - При эрозивном колите
(воспалительные процессы оболочки 12-перстной кишки, которая прилегает к желудку) может повлечь образование язв. - Ишемический колит
(воспаление в ЖКТ) вызывается поражением сосудов, которое ведет к некрозу тканей. - Колит коллагеновый
— это диффузное увеличение числа межэпителиальных лимфоцитов, что со временем приводит к трансформации в коллагеновый лимфоцитарный колит. - При алкогольном колите
у больного развивается хронический панкреатит и нарушается жировой обмен, потому это заболевание вторично. Алкоголь, воздействуя на флору толстой кишки, делает ее болезнетворной. Когда человек перестает пить, колит исчезает. - Неспецифическим язвенным колитом
считается диффузное воспаление слизистой оболочки ободочной и прямой кишки (толстый отдел кишечника). Заболевание хроническое и тип иммунной природы – рецидивирующий. - Болезнь в виде атонического колита
грозит людям пожилого и старческого возраста. Из-за запоров, которые приводят к геморрою, резко понижается двигательная функция кишки. 1 - При геморрагическом колите
заболевание выражается острой кровавой диареей, которая вызвана эшерихией коли. Ее грамотрицательные штаммы повреждают эндотелий кровеносных сосудов и сходно с дизентерией. - При лучевых (радиационных) поражениях
организма, которые вызваны ионизирующим излучением, развивается поражение кишечника. Однако клинические симптомы не всегда выражаются в острой форме повреждения его слизистой оболочки. - Колиты дистальный и левосторонний
характеризуются воспалительным процессом 30-40 сантиметров толстой кишки. Когда воспаление достигнет селезеночного угла, колит называется левосторонним.
Обследование и диагностика
Лабораторные исследования язвенного колита включает:
- общий анализ крови (оценка степени кровопотери, выраженность анемии);
- анализ крови на свертываемость; анализ крови на кровоточивость.
Как ключевой инструментальный метод
исследования является фиброколоноскопия, позволяющая точно диагностировать вид колита и сделать оценку степени поражения слизистой кишки. Гибкий аппарат вводится через анальное отверстие в просвет кишки. К обследованиям относится и стандартный набор исследований, который необходим для госпитализации на стационарное лечение. Учитывая то, что при обострении язвенного колита колоноскопия затруднительна (воспалительные изменения кишки, опасность перфорации) проводят ирригоскопию. Метод безопасный, но менее информативный. Для диагностики осложнения колита, на брюшной полости показана обзорная рентгенография без контрастных средств – перфорация ободочной кишки.