Роль нормальной микрофлоры в защите репродуктивного тракта женщин
Исследование микрофлоры репродуктивного тракта женщин имеет давнюю историю. Первопроходцами в изучении вагинальной микрофлоры были В.В. Строганов, А. Додерлейн, именно они показали ее значение в защите репродуктивного тракта женщин от потенциальной инфекции.
В.В. Строганов в своей докторской диссертации «Бактериологические исследования полового канала женщины в различные периоды ее жизни» писал: «Анатомические особенности женского полового канала создают условия для развития бактерий… Патогенные бактерии ослабляются в своей заразной силе, находясь во влагалище… Микробы влагалища уничтожают их».
В процессе эволюции сформировалась оптимальная и слаженная система защиты репродуктивного тракта женщин от патогенов. Одна из ключевых ролей в этой системе принадлежит колонизационной резистентности — совокупности механизмов, придающих индивидуальную и анатомическую стабильность нормальной микрофлоре, обеспечивающих предотвращение заселения организма-хозяина посторонними микроорганизмами и включающих специфические факторы локального иммунитета и нормальную микрофлору [1].
Резидентную флору принято подразделять на облигатную и факультативную. Облигатные микроорганизмы играют значительную роль в защите репродуктивной системы от возбудителей инфекционных заболеваний и постоянно присутствуют во влагалище здоровой женщины [1, 2]. Факультативные микроорганизмы встречаются достаточно часто, но не постоянно. К транзиторной флоре, привнесенной извне, относятся непатогенные, условно-патогенные микроорганизмы и облигатные патогены. Лактобактерии преобладают у 96% здоровых женщин и являются основными представителями облигатной микрофлоры, выполняют защитную функцию, которая связана с колонизирующей способностью и непосредственной антимикробной активностью [2, 3]. Лактобациллы, будучи плотно адгезированы на эпителиоцитах влагалища, являются неотъемлемой частью экологического барьера, блокируя рецепторы клеток слизистой оболочки, необходимые для адгезии болезнетворных микроорганизмов [3]. Lactobacillus spp.
маловирулентны, однако исследования последних лет показывают, что при определенных условиях они могут вызвать инфекционный процесс. В литературе описаны немногочисленные случаи ассоциации
Lactobacillus spp.
с развитием поражений нижнего и верхнего отделов репродуктивного тракта [4]. Лактобациллы должны быть функционально активны, т. е. обладать способностью к продукции перекиси водорода. Только в этом случае можно говорить о полноценной стабилизирующей функции микробиоценоза во влагалище [5, 6]. На уровень кислотности вагинального отделяемого влияет не только концентрация и функциональная активность лактобациллярной флоры, но и наличие в избытке других факультативных и транзиторных микроорганизмов. Присутствие анаэробной флоры, такой как
Gardnerella vaginalis
,
Bacteroides spp., Peptococcus spp., Mycoplasma hominis, Mobiluncus spp.,
может привести к резкому снижению кислотности влагалища и развитию дисбиотического процесса [6, 7]. Например, сопоставление данных клинической картины с результатами культуральной диагностики и состоянием микроценоза влагалища выявило состояние, характерное для цитолитического вагиноза у 36,54% обследованных женщин, при этом выявлены были лишь лактобактерии [8]. Микробиологические исследования у пациенток с различными клиническими диагнозами показали, что цитолитический вагиноз наиболее часто сопровождает эктопию шейки матки [8].
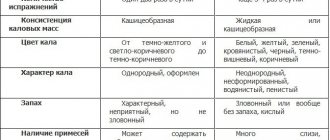
Стадии дисбактериоза
В зависимости от степени развития заболевания стоматологи различают четыре стадии дисбактериоза:
- Латентную. Для первой, скрытой стадии, характерны едва заметные изменения количества микроорганизмов одного штамма. Пациент чувствует себя хорошо и не ощущает никаких симптомов воспаления.
- Субкомпенсированную. Снижается количество лактобактерий, болезнь имеет размытую картину. Пациент может ощущать дискомфорт в полости рта, но не всегда понимает, что это именно дисбактериоз.
- Патогенную. В минимальном количестве в полости рта наблюдаются лактобактерии. Ротовую полость начинает заселять факультативная болезнетворная среда.
- Декомпенсированную. Помимо выраженного воспаления во рту происходит неконтролируемый рост дрожжеподобных грибов. Нарушается работа слюнных желез, а во рту возникает неприятный привкус и жжение.
Для запущенных форм дисбактериоза характерны такие симптомы, как:
- воспаление десен и слизистых;
- налет на зубах и поверхности языка;
- кровоточивость десен;
- язвочки и пузырьки на слизистых;
- повышение температуры тела;
- отечность и болезненность языка;
- сухость кожи, «заед» в уголках рта.
Роль облигатных патогенов в развитии дисбиоза влагалища
По обновленным в 2015 г. данным ВОЗ, ежедневно 1 млн человек приобретают инфекции, передаваемые половым путем (ИППП); ежегодно 357 млн оказываются заражены одним из четырех возбудителей: Chlamydia trachomatis
(131 млн),
Trichomonas vaginalis
(143 млн),
Neisseria gonorrhoeae
(78 млн),
Treponema pallidum
(5,6 млн) [9]. В настоящее время воспалительные заболевания половых органов относят к смешанным полимикробным инфекциям, важнейшими возбудителями которых, по данным ВОЗ, являются анаэробно-аэробные ассоциации (25–60%),
N. gonorrhoeae
(25–40%),
C. trachomatis
(25–30%),
Mycoplasmaspp.
(до 45%). По мнению ряда авторов, острые воспалительные заболевания придатков матки сопровождаются выраженным дисбиозом генитального тракта и часто протекают латентно [2].
По данным Американской ассоциации акушеров и гинекологов, выделения сопровождают не более половины эпизодов гонококкового или хламидийного цервицита и до 35% трихомонадных вагинитов, что свидетельствует о реверсии клинических симптомов и может затруднять своевременную диагностику и терапию. Возможно, определенную роль в изменении клинической картины заболеваний может играть и изменение состава факультативной микрофлоры.
Так, метагеномный анализ показал, что C. trachomatis
достоверно чаще ассоциирована с микробиотой, в составе которой преобладают анаэробные бактерии, такие как
G. vaginalis, Prevotella amnii
,
Prevotella buccalis, Prevotella timonensis
,
Aerococcus christensenii
и
Variovorax guangxiensis
, присутствие этих микроорганизмов может выступать потенциальным биомаркером хламидийной инфекции [10]. Также установлено, что при хламидийной инфекции достоверно повышается продукция лактоферрина, интерлейкинов IL-6, -1α, интерферонов IFN-α и -β при очень низком уровне IFN-γ, что способствует формированию хронического воспаления, характеризующегося повышенной продукцией иммунных медиаторов, ответственных за повреждение тканей. Более того, R.T. Fortner et al. указывают на потенциальный риск развития рака яичников у пациенток с серопозитивностью к
C. trachomatis
[11].
Трихомонадная инфекция занимает лидирующее место в структуре заболеваемости ИППП и чаще всего представляет собой микст-инфекцию [9]. Одновременно с T. vaginalis
достаточно часто выявляются генитальные микоплазмы. Анализ данных 1257 женщин показал, что распространенность
M. hominis
составила 57,4%,
Ureaplasma urealyticum
— 54,9%. Из 50 пациенток с трихомониазом 76% были коинфицированы
M. hominis
, соответственно, пациентки с
T. vaginalis
имели повышенный риск инфицирования микоплазмами [12].
Трихомонадная инфекция сопровождается изменением видового состава резидентной микрофлоры с увеличением численности таких микроорганизмов, как G. vaginalis
,
Atopobium vaginae
и
Prevotella bivia
. Это клинически значимое взаимодействие указанных микроорганизмов может потребовать систематического скрининга микоплазм среди пациентов с трихомониазом для оптимального лечения ИППП [13]. Также очевидно, что трихомонады, являясь облигатными патогенами, способствуют инициации и реализации клеточного иммунного ответа с включением каскада цитокин-опосредованных реакций, индукции цитотоксичности, а характер и исход воспаления будут зависеть от спектра и уровня продуцируемых цитокинов, активности множественных протеиназ [14].
К облигатным патогенам, способным поражать урогениальный тракт, относится Mycoplasma genitalium
. Этот микроорганизм был выявлен D. Taylor-Robinson в начале 1982 г.
M. genitalium
является самой мелкой и подвижной бактерией, имеет колбообразную форму и удлиненную терминальную структуру, используемую для обеспечения скользящего движения, внедрения в слои слизи, покрывающие эпителиальные клетки, для прикрепления к поверхности клеток и проникновения в них. Способность
M. genitalium
к прикреплению к поверхности эукариотических клеток определяется рецепторами, содержащими нейраминовую кислоту, что обусловливает выраженное цитопатогенное действие и формирование клеточного воспалительного ответа [15].
В публикации 2022 г. М.Р. Mahlangu et al. указывают на взаимосвязь M. genitalium
и вируса иммунодефицита человека (ВИЧ), что было определено при обследовании 4731 пациентки [16]. Среди лиц, обследованных на ИППП, относительная распространенность
M. genitalium
у мужчин и женщин составила 8,9% и 10,6% соответственно, в то время как у ВИЧ-инфицированных пациентов частота выявления
M. genitalium
достигает 48,9%. Эта значительная разница в серопревалентности ВИЧ особенно выражена среди женщин [16].
Для пациентов с ВИЧ-инфекцией любые патогены и патобионты могут сыграть критичную роль в развитии инфекционного процесса, в т. ч. новые патогены микроспоридии, вызывающие инфекции мочевыводящих путей, протекающие чаще в субклинической форме. М. Wesołowska et al. указывают на то, что микроспоридиоз может вызвать тяжелые осложнения или смерть у иммуносупрессивных пациентов, и предлагают включить обследование на микроспоридиоз в рутинный скрининг ВИЧ-позитивных пациентов, даже при бессимптомной форме [17].
Чем вызваны бактериальные инфекции у женщин
Если обратиться к классификации бактерий, вызывающих вагинит и цервицит, можно выделить:
– аэробные, которые диагностируют у 30% пациенток. Однако в последнее время врачи говорят об увеличении количества пациенток с анаэробными инфекциями, пример – гарднерелла;
– внутриклеточные микоплазмы – уреаплазма.
При всем многообразии возбудителей стоит отметить, что почти все они являются условно-патогенными. Часто встречаются ассоциации возбудителей, каждая третья женщина с проблемами урогенитального тракта имеет от 6-10 возбудителей. Бактериальная инфекция мочевыводящих путей у женщин может иметь скрытое и\или малосимптомное течение, когда женщина длительное время может не испытывать характерного недомогания: выделений из влагалища, зуда, дискомфорта и так далее. В то же время отмечается повышение резистентности возбудителей к антибиотикам, что делает некоторые принятые ранее схемы неэффективными.
Воспалительные процессы, вызванные условно-патогенными микроорганизмами
Исследования последних лет привнесли существенные изменения в наши представления о роли условно-патогенных микроорганизмов в развитии воспалительных процессов урогенитального тракта.
В условиях современного социума прослеживается четкая тенденция к изменению этиологической структуры инфекционных заболеваний, а именно снижение удельного веса инфекций, вызываемых традиционными патогенами, и возрастающая роль условно-патогенных микроорганизмов, учащение случаев реверсии клинических признаков, сочетание мягкого клинического течения с поражением восходящих отделов мочеполового тракта, случаев осложненного течения с формированием комплекса патологических симптомов и/или синдромов, возрастающая частота микст-инфекций, когда этиологическую роль каждого из участников воспаления выделить трудно [18–22].
Симптоматика воспалительных заболеваний репродуктивного тракта определяется не только микроорганизмами, присутствующими во влагалище, но и многообразными функциональными расстройствами. По данным литературы, хроническое воспаление вызывает изменение морфологической структуры тканей, приводит к нарушению микроциркуляциии, ишемии и к снижению ее функциональной активности, тем самым усугубляя микроэкологические нарушения репродуктивной системы [23–25].
Нарушение иммунологического баланса макроорганизма приводит к неуправляемому росту микрофлоры, ее распространению за пределы определенного биотопа. Только массивное накопление микроорганизмов в очаге инфекции способно вызывать развитие инфекционного процесса. По мнению ряда авторов, такой критической массой может стать количество 103 КОЕ/мл микроорганизмов. Значительная антигенная нагрузка способствует усилению вирулентности микроорганизмов, формированию антибактериальной резистентности [24, 26].
Очевидно, что условно-патогенные микроорганизмы, являясь неотъемлемой частью вагинального биотопа, будут иначе взаимодействовать с иммунной системой человека, чем облигатные патогены, что сопровождается изменением клинической картины, когда при отсутствии явных признаков острого воспаления в патологический процесс вовлекаются верхние отделы генитального тракта и существует реальная угроза нарушений рецепторного аппарата эндометрия, формирования спаечного процесса [19, 20, 23].
Доля вагинальных инфекций неспецифической этиологии составляет не менее 40% среди всех инфекций репродуктивной системы женщин, и наиболее частыми участниками сочетанного процесса являются ассоциированные с бактериальным вагинозом (БВ) микроорганизмы: M. hominis
G. vaginalis, A. vaginae Prevotella bivia
(73,9%), грибы рода
Candida
(32,5%), вирус папилломы человека (31%) [19, 24]. Достаточно часто приходится сталкиваться с состоянием аэробного вагинита, когда происходит снижение количества лактобацилл и воспаление развивается при участии аэробных микроорганизмов, в частности
Escherichia coli, Enterococcus faecalis, Streptococcus viridans, Staphylococcus epidermidis, Streptococcus agalactiae, Staphylococcus aureus
[25]. Именно изменение численности того или иного вида микроорганизмов или появление несвойственных данному месту обитания бактерий служит сигналом для адаптивных или необратимых изменений в биоценозе влагалища [25, 26, 28]. Проведенное в 2014 г. исследование, в котором приняли участие 1817 женщин, показало, что у 432 различное сочетание
U. urealyticum, Ureaplasma parvum, M. hominis
, грибов рода
Candida, G. vaginalis, A. vaginae
было клинически значимо. Кроме того, в состав микробных ассоциаций входили такие микроорганизмы, как
S. epidermidis, Staphylococcus saproрhуticus, Streptococcus spp., Corinebacterium xerosis, E. coli, E. fecalis
[27].
Нарушение микрофлоры полости рта: причины
Дисбактериоз ротовой полости могут спровоцировать самые разные заболевания и проблемы. Нарушение условно-патогенной микрофлоры полости рта чаще всего вызывают такие проблемы, как:
- Заболевания желудочно-кишечного тракта. Сбои работы органов пищеварения приводят к замедлению обменных процессов в организме. Всасываемость витаминов и полезных веществ ухудшается, нарушается баланс бактериальной среды кишечника, что провоцирует проблемы в других органах и системах.
- Снижение иммунитета. Если сопротивляемость организма ухудшается, ротовая полость автоматически становится более уязвимой для патогенной микрофлоры.
- Хронические заболевания. Зачастую небольшой кариес или стоматит, при отсутствии лечения, может из очага воспаления распространиться на всю ротовую полость.
- Вредные привычки, такие как систематический прием алкоголя, курение неизбежно влияют на качество работы слюнных желез. Долгое пересыхание или слишком сильное увлажнение ротовой полости пагубно влияют на состав микрофлоры.
- Неправильное питание и недостаток витаминов ухудшает качество слюны и делает более уязвимой микрофлору полости рта.
- Прием антибиотиков и некоторых лекарственных препаратов, например, гормонов;
- Ношение протезов.
Роль биопленок в развитии патологического процесса репродуктивного тракта
Сегодня факт, что 99% микроорганизмов находятся в составе биопленок, является доказанным. Биопленка с точки зрения биологии — особая экосистема, обеспечивающая жизнеспособность и сохранение составляющих ее видов микроорганизмов, увеличение их общей популяционной устойчивости [29]. Микроорганизмы в биопленке, не изменяя своей индивидуальной чувствительности, лучше выживают при воздействии антибактериальных препаратов, осуществляют электрическую коммуникацию, которая и обеспечивает их метаболическую взаимосвязь в биопленке [29–31]. Пять лет назад был описан один из механизмов взаимодействия микроорганизмов в составе биопленки. Исследователи установили, что волна деполяризации, запущенная метаболическим стрессом центрально расположенных бактерий, ограничивает способность периферических клеток захватывать глутамат и удерживать ионы аммония, делая эти метаболиты более доступными для центральных микроорганизмов. Высокая скорость диффузии ионов калия в водной среде способствует синхронизации метаболической активности даже на расстоянии [32]. Формирование биопленок в очаге воспаления ведет к развитию хронического воспаления и неэффективности проводимой терапии [28, 30, 31]. Интересным представляется взаимодействие грибов рода Candida
и эпителиальных клеток влагалища. В работе A. Swidsinski et al.
Candida
были выявлены в 26 из 35 биопсий, полученных от женщин с вульвовагинальным кандидозом (ВВК), но
Candida
, содержащие биопленку, не были обнаружены ни в одном из случаев. Гистопатологические поражения были исключительно инвазивными и сопровождались вторжением гарднерелл и лактобактерий. Авторы пришли к выводу, что гистопатологические поражения ВВК носят преимущественно инвазивный и полимикробный характер и не напоминают биопленки, клиническое значение инвазии в ткани
Candida
неизвестно [33].
В этом же исследовании удалось установить, что ультраструктура эпителиоцитов влагалища после ВВК повреждена, местный иммунный ответ нарушен, а противогрибковые препараты могут значительно восстановить поврежденную структуру эпителия влагалища после ВВК и усилить защитную иммунную функцию эпителия влагалища [33].
Особое значение в развитии инфекционно-воспалительных заболеваний урогенитального тракта принадлежит анаэробной микрофлоре, в частности G. vaginalis
, которые, обладая уникальными адгезивными способностями, не ограничивают свое местоположение одним лишь влагалищем, а весьма успешно заселяют верхние отделы генитального тракта [33]. Еще 5–7 лет назад считалось, что этот микроорганизм не передается половым путем. Однако в исследовании 2022 г. было показано, что предполагаемый профиль передаваемого половым путем БВ, полученный на основании результатов эпидемиологических исследований, может совпадать с его биопленочной природой, распространением рассеянных клеток или клеточных агрегатов между хозяевами, т. е. передается не
G. vaginalis
, а фрагментом биопленки, в которую этот микроорганизм входит. Формирование биопленки
de novo
в ответ на длительное давление вагинальной экосистемы следует рассматривать как патогенетическую модель. Это обстоятельство позволит пересмотреть терапевтические подходы, которые до сих пор ограничивались ингибированием образования биопленки. Возможно, инновационное клиническое исследование с включением комбинационного подхода (с использованием метронидазола и поверхностно-активного вещества, специально предназначенного для разрушения биопленки) позволит существенно продвинуться в решении проблемы лечения рецидивирующего БВ [34].
Исход любого воспалительного процесса, независимо от его этиологии, — результат взаимодействия макро- и микроорганизма. Ряд патологических состояний, ведущих к дисфункциям факторов врожденного иммунитета, способствует активации условно-патогенной флоры, провоцируя воспалительные процессы различной локализации и степени тяжести. Дисфункции структур врожденного иммунитета обычно проявляются в снижении функциональной активности фагоцитирующих клеток: угнетении биоцидных функций, подавлении их секреторной активности, приводящей к снижению выработки биологически активных мессенджеров, что в конечном итоге приводит к стойким нарушениям в системе противоинфекционной защиты. Особенностью же воспалительных процессов, вызванных условно-патогенными микроорганизмами, является их длительное хроническое вялотекущее течение [18–20, 27]. С одной стороны, условно-патогенные микроорганизмы в процессе эволюции выработали ряд приспособительных свойств, позволяющих уходить от защиты иммунной системы макроорганизма, а с другой стороны, дисфункции в системе противоинфекционной защиты способствуют развитию хронического воспаления. При хроническом течении заболевания наряду с экссудативными определяются и пролиферативные изменения, проявляющиеся воспалительными инфильтратами в субэпителиальном слое. Цилиндрический эпителий на отдельных участках трансформируется в многослойный плоский, нередко и в ороговевающий, исходом чего может стать рубцовая атрофия ткани [23].
Возможные осложнения дисбактериоза
Каждому пациенту важно внимательно следить за состоянием микрофлоры полости рта. Отсутствие лечения дисбактериоза может привести к таким неприятным заболеваниям, как:
- патологический галитоз – неприятный запах изо рта, вызванный дисбалансом микрофлоры полости рта;
- кариес – разрушение твердых тканей зуба;
- пульпит – воспаление пульпы – внутренних тканей зуба;
- периодонтит – воспаление оболочки корня зубов и примыкающей к ней тканей;
- гингивит– воспаление слизистой полости рта;
- стоматит – поражение слизистой оболочки полости рта;
- пародонтит – глубокое поражение околозубной ткани.
Кроме того, научно доказана тесная взаимосвязь состояния микрофлоры полости рта с состоянием сердечнососудистой системы. В 2008 году в США была доказано, что заболевания периодонта как источник хронического воспаления являются независимым фактором риска возникновения ишемической болезни сердца (ИБС).
Итак, теперь вам известна роль нормальной микрофлоры полости рта в организме человека. Относитесь к себе внимательно, и ваш здоровый организм будет радовать вас каждый день.
Принципы терапии
Все эти обстоятельства заставляют нас принципиально изменить подход к терапии хронического воспалительного процесса. Важно не только воздействовать на этиологическую составляющую воспалительного процесса, устранить нарушения локального иммунологического статуса, но и препятствовать формированию и увеличению массы биопленки [7, 8, 19, 27]. И в этом аспекте весьма перспективной является комбинация лекарственных препаратов, действующих локально на различные группы агентов [35]. С учетом того, что наиболее частыми участниками микробных ассоциаций, приводящих к развитию инфекционно-воспалительного процесса, являются анаэробы и грибы рода Candida
, актуальными могут быть препараты, в состав которых входят метронидазол и производное азолов.
В Порядке оказания медицинской помощи по профилю «дерматовенерология», Клинических рекомендациях Российского общества дерматовенерологов и косметологов 2022 г. препаратом выбора для лечения урогенитального трихомониаза и БВ называют препараты группы 5-нитроимидазола [36].
Механизм действия заключается в биохимическом восстановлении 5-нитрогруппы метронидазола внутриклеточными транспортными белками анаэробных микроорганизмов и простейших. Восстановленная 5-нитрогруппа метронидазола взаимодействует с ДНК клетки микроорганизмов, ингибируя синтез их нуклеиновых кислот, что ведет к гибели бактерий и простейших. Спектр действия широк: в отношении T. vaginalis, G. vaginalis, Giardia intestinalis, Entamoeba histolytica,
а также облигатных анаэробов (
Bacteroides spp,Fusobacterium spp., Veillonella spp., Prevotella spp.)
и некоторых грамположительных микроорганизмов (
Eubacter spp., Clostridium spp., Peptococcus spp., Peptostreptococcus spp.
). Большинство аэробных микроорганизмов и факультативных анаэробов нечувствительны к метронидазолу, но в присутствии смешанной флоры (аэробы и анаэробы) метронидазол действует синергически с антибиотиками, эффективными против аэробов.
Для терапии воспалительных заболеваний урогенитального тракта, ассоциированных с грибами рода Candida
, препаратом выбора являются азолы, в частности миконазол. Миконазол — эффективное антимикотическое средство, которое оказывает свое действие прежде всего на дерматофиты и дрожжевые грибы. При интравагинальном применении активен в основном в отношении
Candida albicans.
Миконазол подавляет биосинтез эргостерина в грибах и изменяет состав других липидных компонентов в мембране, что приводит к гибели грибковых клеток, при этом не изменяет состав нормальной микрофлоры и pH влагалища [37]. Эффективность и безопасность применения фиксированной комбинации метронидазола и миконазола были отмечены в ряде исследований [35, 38].
Современный фармацевтический рынок предлагает различные лекарственные препараты для лечения анаэробной и микотической инфекции, однако практикующие врачи предпочитают комбинированные препараты с широким спектром действия. Одним из препаратов, где удачно сочетаются два активных компонента — метронидазол и миконазол, является Гинокапс, содержащий 100 мг метронидазола и 100 мг миконазола. Этот препарат для вагинального применения может успешно использоваться при БВ и ВВК в сочетании с приемом метронидазола внутрь. Согласно Клиническим рекомендациям Российского общества дерматовенерологов и косметологов (2017) для терапии таких состояний предпочтительно применять местнодействующие препараты. При сочетании трихомонадной и микотической инфекции в случае выраженной экссудации, воспаления также рекомендуется одновременно с пероральными препаратами применение местнодействующих протистоцидных препаратов,
но не рекомендуется проведение системной энзимотерапии, иммуномодулирующей терапии и терапии местными антисептическими препаратами [30]. Следует отметить, что вспомогательные вещества, входящие в состав вагинальных капсул, такие как глицерин, диоксид титана, лецитин, являются донатором фосфолипидов, способствуют уменьшению экссудации.