Рождение здорового ребенка – естественное желание каждой беременной женщины. Но, к сожалению, надежды на счастливое материнство не всегда оправдываются. Около 5% новорожденных имеют различные врожденные заболевания. Скрининг в 1 и во 2 триместрах беременности позволяет определить, насколько велик риск врожденной патологии у будущего ребенка.
В настоящее время существуют достаточно эффективные методы пренатальной (дородовой) диагностики многих заболеваний плода, которые можно выявить с 11 недели беременности. Своевременное проведение скрининговых обследований дает возможность определить большой спектр патологии плода и увидеть ультразвуковые признаки хромосомных аномалий.
Что такое ранний пренатальный скрининг и когда он проводится
Скрининг (от англ. «просеивание») – это совокупность исследований, позволяющих определить группы беременных, у которых существует риск рождения ребенка с хромосомными аномалиями и врожденными пороками. Но ранний скрининг – это только начальный, предварительный этап обследования, после которого женщинам, с выявленным риском врожденных аномалий, рекомендуется более детальное диагностическое обследование, которое точно подтвердит или исключит наличие патологии.
Данный комплекс диагностики проводится беременным на сроке 11–13 недель +6 дней (когда копчико-теменной размер плода составляет от 45 до 84 мм). Самым оптимальным временем для проведения скрининга считается возраст от 12 до 13 недели, так как при таком обследовании оцениваются как признаки хромосомной патологии у плода, так и анатомические структуры будущего ребенка, а на сроке в 11 недель – 11 недель +4 дня сделать это очень сложно.
Что включает в себя ранний пренатальный скрининг
В комплексное обследование входят:
- УЗИ плода на наличие маркеров (признаков) хромосомной патологии и врожденных пороков развития;
- определение уровня биохимических маркеров хромосомных аномалий в крови беременной женщины: бета-ХГЧ и РАРР-А. Исследование проходит на специальном высокотехнологичном оборудовании Cobas e, Roshe, разрешенном для расчета риска хромосомных синдромов в программе Astraia (FMF);
- допплерометрия маточных артерий
- цервикометрия – измерение длины шейки матки;
- сбор анамнеза (возраст, рост, вес, количество беременностей и родов, курение, сахарный диабет, артериальная гипертензия и др.);
- измерение артериального давления на обеих руках.
Полученные данные: анамнез, УЗИ и биохимические маркеры помещают в специально разработанную программу Astraia, которая рассчитывает риск рождения ребенка с врожденными аномалиями. Комбинация данных исследований увеличивает эффективность выявления плодов с синдромом Дауна и другими хромосомными заболеваниями.
Медицинские интернет-конференции
Введение. Одним из актуальных аспектов современной детской урологии является диагностика пороков мочевыделительной системы на антенатальном этапе; их доля среди всех антенатально диагностируемых пороков составляет 26-28% [1]. Высокая распространенность и многообразие пороков органов мочевыделения, тяжесть осложнений и нередко их фатальная предопределенность заставляют рассматривать проблему их существования с точки зрения их профилактики [2]. Качественно проведенная антенатальная диагностика позволяет существенно повысить достоверность прогноза, спланировать сроки, объем лечебных мероприятий, проводимых на этапе доклинических проявлений, что в своем комплексе предрешает исход диагностируемого патологического состояния, предотвращает развитие опасных для жизни осложнений, снижает вероятность рождения детей с тяжелыми инкурабельными пороками [3].
Обращаясь к детским урологам и хирургам, педиатрам, врачам акушерам, генетикам и специалистам ультразвуковой диагностики в качестве основной аудитории для дискуссии по проблеме пренатальной диагностики (ПД) врожденных пороков (ВПР) мочевыделительной системы (МВС), мы предлагаем сместить акцент при выявлении данной патологии на максимально ранние гестационные сроки, то есть на первый триместр гестации и обсудить прогностическую значимость такой позиции.
С одной стороны, на сегодняшний день приоритеты для решения проблем первого триместра гестации до сих пор полностью возложены на врачей ультразвуковой диагностики (УЗ), акушеров и генетиков. С другой стороны, в настоящее время в соответствии с имеющимся законодательством, детский уролог должен принимать участие в пренатальном консультировании, а именно, пренатальном прогнозировании диагностированной патологии плода, нести ответственность за принятые решения. В конце концов, именно детский уролог и является тем доктором, который в последующем занимается лечением данных пациентов [4].
В Европейской пренатальной диагностике настоящего времени заложена идеология раннего пренатального скрининга, сформулированная основателем Фонда медицины плода (Fetal Medicine Foundation, FMF, Лондон) Кипросом Николаидесом. Если ранее считалось, что все осложнения развития плода и течения беременности возникают либо реализуются во второй половине беременности, и это предопределяло увеличение частоты контролирующих диагностических процедур с целью выявления патологии, то исследования последнего времени доказали, что формирование осложнений развития плода происходят в сроки до 12 недель, срок первого скрининга 11-14 недель беременности оптимален для диагностики большинства летальных и инвалидизирующих ВПР и хромосомных аномалий (ХА). Данный тезис декларирован в виде основного бренда Фонда медицины плода: «перевернуть «диагностическую пирамиду», заложив в ее основание качественный ранний пренатальный скрининг первого триместра гестации» [5].
Пренатальная диагностика врожденных и наследственных заболеваний (ВНЗ) ставит своей задачей выявление ВПР, хромосомных аномалий, моногенных заболеваний. По данным Европейского регистра, у новорожденных частота ВПР регистрируется в пределах 2,5 – 3,0%, ХА (в основном трисомии) составляют суммарно 2-3 случая на 1000 рождений, а моногенные заболевания регистрируются у 0,5-1,4% родившихся детей. По данным ВОЗ, частота ВНЗ среди живо- и мертворожденных детей не превышает 4-6% [6, 7, 8].
Существующая в России с декабря 1993 года трехуровневая система пренатальной диагностики, включающая УЗИ, биохимический скрининг второго триместра, инвазивные методы (амниоцентез, кордоцентез) не оправдала себя, а подведенные итоги были неутешительными. Реформирование системы массового пренатального обследования беременных женщин было основано на положительном международном опыте FMF и включено в национальный проект «Здоровье» с 2010 года с переводом на экспертный уровень всех субъектов Российской федерации [6].
В качестве приоритетной основы ПД был выбран алгоритм программы Астрайя, базирующийся на рекомендациях FMF, включающих: 1) декретированные сроки проведения исследований ‒ 11-14 недель; 2) комплекс сертифицированных неинвазивных диагностических методов: ультразвуковой и биохимический скрининг и (определение молекулярных сывороточных маркеров: свободной бета-единицы хориогонического гонадотропина человеческого (ХГЧ) и ассоциированного с беременностью протеина плазмы А (ПАПП-А); 3) комбинированный расчет индивидуального риска хромосомных аномалий с отнесением в группу риска беременных, чей риск составил 1:100 и выше [6].
Наряду с этим, за последние годы констатированы значительные успехи в развитии фундаментальных вопросов антенатальной урологии. Разработан диагностический алгоритм пренатальной ультразвуковой идентификации вариантов пороков мочевыделительной системы, что приблизило нас к постановке пренатального диагноза. Определены прогностические критерии перспективной функции почек и объективные уродинамические критерии «фатальных пороков» и т.д. [3, 9, 10]. Однако важно отметить, что все это касается второго и в большей степени третьего триместров гестации, когда анатомические структуры плода, а вместе с тем и ультразвуковые маркеры патологии МВС, становятся наиболее выраженными и доступными для визуализации. Однако в случаях диагностики прогностически неблагоприятных пороков развития упущены сроки для прерывания беременности. Именно эти обстоятельства заставили нас поддержать основной тезис Фонда медицины плода и обратиться к обсуждению вопроса антенатальной диагностики патологии МВС, сместив акцент на первый триместр гестации.
Для первого триместра гестации манифестным УЗ маркером пороков МВС является «синдром мегацистис», который в литературной дискуссии имеет не однозначную трактовку, а соответственно противоречивые тактические рекомендации [11,12,13,14].
Частота выявления синдрома мегацистис первого триместра беременности составляет 0,02% — 0,19% [13,14]. Синдром фетального увеличения мочевого пузыря большинство авторов трактует как результат низкой обструкции мочевых путей, причинами которой могут явиться патология уретры в виде атрезии или фибростеноза, дисгенезии клоаки с атрезией прямой кишки и уретры, встречающиеся у плодов обоего пола. Но наиболее часто диагностируется синдром клапанов задней уретры, характерный для плодов мужского пола [15].
Помимо этого, увеличение мочевого пузыря может сопровождать пороки МВС, патогенез которых не связан с наличием анатомической обструкции нижних мочевых путей, а обструкция в таких случаях носит функциональный характер. В настоящее время известны два синдрома: синдром мегацистис-мегауретер-микроколон кишечной гипоперистальтики и prune-belle синдром, относящиеся к их числу. Причина функциональной обструкции детрузора обусловлена резким снижением, а вернее, отсутствием его сократительной способности, что морфологически проявляется дегенерацией и разреженностью гладких мышц, разрастанием фиброзной ткани, наличием массивных гиалиновых отложений. Летальность при данных синдромах составляет от 20 до 50% вследствие легочной недостаточности в неонатальном периоде или почечной недостаточности в раннем детском возрасте [15,15,16,17,18].
Диагноз мегацистис плода большинство авторов трактует как прогностически неблагоприятный признак, угрожаемый по перинатальным потерям вследствие декомпенсированных пороков мочевыделительной системы, ассоциированных с дисплазией почечной паренхимы. Наиболее неблагоприятным вариантом является формирование кистозной дисплазии почечной паренхимы (приемущественно IV типа, по Поттеру) [7,8,11,14,20].
С другой стороны, N.Sebire и Sahid S. сообщают о самостоятельной спонтанной регрессии синдрома мегацистис плода и рождении здоровых детей [21]. Это, по-видимому, происходит из-за того, что формирование гладкомышечной мускулатуры и иннервации мочевого пузыря не заканчивается к 13-й неделе гестации и продолжается в последующие дни, дает основание для саморазрешения проблемы в последующие недели внутриутробного развития плода [22].
Учитывая, что синдром мегацистис в 25-40% сочетается с хромосомной патологией [23], существенную роль для принятия решения о пролонгировании или прерывании беременности играют результаты генетических исследований, кариотипирования плодного материала. Большинство авторов сходятся во мнении, что клапаны задней уретры, а также prune-belly синдром не являются генетически наследуемой патологией, однако это не исключает возможность хромосомных поломок. A.W.Liao констатирует, что при увеличении размеров мочевого пузыря от 7 до 15мм у плодов 10-14 недель гестации в 25% случаев определяется наличие трисомии по 13 и 18-й хромосоме [23].
Разнообразие литературных данных и неоднозначность тактических рекомендаций заставляет нас подробно и целенаправленно обсуждать данную проблему в кругу детских урологов и врачей антенатальной диагностики, осознавая сложность и ответственность при принятии решения как в случаях пролонгирования течения беременности, так и при ее прерывании.
Целью настоящей работы является проведение анализа перинатальных исходов течения беременностей и разработки алгоритма тактических решений при выявлении синдрома мегацистис плода в первом триместре гестации.
Материалы и методы. Нами проведен анализ течения 11 беременностей первого триместра с антенатально выявленным диагнозом: синдром мегацистис плода, которые входили в группу перинатального наблюдения генетика Областного перинатального центра и детского уролога.
Продольный размер мочевого пузыря превышал условный норматив 7мм и варьировал от 8 до 31 мм (рис. 1).
Рис. 1. Беременность 13 — недель. Синдром мегацистис плода.
Обращает на себя внимание, что в 85% случаев возраст женщин колебался от 31 до 41 года. Из 11-ти наблюдаемых беременных только 6 женщин прошли ранний пренатальный скрининг по программе Астрайя, 5 женщин обследованы не были. По результатам биохимического скрининга уровень ХГЧ был нормальным во всех случаях; уровень PAPPA отклонялся от нормальных значений у 2 из 6.
Результаты и их обсуждение. Ультразвуковые маркеры ВПР и ХА были выявлены в виде увеличения воротникового пространства до 2,6 и 3,0 мм у 2 плодов; наличие сочетанного порока развития – омфалоцеле – у 1 плода; в 1 случае диагностированы кисты пуповины. Ни у кого из обследованных плодов расчетный индивидуальный риск хромосомной патологии не превышал допустимых значений (то есть во всех случаях был более 1:100) (таб. 1).
На момент диагностики данного состояния только в 2 случаях была выявлена одно-двусторонняя пиелоэктазия (рис. 2).
Рис. 2. Беременность 12 недель с наличием расширения лоханок обеих почек.
При динамическом наблюдении в течение 2 недель на фоне нарастания размеров мочевого пузыря двусторонняя пиелоэктазия выявлена в 5-ти случаях (рис. 3).
Рис. 3. Беременность 15 недель. Расширение верхних мочевых путей у плода с синдромом мегацистис.
Результатом исследования явился анализ исходов течения беременностей.
Тактика принятия решений была мотивирована степенью поражения мочевыделительной системы, то есть степенью дилатации мочевого пузыря, наличием ретенции верхних мочевых путей.
Учитывая высокий процент сопутствующей генетической патологии при наличии синдрома мегацистис у плодов, в 5-ти случаях выполнено кариотипирование плодного материала (ворсин хориона). При этом в 1 случае выявлена трисомия по 18 паре хромосом с кариотипом 46, ХХ+47,18, и беременность была прервана; в других случаях патологии кариотипа не выявлено.
В 5 наблюдениях после первичной визуализации увеличенного мочевого пузыря ≥14≤30мм продолжено динамическое наблюдение в течение 2-х недель, что позволило констатировать нарастание увеличения мочевого пузыря, появление расширений верхних мочевых путей у 4 плодов, и обосновало прерывание беременностей.
В 4-х наблюдениях исходное значительное увеличение пузыря до 29-30 мм позволило связать это с выраженной обструкцией уретры и прервать беременности без проведения дополнительных исследований.
В одном случае отмечена замершая беременность. В целом в 10 из 11 случаев беременности были прерваны.
Только в одном случае при исходном увеличении размеров пузыря до 8мм динамическое наблюдение позволило наблюдать положительную динамику и нормализацию размеров пузыря, а как следствие – пролонгирование течения беременности. Однако исход ее оценить пока не представляется возможным, так как роды еще не произошли.
Проведенный анализ диагностических мероприятий и исходов течения беременностей позволил разработать диагностический алгоритм, который предполагает обязательное кариотипирование плодного материала при наличии размеров пузыря в пределах ≥7≤15мм. При подтверждении нарушения кариотипа целесообразно прерывание беременности, в противном случае – динамическое наблюдение до появления убедительных маркеров прогноза диагностируемого состояния.
Исходное значительное увеличение пузыря ≥ 20-30 мм однозначно свидетельствует о выраженной обструкции нижних мочевых путей и не требует динамического наблюдения; целесообразно прерывание беременности.
Наличие расширения верхних мочевых путей не всегда дополняет синдром мегацистис в ранние сроки гестации (11-13 недель) и наиболее отчетливо определяется во втором и третьем триместрах гестации. Однако во всех случаях его наличие является фактором, отягощающим прогноз.
Таким образом, подводя итоги анализу литературных данных и результатам собственных наблюдений, очевидным являются несколько выводов.
Выводы.
1. Комплекс мероприятий, входящих в ранний пренатальный скрининг 11-14 недель гестации (молекулярно-генетические и ультразвуковые маркеры ВПР и ХА) не позволяет определить вероятность наличия у плода ВПР мочевыделительной системы. Выделение группы риска плодов, угрожаемых по наличию врожденный патологии МВС, происходит на основании диагностики увеличенного продольного размера мочевого пузыря ≥ 7 мм, что трактуют как синдром «мегацистис плода» и требует проведения тщательных диагностических мероприятий, позволяющих прогнозировать исход.
2. Синдром мегацистис плода рассматривается как проявление выраженных нарушений уродинамики нижних мочевых путей анатомического или функционального генеза, лежащих в основе развития обструктивных нарушений верхних мочевых путей и диспластичного развития почечной паренхимы, включая ее кистозную дисплазию, что предопределяет декомпенсацию почечных функций и неблагоприятный исход.
3. Комплекс диагностических процедур, уточняющих прогноз при выделении группы плодов с синдромом мегацистис, включает в себя проведение кариотипирования плодного материала (ворсин хориона) при отсутствии расширения верхних мочевых путей и размерах пузыря ≤ 20мм и прерывание беременности в случаях выявленной хромосомной патологии.
4. Наличие увеличения мочевого пузыря ≥ 20 мм изолированно или при наличии расширений верхних мочевых путей является показанием для прерывания беременности.
5. Пролонгирование беременности рекомендовано во всех случаях умеренного расширения пузыря в пределах ≥7≤15мм при отсутствии расширения верхних мочевых путей, положительной динамики наблюдения в течения 2-3 недель, восстановления размеров мочевого пузыря.
6. Проведение диагностических мероприятий и выбор тактических решений должны проводиться при участии детского уролога, включая анте- и постнатальный этапы динамического наблюдения и необходимого лечения.
Что такое программа Astraia
Astraia – это профессиональная программа, вычисляющая вероятность хромосомных аномалий у плода. Программа была разработана Фондом Медицины Плода (Fetal Medicine Foundation – FMF) в Лондоне и успешно апробирована на огромном клиническом материале во многих странах мира. Она постоянно совершенствуется под руководством ведущего специалиста в области пренатальной диагностики профессора Кипроса Николаидеса, в соответствии с последними мировыми достижениями в области медицины плода.
Специалист, проводящий ранний пренатальный скрининг, должен иметь международный сертификат FMF, дающий право на выполнение данной диагностики и работу с программой Astraia. Сертификат подтверждается ежегодно после статистического аудита проделанной за год работы и сдачи сертификационного экзамена. Таким образом обеспечивается высокая диагностическая точность полученных рисков.
Проведение раннего пренатального скрининга с помощью данной программы регламентировано приказом Министерства Здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении порядка оказания медицинской помощи по профилю «акушерство-гинекология» (за исключением использования вспомогательных репродуктивных технологий)».
Ранний пренатальный скрининг позволяет вычислить следующие риски:
- синдром Дауна (трисомия 21) у плода;
- синдром Эдварда (трисомия 18) у плода;
- синдром Патау (трисомия 13) у плода;
- опасность развития ранней (до 34 недель) и поздней (после 37 недель) преэклампсии (гестоза) у самой беременной.
Что оценивается при УЗИ в 1 триместре
Копчико-теменной размер (КТР) плода
Этот показатель точно определяет срок гестации (беременности), особенно в случае, если женщина не помнит 1-й день последней менструации, либо если менструальный цикл у нее не регулярный. В заключении срок беременности выставляется по КТР плода, а не по дате последней менструации.
Правильное измерение КТР плода
Маркеры хромосомной патологии:
— толщина воротникового пространства (ТВП) – является основным признаком хромосомной патологии у плода. Патологической величиной считается увеличение ТВП больше 95-й процентили для каждого срока гестации. Каждое увеличение ТВП повышает риск существования хромосомной аномалии у плода.
ТВП в норме ТВР при патологии
Важно понимать, что увеличение ТВП — это признак (маркер), но не точная диагностика хромосомных аномалий у плода. Определить наличие синдрома Дауна и других заболеваний у будущего ребенка позволяет только инвазивная диагностика с последующим генетическим анализом.
— носовая кость. У плодов с синдромом Дауна носовая кость может отсутствовать, либо быть уменьшенной (гипоплазированной). Очень редко такое может встречаться и у совершенно здоровых детей. Точный диагноз устанавливается только при помощи генетического анализа.
Нормальная носовая кость Отсутствие носовой кости
— кровоток в венозном протоке – это маленький сосуд в печени плода. При обратном (ретроградном) токе крови в данном сосуде можно предположить, что у плода хромосомный синдром, либо врожденный порок сердца.
Нормальный кровоток в венозном протоке
Но важно правильно получить этот кровоток и дать ему оценку. Для этого требуются определенные навыки и квалификация врача, которые подтверждаются ежегодной сертификацией FMF.
— кровоток через трикуспидальный клапан в сердце плода. Здесь ретроградный (обратный) кровоток тоже указывает на хромосомную патологию, либо может проявляться при врожденных пороках сердца.
Анатомические структуры плода и исключение крупных врожденных пороков
Ручка плода Мозг плода в виде “бабочки” в норме
Длина шейки матки
Стенки матки и придатков (яичников)
Кровоток в маточных артериях
УЗИ может проводиться как трансабдоминально, так и трансвагинально.
Что представляет собой скрининг во втором триместре беременности
Согласно приказу № 572н от 1.11.2012 г., второй скрининг состоит из ультразвукового исследования плода на сроке 18-21 неделя беременности. В этом возрасте кровь на биохимические маркеры уже не сдается. Плод имеет массу около 300-500 грамм и длину 20-25 см, и УЗИ позволяет детально проанализировать все анатомические структуры плода и выявить большинство пороков развития. Тогда же оценивается количество околоплодных вод, расположение и структура плаценты, длина шейки матки и др.
После проведения УЗИ на данных сроках беременности большинство вопросов пренатальной диагностики считаются закрытыми.
Надеемся, что эта информация поможет Вам лучше понять важность и необходимость скрининга в первом и втором триместрах беременности. В нашей клинике у Вас есть уникальная возможность пройти качественное обследование и получить максимально объективные данные о состоянии Вашего плода.
Запишитесь на пренатальный скрининг в клинику «Семейный доктор» по телефону в Москве, через форму онлайн записи или в регистратуре.
Аномалии развития плода: классификация
К данной категории принадлежат следующие заболевания:
Аномалии развития нервной трубки
. Самой распространенной патологией ЦНС плода является анэнцефалия – врожденное отсутствие свода черепа и больших полушарий головного мозга. На УЗИ диагностируется на сроке 11-12 недель. Гидроцефалия обнаруживается на 18-й неделе беременности – по расширению передних и задних рогов боковых желудочков. Патологическое уменьшение головки плода (микроцефалия) возникает, как правило, на фоне других смежных заболеваний, и очень редко – в чистом виде. В таких случаях врач проводит УЗИ с разницей в несколько недель (для получения максимально достоверной картины). Округлое выпячивание в области костей свода черепа (энцефаломенингоцеле) диагностируют чаще всего на затылке, и подобная патология также требует повторного УЗИ.
Отклонения в развитии позвоночника
наблюдаются в основном в поясничном и шейном отделе. Увидеть позвоночник на УЗИ можно с 15-й недели беременности, примерно с 18-й недели диагностируются (при наличии) пороки его строения. Самым страшным является кистозная гигрома, поражающая лимфатическую систему. На УЗИ при таком диагнозе видно кисту в шейном отделе позвоночника. Если данное заболевание сопряжено с другими патологиями лимфатической системы, плод гибнет. Сложно выявить миеломенингоцеле (образование состоит из жидкости и элементов спинного мозга) и расщепление позвоночника – эти патологии требуют применения аппаратуры экспертного класса.
Среди патологий развития органов ЖКТ
чаще всего выявляют атрезию двенадцатиперстной кишки. Нередко данному заболеванию сопутствуют многоводие, поражение почек, сердца, нервной системы. Выявить атрезию тонкой кишки с помощью УЗИ очень сложно, чаще всего она обнаруживается в середине беременности или на поздних сроках. Атрезия толстой кишки УЗ-диагностике не поддается. Из нарушений строения передней брюшной стенки в большинстве случаев выявляют омфалоцеле.
Некоторые из аномалий мочевыделительной системы
приводят к очень страшным последствиям, поэтому если патология выявлена на ранних сроках, врач может посоветовать прерывание беременности. Если заболевание обнаружено поздно, меняют тактику ведения беременности. С помощью УЗИ можно обнаружить патологическую двустороннюю обструкцию, мультикистозную почку; диагностирование агенезии (отсутствия) органа бывает затруднено. Определение гидронефроза потребует повторного проведения УЗИ.
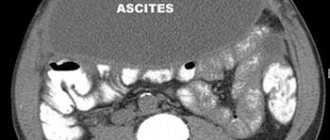
Асцит
– свободная жидкость – на УЗИ видится как анэхогенная зона, которая окружает органы плода. Только после тщательного изучения результатов обследования ставится окончательный диагноз. На водянку указывают утолщение кожи либо наличие жидкости минимум в двух естественных полостях. К этому заболеванию приводят:
- врожденные сердечные пороки;
- резус-конфликт;
- обструкции лимфатических и кровеносных сосудов;
- аритмии.
Для точного диагностирования водянки пациентке назначают дополнительное экспертное УЗИ.
Многоводие также можно обнаружить с помощью УЗИ. Развитию данной аномалии способствуют:
- водянка плода;
- сахарный диабет (у матери);
- нарушения в формировании органов ЖКТ;
- патологии нервной трубки;
- многоплодная беременность;
- скелетные дисплазии грудной клетки;
- пороки строения передней стенки живота.
Маловодие провоцируют:
- двусторонняя аномалия почек;
- задержка внутриутробного развития;
- перенашивание беременности;
- повреждение амниотических оболочек;
- внутриутробная гибель плода.
Процедура УЗИ абсолютно безопасна для жизни и здоровья матери и ребенка, не имеет ограничений по количеству сеансов, поэтому не пренебрегайте рекомендациями доктора и своевременно проходите назначенное обследование.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.