Способность к метастазированию — одна из основных особенностей злокачественных опухолей, которая, собственно, и делает их смертельно опасными. Раковые клетки способны отделяться от первичного очага, проникать в кровеносные или лимфатические сосуды и распространяться в различные части тела, давая начало новым очагам.
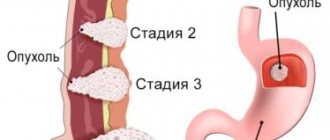
Течение большинства онкологических заболеваний принято делить на пять основных стадий, их обозначают цифрами 0, I, II, III, IV. Рак желудка с метастазами — это рак четвертой стадии. В классификации TNM буква M обозначает отдаленные метастазы. Она может принимать два значения:
- M0 — отдаленных метастазов нет, в таких случаях будет диагностирован рак желудка 0, I, II или III стадии.
- M1 — отдаленные метастазы имеются. В таких случаях диагностируют рак IV стадии.
Как часто диагностируют рак желудка с метастазами?
Так как на ранних стадиях опухоль не имеет симптомов, либо маскируется под другие заболевания (например, гастрит), зачастую она диагностируется на поздних стадиях. Примерно у четырех пациентов из пяти на момент постановки диагноза опухоль уже успела распространиться в организме. Это американская статистика, в России дела обстоят не лучше.
Так как с появлением отдаленных метастазов прогноз резко ухудшается, крайне актуален вопрос ранней диагностики рака желудка. Для этого применяются скрининговые исследования, в частности, гастроскопия. Наиболее удачный пример массового скрининга можно наблюдать в Японии: при высокой распространенности рака желудка в этой стране смертность от него ниже, чем во многих западных странах. Этого удалось добиться благодаря тому, что у многих больных опухоль обнаруживают на ранних стадиях.
Почему рак желудка метастазирует?
В процессе метастазирования принимают участие многие молекулярные механизмы, в современных знаниях о них остается еще немало пробелов. Известно, что злокачественные опухоли желудка развиваются из особых стволовых клеток. Некоторые подтипы стволовых клеток делают рак более склонным к метастазированию.
В общих чертах процесс метастазирования происходит следующим образом:
- Первичная опухоль в желудке постепенно растет и вторгается в окружающие ткани.
- Некоторые раковые клетки отделяются от первичного очага и проникают в кровеносные или лимфатические сосуды.
- С током крови или лимфы опухолевые клетки мигрируют в другие органы, оседают в мелких кровеносных сосудах, проникают через их стенки в окружающие ткани.
- Такое «путешествие» опасно для раковых клеток, многие из них погибают. Но, если условия оказываются благоприятными, раковая клетка закрепляется на новом месте и образует микроскопический вторичный очаг.
- Метастазировавшие клетки могут длительно, годами, оставаться неактивными. В определенный момент времени они могут начать активно размножаться, выделять вещества, которые стимулируют образование новых кровеносных сосудов, необходимых для роста опухолевой ткани.
Даже после того как пациент прошел курс лечения, и наступила ремиссия, в организме могут остаться некоторые микроскопические метастазы. Со временем они способны стать причиной рецидива.
Пути распространения рака
Врачи выделяют следующие пути метастазирования новообразований:
- лимфогенный;
- гематогенный;
- имплантационный.
Также существует смешанный тип распространения опухоли, когда злокачественные ткани разносятся по организму больного разными путями.
Лимфогенный
Лимфоузлы становятся первыми «мишенями» на пути распространения рака. В них скапливается лимфа, оттекающая от желудка. Вместе с ней в лимфоузлах «оседают» измененные клетки. Сначала заболевание поражает лимфоузлы, расположенные у привратника, затем — у грудной аорты и далее.
Известно два типа лимфогенного метастазирования:
- ортоградный — по ходу тока лимфы;
- ретроградный — против него.
Первичные желудочные опухоли быстро распространяются по органам брюшной полости мелкими «пылевыми» узелками.
Эти новообразования имеют характерные лимфогенные узлы, наличие которых упрощает диагностику. Основные из них:
- метастаз Вирхова — локализуется над левой ключицей;
- метастаз Шницлера — в области таза;
- метастаз Айриша — в подмышечных лимфоузлах;
- метастаз Крукенберга — опухоли в яичниках;
- метастаз сестры Марии Джозеф — в пупке.
Узлы Шницлера и «вирховские» метастазы определяются во время УЗИ или пальпации. Вторичный рак Крукенберга обнаруживается при ультразвуковом или лапароскопическом обследовании. Пораженные яичники сильно увеличиваются в размерах, уплотняются, приобретают белесый оттенок.
Особую диагностическую ценность имеет обнаружение очагов в региональных (ближайших) лимфоузлах.
Гематогенный
С током крови измененные ткани первичного новообразования начинают распространяться, когда лимфогенный путь уже пройден. Такие узлы чаще множественные, локализуются далеко от первичной опухоли. Распространение злокачественных клеток проходит по воротной вене, в первую очередь проникают в печень. Поражение органа происходит у 30-50% больных. В ряде случаев они практически полностью заменяют естественную печеночную ткань. Печень значительно увеличивается в размере из-за множественных узлов, у некоторых больных достигает веса в 10 кг.
Вторичные очаги подвержены некрозу, распаду, становятся причиной внутрибрюшинных кровотечений, перитонита.
Второе место по количеству диагностированных случаев являются метастатические узлы в легких. Они поражают органы дыхания, провоцируют такое осложнение, как милиарный карциноматоз.
С кровью злокачественные ткани также попадают в поджелудочную железу, почки, кости, надпочечники.
Имплантационный
Имплатационное (контактное) метастазирование происходит, когда первичное злокачественное новообразование прорастает желудочную стенку полностью, переходя на расположенные рядом органы.
Множественные узлы врачи обнаруживают в:
- пищеводе;
- плевре;
- печени;
- перикарде;
- поджелудочной железе;
- диафрагме;
- селезенке;
- кишечнике;
- сальнике;
- желчном пузыре;
- брюшине.
Обсеменение брюшины злокачественными клетками называется канцероматоз. Состояние свидетельствует о финальной стадии рака, сопровождается многочисленными осложнениями.
Так, когда новообразование прорастает в головку поджелудочной железы или печень больного, узел передавливает желчные протоки, вызывает желтуху, асцит, портальную гипертензию. Поражение любой части кишечника провоцирует его непроходимость.
Первичные новообразования кардиального отдела органа чаще распространяются на пищевод, вызывают сужение просвета, затрудняют проглатывание пищи, воды. Обсеменение злокачественными тканями диафрагмы, плевры провоцирует различные формы плеврита.
В какие органы метастазирует рак желудка?
В 2016 году группой ученых из Германии, Швеции и Финляндии было проведено исследование, по результатам которого были названы наиболее распространенные места локализации метастазов рака желудка:
- Печень — 48%.
- Брюшина — 32%.
- Легкие — 15%.
- Кости — 12%.
Локализация метастазов зависит от типа опухоли. Так, при раке кардии (места перехода пищевода в желудок) у мужчин опухолевые клетки чаще распространяются в легкие, нервную систему и кости. Опухоли в других частях органа склонны метастазировать в брюшину. Перстневидноклеточный рак чаще метастазирует в брюшину, кости и яичники, реже — в легкие и печень. В печени и брюшине обычно обнаруживают одиночные метастазы, в то время как метастазы в легких часто сочетаются с метастазами в печени.
Диагностика метастазов в печени
Для выявления этой патологии наши специалисты-онкологи используют весь спектр современных лабораторных и инструментальных методик. Визуализировать вторичные опухолевые очаги можно при помощи:
- ультразвукового исследования печени;
- компьютерной, магнитно-резонансной и позитронно-эмиссионной томографии, совмещенной с компьютерной томографией;
- радиоизотопного сканирования и т.д.
Важную роль среди специфических методов диагностики первичного рака печени играет выявление в крови пациента онкомаркера, называемого альфа-фетопротеином (АФП). Он представляет собой белковое соединение, которое в норме наличествует только в кровеносной системе плода и самостоятельно пропадает после рождения ребенка. Появление АФП в крови взрослого человека — свидетельство развития опухолевого процесса в печени.
Окончательное подтверждение диагноза вторичного рака печени проводят при помощи биопсии опухолевого очага. Она может выполняться инцизионным, аспирационным или пункционным способом. Выбирает методику врач, учитывая все факторы, имеющиеся у конкретного больного. Биологический материал, полученный в ходе биопсии, направляют в лабораторию, где проводят их гистологическое и цитологическое типирование под микроскопом.
Собственного деления по стадиям метастатический рак печени не имеет. В соответствии с международной классификацией TNM наличие или отсутствие метастазов в отдаленных органах отражает параметр «М». И вне зависимости от того, где именно возникла первичная опухоль, появление ее отдаленных метастазов классифицируется, как «М1» и автоматически переводит заболевание в IV стадию. Следовательно, если первичная опухоль уже метастазировала в печень, то это в любом случае рак IV стадии.
Симптомы
Зачастую первые симптомы рака желудка появляются именно на поздних стадиях, когда уже произошло метастазирование. Симптомы зависят от того, в какой орган распространились раковые клетки:
- В брюшине: боли в животе, увеличение живота за счет скопления внутри жидкости (асцит), потеря аппетита, беспричинное сильное снижение веса.
- В печени: потеря аппетита и снижение веса, окрашивание мочи в темный цвет, увеличение живота, желтуха, боль в верхней части живота справа (под правым ребром), тошнота, рвота, повышенная потливость.
- В легких: боль в грудной клетке, упорный хронический кашель, примесь крови в мокроте, хрипы, одышка, снижение веса.
- В костях: боли, патологические (от небольшого усилия) переломы.
- В головном мозге: головные боли, тошнота, рвота, слабость, онемение в руках и ногах, нарушение координации движений, расстройства личности и поведения, речи, глотания, недержание мочи и стула.
Все эти симптомы могут быть вызваны другими заболеваниями.
Симптомы метастазов в печени
Вторичная опухоль печени может сопровождаться следующими проявлениями:
- вздутием живота и связанными с этим дискомфортными ощущениями;
- появлением тошноты, иногда с эпизодами рвоты;
- диспепсическими явлениями в виде запоров или диареи;
- снижением аппетита;
- резкой потерей массы тела;
- незначительным, но стойким увеличением температуры тела;
- появлением общего недомогания и быстрой утомляемости.
К сожалению, все эти признаки появления метастазов в печени не являются специфическими для онкологических патологий. Отсутствие специфичности означает, что данные проявления довольно просто перепутать с симптомами других печеночных нарушений. Это усложняет диагностику заболевания и ухудшает прогноз. Тем не менее, специалисты Онкологического центра всегда помнят о том, что вторичные очаги в печеночной ткани — один из самых частых путей метастазирования при многих типах злокачественных патологий. Поэтому, если у пациента уже выявлена опухоль в другом органе, наши онкологи всегда будут с особенной внимательностью оценивать результаты обследований печени.
Еще один частый симптом метастазов в печени — нарушение работы желчного пузыря. С ростом размеров вторичного очага он начинает постепенно пережимать желчевыводящие пути, все в большей степени затрудняя отток желчи в полость кишечника. На этом этапе у пациента начинает развиваться механическая желтуха, которая обусловлена тем, что желчь, не способная вывестись из желчного пузыря естественным образом, начинает через его стенки поступать в кровяное русло. С током крови она разносится по всему организму, что приводит к характерному желтушному окрашиванию кожных покровов, склер (белковых) и слизистых оболочек глаза, осветлению кала и приданию моче темного оттенка. Кроме того, химическое воздействие желчных кислот на кожу вызывает появление зуда. На этой же стадии развития заболевания больные начинают предъявлять жалобы на постоянные боли ноющего характера, которые локализуются в правой подреберной области и обусловлены повышением давления в желчном пузыре.
На поздних стадиях развития опухоли в области правого подреберья начинает прощупываться плотное бугристое новообразование. В этот период печеночные метастазы уже провоцируют развитие анемии, появление спонтанных кровотечений из внутренних органов и возникновение асцита (накопление жидкости в брюшной полости). Наконец, вся печень в целом постепенно утрачивает способности нейтрализовать различные опасные химические вещества, и состояние больного ухудшается по причине нарастающей интоксикации организма.
Как диагностируют метастазы рака желудка?
Для поиска метастазов при раке желудка прибегают к следующим методам диагностики:
- Компьютерная томография хорошо обнаруживает метастазы в костях, но может также показать очаги и в мягких тканях.
- МРТ — безопасное исследование с применением магнитного поля, которое помогает обнаруживать метастазы в мягких тканях. В этом плане она точнее, чем КТ.
- Позитронно-эмиссионная томография — исследование, во время которого в организм вводят особую метку — безопасный радиоактивный сахар. Так как опухолевые клетки активно размножаются и нуждаются в большом количестве энергии, они накапливают этот сахар, благодаря чему становятся видны на снимках, сделанных специальным аппаратом. Существуют аппараты, с помощью которых можно одновременно выполнять ПЭТ и КТ, это помогает получить более детальную картину.
- Рентгенографию грудной клетки применяют для поиска метастазов в легких.
- Иногда возникает необходимость в диагностической лапароскопии — процедуре, во время которой врач делает прокол в стенке брюшной полости и вводит внутрь инструмент с видеокамерой (лапароскоп). Это помогает оценить степень распространения опухоли, обнаружить вторичные очаги в брюшине, внутренних органах.
Можно провести биопсию метастатического очага. При изучении ткани под микроскопом, в ней обнаруживают опухолевые клетки, характерные для рака желудка. Для того чтобы подобрать оптимальное лечение, проводят молекулярно-генетический анализ на некоторые вещества-маркеры:
- HER2 — рецептор на поверхности клеток, который стимулирует их размножение. При раке активность HER2 может быть повышена.
- PD-L1 — белок, который может взаимодействовать с иммунными клетками и подавлять их активность. Его относят к классу веществ, называемых контрольными точками.
Первый этап патологии
Первый этап развития рака — наличие опухолевого узла. При этом лимфатические узлы еще не поражены и метастазов в организме нет. За последнее время количество обнаруженных и вылеченных опухолей существенно возросло. Это указывает на увеличение сознательности людей в данном вопросе и способность заботиться о своем здоровье. Грамотное лечение помогает в большинстве случаев.
Методы лечения
Если обнаружены отдаленные метастазы, ремиссия, как правило, становится невозможна. Лечение носит паллиативный характер, оно направлено на сокращение размеров и замедление роста опухоли, продление жизни пациента, борьбу с симптомами. Но рак с метастазами — это еще не приговор. Современные онкологи все чаще говорят о нем как о временно хроническом заболевании. На какой бы период времени ни удалось продлить жизнь пациента — это в любом случае небольшая победа.
Хирургическое лечение
Иногда удается удалить часть желудка с опухолью — провести субтотальную резекцию. Если такая операция невозможна, и опухоль создает препятствие для пищи, возможен один из следующих вариантов лечения:
- Шунтирование: верхнюю часть желудка соединяют отверстием с тонкой кишкой.
- Стентирование: в месте сужения устанавливают каркас с сетчатой стенкой, он помогает восстановить просвет желудка.
- Гастростомия или еюностомия: отверстие из желудка или тонкой кишки выводят на кожу, через него можно вводить пищу.
- Разрушение опухолевой ткани лазером с помощью эндоскопа, введенного через рот.
Химиотерапия
При раке желудка применяют препараты: 5-фторурацил, капецитабин, карбоплатин, цисплатин, доцетаксел, эпирубицин, иринотекан, оксалиплатин, паклитаксел. Их назначают в разных комбинациях.
Лучевая терапия
Облучение помогает сократить размеры опухоли, улучшить прохождение пищи, уменьшить боль. Применяются такие современные методы, как трехмерная конформная лучевая терапия, интенсивно-модулированная лучевая терапия. В них используются точные расчеты, которые помогают сконцентрировать излучение в области опухоли, минимально затрагивая здоровые ткани.
Иногда лучевую терапию сочетают с химиотерапией. Это помогает повысить эффективность лечения, но повышает риск серьезных побочных эффектов.
Таргетная терапия и иммунотерапия
При раке желудка с метастазами могут быть назначены некоторые таргетные препараты и иммунопрепараты:
- Если опухоль является HER2-позитивной, назначают трастузумаб (герцептин).
- Рамуцирумаб (цирамза) блокирует VEGF — вещество, которое раковые клетки синтезируют, чтобы стимулировать рост новых сосудов и обеспечить себя кислородом.
- Пембролизумаб (кейтруда) — иммунопрепарат, блокатор контрольной точки PD-L1. Он снимает блок с иммунных клеток, в результате чего те начинают атаковать опухолевую ткань.
Борьба с симптомами
На поздних стадиях онкологических заболеваний многих пациентов беспокоят сильные боли. Адекватное обезболивание помогает улучшить качество жизни. Применяются как ненаркотические, так и наркотические анальгетики. При желудочных кровотечениях развивается анемия. Если уровни эритроцитов и гемоглобина в крови сильно снижаются, приходится прибегать к переливанию эритроцитарной массы.
Важно оценивать нутритивный статус пациента. Если организм не получает нужных веществ, и проблему не удается решить с помощью диеты и гастростомии, назначают парентеральное питание: растворы питательных веществ вводят внутривенно, в обход пищеварительной системы.
Справиться с побочными эффектами и комфортно перенести курс лучевой терапии, химиотерапии помогает поддерживающее лечение.
Лечение метастазов в печени
Для борьбы с метастазами в печени при раке желудка существуют некоторые специальные методы:
- Интраартериальная химиотерапия, когда химиопрепарат вводят непосредственно в сосуд, питающий опухоль. При этом можно сильно увеличить дозировку и добиться положительного эффекта, не боясь серьезных побочных эффектов.
- Химиоэмболизация. В печеночную артерию вводят эмболизирующий препарат в сочетании с химиопрепаратом. Эмболизирующий препарат состоит из эмболов — микросфер, которые перекрывают просвет мелких сосудов и нарушают поступление к опухоли кислорода, питательных веществ.
- Радиочастотная абляция. В узел в печени вводят тонкий электрод в виде иглы и подают на него радиоволны, которые уничтожают раковые клетки. При необходимости процедуру можно повторять.
Лечение асцита
Асцит — скопление жидкости в брюшной полости — возникает при раке желудка в результате поражения метастазами печени и брюшины. Бороться с этим состоянием можно разными способами:
- Ограничение потребления жидкости и соли, мочегонные препараты.
- Лапароцентез — процедура, во время которой в брюшной стенке делают прокол и выводят избыток жидкости. Можно установить специальный перитонеальный катетер для оттока жидкости.
- Хирургические вмешательства, направленные на профилактику скопления жидкости в брюшной полости: оментогепатофренопексия, перитонеовенозный шунт, деперитонизация стенок брюшной полости.
- Внутрибрюшинная химиотерапия для борьбы с метастазами брюшины.
Несмотря на глобальное снижение онкологической заболеваемости (современный уровень не превышает 1/4 от показателей 50-х годов XX века), на долю рака желудка приходится около 10% общего числа злокачественных новообразований. В последние годы в мире регистрируется около 800 000 новых случаев рака желудка. В Российской Федерации рак желудка занимает пятое место в структуре онкологической заболеваемости. Поздняя диагностика и неудовлетворительные результаты лечения приводят к тому, что летальность больных в течение года с момента установления диагноза остается очень высокой и в 2010 г. составила 53,3% [1].
Несмотря на то что хирургическое лечение рака желудка, а также многочисленные попытки применения различных вариантов адъювантных воздействий с целью увеличения его эффективности насчитывают уже не один век, проблема успешного лечения данной патологии остается весьма далекой от своего разрешения [2]. Рандомизированные исследования и метаанализы, результаты которых были опубликованы в последние годы, показывают, что оптимальным объемом вмешательства на желудке и лимфатических коллекторах в настоящее время и в обозримом будущем является гастрэктомия или субтотальная резекция желудка D2 [3—5]. Вместе с тем вопросы безопасности и воспроизводимости данного объема оперативного вмешательства, а также возможность и целесообразность его сочетания с различными вариантами неоадъювантной и адъювантной терапии продолжают оставаться предметом дискуссии.
Целью настоящей работы явился анализ непосредственных результатов лечения, а также факторов прогноза развития рецидивов и метастазов у больных раком желудка, оперированных с лимфодиссекцией D2 в МРНЦ за последние 10 лет.
Материал и методы
С 2002 по 2011 г. хирургическое лечение с лимфодиссекцией D2 было выполнено 220 больным, причем 114 больных были оперированы в течение последних трех лет. Соотношение мужчин и женщин было приблизительно равным; возраст больных варьировал от 20 до 80 лет, составив в среднем 60 лет. Осложнения основного заболевания были выявлены у 60% больных, преобладали анемия и стеноз выходного отдела желудка. Более чем в половине случаев имелась выраженная клинически значимая сопутствующая патология сердечно-сосудистой, бронхолегочной и эндокринной систем. У 17 (7,7%) больных были диагностированы полинеоплазии, в том числе у 7 синхронные. Среди вторых опухолей преобладали новообразования мочевыводящей системы (7случаев) и желудочно-кишечного тракта (6). По поводу всех вторых опухолей было проведено радикальное лечение в соответствии с их локализацией и морфологическим строением.
По локализации преобладали опухоли нижней (73 больных) и средней (65) третей желудка; весьма часто имело место субтотальное (49) и тотальное (10) поражение органа. В большинстве случаев (142 больных — 65%) опухоль была представлена низко- и недифференцированным раком, в том числе в 22% — перстневидно-клеточным раком. У 46 больных имел место ранний рак желудка (поражение слизистого слоя — 20, подслизистого слоя — 26). Наиболее часто опухоль прорастала за пределы серозной оболочки (82 больных). Метастатическое поражение регионарных лимфатических узлов морфологически подтверждено у 105 (48%) больных. Отдаленные метастазы выявлены у 6 больных: поражение брюшины — у 3, печени — у 1, яичников — у 1, парааортальных лимфатических узлов — у 1. Распределение больных по стадиям опухолевого процесса представлено в табл. 1;
количество больных раком желудка I, II и III стадий было практически одинаковым.
Оперативные вмешательства в объеме гастрэктомии выполнены у 143 больных, дистальной субтотальной резекции — у 74, проксимальной субтотальной резекции — у 2 больных. Во всех случаях объем лимфодиссекции соответствовал D2. Комбинированные операции произведены у 32 больных, из них спленэктомия — у 15 больных. Непрерывность желудочно-кишечного тракта после гастрэктомии восстанавливали формированием двухрядного пищеводно-кишечного анастомоза конец в бок с межкишечным соустьем по Ру; после дистальной субтотальной резекции желудка — позадиободочного гастроэнтероанастомоза с межкишечным соустьем по Брауну; после проксимальной субтотальной резекции желудка — погружного эзофагогастроанастомоза.
В работе применяли классификацию ТNМ (7 издание, 2009 г.) и Японскую классификацию рака желудка (третье английское издание, 2011 г.). Для статистической обработки использовали лицензионный биомедицинский пакет Prism 3 «GraphPad Software, Inc.», США). Достоверность различий между показателями оценивали с помощью точного критерия Фишера и критерия χ2, использовали двусторонний тест. Различия считали достоверными при р<0,05.
Результаты
Осложнения и летальность
У 206 (94%) больных послеоперационный период протекал гладко. Ранние послеоперационные осложнения имели место у 13 (6%) больных: пневмония (2 случая), плеврит (2), тромбоэмболия мелких ветвей легочной артерии (1), инфаркт миокарда (1), острая коронарная недостаточность (1), панкреатит (1), нагноение лапаротомной раны (1), подкожная эвентерация (1), спаечная тонкокишечная непроходимость (3). В последних 4 случаях (1,8% по отношению ко всем операциям) были выполнены повторные оперативные вмешательства: ушивание раны передней брюшной стенки, рассечение спаек. Считаем необходимым обратить внимание на отсутствие таких грозных осложнений, как несостоятельность швов анастомозов и культи двенадцатиперстной кишки, а также панкреонекроза, которые до настоящего времени, по данным разных авторов, наблюдаются у 2—6% больных. В раннем послеоперационном периоде умер 1 больной, летальность составила 0,45%. Больной Б., 65 лет, диагноз: рак антрального отдела желудка pT2N2M0G2, скончался через 6 ч после дистальной субтотальной резекции желудка от острой коронарной недостаточности (диагноз был подтвержден при аутопсии). За последние три года при выполнении 114 оперативных вмешательств с лимфодиссекцией D2 летальных исходов не было. При этом следует отметить, что структура оперативных вмешательств на желудке существенно изменилась: если в 2002—2008 гг. количество гастрэктомий и субтотальных резекций было практически равным — 56 и 50, то в 2009—2011 гг. это соотношение составило 88 и 26 (77 и 23%), различие статистически достоверно (р=0,0002).
Таким образом, в настоящее время основным объемом оперативного вмешательства по поводу рака желудка является гастрэктомия D2.
Закономерности лимфогенного метастазирования
Метастазы в регионарных лимфатических узлах были выявлены у 105 (48%) больных. При раннем (рТ1а—b) раке желудка частота лимфогенного метастазирования составила 13%. Далее она закономерно возрастала с увеличением глубины инвазии в стенку желудка, превысив 70% при прорастании опухоли за пределы серозной оболочки; различие по категории pN в зависимости от категории pT статистически значимо (p<0,0001). В целом частота метастазов в лимфатических узлах увеличивалась в 2 раза и более с инвазией опухоли в каждый последующий слой стенки желудка (табл. 2).
Метастазы в лимфатических узлах чревного ствола и его ветвей были выявлены у 25% больных, в том числе у каждого третьего больного при прорастании опухоли в субсерозный и серозный слои. Отмеченная выше динамика увеличения их частоты с увеличением глубины инвазии опухоли в стенку желудка сохранялась, однако существенных различий при прорастании субсерозного слоя и серозы не было (33 и 37%). Тем не менее различие по категории рТ также было значимым с высокой степенью статистической достоверности (p<0,0001).
Таким образом, применение лимфодиссекции D2 показывает высокую частоту лимфогенного метастазирования, в том числе во второй коллектор лимфооттока, особенно при прорастании опухоли за пределы субсерозного слоя, что позволяет считать меньший объем вмешательства нерадикальным.
Рецидивы и метастазы
За период наблюдения рецидивы и метастазы, а также их основные характеристики (время развития, локализация, распространенность) были установлены у 37 больных. Основными методами диагностики рецидивов и метастазов были УЗИ, СКТ, МРТ, радионуклидные исследования, эндоскопия, лапароскопия, пункционная биопсия, релапаротомия, аутопсия. Сроки выявления рецидивов и метастазов варьировали от 2 до 54 мес, в среднем 15,5 мес. В сроки до 1 года они были диагностированы у 20 больных, от 1 до 3 лет — у 15, более 3 лет — у 2 больных (табл.3).
Изолированные рецидивы: локальный (внутрипросветный), а также регионарный (в мягких тканях зоны чревного ствола) с морфологическим подтверждением были диагностированы у 1 больного каждый. У абсолютного большинства больных (35) были выявлены отдаленные метастазы. Среди них преобладал канцероматоз брюшины (23 больных), в том числе в сочетании с поражением яичников (4). Гематогенные метастазы развились у 11 больных, при этом имело место поражение печени (7), костей скелета (3), легких (1). Только в одном случае было зарегистрировано сочетание перитонеальных и гематогенных метастазов.
Факторный анализ показал, что больные, у которых развивались перитонеальные и гематогенные метастазы, имели существенные различия клинико-морфологических параметров. Так, в структуре развития метастазов (37 больных) поражение брюшины было значительно чаще по сравнению с гематогенными метастазами при инвазии опухоли в серозную оболочку и окружающие органы (57 и 18%), при тотальном поражении желудка (22 и 0%), при перстневидно-клеточном и недифференцированном раке (57 и 18%); все различия близки к границе статистической значимости (р=0,055—0,065). В то же время частота поражения регионарных лимфатических узлов не различалась (65 и 64%); поражение лимфатических узлов второго коллектора было чаще у больных с гематогенными метастазами (55 и 35%). Однако различие в связи с малым количеством наблюдений статистически недостоверно (р=0,45). Также весьма важным фактором развития обоих видов метастазов было субциркулярное и циркулярное поражение желудка опухолью, имевшее место в 73—83% случаев.
У единственной больной с синхронными метастазами по брюшине, в печени и легких имелось сочетание описанных выше факторов прогноза: прорастание опухоли в серозную оболочку (рТ4а), множественные метастазы в регионарных лимфатических узлах (pN3а), в том числе в трех лимфатических узлах левой желудочной и общей печеночной артерий, наличие умереннодифференцированной аденокарциномы с субциркулярным поражением желудка.
Таким образом, частота развития изолированного локального и регионарного рецидивов была исключительно низкой. Преобладают отдаленные метастазы, среди которых доминирует канцероматоз брюшины. Сочетание клинико-морфологических параметров является достоверным фактором прогноза путей метастазирования.
Обсуждение
В последние годы в ведущих клиниках хирургическое лечение рака желудка с лимфодиссекцией D2 сопровождается следующими показателями течения раннего послеоперационного периода: послеоперационная летальность составляет 0—7%, послеоперационные осложнения развиваются у 16—29% больных (в том числе несостоятельность швов анастомозов — у 0—5%, абсцесс брюшной полости и перитонит — у 2—6%); релапаротомии выполняются у 3—5% пациентов [2, 3, 6—8]. В популяционном исследовании 2010 г., проведенном в ряде Европейских стран, показатель послеоперационной летальности был существенно выше и варьировал от 5,2—6,4% (Италия, Франция, Англия) до 11—16% (Испания, Голландия, Словения, Польша) [10]. В опубликованном анализе [11] 30-дневная летальность после выполнения более чем 9000 гастрэктомий и резекций желудка в странах Северной Европы составила 3,5—6,9%. Таким образом, полученные нами результаты (летальность — 0,45%; частота осложнений — 6%, в том числе отсутствие несостоятельности швов анастомозов, абсцессов брюшной полости и панкреонекроза; количество релапаротомий — 1,8%) вполне соотносятся, а во многих случаях и превосходят данные отечественных и зарубежных хирургических и онкологических центров. Многие авторы [7—9] подчеркивают исключительную важность специализации и накопления хирургического опыта в снижении показателей послеоперационной летальности и осложнений, а также выполнения операций по поводу рака желудка в многопрофильных хорошо оснащенных учреждениях.
Наши данные о частоте лимфогенного метастазирования при выполнении лимфаденэктомии D2 с учетом достаточно большого числа больных раком желудка ранних стадий вполне соотносятся с аналогичными показателями ведущих отечественных и зарубежных клиник [6, 12, 13]. Так, по данным М.И. Давыдова и соавт., А.Ф. Черноусова и соавт. [13], основанных на значительном количестве собственных наблюдений, а также анализе мировой литературы, частота поражения лимфатических узлов 2-го коллектора составляет 23—26% (в нашем исследовании — 25%). В целом совпадает и динамика увеличения частоты их поражения с увеличением категории рТ. Так, при прорастании опухоли в серозную оболочку частота метастатического поражения лимфатических узлов чревного ствола и его ветвей, по данным разных авторов, составляет 31—42% (в нашем исследовании — 37%).
Таким образом, для уточняющей диагностики распространенности лимфогенного метастазирования рака желудка ценность применения лимфодиссекции D2 сомнений не вызывает. В отношении ее лечебной значимости и влияния на отдаленные результаты лечения все не так однозначно. Об этом свидетельствуют как продолжающиеся рандомизированные Европейские исследования D1 против D2 [4], так и попытки ответить на вопрос, может ли адъювантная химиолучевая терапия быть ее альтернативой [14]. Совершенно очевидно, что расширение объема лимфодиссекции не может привести к увеличению показателя выживаемости у всех больных раком желудка, особенно при высоком риске раннего имплантационного метастазирования [15]. Более того, она может способствовать диссеминации раковых клеток в брюшной полости [16].
Изучение закономерностей развития рецидива рака желудка является ключевым моментом как в плане оценки возможностей хирургического лечения, так и разработки оптимальных схем адъювантной терапии. Поскольку оперативное вмешательство, включая лимфодиссекцию, является методом локорегионарного воздействия, основным показателем качества их выполнения является именно данный вид контроля. Мы полностью разделяем мнение В.И. Чиссова и соавт. [12], С.Н. Нереда и соавт. [15] о том, что развитие отдаленных метастазов связано в первую очередь с клинико-морфологическими характеристиками опухолевого процесса, а не с видом и объемом хирургического лечения. Данные относительно преимущественного влияния биологических особенностей перстневидно-клеточного и недифференцированного рака желудка на закономерности метастазирования были получены в МРНЦ и ранее опубликованы [17, 18].
Из 220 оперированных больных и 37 зарегистрированных случаев прогрессирования опухоли только у 1 больного имел место локальный рецидив и у 1 больного — регионарный рецидив. У 35 больных были выявлены отдаленные метастазы, из которых более 2/3 составили случаи канцероматоза брюшины. По данным ведущих отечественных и зарубежных авторов, количество локорегионарных рецидивов в настоящее время составляет 16—20% [2, 7, 8, 12]. Исключительно низкая частота развития изолированных локальных и регионарных рецидивов в нашем исследовании мы связываем с двумя основными причинами: выполнением адекватного объема хирургического вмешательства на желудке и на лимфоколлекторах; ранней манифестацией отдаленных метастазов, прежде всего перитонеальных, у больных местно-распространенным, низко- и недифферецированным раком желудка. В последнем случае выявление регионарного рецидива крайне затруднительно и не имеет практического значения.
Таким образом, основной задачей проводимых во всем мире клинических исследований является разработка оптимальных схем неоадъювантной и адъювантной терапии, направленной на профилактику развития отдаленных метастазов, в том числе вызванных диссеминацией раковых клеток во время оперативного вмешательства [14, 19—21]. Так, в рамках рандомизированного исследования T. Kim и соавт. [20] показали, что адъювантная химиолучевая терапия по сравнению с химиотерапией после гастрэктомии D2 способствует статистически достоверному улучшению безрецидивной выживаемости больных раком желудка III стадии. Перспективным направлением является и разработка неоадъювантной терапии, целью которой, кроме системного воздействия, являются регрессия первичной опухоли и регионарных метастазов и достижение увеличения R0 резекций [21].
Заключение
В настоящее время основным объемом оперативного вмешательства по поводу рака желудка является гастрэктомия D2, которая в специализированных центрах может выполняться с низкими показателями послеоперационных осложнений и летальности. Применение лимфодиссекции D2 показывает высокую частоту лимфогенного метастазирования, в том числе во второй коллектор лимфооттока, особенно при прорастании опухоли за пределы субсерозного слоя. Адекватный объем оперативного вмешательства на желудке и лимфоколлекторах приводит к низкой частоте развития изолированного локального и регионарного рецидивов. В структуре прогрессирования рака желудка преобладают отдаленные метастазы, среди которых доминирует канцероматоз брюшины. Для повышения показателей резектабельности, локорегионарного контроля и профилактики развития отдаленных метастазов необходимо оптимальное сочетание адъювантного системного (химиотерапия, таргетная терапия) и локального (лучевая терапия) воздействия.
Прогноз при раке желудка с метастазами
Пятилетняя выживаемость на 4 стадии рака желудка составляет 5%. Это означает, что только пять из ста пациентов, у которых было диагностировано заболевание, останутся живы спустя 5 лет.
В среднем спустя 3 месяца с момента диагностики рака желудка с метастазами в живых остается половина пациентов. Прогноз хуже, если рак распространился в кости и печень: при таких метастазах половина пациентов погибает в течение 2 месяцев.
| Подробнее о лечении рака желудка в клиниках «Евроонко»: | |
| Лечение рака желудка | |
| Онколог-гастроэнтеролог | 5 100 руб |
| Приём химиотерапевта | 6 900 руб |
| Скорая онкологическая помощь | от 12 100 руб |
| Консультация радиолога | 11 500 руб |
Запись на консультацию круглосуточно
+7+7+78
Осложнения метастатического рака печени
Наиболее частым осложнением вторичных опухолевых очагов в печеночной ткани является прорастание новообразования в желчный пузырь и желчевыводящие пути, что проявляется:
- болевыми ощущениями в верхних и правых отделах живота, носящими тупой и постоянный характер;
- усиленным образованием газов в кишечнике;
- некоторым повышением температуры тела, которое упорно держится на одинаковом уровне;
- нарушениями аппетита и потерей массы тела;
- тошнотой и иногда рвотой, не приносящей облегчения;
- желтушной окраской кожных покровов и белков глаз;
- усиленным потоотделением, особенно в ночное время.