Желудок у собак и кошек
Желудок у кошек и собак – это самостоятельный орган, который является частью пищеварительного тракта. Как любой орган, желудок подвержен специфическим болезням, каждая из которых имеет свое название, этиологию и патогенез. Одной из важнейших задач врача-клинициста, столкнувшегося с заболеванием желудка, является определение, с какой именно нозологической единицей он имеет дело, поскольку от этого зависит как диагностический план, так и тактика дальнейшего лечения.
Как правило, заболевания желудка, как и многие другие заболевания ЖКТ у собак, возникают в результате воспаления, изъязвления, неоплазии или обструкции. Клинические проявления заболеваний желудка схожи: чаще всего это рвота и /или позывы на рвоту, гематемезис, мелена, отрыжка, гиперсаливация, абдоминальный дискомфорт, потеря веса (при хронических болезнях). Гастриты, о которых пойдет речь в этом материале – это только часть из многочисленных болезней, связанных непосредственно с желудком. Чаще всего ветврачи имеют дело со следующими патологиями желудка:
- воспаление (гастрит);
- острое расширение;
- заворот;
- эрозии и язвы;
- неоплазии;
- нарушения моторики.
Гастрит – один из наиболее часто ставящихся диагнозов, если пациент поступает с жалобой на острую или хроническую рвоту. Между тем, синдром острой/хронической рвоты чрезвычайно часто встречается у мелких животных и в подавляющем большинстве случаев имеет множество других причин. Необходимо ясное понимание того, в каких случаях диагноз «гастрит» является правомерным. Кроме того, поскольку синдром острой/хронической рвоты может возникать в силу весьма разнообразных причин, и постановка диагноза в этом случае – непростая задача, очень важно следовать общепринятому диагностическому плану, чтобы избежать ошибок в диагностике и, в дальнейшем, в лечении пациента.
Введение
Проблема хронического гастрита интересна и многолика. Пожалуй, ни одно из заболеваний желудочно-кишечного тракта не претерпевало таких дефинициальных изменений от «хронической флегмозии» и причины смерти в наполеоновскую эпоху (Broussais F., 1808) до хронического инфекционного заболевания слизистой оболочки желудка (СОЖ), вызванной прежде всего бактерией Helicobacter pylori (Marshall В. и Warren J., 1984), от функционального заболевания до формирования его «морфологической сущности». На сегодняшний день мы говорим о хроническом гастрите как о наиболее распространенном заболевании верхних отделов пищеварительного тракта, которое морфологически характеризуется воспалительными, дистрофическими и дисрегенераторными процессами в СОЖ [1, 2].
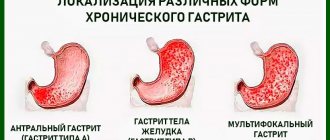
Для постановки правильного диагноза в первую очередь необходимо уточнение топики поражения, т.к. это оказывает влияние на выбор тактики лечения и выживаемость пациентов. Во-вторых, мы обязательно исследуем морфологические особенности инфильтрата, а именно наличие, распространенность (антральный отдел, тело желудка) и выраженность атрофических изменений СОЖ (рис. 1).
Ключевой этап на пути к диагнозу – установление этиологии заболевания для его дальнейшего лечения и разработки плана наблюдения за пациентом. Несомненно, H. pylori вызывает прогрессирующее повреждение СОЖ и в настоящее время воспринимается как причинный фактор при ряде серьезных заболеваний, включая язвенную болезнь и ее осложнения, а также рак желудка [3]. Но мы знаем, что еще в 1947 г. в своей монографии «Гастриты» R. Schindler, анализируя и сопоставляя эндоскопические и гистологические картины повреждения СОЖ, пишет о других возможных его причинах (дуодено-гастральный рефлюкс, нарушение кровоснабжения и др.).
Ключевым моментом при анализе и систематизации этиологических факторов хронического гастрита, оценке взаимосвязи структурных и функциональных изменений, патоморфологической картины внес в 2015 г. Киотский консенсус [4]. Была подчеркнута важность не только инфекции H. pylori, но и других форм гастрита, в число которых входит и аутоиммунный гастрит (АИГ).
Целью данной публикации стала актуализация информации по диагностике и лечению АИГ в медицинской практике (врача-терапевта и гастроэнтеролога) на конкретном клиническом примере.
Клинический случай
Пациентка Б. 1967 г. рождения обратилась к врачу с жалобами на тяжесть, распирающие боли в эпигастральной области через 30 минут после приема пищи, жжение в эпигастрии, изжогу после приема экстрактивной пищи. Вес пациентки стабилен, аппетит сохранен, стул ежедневный, оформленный, без патологических примесей. Со стороны других систем органов жалоб не предъявляла.
Из анамнеза заболевания известно, что жалобы на тяжесть и жжение в эпигастральной области впервые появились в 2016 г. При проведенной амбулаторно эзофагогастродуоденоскопии (ЭФГДС) были выявлены изменения в виде катарального дистального эзофагита, недостаточности кардии, гастрита с наличием эрозий в теле и верхней трети желудка (изменения слабые, на фоне субатрофии слизистой оболочки антрума), рубцовой деформации луковицы двенадцатиперстной кишки (ДПК), бульбита. Ранее эндоскопического исследования желудка, со слов пациентки, не проводилось, в связи с чем установление давности язвенной болезни ДПК не представляется возможным. При морфологическом исследовании гастробиоптата, взятого из антрума, выявлены поверхностные фрагменты слизистой оболочки антрального отдела желудка с наличием слабой мононуклеарной воспалительной инфильтрации собственной пластинки; колонизация H. pylori не выявлена. По результатам общего и биохимического анализов крови патологии выявлено не было. Пациентка наблюдалась с диагнозом «гастроэзофагеальная рефлюксная болезнь, неэрозивная форма, неосложненное течение. Недостаточность кардии. Хронический H. pylori – негативный гастрит со слабой атрофией антрального отдела и наличием эрозий тела и верхней трети желудка. Язвенная болезнь ДПК в анамнезе: рубцовая деформация луковицы ДПК». Была проведена беседа о возможных побочных эффектах от приема препаратов, обладающих повреждающим действием на слизистую оболочку желудка и ДПК (ацетилсалициловая кислота, нестероидные противовоспалительные препараты) [5], прием которых больная отрицала. Пациентка получала ингибиторы протонной помпы, препараты висмута трикалия дицитрата в стандартной дозировке в течение 4 недель, что привело к полному заживлению эрозий по результатам контрольной ЭФГДС. Рекомендовано повторное проведение ЭФГДС через год с забором биоптатов по стандартному протоколу для мониторинга атрофии СОЖ.
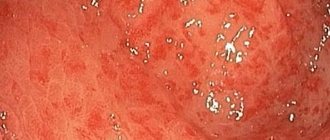
При проведении ЭФГДС в декабре 2022 г. выявлено: пищевод свободно проходим, просвет округлой формы, складки продольные, расправляются воздухом, стенки эластичные, слизистая оболочка бледно-розового цвета, кардия зияет; желудок в форме крючка средних размеров, свободно расправляется воздухом, стенки эластичные, складки извиты, средние по высоте, перистальтика умеренная, прослеживается во всех отделах, СОЖ пятнисто гиперемирована, в кардиальном отделе мелкоочаговая гиперплазия слизистой оболочки 2–3 мм (рис. 2), пилорус в виде овального отверстия, смыкается; ДПК – луковица округлой формы, просвет кишки овальный, складки циркулярные, слизистая оболочка проксимального отдела умеренно гиперемирована, большой дуоденальный сосочек не изменен, в нисходящей ветви по латеральному краю имеется приподнято-плоское образование до 5–6 мм (рис. 3), поверхность гиперемирована. Заключение по ЭФГДС: недостаточность кардии, диффузный поверхностный (эритематозный) гастрит, мелкоочаговая гиперплазия кардиального отдела желудка, дуоденит, очаговая гиперплазия ДПК.
Эндоскопический забор фрагментов СОЖ проведен в соответствии с рекомендациями (протоколом) OLGA-system [6]: три биоптата из антрального отдела (большая и малая кривизна, угол желудка) и два биоптата из тела желудка (передняя и задняя стенки). После процедур стандартной проводки материала и заливки в парафин выполнено окрашивание гистологических срезов гематоксилином и эозином. Для выявления H. pylori применяли окраску 0,1%-ным толуидиновым синим, использовали альциановый синий (рН=2,5) в сочетании с ШИК-реакцией для определения очагов кишечной и псевдопилорической метаплазии. При исследовании биопсийного материала обнаружены умеренная мононуклеарная воспалительная инфильтрация, признаки атрофии желез умеренной степени как в антральном отделе, так и в теле желудка.
При этом в антральном отделе отмечено наличие неметапластической атрофии, характеризовавшейся укорочением желудочных (пилорических) желез с признаками фиброза собственной пластинки. В теле желудка количественный дефицит желез сочетался с признаками метапластической атрофии, хорошо выявляемой при использовании дополнительных гистохимических окрасок (рис. 4): оригинальные фундальные железы очагово были замещены слизепродуцирующим цилиндрическим эпителием, напоминающим пилорические железы (псевдопилорическая метаплазия), а также кишечным эпителием с наличием бокаловидных клеток и щеточной каемки (полная кишечная метаплазия, тип I). Колонизация H. pylori при гистобактериоскопии не выявлена. Во фрагменте ДПК – сохранная гистоархитектоника, умеренная лимфоплазмоцитарная инфильтрация собственной пластинки с примесью эозинофильных лейкоцитов.
По критериям OLGA-system морфологические признаки хронического гастрита соответствовали степени III, стадии III.
Из анамнеза жизни известно, что пациентка родилась в Омской области доношенным, здоровым ребенком, работает. Туберкулез, вирусный гепатит, венерические заболевания отрицает. Травм, операций не было. Гемотрансфузии отрицает. Аллергологический, наследственный анамнез не отягощены. Из сопутствующих заболеваний – аутоиммунный тиреоидит, эутиреоз (уровень тиреотропного гормона, свободного Т3 и Т4 в норме).
При осмотре состояние пациентки удовлетворительное, сознание ясное, телосложение правильное, тип конституции смешанный, питание достаточное. Рост – 166 см, вес – 70,0 кг, индекс массы тела – 25,4 кг/м2. Кожные покровы бледно-розового цвета, сухие. Видимые слизистые оболочки бледные, чистые. Зев бледно-розового цвета, чистый, миндалины не увеличены. Лимфоузлы не пальпируются. Щитовидная железа 0-й степени по ВОЗ. Суставы не деформированы, ограничений активных и пассивных движений нет. Позвоночник искривлен (сколиоз), при пальпации безболезненный. Грудная клетка симметричная неправильной формы, сколиотическая. Перкуторно над легкими ясный легочный звук. Дыхание везикулярное, хрипов нет. Границы сердца в норме. Тоны сердца ритмичные, приглушены, 70 в минуту. Артериальное давление 130/70 мм рт.ст.
Язык влажный, обложен густым бело-желтым налетом у корня. Живот при поверхностной пальпации мягкий, безболезненный. При глубокой пальпации болезненность в эпигастрии, в проекции антрального отдела желудка. Симптомы напряжения брюшины отрицательные. Симптомы желчного пузыря: Кера, Ортнера – отрицательные, Мерфи – слабоположительные. Печень не увеличена, край гладкий, эластичный, безболезненный. Поджелудочная железа при пальпации по Гроту безболезненная. Селезенка не пальпируется. Почки не пальпируются. Симптом поколачивания отрицательный с обеих сторон. Отеков нет.
Таким образом, мы наблюдаем у пациентки с синдромом эпигастральной боли атрофические изменения слизистой оболочки антрального отдела и тела желудка с большей выраженностью морфологических изменений в теле, сочетание разнообразных форм атрофии (абсолютной в антральном отделе и метапластической в теле). Дважды проведенные эндоскопическое и морфологическое исследования говорят нам об отсутствии инфекции H. pylori, что стало причиной поиска других причин формирования подобных изменений. И безусловно, опираясь на данные о наличии атрофии слизистой оболочки тела желудка, мы рассмотрели возможность аутоиммунного характера заболевания.
Обсуждение
Впервые об атрофическом АИГ сообщил Томас Аддисон, который в 1849 г. описал «выдающуюся форму анемии», позднее названную пернициозной. В 1860 г. Флинт связал ее с развитием атрофии СОЖ. Успешное лечение сырой печенью позволило предположить, что мегалобластная анемия была вызвана недостаточностью внешнего (витамина В12) и внутреннего факторов Кастла в желудочном соке. Открытие антител к внутреннему фактору Шварцем в 1960 г. и антител к париетальным клеткам Ирвиным в 1962 г. обосновало иммунологическую природу атрофического гастрита, приводящего к пернициозной анемии [7, 8]. АИГ был описан в 1965 г. O.R. Mclntyre et al. у пациентов с пернициозной анемией, у которых выявляли гистаминоустойчивую ахлоргидрию, атрофию СОЖ и антитела к внутреннему фактору Кастла [9].
Распространенность АИГ в популяции составляет от 1 до 5%, по некоторым данным – до 15%, однако широкомасштабных эпидемиологических исследований, посвященных этому заболеванию, до сих пор проведено не было [10–12]. Указывалось, что возникновение АИГ ассоциировано с населением Северной Европы, однако последние исследования не поддерживают подобную этническую кластеризацию также ввиду недостаточности эпидемиологических данных. Однако все исследователи сходятся во мнении о частой встречаемости АИГ у лиц женского пола старшей возрастной группы, как и в нашем клиническом примере.
Клинические проявления АИГ можно представить в виде гастроэнтерологического, гематологического и неврологического синдромов, что обусловлено прогрессирующей атрофией СОЖ с постепенным угасанием активной желудочной секреции и выработки фактора Кастла, необходимого для усвоения витамина В12. Течение заболевания может быть и бессимптомным. Гастроэнтерологический синдром характеризуется симптомами желудочной диспепсии: тяжесть в эпигастральной области, возникающая во время или вскоре после еды, а также снижение аппетита, отрыжка (пустая, горького вкуса, с неприятным запахом), редко – тошнота и рвота, приносящая облегчение [13].
У пациентов с развернутым АИГ может наблюдаться железодефицитная анемия с типичными проявлениями в виде слабости, головокружения, сидеропенических симптомов. Гипохромная анемия (у 15% пациентов) может быть вызвана ахлоргидрией, т.к. соляная кислота важна для абсорбции негемового железа, составляющего две трети необходимого суточного количества железа у лиц, придерживающихся «западного типа питания» [14]. В связи с повышенной потребностью в железе в молодом возрасте и у половозрелых женщин его дефицит может предшествовать таковому кобаламина в течение многих лет – до тех пор, пока потеря внутреннего фактора не станет критичной для тех больных, у кого развивается типичная пернициозная анемия, в некоторых случаях сопровождающаяся гастроэнтерологическими симптомами (эрозии желудка) и фуникулярным миелозом.
Отсутствие патогномоничных клинических признаков АИГ обосновывает важность оценки эндоскопических и морфологических изменений СОЖ в теле и антральном отделе. СОЖ демонстрирует изменения от минимальных воспалительных до выраженной атрофии, максимально проявляющейся в теле желудка, с псевдополипозными и/или полипозными разрастаниями, что связано с чередованием атрофических участков СОЖ и гипертрофированных участков обкладочных и G-клеток, активизирующихся в условиях снижения секреции соляной кислоты.
При гастроскопии СОЖ истонченная, бледная с сероватым оттенком, складки слизистой оболочки продольные, извитые, просвечивают сосуды подслизистого слоя, могут обнаруживаться полипы (гиперпластические, аденоматозные и др.) [15, 16].
При исследовании биопсийного материала на ранних стадиях в слизистой оболочке тела желудка наблюдается многофокальная лимфоплазмоцитарная инфильтрация с проникновением в более глубокую железистую часть. Железы могут быть разрушены фрагментарно, а париетальные клетки могут подвергаться псевдогипертрофическим изменениям. Поскольку эти изменения неспецифичны, морфологи могут неправильно интерпретировать результаты без информации о сывороточных маркерах. Метаплазия, хроническое воспаление всех слоев стенки желудка и полная деструкция желез определены как ранние неспецифические изменения при АИГ. Кроме того, ранней находкой при АИГ может быть гиперплазия эндокринных клеток.
В нашем клиническом случае для выявления гиперплазии нейроэндокринных клеток использовали иммуногистохимический метод детекции с антителами к хромогранину А (клон SP12, Spring, США) и безбиотиновую систему детекции UnoVue (Diagnostic BioSystems, США), первичную высокотемпературную демаскировку антигена в гистологических срезах проводили на водяной бане в цитратном буфере (рH=6,0) в течение 30 минут. При реакции с хромогранином А в теле желудка определяли признаки гиперплазии нейроэндокринных ECL-клеток (рис. 5), определяемой по критерию наличия мелких кластеров из ≥5 позитивно-окрашенных клеток, расположенных в цепочку [17].
По мере прогрессирования заболевания обнаруживается диффузная лимфоплазмоцитарная инфильтрация собственной пластинки СОЖ с участками выраженной атрофии желез, отчетливо проявляется кишечная метаплазия. Конечная стадия заболевания характеризуется уменьшением или полной потерей желез тела желудка; более того, могут быть найдены псевдополипы или гиперпластические полипы, а воспалительная инфильтрация снижается по сравнению с более ранними стадиями заболевания [18, 19]. Обращает на себя внимание тот факт, что вышеописанные изменения при АИГ максимально проявляются в теле желудка по сравнению с антральным отделом, поэтому забор биоптатов следует выполнять по стандарту OLGA, как и было выполнено в представленном клиническом случае.
Обсуждается вопрос эффективности применения в диагностике АИГ pH-метрии желудка, однако данный метод не может отобразить всей полноты объема желудочной секреции и является технически трудной и инвазивной для пациента процедурой [120], что огранивает его использование в настоящей клинической ситуации.
Не менее важным элементом диагностики АИГ является серологическое исследование: определение увеличения в сыворотке количества антител типа IgG к париетальным клеткам, антител типа IgG к Н+/К+-АТФазе (аденозинтрифосфатаза протонной помпы) в париетальной клетке, что клинически сопровождается умеренной или выраженной секреторной недостаточностью, а также антител типа IgG к внутреннему фактору Кастла, что клинически проявляется гиперхромной В12-дефицитной анемией, гипопепсиногенемии-1 и гипергастринемии в исходе функциональной гиперплазии антральных G-клеток. Антитела к внутреннему фактору продемонстрировали в исследованиях низкую чувствительность [21], однако их рост был отмечен при прогрессировании заболевания [22]. Стоит обратить внимание на то, что уровень витамина В12 не коррелирует с титрами антител к фактору Кастла [23]. Уровень же антител к париетальным клеткам характеризуется высокой специфичностью, но не коррелирует с тяжестью заболевания, что закономерно ввиду прогрессирующей атрофии желез желудка при АИГ [24], но эти специфические аутоантитела могут предшествовать клиническим симптомам в течение длительного срока, как продемонстрировано в ряде других аутоиммунных нарушений [25]. Уровни гастрина и пепсиногена не специфичны для диагностики АИГ, но предсказывают уровень атрофии. В целом определение антител к париетальным клеткам желудка считается оптимальным скрининговым тестом для АИГ, а определение антител к внутреннему фактору – резервной методикой для подтверждения диагноза. Нередко выявляются антитела к Н. pylori, однако роль этой инфекции в развитии АИГ спорна: участие Н. pylori в развитии атрофии СОЖ объясняется феноменом антигенной мимикрии [26, 27], что продемонстрировано на рис. 6.
Обсуждается роль грелина в качестве маркера выраженности атрофии слизистой оболочки тела желудка пациентов с АИГ [28]. Подобную взаимосвязь авторы объясняют анатомическими особенностями близкого расположения грелин-иммуннореактивных клеток в СОЖ и париетальных клеток, которые становятся клетками-мишенями при аутоиммунном поражении. Исследователи установили, что уровень грелина негативно коррелирует с выраженностью атрофических изменений и может их предсказывать с более высокими чувствительностью и специфичностью по сравнению с гастрином и пепсиногеном.
Известна взаимосвязь АИГ с другими заболеваниями аутоиммунного характера, что требует более тщательного обследования таких пациентов. Имеются данные о нередкой его ассоциации с сахарным диабетом 1 типа. Также АИГ может сосуществовать с полигландулярными аутоиммунными синдромами, но наиболее распространена его ассоциация с аутоиммунным тиреоидитом («тиреостатический аутоиммунитет»): более 50% пациентов, страдающих АИГ, имеют циркулирующие антитиреопероксидазные антитела [29], как и в случае с нашей пациенткой. Сообщалось об значимых ассоциациях АИГ с витилиго, алопецией, целиакией, миастенией и аутоиммунным гепатитом [30, 31].
Учтя имеющиеся данные эндоскопического и морфологического исследований, анамнез аутоиммунного тиреоидита у нашей пациентки, мы провели дополнительное обследование для уточнения причин выявленных изменений: по результатам общего анализа крови – без патологии; биохимический анализ крови – выявлено увеличение уровня триглицеридов до 1,94 ммоль/л; копрограмма – без патологии; цианокобаламин, железо сыворотки, общая железосвязывающая способность сыворотки, трансферрин, ферритин – в норме, антитела классов IgG и IgM к описторхозу, лямблиозу, токсокарозу не выявлены; гельминтологическое исследование кала комплексным сверхчувствительным методом – яйца гельминтов не выявлены. По результатам абдоминального ультразвукового исследования – диффузные изменения поджелудочной железы. Пациентке также было проведено исследование антител в сыворотке крови к фактору Кастла и париетальным клеткам: антитела к внутреннему фактору Кастла – 40,1 ЕД/мл при норме 0–6 ЕД/мл, антитела к париетальным клеткам желудка – титр 1:85 при норме до 1:40. Таким образом, больной был выставлен окончательный диагноз «гастроэзофагеальная рефлюксная болезнь, неэрозивная форма, неосложненное течение. Недостаточность кардии. Хронический атрофический Н. pylori негативный, аутоиммунный гастрит. Дуоденит. Язвенная болезнь ДПК в анамнезе: рубцовая деформация луковицы ДПК».
Пациенты с АИГ имеют более высокий риск развития рака в хронически воспаленной ткани желудка, согласно каскаду Корреа (1988). Мета-анализ от 2012 г. демонстрирует, что годовая заболеваемость аденокарциномой желудка составляет 0,27% на человеко-год с общим относительным риском 6,8% [32]. К тому же хроническая ахлоргидрия увеличивает выработку гастрина G-клетками в антруме, который затем стимулирует энтерохромафинные клетки, что приводит к их гиперплазии и развитию карциноидов желудка [33, 34]. Имеющие данные говорят о необходимости наблюдения и лечения АИГ.
Стандарты ведения пациентов с данным заболеванием отсутствуют. С учетом изменения СОЖ при АИГ (атрофия, кишечная метаплазия) отечественными согласительными документами рекомендовано динамическое эндоскопическое наблюдение, но, к сожалению, без указаний на кратность. Более подробную информацию мы можем найти в рекомендациях по ведению пациентов с предраковыми состояниями и изменениями желудка (Guidelines for the Management of Precancerous Conditions and Lesions in the Stomach – MAPS) [35]. При выборе метода исследования для диагностики и наблюдения за пациентами с подобными изменениями следует предпочесть увеличительную хромо- и узкоспектральную эндоскопию (как с увеличением, так и без него). Для адекватной диагностики предраковых изменений необходимо выполнить как минимум 4 нецелевые биопсии из двух топографических зон (тело, антрум) и брать целевой биопсийный материал из визуально измененных зон, а для оценки степени риска развития рака желудка следует использовать современные диагностические системы гистопатологического стадирования изучаемой патологии (OLGA). Пациенты с низкой степенью дисплазии и без эндоскопических повреждений могут проходить следующую эндоскопию через год. При наличии эндоскопических повреждений желательна эндоскопическая резекция с внимательным морфологическим исследованием. При высокой степени дисплазии и отсутствии эндоскопических повреждений требуется немедленно повторить эндоскопию с обширными биопсиями и тщательным наблюдением от 6 месяцев до 1 года. Учтя наличие в нашем клиническом случае кишечной метаплазии, мы рекомендовали пациентке проведение эндоскопического контроля через год с применением хромоэндоскопии и взятием гастробиоптатов по стандарту OLGA.
Этиопатогенетическая терапия АИГ не разработана. Стандартным заместительным лечением служат регулярные ежемесячные инъекции витамина В12 в дозе 100 мкг для коррекции его дефицита. Наиболее частым режимом поддерживающей терапии являются инъекции витамина В12 по 1000 мкг каждые 3 месяца [13]. Классическая схема лечения предполагает ежедневные внутримышечные инъекции витамина В12 в дозе 100 мкг в течение 1 недели с дальнейшим ежемесячным введением по 100 мкг. В тяжелых случаях показано парентеральное введение по 1000 мкг в день в течение 1 недели с дальнейшим назначением 1000 мкг в неделю в течение 1 месяца, затем – ежемесячно внутримышечные инъекции 1000 мкг.
Доказано, что у данной категории больных эрадикационная терапия ассоциируется с уменьшением активности и выраженности гастрита и в 80% случаев обеспечивает отсутствие прогрессирования атрофии СОЖ при наблюдении на протяжении 2 лет. Таким образом, проведение эрадикации у пациентов с АИГ при наличии H. pylori служит важным аспектом лечения этого заболевания [36, 37]. В начальной и прогрессирующей стадиях болезни с сохраненной секреторной функцией желудка при серьезном нарушении иммунных процессов назначаются глюкокортикостероиды (короткими курсами, средними дозами, не превышающими 30 мг преднизолона в сутки при условии проведения иммунных тестов). Отсутствие эффекта делает проведение повторного курса такой терапии нецелесообразным.
Кроме того, схема терапии АИГ должна включать лечение диспепсического синдрома с применением в дебюте заболевания антисекреторных препаратов и прокинетиков. В комплекс лечения включают также обволакивающие лекарственные средства, а при формировании секреторной недостаточности используют средства заместительной терапии [38].
Рассматривая АИГ с позиций атрофического гастрита, можно рекомендовать в прогрессирующих стадиях препараты, стимулирующие выработку соляной кислоты. В настоящее время существует масса лекарственных средств, которые «теоретически» должны оказывать стимулирующее действие на париетальные клетки. Однако в реальной клинической практике эффективность большинства из них весьма незначительна, а продолжительность действия короткая.
Следует все же упомянуть о некоторых методах стимулирующей терапии:
- минеральные воды (Ессентуки № 4, № 17, Нарзан, Миргородская) применяют в теплом виде за 15–20 минут до еды;
- отвар шиповника, а также лимонный, капустный, томатный соки, разведенные кипяченой водой;
- лекарственные сборы (подорожник, зверобой, полынь, чабрец). Особенно широко в практике используется Плантаглюцид – гранулы листьев подорожника, который применяют по 1 чайной ложке 3 раза в день с теплой водой за 20 минут до еды;
- Лимонтар (лимонная и янтарная кислота) по 1 таблетке 3 раза в день за 20 минут до еды [39].
Целесообразно рассматривать в качестве средства терапии АИГ и мукоцитопротекторы, улучшающие трофику и регенерацию СОЖ, а также, возможно, снижающие риск канцерогенеза. К таким препаратам можно отнести висмута трикалия дицитрат, ребамипид [40].
Данные о применении при АИГ ингибиторов протонной помпы с позиций влияния на атрофию СОЖ спорны и неоднозначны [41, 42]. В данном вопросе, вероятно, необходимо индивидуально подходить к вопросу о взаимосвязи причин повреждения СОЖ и возникновения атрофии с учетом прогрессирования заболевания и прогноза.
В рамках нашего клинического случая мы рекомендовали длительный прием пантопразола по 40 мг за 30 минут до завтрака, чередование курсов мукоцитопротекторов (висмута трикалия дицитрат 120 мг 4 раза в сутки за 30 минут до еды и ребамипид по 100 мг 3 раза в сутки по 4 недели) с приемом Плантоглюцида по 1 чайной ложке 3 раза в сутки с 100 мл теплой воды за 15 минут до еды в течение 4 недельс последующим наблюдением: выполнение ЭФГДС с увеличительной хромоэндоскопией и забором биоптатов, согласно протоколу OLGA-system, в сочетании с прицельным забором биоптатов измененной СОЖ через 6 месяцев.
Заключение
Таким образом, в каждом конкретном случае хронического гастрита важна оценка причинного фактора повреждения СОЖ, а также степени, вида, распространенности морфологических изменений слизистой оболочки (тело, антральный отдел желудка), что требует не только учета анамнестических данных и результатов физикального исследования, но по большей части грамотного анализа результатов эндоскопического и морфологического исследований. Тесная взаимосвязь клинициста и морфолога в вопросах дифференциальной диагностики хронического гастрита – залог правильности постановки диагноза и выбора тактики ведения пациента.
Желудок – строение
Желудок состоит из 4 функциональных отделов: кардия, дно, тело и антральный отдел.
- кардиальный отдел отвечает за контроль поступления пищевого кома из пищевода в желудок (а эзофагеальный сфинктер препятствует обратному поступлению его в пищевод);
- тело и дно желудка обладают большой способностью к растяжению (прием большого объема пищи);
- антральный отдел имеет более толстую мышечную стенку (перетирание и гомогенизация пищевой массы перед поступлением в кишечник);
- пилорический сфинктер контролирует поступление химуса в кишечник.
Гистологическое строение желудка соответствует таковому любого трубчатого органа (см. схему ниже). Эпителий желудка является секреторным и продуцирует как защитный буфер для слизистой, так и пищеварительные ферменты (тип секреции зависит от месторасположения эпителия по отделам желудка).
Принципиальная схема строения трубчатого органа, с сайта https://www.vetmed.vt.edu
Автор рекомендует этот интернет-ресурс как настоящий кладезь учебной информации с очень доступными объяснениями, рисунками и микрофотографиями
Хронический атрофический гастрит: что пишет патологоанатом, что должен понять и сделать клиницист
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Пришло время для выступления Алексея Владимировича Кононова из Омска.
Алексей Владимирович Кононов, профессор:
– Дорогие коллеги, мы сегодня поговорим с вами о взаимоотношениях специалистов в таком сложном деле, как канцерпревенция и курации пациентов с предраковыми состояниями и предраковыми изменениями. Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Что делать, когда термин «атрофия», «атрофический гастрит» появляется в патологоанатомическом заключении? На сегодняшний день как будто бы проблем с этим нет. Существует основной классификационный вариант для оценки атрофии слизистой оболочки – это модифицированная сиднейская система, где в визуально-аналоговой шкале эти состояния ранжированы на уровни: нет атрофии, слабая, умеренная, выраженная, как в теле, так и в антральном отделе желудка. Но проблема состоит вот в чем. Проблема состоит в том, что для точной идентификации атрофии даже по модифицированной сиднейской системе необходим не один фрагмент слизистой оболочки, не два фрагмента, а 5 фрагментов, взятых по протоколу: по большой и малой кривизне тела желудка, в области угла желудка и по большой и малой кривизне в антральном отделе желудка. Больше того, когда в 2008 году мы получили новую классификацию хронического гастрита, где атрофия и воспаления оцениваются как интегральные понятия на уровне целого органа, то это взятие биоптата из 5 точек является просто необходимой процедурой, без которой система, которая получила название OLGIM, просто не работает.
Вот это визуально-аналоговая шкала, отечественный вариант ее. По уровню абсцисс и ординат пиктограммы изменения слизистой оболочки – слабая, выраженная, умеренная атрофия в теле, в антральном отделе, а на перекрестии стадия, выраженность на уровне целого органа атрофических изменений. Точно так же построена шкала для оценки воспалительных изменений, которые называются степенью гастрита, там тоже пиктограммы. Смотрите, вот это воспалительный инфильтрат, причем здесь интегрально и нейтрофильные лейкоциты, и мононуклеары, которые, по сути, собой представляют воспалительный ответ слизистой оболочки, и мукозальный иммунитет одновременно. Проблема состоит в том, что появилось новое понимание атрофии слизистой оболочки. Это не просто уменьшение объема желез в теле и антральном отделе, но и замена их метаплазированным эпителием. Это так называемая метапластическая атрофия, и вот ее место в каскаде Пелайо Корреа. Причем сам, кстати, Пелайо Корреа очень положительно относится к этому термину и идентификации кишечной метаплазии с оценкой вместе с атрофией слизистой оболочки. Проблема возникает в другом. Иногда воспалительный инфильтрат настолько раздвигает желудочные железы, что возникает феномен так называемой неопределенной атрофии.
Вот давайте полечим больного, воспалительный инфильтрат рассосется частично в результате апоптоза воспалительных клеток, частично в результате миграции по лимфатическим сосудам, межтканевым щелям и так далее, а потом мы посмотрим. Но если выраженная кишечная метаплазия, то она никуда не исчезнет. Эксперты Маастрихт-4 считают, что метаплазия не подвергается обратному развитию, поэтому вот понимание кишечной метаплазии приобрело некоторое такое мистическое направление. Вдобавок она еще разработана по типам – полная, неполная метаплазия, тонкокишечная, толстокишечная, тип IIA, IIВ и так далее. Все это приводит к тому, что появляются мысли: а не является ли собственно кишечная метаплазия прекурсором, предшественником рака желудка кишечного типа? Ну, по этому поводу написаны горы статей и сломаны многочисленные копья, на сегодняшний день все упирается в Кохрановский обзор от сентября прошлого года. Доказательных, совершенно выстроенных по критериям медицины, основанной на доказательствах, исследований в отношении того, что кишечная метаплазия предрак, нет, поэтому давайте прислушаемся к личному мнению Дэвида Грэхема, который высказывается, как всегда, четко, ясно и совершенно понятно: кишечная метаплазия на сегодняшний день – это надежный показатель атрофии слизистой оболочки. Есть кишечная метаплазия – значит, есть атрофия слизистой оболочки.
Кстати говоря, вот наши прибалтийские коллеги опубликовали в январском номере этого года «Вирховского архива» – уважаемый, авторитетнейший патологоанатомический журнал Европы – такую статью, где они сравнили кишечную метаплазию, взятую в качестве детекции атрофии, и систему OLGIM. Оказалось, что критерий согласия экспертов выше там, где в качестве маркера атрофии применяли кишечную метаплазию. Правда, деликатно замечают наши коллеги, есть стадии атрофического гастрита, когда только кишечной метаплазии для детекции собственно атрофии недостаточно. Что еще пишут про кишечную метаплазию и атрофию? Оказывается, мы можем очень тесно сотрудничать с врачами эндоскопической диагностики. Мы можем говорить об уровне выраженности атрофических изменений, определяя стадию, а врачи эндоскопической диагностики определяют площадь очагов кишечной метаплазии, как это блестяще показал сегодня Сергей Владимирович, и вот это сочетание дает более точный прогноз канцерогенеза у конкретного пациента. Неопластические изменения, собственно, опухолевые уже изменения, когда эпителиальная клетка встала на опухолевый путь. Началось все с падуанских вопросов почти 20 лет назад, все это закончилось хорошо известной вам, уважаемые коллеги, Венской классификацией неоплазии пищеварительного тракта, которая построена, наверное, как образец для всех последующих патологоанатомических и параклинических классификаций.
Вот здесь вот слева обозначены изменения, которые находит врач эндоскопической диагностики и патологоанатом в своем заключении, а справа написано, что должен делать клиницист с пациентом. Определены дефиниции, что такое неоплазия, что такое неоплазия низкой степени, что такое неоплазия высокой степени. Мы можем просто посмотреть, пока я говорю, следующие слайды. Пожалуйста, следующий, еще следующий слайд. Неопределенная неоплазия. Вот так же, как неопределенная атрофия, так и неопределенная неоплазия – то ли это изменения регенеративные, то ли это уже действительно опухолевый процесс. А вот здесь интересная работа, которая опубликована в прошлом году в американском журнале «Клинические патологии», которая нас призывает интегрировать два этих представления – атрофию слизистой оболочки и неопластические изменения. Вот когда мы сумеем интегрировать оба этих понятия в своих заключениях, мы сможем дать точный прогноз. Я хотел бы подчеркнуть, что опухолевые изменения клеток слизистой оболочки желудка возникают не в воздухе, они возникают на фоне и в сочетании с атрофическими изменениями слизистой оболочки вообще.
Какие возможны утешения? Только ли наблюдать? Только ли брать биопсии и ставить диагноз? Сегодня мы знаем новые молекулярные клеточные мишени, открывшиеся сравнительно недавно для хорошо известного препарата на основе ионов висмута. Ну, во-первых, антиоксидантное свойство висмута. Свободные радикалы нейтрофильных лейкоцитов, возникающие при кислородном взрыве в них, нарушают ДНК стволовых клеток слизистой оболочки желудка до уровня двунитевых разрывов. Эти двунитевые разрывы подвергаются репарации, но при этом возникают мутации, накопление которых может закончиться канцерогенезом. Таким образом, препараты висмута в условиях воспалительной инфильтрации слизистой оболочки защищают ДНК, предотвращают процесс маргинализации. Это вторичная профилактика. Опять же, ионный эффект висмута великолепно продемонстрирован в попытке создания нового препарата, где висмут будет в составе растворимого соединения, и ионная активность его будет повышаться.
2 года назад Нобелевскую премию получили молекулярные биологи за изучение серпантинных рецепторов и G-белков, которые являются регуляторными путями клетки. Оказывается, в них вмешивается висмут и запускает в стволовых клетках пролиферативный стимул, и проводя эрадикацию с помощью солей висмута мы попутно решаем и вторую задачу – мы мобилизируем и стимулируем местные стволовые клетки в слизистой оболочке желудка, и если не устраняем атрофию, то по крайней мере препятствуем ее обратному развитию. Что еще появилось нового в отношении ионов висмута как фармакопрепаратов? Появились следующие результаты. Это работа, которая известна пока еще только в препринте, январский номер, она еще не вышла. О чем говорит препринт? Культура ткани и ионы висмута. Оказывается, ионы висмута обладают меньшей степенью повреждения бактериальной клетки Helicobacter рylori, нежели висмут металлический, который нанесен в виде монослоя, атомарный висмут, на носители, которые взаимодействуют с бактериальной клеткой. Нанотехнологии и антибактериальный эффект препаратов висмута – это новое.
Давайте обсудим клинический пример. Пациенту 55 лет, с диспептическими жалобами, выполнена эндоскопическая биопсия слизистой оболочки желудка. Что получил патологоанатом и что он написал? «Два фрагмента слизистой оболочки – тело и антральный отдел». Я хочу обратить ваше внимание – два фрагмента. Дальше патологоанатом по классификационной схеме, модифицированной сиднейской системе описывает ситуацию. Все очень правильно, в каждом кусочке, и он определяет изменения в теле и антральном отделе желудка. Что должен делать клиницист, получив такое заключение? Ну, прежде всего, принять, что верифицирован Helicobacter-ассоциированный атрофический гастрит. Очень хорошо. Затем он должен отметить про себя, что идентифицировать стадию по системе OLGA и. соответственно, риск рака желудка невозможно. О чем еще должен подумать клиницист? Он должен подумать, что, конечно, риск рака желудка есть, особенно если это атрофия у пациента старше 50 лет, но риск не определен. Затем он должен выполнить наверняка эрадикационную терапию, а вот уже когда он будет выполнять контрольное эндоскопическое исследование через 4 недели после окончания эрадикационной терапии, то тут необходимо, просто необходимо взять 5 биоптатов из совершенно точно по протоколу указанных точек и определить стадию атрофии по системе OLGA. Вот так это все выглядит в идеале, а вот так это выглядит в только что рассматриваемом примере, причем это обычная практика.
Давайте посмотрим, как это выглядит вообще на популяционном уровне. Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».
О чем должен думать клиницист? Не сговариваясь с Сергеем Владимировичем, мы обсудили эту ситуацию, поэтому я могу только прокомментировать. Ну, прежде всего, принять наличие у пациента предопухолевого состояния или даже предопухолевого заболевания. Затем необходимо отметить, что степень риска развития рака желудка определить невозможно. Во-первых, один фрагмент. Взятый рядышком фрагмент может показать дисплазию/неоплазию высокой степени, а еще третий может показать инвазивную карциному. Значит, весь объем образования должен быть представлен достаточно репрезентативно при повторных биопсиях, если нет возможности выполнить мукозальную резекцию так, как это написано в Европейских рекомендациях по предраковым состояниям. Ну, и, наконец, что делать врачу-гастроэнтерологу или терапевту в данной ситуации? Он должен, по крайней мере, заказать повторное исследование для того, чтобы взять биоптаты из визуально измененного участка, а также обязательно 5 биоптатов по системе OLGA для того, чтобы точно определить риск рака желудка у пациента.
И последний пример. Пациенту 55 лет с хроническим Helicobacter-ассоциированным гастритом, выраженной атрофией (стадия III) – должен отметить, риск рака желудка априори увеличен в 5-6 раз по сравнению с популяцией – выполнена успешная эрадикационная терапия. Эндоскопическое исследование через 4 недели после окончания терапии имеет следующий результат. Взяты 5 фрагментов по схеме. Вот это картинки, которые мы с вами рассматриваем в микроскоп. Это пластическая атрофия в антральном отделе, но что нас особенно взволновало – это то, что спустя месяц после окончания эрадикационной терапии в собственной пластинке слизистой оболочки в инфильтрате сохранились нейтрофильные лейкоциты. А мы с вами уже договорились, чем чреват кислородный взрыв нейтрофильных лейкоцитов, и это атрофический гастрит, кстати говоря.
Что же должен в ответ вот на эти замечания, которые сделал патологоанатом, выполнить клиницист? Как он должен интерпретировать эту ситуацию? Ну, прежде всего, констатировать успешную эрадикацию, но на этом отнюдь не успокоиться. Он должен отметить, что уровень атрофических изменений остался прежним – что, в общем, не удивительно – и это уровень, который говорит о риске рака желудка, в 5-6 раз большем, чем в популяции. Обратить особое внимание на инфильтрацию нейтрофильными лейкоцитами, то есть активность воспаления. Это скрытая угроза повреждения ДНК стволовых клеток, особенно атрофически измененной слизистой оболочки, опасность канцерогенных мутаций. А что же сделать с пациентом? А обратиться к рекомендациям Российской гастроэнтерологической ассоциации. И я хочу закончить теми же рекомендациями, которые уже цитировал глубокоуважаемый Сергей Владимирович. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута от 4 до 8 недель для обеспечения защиты слизистой оболочки желудка. Благодарю вас, уважаемые коллеги!
Функции желудка
Желудочный сок способствует началу переваривания белков (пепсин) и жиров (желудочная липаза), а также стимулирует опорожнение желудка и стимуляцию секреторной функции поджелудочной железы. Кроме того, кислота желудочного сока ограничивает пролиферацию желудочно-кишечной микрофлоры. Примечательно, что желудочная липаза сохраняет активность и в тонком кишечнике и составляет до 30% общей липазы у собак.
Желудок защищен от кислоты желудочного сока БСЖ – барьером слизистой оболочки желудка. В это понятие включают плотный эпителиальный слой, секретируемую гидрокарбонатную слизь, местную продукцию простагландинов и быструю репарацию эпителия в случае повреждения.
Причины возникновения гастрита
- Употребление лекарственных средств (нестероидных противовоспалительных препаратов — аспирин, диклофенак и др.).
- Злоупотребление алкоголем.
- Курение.
- Нерациональное питание – слишком строгая диета или употребление острой, жирной, копченой и соленой пищи.
- Различные стрессовые ситуации.
- Обратный ток желчи из желчного пузыря в 12-перстную кишку и желудок.
- Тяжелые заболевания нервной системы.
- Острое снижение кровотока в результате стресса.
- Травмы, множественные переломы.
- Инфекционные заболевания, в том числе — туберкулез, ВИЧ, сифилис, цитомегаловирус, паразитарная инфекция.
- Радиация (лучевая терапия).
- Аллергические реакции.
- Аутоиммунные нарушения и заболевания.
- Болезнь Крона.
- Другие заболевания желудочно-кишечного тракта.
Подавляющее большинство случаев хронического гастрита (85-90%) связано с инфицированием Helicobacter pylori (H.p.) – бактерией, живущей под пристеночной слизью желудка, на поверхности клеток или в межклеточных промежутках. Helicobacter pylori может проникать внутрь клеток, вызывая их дезориентацию.
Спектр действия бактерий на слизистую желудка многообразен:
- повреждение защитного барьера слизистой оболочки желудка;
- гибель клеток эпителия желудка;
- иммунные реакции, в результате которых поддерживается воспаление в слизистой желудка и 12-перстной кишки;
- увеличение выработки соляной кислоты;
- повышение риска развития язвы и рака желудка.
Микрофлора желудка
Желудок собак и кошек постоянно населяют бактерии Helicobacter spp. Это кислотоустойчивые микроорганизмы, вырабатывающие уреазу для создания буфера, защищающего их от кислоты. Некоторые другие бактерии (Proteus, Streptococcus и др.) могут временно присутствовать, однако в норме секреция кислоты и нормальная перистальтика успешно регулируют их численность. Поэтому при снижении секреторной функции слизистой может отмечаться пролиферация этих микроорганизмов. Роль Helicobacter в развитии воспаления и атрофии слизистой у кошек и собак обсуждается.
Диагноз «гастрит» — один из самых часто ставящихся ветврачами диагнозов животным, чьи владельцы обратились с жалобой на острую или хроническую рвоту. Между тем, синдром острой (хронической) рвоты далеко не всегда связан с непосредственно желудочно-кишечным трактом, а заболевания желудка – это далеко не только гастрит. Помимо воспалительных причин, болезни желудка могут быть связаны и с рядом других. В зарубежной литературе болезни желудка принято подразделять согласно их этиологии и патогенетическому механизму:
- воспаление (inflammation);
- инфекционные (инвазионные) причины (infection);
- заболевания, связанные с нарушением проходимости (obstruction);
- заболевания, связанные с нарушением моторики (dysmotility);
- онкологические заболевания (neoplasia);
- эрозивные и язвенные поражения (ulcer).
В статье представлена информация по группе заболеваний, объединенных воспалением как основным патогенетическим механизмом развития.
Острый гастрит у собак и кошек
Острый гастрит – это термин, используемый для определения синдрома внезапного приступа рвоты. Чаще всего причину состояния можно установить, подробно расспросив владельца. Повреждение слизистой желудка с последующим воспалением может происходить как при непосредственном контакте с повреждающей субстанцией (тогда речь идет о первичном остром гастрите), так и из-за опосредованного поражения, связанного с заболеванием других систем органов (вторичный гастрит, яркий пример – уремическая гастропатия при хронической почечной недостаточности).
| Причина | Примеры |
| Нарушение режима кормления или пищевая непереносимость | Поедание отбросов; пищевая аллергия |
| Инородные тела | Кости, игрушки, шерстяные комки |
| Препараты и токсины | Антибиотики, НПВС, тяжелые металлы, ядовитые растения, бытовая химия, отбеливатель |
| Системные болезни | Гиперадренокортицизм, уремия, болезни печени |
| Паразиты | Ollulanus, Physaloptera spp. |
| Бактерии | Бактериальные токсины, Helicobacter? |
| Вирусы |
Какие симптомы должны насторожить?
Симптомы заболевания несколько отличаются в зависимости от типа гастрита.
Так, при обострении хронического гастрита типа А (аутоимунного) чаще встречаются метеоризм, диарея, урчание в животе, послабление стула после употребления молочных продуктов и жиров.
Если же речь идет о хроническом гастрите типа В (вызванном бактерией Helicobacter pylori), то в этом случае болезнь чаще проявляется запорами или склонностью к ним. Кроме того, для заболевания характерны тяжесть в подложечной области, которая чаще всего появляется после еды, отрыжка, тошнота, срыгивания, неприятный привкус во рту (чаще в утреннее время), изжога.
Боли в области желудка чаще бывают тупыми и появляются, как правило, после еды (особенно, после употребления острых блюд, жареной, копченой пищи). При ходьбе и в положении стоя боли при гастрите усиливаются.
Коварство хронического гастрита в том, что он может долгое время, иногда в течение нескольких лет, протекать абсолютно бессимптомно либо с незначительными болями в области живота, которые не особенно беспокоят пациентов. Чаще всего это заболевание встречается у взрослых мужчин.
Клинические признаки острого гастрита у собак и кошек
Основной клинический признак – внезапно начавшаяся рвота. Важно помнить, что иногда анорексия может являться единственным клиническим признаком (как следствие тошноты) при остром гастрите. Общее состояние животного чаще всего удовлетворительное, может отмечаться снижение аппетита и активности. Если острый гастрит связан с проглатыванием инородных тел, токсинами, системными нарушениями, часто появляется примесь крови в рвотных массах, кале, сопутствующая диарея, значительное ухудшение общего состояния. Такие пациенты нуждаются в более тщательном диагностическом подходе.
Диагностика острого гастрита у собак и кошек
Основывается на анамнестических данных, клинических проявлениях и реакции на симптоматическое лечение. Если нет признаков системного заболевания, в диагностических исследованиях обычно нет необходимости. Однако необходимо немедленно начинать обследование, если:
- присутствуют признаки системного заболевания;
- отмечается значительное ухудшение общего состояния;
- помимо рвоты, отмечается диарея, абдоминальная боль, примесь крови в рвоте и/или кале;
- присутствует лихорадка;
- проглатывание инородных предметов, токсичных веществ в анамнезе;
- нет ответа на симптоматическую терапию в течение 1-2 суток.
Базовый диагностический профиль в этих ситуациях включает:
- общеклинический и биохимический анализ крови, анализ кала на паразитов (флотационный метод), анализ мочи;
- рентгенологическое исследование (с контрастом и/или без него);
- УЗИ;
- эндоскопия.
Дополнительные исследования могут включаться в протокол обследования по результатам базовых тестов (ПЦР на инфекции, тест на желчные кислоты, тест на специфическую панкреатическую липазу и пр.)
Кормление кошек и собак с острым гастритом
Воспаленному желудку целесообразно предоставить «отдых». Его длительность зависит от возраста животного и тяжести проявлений гастрита. Голодная диета не должна быть слишком длительной, поскольку поступление пищи в ЖКТ поддерживает его барьерную функцию. Обычно при неосложненных гастритах это 12-24 часа. Воспаленная слизистая реагирует на растяжение, поэтому во избежание возобновления рвоты порции воды и пищи должны быть по возможности небольшими. Основные задачи – избегать растяжения стенок желудка и минимально стимулировать секрецию кислоты. Известно, что из источников белка самым активным стимулятором секреции является животный белок, а меньше всего стимулируют выработку кислоты растительные и молочные белки. Поэтому, подбирая диету пациенту, находящемуся на натуральном рационе, стоит выбрать обезжиренный творог и рис в пропорции 1:3. Из готовых рационов лучше всего подойдут корма, содержащие соевый гидролизат как единственный источник белка (например, PRO PLAN® VETERINARY DIETS HA), либо легкопереваримые лечебные диеты с невысоким содержанием белка для животных с заболеваниями желудочно-кишечного тракта (например, Purina® EN).
Осложнения гастрита
Язва (язвенная болезнь) желудка — это сильное, глубокое воспаление слизистой, при котором поражаются не только поверхностные, но и мышечные ткани. Язва — очаговое поражение слизистой, которая разъедается кислотой желудочного сока. Полностью вылечить язву желудка невозможно, можно только добиться рубцевания язвы на длительный срок при строгом соблюдении рекомендаций лечащего врача.
Симптомы язвы очень характерны: режущие острые боли натощак, изжога, рвота. В некоторых случаях язва может стать риском развития рака желудка.
Рак желудка может развиваться довольно медленно, в течение многих лет, редко сопровождается выраженными клиническими симптомами, поэтому пациент, как правило, даже не догадывается о своем заболевании. Причинами развития рака желудка называются как полипы — грибовидные образования, растущие из слизистой оболочки, так и хеликобактерная инфекция – поражение слизистой желудка бактериями Helicobacter pylori.
Большинство новообразований желудка возникает в железах слизистой оболочки – аденокарциномы. Однако другие опухоли, например, лимфомы – развиваются из лимфоидных узлов, расположенных в стенках желудка, стромальные – из мышечной или соединительной ткани и т.д.
Гастрит – благоприятная почва не только для развития заболеваний желудочно-кишечного тракта. Нарушения пищеварения влияют на состояние организма в целом, так как в этом случае функциональные системы не получают необходимых для обеспечения нормальной работы веществ. Также осложнениями гастрита являются отчетливо выраженные симптомы – метеоризм (повышенное газообразование), диарея, запоры.
Лечение гастропротекторами кошек и собак с острым гастритом
Препараты этой группы назначают при гастритах с целью защиты слизистой желудка, а также для связывания бактериальных токсинов и самих бактерий. Препаратами выбора являются:
- сукральфат (собаки — 1 г/30кг каждые 8-12 часов, за 30-60 мин. до кормления, кошки — 250 мг/кошку); из таблетированной формы можно готовить суспензию и выпаивать ее, это считается более эффективным;
- препараты висмута: оказывают цитопротекторное действие, а также активны против бактерий Helicobacter. Стоит избегать назначения на длительный срок из-за возможной адсорбции солей висмута.
Н2-блокаторы и антибиотики: целесообразно их назначение в случае признаков эрозивного поражения слизистой желудка (гематемезис, мелена), а также при хроническом гастрите. При острых неосложненных гастритах в них обычно нет необходимости.
В чем заключается профилактика гастрита?
Предупреждение гастрита состоит в ведении здорового образа жизни, правильном и регулярном питании, отказе от курения и злоупотребления алкоголем. Безусловно, необходимо проходить ежегодный осмотр терапевтом, стандартные обследования крови, при необходимости – эзофагогастроскопию (осмотр слизистой желудка при помощи гастроскопа).
Если у Вас остались вопросы, Вы можете задать их врачу-гастроэнтерологу онлайн в приложении Доктис.
Лечение противорвотными средствами кошек и собак с острым гастритом
Назначение противорвотных препаратов при остром гастрите оправданно только в тех случаях, когда интенсивная многократная рвота приводит к значительной дегидратации и существенно ухудшает состояние животного. В остальных случаях стоит попробовать не назначать противорвотные препараты, чтобы оценить ответ на симптоматическое лечение (диетотерапия+гастропротекторы). При продолжающейся рвоте в лечебный протокол включаются противорвотные средства и пересматривается диагностический план. Препараты выбора:
- маропитант — 0,1 мл/кг 1 р/сут; помимо мощного противорвотного действия, значительно снижает абдоминальный дискомфорт, что может существенно улучшить общее состояние пациента в короткие сроки.
- метоклопрамид — 0,2-0,5 мг/кг каждые 8-12 часов; противорвотное действие слабее, чем у маропитанта, однако его прокинетическое действие подавляет гастроэзофагеальный рефлюкс и способствует опорожнению желудка.
Хронический гастрит у собак и кошек
Это достаточно распространенное заболевание у собак (обнаруживается в среднем у 30-35% собак, обследуемых как по поводу хронической рвоты, так и по другим причинам, характерные симптомы могут быть и не выражены); нет достоверных исследований по поводу частоты встречаемости хронического гастрита у кошек. Важные аспекты:
- хронический гастрит – это гистологический диагноз, то есть он может быть подтвержден только с помощью гистологического исследования биоптатов желудка;
- должны быть исключены все возможные причины хронической рвоты и другие заболевания ЖКТ у собак, прежде чем диагноз «хронический гастрит» может быть поставлен;
- если диагноз «хронический гастрит» подтвержден гистологически, необходимо попытаться найти его причину, прежде чем признать его идиопатическим. Чаще всего причина может быть выявлена.
Принципы диагностики и рациональной фармакотерапии хронического гастрита
Маев И.В., Голубев Н.Н.
На современном этапе развития гастроэнтерологии термин «хронический гастрит»; объединяет целую группу заболеваний, характеризующихся воспалением слизистой оболочки желудка.
Основной причиной хронического гастрита является инфекция H. pylori. Только менее 10% случаев приходятся на аутоиммунный гастрит, редкие формы гастритов (лимфоцитарный, эозинофильный, гранулематозный), другие инфекционные агенты и химические вещества. Распространенность хронического гастрита в мировой популяции очень велика и составляет от 50 до 80%. В России этот показатель находится на таком же уровне.
Классификация хронического гастрита: Модифицированная Сиднейская классификация предполагает подразделение хронического гастрита по этиологии и топографии морфологических изменений. Выделяют три типа гастрита [24]:
- неатрофический (поверхностный) гастрит;
- атрофический гастрит;
- особые формы хронического гастрита (лимфоцитарный, эозинофильный, гранулематозный, химический, лучевой).
С инфекцией H. pylori ассоциированы неатрофический антральный гастрит и мультифокальный атрофический гастрит с вовлечением тела и антрального отдела желудка. Атрофический гастрит тела желудка имеет аутоиммунную природу.
Ниже рассмотрены основные принципы диагностики и рациональной фармакотерапии хронического гастрита, ассоциированного с H. pylori.
Патофизиология хронического хеликобактерного гастрита и естественное течение инфекции H. pylori
Для инфекции H. pylori свойственна длительная персистенция на слизистой оболочке желудка с развитием инфильтрации ее собственной пластинки клетками воспаления. Инфицирование H. pylori всегда ведет к развитию иммунного ответа, практически никогда не заканчивающегося, однако, полной элиминацией возбудителя. В первую очередь это связано с тем, что, в отличие от других внеклеточных возбудителей, H. pylori вызывает иммунный ответ преимущественного первого типа, сопровождающийся активацией клеточного звена иммунитета [27,37].
Развитие нейтрофильной инфильтрации собственной пластинки слизистой оболочки связано с двумя различными механизмами. Прямой механизм реализуется через выделение H. pylori активирующего нейтрофилы белка, а опосредованный через стимуляцию экспрессии эпителиоцитами ИЛ-8 с последующим запуском сложного воспалительного каскада [37].
Мигрирующие в слизистую оболочку желудка гранулоциты посредством выделения активных форм кислорода повреждают эпителиальные клетки и интенсивно продуцируют провоспалительные цитокины. В таких условиях на фоне прогрессирования воспаления в одних случаях имеет место повреждение и гибель эпителиоцитов с формированием эрозивных и язвенных дефектов, а в других постепенно формируются атрофия, метаплазия и неоплазия слизистой оболочки желудка.
Другой значимой особенностью патогенеза инфекции H. pylori является несостоятельность гуморального иммунитета и отсутствие эрадикации под воздействием антихеликобактерных антител. Данный факт обычно объясняется «недоступностью» бактерии для антител в слое желудочной слизи, невозможностью выделения IgG в просвет желудка при относительном дефиците секреторных IgA, а также «антигенной мимикрией» бактерии [37].
Несмотря на то, что хронический гастрит развивается у всех людей, инфицированных H. pylori, какие-либо клинические проявления имеются далеко не в каждом случае. В целом для H. pylori-позитивных пациентов риск развития язвенной болезни и рака желудка в течение жизни составляет соответственно 10-20 и 1-2% [27].
Язвенная болезнь двенадцатиперстной кишки (ДПК) и рак желудка обычно ассоциируются с разными типами хронического гастрита. При антральном гастрите с отсутствием или минимальной выраженностью атрофии, нормальной или повышенной секрецией соляной кислоты нередко развиваются язвы ДПК. При пангастрите с тяжелой атрофией слизистой оболочки, гипо- или ахлоргидрией значительно чаще регистрируется рак желудка [15,25].
Данный факт получил объяснение после открытия H. pylori, когда стало понятно, что в большинстве случаев антральный гастрит и пангастрит представляют собой различные направления естественного течения этой инфекции.
После заражения, которое обычно происходит в детском или подростковом возрасте, H. pylori вызывает острый гастрит с неспецифическими транзиторными симптомами диспепсии (боли и тяжесть в эпигастрии, тошнота, рвота) и гипохлоргидрией [17,27].
В дальнейшем острый хеликобактерный гастрит переходит в хронический. Постепенно формируется либо поверхностный антральный гастрит, либо атрофический мультифокальный пангастрит. Ключевым фактором, детерминирующим топографию гастрита, а значит, и вероятность развития язвенной болезни ДПК или рака желудка, является уровень секреции соляной кислоты [17,25,27].
У лиц с нормальной или высокой секреторной активностью париетальных клеток соляная кислота подавляет рост H. pylori в теле желудка, и бактерия интенсивно колонизирует только антральный отдел, вызывая, соответственно, ограниченный антральный гастрит. Хроническое воспаление в антральном отделе ведет к гипергастринемии и гиперхлоргидрии, закислению полости ДПК и язвообразованию. У пациентов с пониженным уровнем секреции соляной кислоты H. pylori беспрепятственно колонизирует слизистую оболочку тела желудка, вызывая пангастрит. Хроническое активное воспаление через эффекты ряда цитокинов еще больше ингибирует функцию париетальных клеток, а в дальнейшем вызывает развитие атрофии и метаплазии главных желез. В итоге у данной категории больных значительно повышается риск развития рака желудка [17,25,27].
Определяющая роль в детерминации этих процессов по современным представлениям принадлежит генетическим факторам организма человека. С ними напрямую связаны особенности иммунного ответа, в частности, уровень продукции провоспалительного цитокина ИЛ-1β, обладающего выраженными антисекреторными свойствами. Генетически обусловленная избыточная экспрессия этой субстанции вызывает стойкое подавление секреции соляной кислоты уже на стадии острого хеликобактерного гастрита. В такой ситуации создаются благоприятные условия для заселения H. pylori в тело желудка [14,15].
Тесная взаимосвязь между раком желудка и H. pylori была подтверждена и крупными эпидемиологическими исследованиями. Наличие инфекции увеличивает риск развития данной злокачественной опухоли в 4-6 раз. У пациентов с хроническим атрофическим пангастритом, ассоциированным с H. pylori, вероятность возникновения неоплазии возрастает еще больше. Международное Агентство по изучению рака классифицировало H. pylori, как канцероген I класса у человека в отношении некардиального рака желудка [6].
Таким образом, хронический хеликобактерный гастрит является тем фоном, на котором в большинстве случаев развивается рак желудка. Важным условием для его возникновения является наличие нарушений клеточного обновления в слизистой оболочке желудка в виде ее атрофии и кишечной метаплазии.
Диагностика хронического гастрита
Достоверный диагноз хронического гастрита может быть установлен только после морфологического исследования биоптатов слизистой оболочки желудка врачом-морфологом. Для адекватной оценки гистологических изменений и определения топографии хронического гастрита в соответствии с требованиями Сиднейской системы необходим забор минимум пяти биоптатов (2 из антрального отдела, 2 из тела и 1 из угла желудка). Заключение должно содержать сведения об активности и выраженности воспаления, степени атрофии и метаплазии, о наличии H. pylori.
Неинвазивная диагностика атрофического гастрита может быть проведена с использованием ряда сывороточных маркеров. Для выраженной атрофии слизистой оболочки тела желудка характерно снижение уровня пепсиногена I, а атрофия антрального отдела проявляется низкими уровнями базального и постпрандиального гастрина-17.
Исключить аутоиммунный хронический гастрит помогает определение антител к париетальным клеткам желудка и выявление признаков B12-дефицитной анемии.
Принципиальным моментом в диагностике хронического гастрита является выявление H. pylori. На практике выбор конкретного метода в большинстве случаев определяется клиническими особенностями пациента и доступностью тех или иных тестов.
Все методы диагностики Н. pylori в зависимости от необходимости проведения эндоскопического исследования и забора биопсийного материала подразделяются на инвазивные и неинвазивные. Стартовая антихеликобактерная терапия может быть назначена при получении положительного результата любого из них.
Хронический гастрит всегда требует морфологического подтверждения. В этом случае предпочтение следует отдать инвазивным методам диагностики хеликобактериоза, к которым относятся быстрый уреазный тест, гистологическое исследование биоптатов слизистой желудка на предмет наличия Н. pylori, полимеразная цепная реакция в биоптате [31].
Первичная диагностика хеликобактериоза с помощью указанных тестов может давать ложноотрицательные результаты при низкой плотности обсеменения слизистой оболочки бактерией, что часто имеет место на фоне приема ингибиторов протонной помпы (ИПП), антибиотиков и препаратов висмута, а также при выраженном атрофическом гастрите. В таких случаях рекомендуется обязательная комбинация инвазивных методов с определением антител к Н. pylori в сыворотке крови [33].
Контроль эрадикации, независимо от используемых тестов, должен проводиться не ранее 4-6 недель после окончания курса эрадикационной терапии. Предпочтение следует отдавать уреазному дыхательному тесту и определению антигена Н. pylori в кале методом иммуноферментного анализа (ИФА). При недоступности этих неинвазивных методов следует повторить гистологическое исследование и быстрый уреазный тест [31].
Лечение хронического хеликобактерного гастрита
Лечение хронического хеликобактерного гастрита предполагает проведение эрадикационной терапии, целью которой является полное уничтожение H. pylori в желудке и ДПК. Необходимость лечения хеликобактериоза у таких пациентов связана с профилактикой некардиального рака желудка и язвенной болезни, так как большинство больных гастритом не предъявляют каких-либо жалоб. Только эрадикация H. pylori позволяет добиться регресса явлений воспаления, а также предотвратить развитие или прогрессирование предраковых изменений слизистой оболочки [22,31].
Следует отметить, что длительная монотерапия хронического хеликобактерного гастрита ИПП недопустима. Стойкое подавление кислотной продукции способствует перемещению H. pylori из антрального отдела в тело желудка и развитию там выраженного воспаления. Создаются предпосылки для изменения топографии гастрита. Преимущественно антральный гастрит переходит в пангастрит. У таких пациентов увеличивается вероятность развития атрофии слизистой оболочки тела желудка, по сути, ятрогенного атрофического гастрита [6,31].
В рекомендациях III Маастрихтского консенсуса в ряду абсолютных показаний для назначения антихеликобактерной терапии фигурирует только атрофический гастрит. В то же время составители авторитетных международных руководств подчеркивают, что оптимальным все же является проведение терапии до развития атрофии и кишечной метаплазии слизистой оболочки, еще на стадии неатрофического (поверхностного) гастрита. Настоятельно рекомендуется эрадикация у близких кровных родственников больных раком желудка [15,21,31].
Современная антихеликобактерная терапия базируется на стандартных схемах на основе ИПП и висмута трикалия дицитрата (Де-Нол). Рекомендации Третьего Маастрихтского консенсуса по лечению инфекции H. pylori выделяют схемы терапии первой и второй линии. Активно обсуждаются варианты схем третьей линии (терапия «спасения»), которые могут применяться после двух неудачных попыток эрадикации [31].
Лечение начинают с тройной схемы первой линии: ИПП в стандартной дозе 2 раза в сутки, кларитромицин 500 мг 2 раза в сутки и амоксициллин 1000 мг 2 раза в сутки. Длительность терапии рекомендовано пролонгировать с 7 до 14 дней, что достоверно повышает эффективность эрадикации. Применение тройных схем с включением метронидазола абсолютно неоправдано, так как критический порог резистентности H. pylori к этому антибиотику (40%) в России уже давно преодолен.
Значительно ограничивает перспективы тройной терапии первой линии быстрый рост устойчивости пилорического хеликобактера к кларитромицину.
Основными причинами роста числа антибиотикорезистентных штаммов H. pylori являются увеличение числа пациентов, получающих неадекватную антихеликобактерную терапию, низкие дозы антибиотиков в схемах эрадикации, короткие курсы лечения, неправильная комбинация препаратов и бесконтрольное самостоятельное использование больными антибактериальных средств по другим показаниям [5,31].
Многоцентровые исследования по определению резистентности H. pylori к кларитромицину, проведенные в странах Европейского региона, выявили ее наличие в 21-28% случаев у взрослых и в 24% случаев у детей [23,32]. В России постепенно складывается та же неблагоприятная ситуация. В 2006 году в Москве у взрослого населения и в Санкт-Петербурге у детей резистентные штаммы выявлялись у 19,3 и 28% обследованных [9,10]. К 2009 г. в Санкт-Петербурге у взрослых пациентов их доля возросла до 40-66% [2,4].
Рост резистентности H. pylori к кларитромицину ведет к неуклонному снижению эффективности стандартной тройной терапии первой линии на основе кларитромицина. По данным как российских, так и зарубежных клинических исследований, этот показатель уже составляет 55-61% [3,30].
Как эффективную альтернативу тройной терапии Третий Маастрихтский консенсус в качестве первой линии эрадикации рекомендует стандартную четырехкомпонентную схему на основе висмута: висмута трикалия дицитрат (Де-Нол) по 120 мг 4 раза в сутки, ИПП в стандартной дозе 2 раза в сутки, тетрациклин 500 мг четыре раза в сутки и метронидазол 500 мг 3 раза в сутки в течение 10 дней. Следует подчеркнуть, что применение препарата висмута позволяет преодолеть резистентность пилорического хеликобактера к метронидазолу [31].
Такой вариант эрадикации является предпочтительным при высоком уровне резистентности H. pylori к кларитромицину в регионе (выше 20%), наличии в анамнезе у пациента аллергических реакций на кларитромицин, амоксициллин или другие антибиотики из их групп, а также при предшествующем приеме макролидов по другим показаниям.
В нашей стране в качестве терапии первой линии используется трехкомпонентная схема с включением висмута трикалия дицитрата в дозе 120 мг 4 раза в сутки, амоксициллина в дозе 1000 мг 2 раза в сутки и кларитромицина в дозе 500 мг 2 раза в сутки. Данная комбинация особенно подходит пациентам с хроническим атрофическим гастритом при отсутствии какой-либо клинической симптоматики. У таких больных нет необходимости в быстром подавлении продукции соляной кислоты, и эти схемы могут оказаться оптимальными по соотношению стоимость/эффективность [6,14].
Если после проведения тройной антихеликобактерной терапии первой ступени лечение оказалось неэффективным (отсутствие эрадикации Н. pylori через 6 недель после полной отмены антибиотиков и антисекреторных препаратов), в соответствии с Маастрихтскими рекомендациями в качестве схемы второй линии назначается квадротерапия на основе висмута трикалия дицитрата сроком на 10 дней. Замена в данной схеме метронидазола на фуразолидон не снижает эффективности лечения [35].
В том случае, если квадротерапия применялась на первом этапе, могут использоваться альтернативные тройные схемы второй линии, включающие ИПП в стандартной дозе и амоксициллин 1000 мг 2 раза в сутки в комбинации с тетрациклином (500 мг четыре раза в сутки) или фуразолидоном (200 мг 2 раза в сутки) [31].
В целом с ростом устойчивости H. pylori к основным антибактериальным препаратам ведущую роль в схемах первой и второй линии эрадикации начинает играть висмута трикалия дицитрат (Де-Нол), что связано с наличием у него целого ряда уникальных свойств.
Висмута трикалия дицитрат обладает наиболее выраженными антибактериальными свойствами в отношении инфекции H. pylori среди всех препаратов висмута. Де-Нол хорошо растворяется в водной среде желудочного сока и способен сохранять высокую активность при любом уровне желудочной секреции. Он легко проникает в желудочные ямки и захватывается эпителиоцитами, что позволяет уничтожать бактерии, находящиеся внутри клеток. Важным моментом является полное отсутствие штаммов H. pylori, резистентных к солям висмута [18,29].
Антихеликобактерный эффект Де-Нола имеет комплексный характер и обусловлен целым рядом механизмов [7,8,29]:
- преципитация на мембране H. pylori с последующим нарушением ее проницаемости и гибелью микроорганизма;
- подавление адгезии H. pylori к эпителиоцитам;
- подавление подвижности H. pylori;
- действие на вегетативные и кокковые формы H. pylori;
- синергизм в отношении H. pylori с другими антибиотиками (метронидазол, кларитромицин, тетрациклин, фуразолидон).
Последние данные по применению висмута трикалия дицитрата в качестве средства антихеликобактерной терапии были получены в ходе недавнего исследования, целью которого стала оценка эффективности модифицированной 7- и 14-дневной тройной схемы первой линии. К стандартной комбинации, включавшей омепразол, кларитромицин и амоксициллин, был добавлен висмута трикалия дицитрат в дозе 240 мг 2 раза в сутки. Перед началом лечения определялась чувствительность H. pylori к антибиотикам.
Итоги исследования показали чрезвычайно многообещающие результаты. 14-дневный режим терапии продемонстрировал достоверно большую эффективность, чем 7-дневный. В первом случае эрадикация была достигнута у 93,7% пациентов, тогда как во втором лишь у 80% больных. При наличии резистентных к кларитромицину штаммов H. pylori лечение оказалось успешным у 84,6% лиц, прошедших двухнедельный курс лечения, и только в 36,3% случаев при применении 7-дневного режима, что свидетельствует о возможности преодоления устойчивости бактерии к кларитромицину на фоне использования препарата висмута [34].
Указанная четырехкомпонентная схема в составе висмута трикалия дицитрата, ИПП, амоксициллина и кларитромицина уже рекомендована ведущими российскими экспертами в качестве одного из вариантов терапии первой линии при лечении хеликобактериоза [14].
Таким образом, широкое применение висмута трикалия дицитрата дает в будущем реальный шанс компенсировать отсутствие новых высокоактивных в отношении H. pylori антибактериальных средств. Модифицированная 14-дневная схема с включением данного препарата, по-видимому, может успешно назначаться в качестве терапии первой линии даже в регионах с высокой распространенностью кларитромицин-резистентных штаммов бактерии. Такая стратегия позволит значительно снизить уровень устойчивости пилорического хеликобактера к используемым в настоящее время антибиотикам и сохранить высокие показатели эффективности эрадикационной терапии [28].
Кроме антибактериального эффекта, висмута трикалия дицитрат оказывает выраженное цитопротективное действие. Препарат создает на поверхности слизистой оболочки желудка и ДПК пленку, защищающую эпителиоциты от воздействия кислотно-пептического фактора и потенцирующую процессы репарации в области эрозивно-язвенных дефектов. Причем ионы висмута обладают способностью непосредственно стимулировать пролиферацию клеток эпителия [1,11,26].
Де-Нол почти не влияет на базальную и стимулированную секрецию соляной кислоты и серьезно не нарушает физиологию желудка. Это особенно важно для пациентов с атрофией слизистой оболочки на фоне выраженного воспаления. Дополнительная супрессия кислотной продукции при приеме ИПП в такой ситуации может запустить кишечную дифференцировку эпителия и развитие кишечной метаплазии.
Висмута трикалия дицитрат стимулирует синтез простагландина Е2 и повышает качество гидрофобного слоя желудочной слизи, вырабатываемой поверхностным эпителием. Увеличение продукции простагландина Е2 потенцирует секрецию бикарбонатов, улучшает микроциркуляцию, стимулирует ангиогенез, поддерживает реконструкцию внеклеточного матрикса, оказывает противовоспалительное действие. Препарат препятствует деградации слизистого слоя, предохраняет от разрушения и фиксирует в области повреждений эпидермальный фактор роста, необходимый для полноценной физиологической и репаративной регенерации эпителиоцитов [7,8,11].
Доказан выраженный антиоксидантный эффект солей висмута, подавляющих перекисное окисление липидов и защищающих ДНК от воздействия активных форм кислорода. На этом фоне снижается риск возникновения мутаций в клетках эпителия, служащих основой для начала опухолевого роста [18].
Положительной стороной применения Де-Нола является низкая биодоступность. При курсовом приеме данного препарата в течение 1 месяца его концентрация в крови составляет 50 мкг/л, а в желудочном соке — 100 мг/л, что практически исключает проявление системных эффектов висмута.
В случае неудачи второй линии терапии возможны два варианта действий [36]:
- Проведение эмпирической терапии «спасения» (третья линия);
- Подбор препаратов в зависимости от результатов определения чувствительности H. pylori ко всем антибиотикам, использующимся в схемах эрадикации.
В настоящее время в России наиболее оправдано применение двух потенциальных вариантов десятидневной терапии «спасения». К ИПП (стандартная дозировка 2 раза в сутки) и амоксициллину (1000 мг 2 раза в сутки) добавляется левофлоксацин (250 мг 2 раза в сутки) либо фуразолидон (200 мг 2 раза в сутки) [36].
Эффективность индивидуального подбора антибиотиков в зависимости от чувствительности к ним H. pylori иллюстрируется результатами применения семидневной схемы третьей линии в составе висмута трикалия дицитрата, эзомепразола, доксициклина и амоксициллина. Даже в случае выявления штаммов с резистентностью к нескольким антибактериальным препаратам эрадикация была достигнута в 91% случаев [20].
Несмотря на то, что элиминация H. pylori приводит к постепенной редукции явлений воспаления и нормализации процессов обновления эпителиоцитов, у значительной части пациентов сохраняется эксхеликобактерный гастрит, морфологической основой которого служит мононуклеарная инфильтрация собственной пластинки слизистой оболочки. Его длительная персистенция создает условия для прогрессирования структурных изменений в постэрадикационном периоде даже при отсутствии инфекционного фактора [12].
В такой ситуации патогенетически обоснованной является пролонгация курса лечения H. pylori с назначением монотерапии препаратом Де-Нол по 240 мг 2 раза в сутки в течение 6 недель. Благодаря своим цитопротективным и антиоксидантным свойствам висмута трикалия дицитрат предотвращает повреждение эпителиоцитов, а стимуляция клеточного обновления потенциально способствует обратному развитию атрофии.
В целом у пациентов с хроническим гастритом успешная эрадикация H. pylori позволяет добиться регресса воспалительной инфильтрации и восстановления нормальной морфологической структуры слизистой оболочки желудка. При наличии атрофии и метаплазии устранение инфекционного агента дает возможность остановить дальнейшее прогрессирование данных предраковых изменений, а в ряде случаев достичь и обратного развития атрофии. Учитывая, что хеликобактерный гастрит, особенно при наличии атрофических изменений, значительно повышает риск развития рака желудка, лечение инфекции H. pylori с последующим курсовым применением висмута трикалия дицитрата служит важнейшей мерой профилактики этого широко распространенного онкологического заболевания.
Литература 1. Аруин Л.И. Качество заживления гастродуоденальных язв: функциональная морфология, роль методов патогенетической терапии // Экспериментальная и клиническая гастроэнтерология. — 2006. — №5 (репринт). — С. 1-5. 2. Барышникова Н.В., Денисова Е.В., Корниенко Е.А., с соавт. Эпидемиологическое исследование резистентности Helicobacter pylori к кларитромицину у жителей Санкт-Петербурга с язвенной болезнью // Экспериментальная и клиническая гастроэнтерология. — 2009. — № 5 — С. 73-76. 3. Барышникова Н.В., Успенский Ю.П., Ткаченко Е.И. Оптимизация лечения больных с заболеваниями, ассоциированными с Helicobacter pylori: обоснование необходимости использования препаратов висмута // Экспериментальная и клиническая гастроэнтерология. — 2009. — № 6. — C. 116-121. 4. Жебрун А.Б., Сварваль А.В., Ферман Р.С. Исследование антибиотикорезистентности штаммов H. pylori, циркулирующих в Санкт-петербурге в современный период // Клиническая микробиология и антимикробная химиотерапия. — 2008. — № 2 (приложение 1). — С. 18-19. 5. Захарова Н.В. Пути повышения эффективности и безопасности схем эрадикации Helicobacter pylori // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2006. — № 3. — С. 45-51. 6. Ивашкин В.Т., Шептулин А.А., Лапина Т.Л. Хронический гастрит, вызванный инфекцией Helicobacter pylori: диагностика, клиническое значение, прогноз. Пособие для врачей. — Москва. — 2009. — 24 с. 7. Исаков В.А., Домарадский И.В. Хеликобактериоз — М.: Медпрактика — М, 2003. — 412 с. 8. Кононов А.В. Цитопротекция слизистой оболочки желудка: молекулярно-клеточные механизмы // Росс. журн. гастроэнтерол., гепатол., колопроктол. — 2006. — №3. — С. 12-16. 9. Корниенко Е.А., Паролова Н.И. Антибиотикорезистентность Helicobacter pylori у детей и выбор терапии // Вопр. совр. педиатрии. — 2006. — №5. — C. 46-50. 10. Кудрявцева Л.В. Биологические свойства Helicobacter pylori // Альманах клинической медицины. — 2006. — Том XIV. — С. 39-46. 11. Лапина Т.Л. Возможности лекарственного воздействия на цитопротективные свойства гастродуоденальной слизистой оболочки // Росс. журн. гастроэнтерол., гепатол., колопроктол. — 2006. — №5. — С. 75-80. 12. Ливзан М.А., Кононов А.В., Мозговой С.И. Постэрадикационный период хронического гастрита, ассоциированного с инфекцией Helicobacter pylori // Consilium medicum. — 2008. — №. 8. — С. 15-20. 13. Маев И.В., Кучерявый Ю.А., Оганесян Т.С. Аллельный полиморфизм интерлейкина-1 при геликобактериозе // Росс. журн. гастроэнтерол., гепатол., колопроктол. — 2008. — №5. — С. 4-11. 14. Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (Четвертое московское соглашение) // Экспериментальная и клиническая гастроэнтерология. — 2010. — № 5. — C. 113-118. 15. Amieva M.R., E.M. El-Omar. Host-bacterial interactions in Helicobacter pylori infection // Gastroenterology. — 2008. — Vol. 134. — P. 306-323. 16. Asaka M., Kato M., Takahashi S., et al. Guidelines for the Management of Helicobacter pylori Infection in Japan: 2009 Revised Edition // Helicobacter. — 2010. — Vol. 15. — P. 1-20. 17. Axon A.T.R. Relationship between Helicobacter pylori gastritis, gastric cancer and gastric acid secretion // Advances in medical sciences. — 2007. — Vol. 52. — P. 55-60. 18. Bagchi D., McGinn T.R., Ye X., et al. Mechanism of gastroprotection by bismuth subsalicylate against chemically induced oxidative stress in cultured human gastric mucosal cells // Digestive Diseases and Sciences. — 1999. — Vol. 44. — P. 2419-2428. 19. Bianchi R., Dajani E., Casler J. Gastric anti-ulcer and antisecretory effects of bismuth salts in the rat. // Pharmacologist. — 1980. — Vol. 22. — 168A. 20. Cammarota G., Martino A., Pirozzi G., et al. High efficacy of 1-week doxycycline- and amoxicillin-based quadruple regimen in a culture-guided, third-line treatment approach for Helicobacter pylori infection // Aliment Pharmacol Ther. — 2004 — Vol. 19. — P. 789-795. 21. Chey W.D., Wong B.C.Y. American College of Gastroenterology Guideline on the Management of Helicobacter pylori Infection // Am J Gastroenterol. — 2007. — Vol. 102. — P. 1808-1825. 22. Correa P., Houghton J. Carcinogenesis of Helicobacter pylori // Gastroenterology. — 2007. — Vol. 133. — P. 659-672. 23. De Francesco V., Margiotta M., Zullo A. et al. Prevalence of primary clarithromycin resistance in Helicobacter pylori strains over a 15 year period in Italy // J. Antimicrob. Chemother. — 2007. — Vol. 59. — P. 783-785. 24. Dixon M.F., Genta R.M., Yardley J.H., et al. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis, Houston 1994 // Am J Surg Pathol. — 1996. — Vol. 20. — P. 1161-1181. 25. El-Zimaity H. Gastritis and Gastric Atrophy // Curr Opin Gastroenterol. — 2008. — Vol. 24. — P. 682-686. 26. Gilster J., Bacon K., Marlink K., et al. Bismuth subsalicylate increases intracellular Ca2+, MAP-kinase activity, and cell proliferation in normal human gastric mucous epithelial cells // Digestive Diseases and Sciences. — 2004. — Vol. 49. — P. 370-378. 27. Kusters J.G., van Vliet A.H.M., Kuipers E.J. Pathogenesis of Helicobacter pylori Infection // Clin 28. Malfertheiner P. Bismuth Improves PPI-based Triple Therapy for H. pylori Eradication // Nat Rev Gastroenterol Hepatol. — 2010. — Vol. 7. — P. 538-539. 29. Malfertheiner P, Nilius M. Bismuth preparations. In: Goodwin C. & Worsley B. (eds): Helicobacter pylori. Biology and Clinical practice. Boca Raton, CRC Press, 1993, pp. 351-364. 30. Malfertheiner P., Megraud F. Quadruple Therapy With Bismuth Subcitrate Potassium, Metronidazole, Tetracycline, and Omeprazole is Superior to Triple Therapy With Omeprazole, Amoxicillin, and Clarithromycin in the Eradication of Helicobacter pylori // Gastroenterology. — 2010. — Vol. 138 (Suppl 1): S-33. 31. Malfertheiner P., Megraud F., O’Morain C., et al. Current concepts in the management of Helicobacter pylori infection — The Maastricht III Consensus Report // Gut. — 2007. — Vol. 56. — P. 772-781. 32. Megraud F. H. pylori antibiotic resistance: prevalence, importance, and advances in testing // Gut. — 2004. — Vol. 53. — P. 1374-1384. 33. Selgrad M., Kandulski A., Malfertheiner P. Helicobacter pylori: Diagnosis and Treatment // Curr Opin Gastroenterol. — 2009. — Vol. 25. — P. 549-556. 34. Sun Q., Liang X., Zheng Q., et al. High Efficacy of 14-Day Triple Therapy-Based, Bismuth-Containing Quadruple Therapy for Initial Helicobacter pylori Eradication // Helicobacter. — 2010. — Vol. 15. — P. 233-238. 35. Treiber G., Ammon S., Malfertheiner P., Klotz U. Impact of furazolidone-based quadruple therapy for eradication of Helicobacter pylori after previous treatment failures // Helicobacter — 2002. — Vol. 7. — P. 225-231. 36. Vakil N., Megraud F. Eradication therapy for Helicobacter pylor // Gastroenterology. — 2007. — Vol. 133. — P. 985-1001. 37. Wilson K.T., Crabtree J.E. Immunology of Helicobacter pylori: insights into the failure of the immune response and perspectives on vaccine studies // Gastroenterology. — 2007. — Vol. 133. — P. 288-308.
Причины хронического гастрита у собак и кошек
Причинами хронического гастрита могут становиться те же факторы, что и при остром воспалении (см. таблицу). Если эти факторы отсутствуют, хронический гастрит связывают с аллергией на пищу или пищевой непереносимостью, скрытым паразитарным заболеванием, реакцией на бактериальные антигены (в том числе и собственной микрофлоры ЖКТ).
Гастрит у собак и кошек гистопатологи классифицируют в соответствии со следующими гистологическими изменениями:
- превалирующий вид инфильтрирующих клеток (эозинофилы, лимфоциты, плазматические клетки и пр.);
- структурные изменения (атрофия, гипертрофия, фиброз и пр.);
- степень выраженности – субъективно (легкая, средней тяжести, тяжелая).
Гистопатологическая оценка биоптатов не стандартизирована для собак и кошек, поэтому очень многое зависит от опыта и квалификации врача-гистопатолога. Необходимо очень внимательно подходить к выбору лаборатории для отправки образцов, поскольку медицинские стандарты оценки существенно отличаются от таковых для животных, и нередко можно получить сбивающее с толку заключение, если опираться на мнение медицинских специалистов.
Наиболее часто выявляется поверхностный лимфоплазмацитарный гастрит легкой или средний тяжести с сопутствующей лимфоидной фолликулярной гиперплазией.
Фото с https://scialert.net
Картина хронического лимфоплазмацитарного гастрита. Широкими стрелками отмечены участки лимфоидной фолликулярной гиперплазии
Как часто в развитии гастрита виновата бактерия Helicobacter pylori?
Helicobacter pylori-ассоциированный гастрит составляет 85−90% всех случаев, аутоиммунный гастрит — 5%. Остальные гастриты, в том числе химико-токсикоиндуцированный, лимфоцитарный, эозинофильный, грануломатозный и другие редкие формы поражения желудка, – 5−10%.
Бактерия Helicobacter pylori всегда приводит к развитию хронического воспаления в стенке желудка, которое, порой не проявляется болями и диспепсией. Кроме того, Helicobacter pylori является онкогенным фактором и может приводить к развитию рака желудка.
Диагностика хронического гастрита у собак и кошек
Результаты стандартных лабораторных тестов (клинический и биохимический анализы крови, мочи, рентгенологическое исследование, УЗИ), как правило, при хроническом гастрите не имеют характерных изменений, однако их необходимо проводить всегда, чтобы попробовать исключить системную или метаболическую, или другую, не связанную непосредственно с желудком причину хронической рвоты. Обнаруженная эозинофилия может указывать на присутствие гастрита, связанного с паразитами или пищевой аллергией, мастоцитомой. Пангипопротеинемия наблюдается при генерализованном ВЗК (воспалительное заболевание кишечника), лимфоме ЖКТ, гастроэнтеропатии норвежских лундехундов. Высокий уровень глобулина и низкий уровень альбумина могут наблюдаться у бассенджи при характерной для этой породы гастроэнтеропатии.
Эндоскопическое исследование с забором биоптатов является ключевым исследованием для окончательной постановки диагноза «хронический гастрит». Забор биоптатов следует проводить даже тогда, когда макроскопическая оценка состояния слизистой не выявила визуальных изменений. Результат гистологического исследования крайне важен с точки зрения выбора тактики лечения, так как при различной степени выраженности одной и той же формы гастрита будут применяться различные лечебные схемы.
Идиопатический хронический гастрит у собак и кошек
Если все возможные системные/метаболические/эндокринные причины гастрита были исключены на этапе стандартного протокола обследования, хронический гастрит, подтвержденный гистологически, признается идиопатической формой (то есть заболеванием, этиология которого не выяснена). Наиболее распространенный вид идиопатического хронического гастрита у кошек и собак – лимфоцитарно-плазмацитарный гастрит легкой или средней степени тяжести. Этот термин означает, что слизистая оболочка желудка инфильтрирована («пропитана») клетками воспаления – лимфоцитами и плазмацитами. Этот процесс может сопровождаться атрофией и фиброзом слизистой, реже – гиперплазией.
Лимфоплазмоцитарный гастрит легкой степени у собак и кошек
Наиболее распространенный вариант, и первый этап лечения обычно заключается в назначении элиминационной (исключающей) диеты, содержащей новый для животного источник белка. Если пациент получает натуральный рацион, за основу лечебного кормления можно взять рационы, рекомендуемые для дерматологических пациентов (рыба и картофель для собак, свинина или конина для кошек). Рацион животных, содержащихся на готовых диетах, корректировать проще. Для собак можно использовать дерматологический рацион PRO PLAN® VETERINARY DIETS DRM DERMATOSIS, в качестве основного источника белка содержащий мойву, либо PRO PLAN® VETERINARY DIETS HA HYPOALLERGENIC, содержащий гидролизированный белок сои как единственный источник белка. Для кошек подойдет диета PRO PLAN® VETERINARY DIETS HA ST/OX HYPOALLERGENIC.
В гастроэнтерологии элиминационная диета назначается, в отличие от дерматологических схем, на 2 недели – столько времени нужно, чтобы оценить ее эффективность, кроме того, обычно это максимальный срок, на который согласен владелец пациента. Если рацион оказался эффективным, можно проводить провокационные пробы компонентами исходного рациона, чтобы выявить продукт, вызывающий рвоту. Практика показывает, что владельцы нередко отказываются от провокационных проб – в этом случае пациента можно оставить на элиминационном рационе. Можно пробовать другой вариант рациона, если первый оказался неэффективным. Однако чаще всего в этих случаях приходится переходить к медикаментозной терапии, поскольку продолжающаяся на фоне начатого лечения рвота беспокоит как пациента, так и его владельца. Препарат выбора – преднизолон, его назначают внутрь в дозе 1-2 мг/кг 1 раз в день, после прекращения рвоты прием сокращают до 1 раза в 48 часов, затем доза постепенно снижается до наименьшей поддерживающей ремиссию (дозу снижают, пока рвота не начнется снова, тогда необходимо вернуться к предыдущей эффективной дозе и оставаться на ней около 8-12 недель).
Лимфоплазмацитарный гастрит средней и тяжелой степени у собак и кошек
Лечение преднизолоном начинают сразу же, обязательно сочетая его с элиминационной диетой. После прекращения рвоты дозу преднизолона снижают, как и в предыдущем случае, а диету оставляют на максимально длительный срок. Средняя и тяжелая степень ЛПГ нередко сочетаются с образованием эрозий и даже изъязвлений слизистой; в этих случаях в лечебную схему включаются гастропротекторы и Н2-блокаторы:
- внутрь Сукральфат 1 г/30 кг веса собаки за час до кормления. 2-3 раза в день: 250 мг/кошку в том же режиме;
- внутрь, внутривенно Фамотидин 0,1-0,5 мг/кг 2 р/сут.
Стоит избегать длительного назначения антисекреторных препаратов (н2-блокаторы, ингибиторы протонной помпы), поскольку в этом случае возможен избыточный рост желудочной флоры, а также развитие гипертрофического гастрита (до сих пор не подтверждено у кошек и собак).
Если на фоне диеты, преднизолона и гастропротекторов не наступает улучшение, следует перед началом более агрессивной иммуносупрессивной терапии пересмотреть диагноз и убедиться, что исключены все метаболические/системные/эндокринные причины развития хронического гастрита.
Если все же необходимо применить препараты с более выраженным иммуносупрессивным эффектом, либо если у пациента значительно выражено побочное действие преднизолона, препаратом выбора для собак является азатиоприн (внутрь 2 мг/кг 1 раз в день 5 дней, затем – чередуется с преднизолоном; 1 день азатиоприн, 1 день преднизолон). Для кошек препарат выбора – хлорамбуцил в дозе 0,25 мг/кг каждые 24-48 часов.
Лимфоцитарно-плазмоцитарный энтероколит у собак
Аванесова Марина Шамировна — ветеринарный врач ИВЦ МВА, хирург, эндоскопист, соискатель кафедры анатомии и гистологии животных им. профессора А.Ф. Климова.
В настоящее время лимфоцитарно-плазмоцитарный энтероколит встречается достаточно часто. Одним из самых распространенных признаков возникновения данной патологии является хроническая диарея, рвоты и следствием этого потеря веса у собак. Чаще поражаются животные среднего и старшего возраста. Пол значения не имеет.
LPE — наиболее распространенная форма IBD (воспалительные заболевания кишечника). В свою очередь IBD могут иметь другие формы клеточных инфильтратов, таких как эозинофильный гастроэнтерит, гранулематозный энтерит, хронический гистиоцитарный язвенный колит.
LPE – это хроническое, идиопатическое, воспалительное заболевание кишечника, характеризующейся диффузной инфильтрацией лимфоцитов и плазматических клеток в слизистую оболочку ЖКТ, что приводит к диффузным воспалительным реакциям слизистой оболочки кишечника. Повышенное количество лимфоцитов и плазматических клеток вызывает реакцию лимфоидной ткани из-за этого возникает нарушение проводимости стенки кишечника.
Этиология возникновения и патогенез этого заболевания до конца остается неизвестным, но полагают, что есть несколько факторов причиной которых являются поражения слизистой кишечника: реакция иммунной системы, аномальный иммунный ответ слизистой оболочки на различные антигены окружающей среды ( бактериальные, пищевые) приводят к аллергическим реакциям, при которых иммунная система организма атакует собственные клетки и органы.
Продолжительное воздействие антигена вызывает длительное воспаление желудочно-кишечного тракта, вследствие этого высвобождаются протеолитические и лизосомальные ферменты, вырабатываются цитокины, активируются вторичные иммуно-комплексы, а так же образуется большое количество радикалов кислорода. Задержка опорожнения желудка так же может привести вторично к воспалению слизистой жкт. Генетические факторы так же могут влиять на развитие LPE. Бассенджи, шарпей, пшеничный терьер, немецкая овчарка имеют наследственную предрасположенность к данному заболеванию. У Басенджи описана самая тяжелая наследственная форма LPE.
Чаще всего при LPE поражается тонкий кишечник, но не исключено поражение толстого кишечника. В некоторых случаях поражения толстого кишечника могут быть виной желчные кислоты. Мальабсорбция желчных кислот играет роль при постановке диагноза LPE. Мальабсорбция желчных кислот это неспособность кишечника полностью абсорбировать желчные кислоты. Желчь несет токсины и продукты жизнедеятельности из организма и помогает организму усваивать жиры. Желчные кислоты, которые достигают толстой кишки, могут привести к диарее.
Кроме того заболевания относящиеся к патологиям IBD могут вызывать тромбоэмболические поражения, полиартриты, почечнокаменной болезни, дерматологические заболевания и иммуноопосредованную анемию.
Дифференциальный диагноз включает в себя другие причины воспалительного заболевания кишечника: инфекционные заболевания, инфильтрационные воспалительные заболевания (например, эозинофильный, гранулематозный энтерит), опухоли (лимфома, лейомиомы, лейомиосаркома), а так же другие заболевания, такие как лимфангиэктазия, желудочно-кишечные расстройства моторики и экзокринной панкреатической недостаточности.
Диагностика LPE: по гематологическому обследованию первоначальные диагностические данные могут включать в себя нейтрофильный лейкоцитоз со сдвигом влево, микроцитарную анемию, гипопротеинемию, гипоальбуминемию, гиперглобулинемию, лимфопению, гипокальциемию и гиперхолестеринемию . Значения желчных кислот должны быть оценены, чтобы исключить возможные печеночные причины заболевания желудочно-кишечного тракта.
Дополнительные диагностические тесты, которые должны быть выполнены, чтобы исключить эти заболевания могут включать в себя анализ мочи, чтобы исключить почечную причину для потери белка, анализ кала ( Giardia зр, Salmonella зр., Campylobacter зр, Clostridium зр.), исследование фолиевой кислоты и кобаламина (избыточный бактериальный рост), TLI – тест на трипсиноподбную иммунореактивность (экзокринная недостаточность поджелудочной железы).
Тяжелые формы IBD и LPE могут приводить к перитонеальным выпотам, для их классификации потребуется лапароцентез или лапароскопия для забора материала на цитологическое исследование, а так же рентген и УЗИ-диагностика.
Эндоскопическая диагностика играет важную роль в диагностике и лечении данном заболевании. С помощью эндоскопии верхних и нижних отделов ЖКТ, можно визуализировать состояние слизистой оболочки, ворсинок двенадцатиперстной кишки ( цвет, отечность, васкуляризация, поражения слизистой в виде эрозий или язв, расправление складок, инфильтраты и т.д. (рис.1). При патологических изменениях визуализируется усиление рыхлости и зернистости слизистой оболочки (рис.2), уменьшение васкуляризации подслизистого слоя, в некоторых случаях появление эрозий.
Рис. 1 Поражение слизистой оболочки двенадцатиперстной кишки при LPE
Рис. 2 Усиление рыхлости и зернистости слизистой оболочки
Для подтверждения диагноза необходимо взять биопсию слизистой оболочки (рис .3) на морфологическое исследование (рис.4).
Рис. 3 Взятие щипковой биопсии слизистой оболочки двенадцатиперстной кишки.
Рис. 4 Гистопрепарат – слизистая оболочка двенадцатиперстной кишки с признаками воспалительной диффузной инфильтрации лимфоцитарно- плазмоцитарного характера.
При лапароскопическом исследовании можно визуализировать перитонеальный выпот, утолщение петель кишечника, сосудистый рисунок, оценить состояние брызжеечных лимфоузлов, перистальтику, взять кишечную биопсию через все слои для дальнейшего гистологического изучения образцов для постановки окончательного диагноза.
Диагноз ставится на основании исключения заболеваний, которые могут вызвать воспаление кишечника наряду с гистологическими признаками воспалительной инфильтрации в слизистой оболочке кишечника. Стандартизация гистологических описаний кишечных тканей, которые коррелируют с клиническими признаками было бы идеальным для врачей в постановке диагноза LPE.
Лечение LPE как правило симптоматическое с антидиарейными препаратами.
- Смена диеты с низким содержанием гликемического индекса, устранение аллергена (гипоаллергенные корма)
- Преднизолон (ГКС) : 1-2 мг/кг каждые 12 часов продолжительностью 1-2 недели, 0.5-1 мг/кг каждые 24 часа продолжительностью месяц, далее 0.5-1 мг/кг через день в течении месяца.
При отсутствии результата после 2-х недельного лечения вводится более агрессивное иммуносупрессивное лечение:
- Метронидазол ( Флагил) противопротозойный препарат с антибактериальной активностью: 25-65 мг/кг каждые 12-24 часов 5 дней, далее 7.5 мг кг каждые 8 часов: 10-15 мг/кг каждые 8-12 часов.
- Азатиоприн ( Имуран)- иммунодепрессивный препарат : 1мг/кг каждые 24-48 часов.
- Циклофосфамид (Циклофосфан, Эндоксан) противоопухолевое (цитостатическое), алкилирующее, иммунодепрессивное средство : 1-1.5 мг / кг каждые 2 часа.
- А так же симптоматические препараты, такие как метоклопрамид, серения, омепразол.
У большой части пациентов появляется необходимость всю оставшуюся жизнь соблюдать диеты, а также продолжать лечение малыми дозами иммунодепрессантов.
При правильном лечении, многие собаки реагируют положительно и клинические симптомы можно убрать, но у большой части пациентов появляется необходимость всю оставшуюся жизнь соблюдать диеты, а также продолжать лечение малыми дозами иммунодепрессантов для поддержания хорошего качества жизни.
Список литературы:
- Kobayashi S. (2007) Measurement of intestinal mucosal permeability in dogs with lymphocytic-plasmacytic enteritis. J Vet Med pp.745-749
- Rodríguez-Alarcón C.A. (2012) Protein-losing enteropathy in a dog with lymphangiectasia, lymphoplasmacytic enteritis and pancreatic exocrine insufficiency.pp.193-197
- Rousseau M. (2005) Severe lymphocytic-plasmacytic and atrophic gastritis, as well as predominantly eosinophilic, severe enteritis. Pp. 264-267
- Guilford W.G. (1996) Idiopathic inflammatory bowel diseases. In: Guilford W.G., Center S.A., Strombeck D.R., Williams D.A., Meyer D., editors. Strombeck’s Small Animal Gastroenterology. pp:451–486
- Tams T.R. (1999) Small Animal Endoscopy. pp:173–216
- Edward J. Hall (2010) BSAVA Manual of Canine and Feline Gastroenterology. p.328
Вернуться к списку
Эозинофильный гастрит у собаки и кошек
Клинические признаки сходны с таковыми при лимфоплазмацитарном гастрите; гистологически проявляется в инфильтрации слизистой желудка эозинофилами (либо эозинофилы будут преобладать в клеточном инфильтрате). Чаще всего такой тип гастрита связывают с гиперчувствительностью к компонентам пищи либо с эндопаразитозами, поэтому перед началом иммуносупрессивной терапии необходимо провести дегельминтизацию, даже если паразиты не были обнаружены в пробах фекалий. В целом лечебная тактика при эозинофильном гастрите идентична: элиминационная диета, иммуносупрессоры, гастропротективные средства при средней и тяжелой степени выраженности воспаления.
Прочие формы хронического гастрита (гистиоцитарный, атрофический, гипертрофический и пр.) встречаются у кошек и собак редко и чаще всего связаны либо со специфическими поражениями (напр., поражение грибом рода Pythium при гистиоцитарном/гранулематозном гастрите), либо с породной предрасположенностью к некоторым гастропатиям (например, гипертрофия слизистой антрального отдела у собак брахицефалических пород – лхасский апсо и др. Это может приводить к обструкции пилорического отдела желудка и требует хирургической коррекции).
С сайта https://www.familyvet.com
Гипертрофический гастрит и пилорическая гипертрофия слизистой у собак-брахицефалов.