Колонизация Helicobacter pylori поверхности и складок слизистой оболочки желудка значительно затрудняет антибактериальную терапию. Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной.
Эрадикационная терапия Helicobacter pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, — замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы.
Ингибиторы протонной помпы (ИПП)
Терапия ИПП доказала эффективность в различных клинических исследованиях. Хотя in vitro ИПП и оказывают прямой антибактериальный эффект на H. pylori, тем не менее они не играют важной роли в эрадикации инфекции.
Механизм синергии ИПП при сочетании с противомикробными препаратами, который повышает клиническую эффективность эрадикационной терапии, полностью не установлен. Предполагается, что антисекреторные препараты группы ИПП могут способствовать повышению концентрации антимикробных средств, в частности метронидазола и кларитромицина, в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, и концентрация, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильность антимикробных препаратов.
Что происходит в организме
Как только хеликобактерия попадает в организм человека, она сразу опускается в желудок, где и обитает всё оставшееся время. Для того чтобы не погибнуть от желудочного сока, состав которого достаточно агрессивен, хеликобактер выделяет специальные ферменты, которые окружат её оболочкой и обезвреживают кислоту. Спиралевидные усики, которые имеет хеликобактерия, позволяют ей пробурить слой слизистой и пробраться к клеткам пристеночных тканей, которые обычно скрыты от кислоты.
Именно пристеночные клетки тканей становятся основным питанием хеликобактер. Патогенный микроорганизм поедает их и отравляет окружающую среду продуктами своей жизнедеятельности. При этом в организме просыпаются те клетки крови, которые реагируют на хеликобактерии и стремятся их уничтожить (нейтрофилы). Однако, уничтожая патогенный микроорганизм, нейтрофилы уничтожают и клетки слизистой, к которым уже прикоснулась хеликобактер.
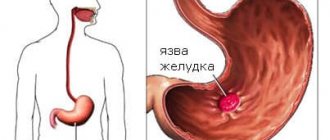
После того, как слой слизистой оболочки нарушен, соляная кислота начинает активно воздействовать на ткани. Так развивается воспалительный процесс и возникает язва. Локализация язв чаще всего похожая. Объясняется это тем, что сама хеликобактерия очень любит два отдела желудка – луковицу и пилорический.
Препараты висмута
Висмут стал одним из первых препаратов для эрадикации H. pylori. Существуют доказательства, что висмут оказывает непосредственное бактерицидное действие, хотя его минимальная ингибирующая концентрация (МИК — наименьшее количество препарата, ингибирующее рост возбудителя) в отношении H. pylori слишком высока. Как и другие тяжелые металлы, такие как цинк и никель, соединения висмута снижают активность фермента уреазы, который принимает участие в жизненном цикле H. pylori. Кроме того, препараты висмута обладают местной антимикробной активностью, действуя непосредственно на клеточную стенку бактерий и нарушая ее целостность.
MALT-лимфома
MALT-лимфома — экстранодальная маргинальной зоны В-клеточная лимфома, ассоциированная со слизистыми оболочками представляет неходжкинскую лимфому, субстратом которой являются достаточно зрелые злокачественно трансформированные лимфоциты, происходящие из солитарных лимфоидных фолликулов слизистых оболочек.
В настоящее время H.Pylori рассматривается как основной каузативный агент заболевания, однако заболеваемость в мире невысока и составляет 1 случай на 30000-80000 инфицированных лиц.
Метронидазол
H. pylori, как правило, очень чувствительны к метронидазолу, эффективность которого не зависит от pH среды. После перорального или инфузионного применения в желудочном соке достигаются высокие концентрации препарата, что позволяет достичь максимального терапевтического эффекта. Метронидазол — это пролекарство, которое в процессе метаболизма проходит активацию бактериальной нитроредуктазой. Метронидазол приводит к потере спиральной структуры ДНК H. pylori, в результате чего происходит поломка в ДНК и бактерия погибает.
NB! Результат лечения считается положительным, если результаты теста на H. pylori, проведенного не ранее 4 недель после курса лечения, будут отрицательными. Проведение теста до истечения 4 недель после эрадикационной терапии значительно повышает риск ложноотрицательных результатов. Предпочтительна отмена приема ИПП за две недели до диагностики.
Эрадикационная терапия хеликобактер пилори: схема
Первая линия эрадикции хеликобактер пилори
Трехкомпонентная схема первой линии получила свое название за то, что она состоит из трех препаратов:
- антибиотик Кларитромицин,
- антибиотик Амоксициллин,
- ингибитор протонной помпы на основе Омепразола, регулирующий активность кислой среды желудочного сока.
Ингибиторы протонной помпы позволяют избавиться от множества негативных проявлений язвы и гастрита, вызванных повышенной кислотностью среды желудка, а так же избежать чрезмерно строгих ограничений, вносимых в рацион питания больного язвенной болезнью. Тем не менее, ограничения все-таки сохраняются, хотя и не такие строгие.
Допускается замена Амоксициллина на антибиотик Нифурател или на Метронидазол. По показаниям гастроэнтеролог может назначить в схему 4 препарат, имеющий в основе производные висмута. В норме такие лекарства включают в эрадикционную схему второй линии, но их свойства положительно влияют на течение процесса купирования воспалительного процесса. На поверхности желудка образуется защитное покрытие, снимающее симптомы воспаления и боль.
Облегченная схема для больных пожилого возраста:
- Антибиотик Амоксициллин;
- Ингибитор протонной помпы;
- Препарат висмута.
Для увеличения эффективности стандартной терапии первой линии предлагается удвоить срок ее применения – с 7 до 14 дней. Ожидаемая эффективность – до 95%. При неэффективности лечения врач рекомендует перейти на вторую линию эрадикционной терапии.
Кларитромицин
Кларитромицин, 14‑членный макролид, представляет собой производное эритромицина с аналогичным спектром активности и показаниями к применению. Однако в отличие от эритромицина он более устойчив к воздействию кислот и имеет более длительный период полувыведения. Результаты исследований, доказывающих, что схема тройной эрадикационной терапии хеликобактер пилори с использованием кларитромицина дает положительный результат в 90 % случаев, привели к широкому использованию антибиотика.
В связи с этим в последние годы было зафиксировано увеличение распространенности устойчивых к кларитромицину штаммов H. pylori. Нет никаких доказательств того, что увеличение дозы кларитромицина позволит преодолеть проблему антибиотикорезистентности к препарату.
Выбор препаратов при необходимости проведения повторного курса эрадикционной терапии
И первая, и вторая, и даже третья схема терапии Helicobacter pylori может быть неэффективной, когда процент эрадикции составляет 80% или менее случаев целевого достижения цели лечения. Эффективность лечения снижается по причине резистентности бактерии к антибиотикам, поэтому исследователи проблемы не прекращают поиск лучших схем.
Не вызывает опасения резистентность Helicobacter pylori к Амоксициллину (менее 1%), к Тетрациклину (близка к 0).
Количество резистентных штаммов бактерии к другим антибактериальным препаратам:
- К Кларитромицину – в Европе от 9,9 до 18%, в Москве – 19,3% у взрослых, 28,5% — у детей;
- К Метронидазолу – в Европе от 20 до 40%, в Москве — 54,8% у взрослых, 23,8% – у детей
Это объясняется частым назначением антибиотиков из группы макролидов в педиатрической и терапевтической практике. Немаловажное значение в успешности эрадикционной терапии имеют ингибиторы протонной помпы, создающие в ЖКТ благоприятную среду для применения антибиотиков. При низком качестве препаратов этой группы эффективность антибактериальных средств тоже снижается.
Проводятся исследования о добавлении к стандартной терапии пробиотика, позволяющего уменьшить частоту стула и проявления метеоризма.
Появилась новая схема эрадикции бактерии – последовательная терапия, занимающая 10 дней. Ее используют при неудаче использования схемы первой линии.
В первые 5 дней принимают:
- Ингибитор протонной помпы – 2 раза в сутки;
- Амоксициллин – 2000 мг/сутки.
В следующие 5 дней:
- Ингибитор протонной помпы – 2 раза в сутки;
- Кларитромицин – 1000 мг/сутки;
- Тинидазол – 1000 мг/сутки.
По данным исследования, даже у пациентов, зараженных Helicobacter pylori с высокой резистентностью к Кларитромицину, эрадикция повысилась с 29% до 89%. У остальных больных с неудачной эрадикцией первой линии показатель повысился с 78% до 91%.
Показания к эрадикационной терапии
В соответствии с принципами, утвержденными в Маастрихте в 2000 году (the Maastricht 2–2000 Consensus Report), эрадикация H. pylori настоятельно рекомендуется:
- всем больным с язвенной болезнью;
- пациентам с низкодифференцированной MALT-лимфомой;
- лицам с атрофическим гастритом;
- после резекции по поводу рака желудка;
- родственникам больных раком желудка первой степени родства.
Необходимость проведения эрадикационной терапии пациентам с функциональной диспепсией, ГЭРБ, а также лицам, длительно принимающим нестероидные противовоспалительные препараты, пока остается предметом дискуссий. Доказательств того, что эрадикация H. pylori у подобных больных влияет на течение заболевания, нет. Однако хорошо известно, что у лиц с H. pylori, страдающих неязвенной диспепсией и корпус-преобладающим гастритом, повышается риск развития аденокарциномы желудка. Таким образом, эрадикацию H. pylori следует рекомендовать также и пациентам с неязвенной диспепсией, особенно если в гистологии выявляется корпус-преобладающий гастрит.
Аргумент против антихеликобактерной терапии у пациентов, принимающих НПВП, таков: организм защищает слизистую оболочку желудка от повреждающего действия лекарственных препаратов, повышая активность циклооксигеназы и синтез простагландина, а ИПП снижают естественную защиту. Тем не менее ликвидация H. pylori до назначения НПВП достоверно снижает риск язвенной болезни на фоне последующего лечения (исследование американских ученых под руководством Франсиса Чана (Francis K. Chan), опубликованное в The Lancet в 1997 году).
Что собой представляет бактерия хеликобактер?
Хеликобактерия является особенным видом патогенных микроорганизмов. Она представляет собой опасную бактерию, которая инфицирует двенадцатиперстную кишку и желудок человека. Сам по себе микроорганизм является паразитом, который производит токсические вещества, повреждающие слизистые оболочки органов. Именно повреждения слизистой и приводят к язвенной болезни, гастриту и другим опасным недугам.
Долгое время считалось, что ни один из организмов не способен выжить в кислой желудочной среде. Но это не касается хеликобактер. Бактерия, напротив, отлично существует в кислой среде, которая для неё является предпочтительнее любого другого обиталища. Helicobacter pylori обладает формой в виде спирали и жгутиками. Такая структура микроорганизма позволяет ему передвигаться по слизистым внутренних органов и наносить непоправимый вред их целостности.
Хеликобактерия может приспособиться практически к любой среде обитания. Объясняется это тем, что данный организм практически не требует кислорода. А ещё одной отличительной особенностью Helicobacter pylori является её умение изменять собственную форму и становиться овальной или круглой.
Российские ученые пришли к решению ввести специальный термин — хеликобактериоз. Обозначает он все процессы, которые начинают происходить в организме сразу после внедрения в него этого патогенного микроорганизма. А вот западные ученые провели исследования карт больных и пришли к выводу, что возникновению инфицирования подвержены около 60-65% населения всей Земли. Так, хеликобактерия — самое распространенное инфекционное заболевание человечества после герпеса, который является вирусным недугом.
Эрадикационная терапия
Несмотря на применение комбинированных схем лечения, у 10–20 % пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя. Наилучшей стратегией считается подбор наиболее эффективной схемы лечения, однако не следует исключать возможность использования двух и даже более последовательных схем в случае недостаточной эффективности терапии выбора.
В случае неудачной первой попытки эрадикации H. pylori рекомендуют сразу перейти к терапии второй линии. Посев на чувствительность к антибиотикам и переход на схемы терапии спасения показан только тем пациентам, у которых терапия второй линии также не приведет к эрадикации возбудителя.
Одной из самых эффективных «схем спасения» является комбинация ИПП, рифабутина и амоксициллина (или левофлоксацина по 500 мг) на протяжении 7 дней. Исследование итальянских ученых, проведенное под руководством Фабрицио Перри (Fabrizio Perri) и опубликованное в Alimentary Pharmacology & Therapeutics в 2000 году, подтвердило, что схема с рифабутином эффективна против штаммов H. pylori, резистентных к кларитромицину или метронидазолу. Однако высокая цена рифабутина ограничивает его широкое применение.
NB! Во избежание формирования резистентности одновременно к метронидазолу и кларитромицину эти препараты никогда не комбинируют в одной схеме. Эффективность подобной комбинации очень высока, однако у пациентов, не ответивших на терапию, обычно формируется устойчивость сразу к обоим препаратам (исследование немецких ученых под руководством Ульриха Пейтца (Ulrich Peitz), опубликованное в Alimentary Pharmacology & Therapeutics в 2002 году). И дальнейший подбор терапии вызывает серьезные затруднения.
Данные исследований подтверждают, что 10‑дневная схема терапии спасения, включающей рабепразол, амоксициллин и левофлоксацин, гораздо эффективнее, чем стандартная эрадикационная терапия второй линии (исследование итальянских ученых под руководством Энрико Ниста (Enrico C Nista), опубликованное в Alimentary Pharmacology & Therapeutics в 2003 году).
РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ИНФЕКЦИИ HELICOBACTER PYLORI
The paper discusses H.pylori eradication more specifically. Based on her own findings and the International Consensus Committee’s recommendations for treating H.pylori infection, the author provides guidelines for the practitioners. The paper underlines the need for applying a uniform approach to the diagnosis and treatment of H.pylori infection.
Т.Л. Лапина – ассистент курса “Функциональная диагностика и фармакотерапия в гастроэнтерологии”, кафедры семейной медицины факультета послевузовского профессионального образования
ММА им. И.М. Сеченова
T.L.Lapina, Assistant, Course “Functional Diagnosis and Pharmacotherapy in Gastroenterology”, Department of Family Medicine, Faculty of Postgraduate Training I.M. Sechenov Moscow Medical Academy
С
1983 г., когда впервые был выделен в культуре новый вид микрооганизма – Helicobacter pylori (H. pylori), многочисленными исследованиями доказано его патогенетическое значение (табл. 1). Изучение H. pylori ведется с использованием современнейших научных методов и продвигается вперед огромными шагами. Такое «стремительное» накопление теоретических знаний в данной области, к сожалению, ведет к некоторому отставанию популяризации этой информации среди практических врачей. В итоге это оборачивается ошибками в диагностике, а главное, в выборе лечения инфекции H. pylori. К сожалению, большинство литературных источников, в которых методически правильно описывается практика эрадикационной терапии, т.е. терапии, направленной на уничтожение H. pylori, англоязычны, на русском языке опубликованы пока единичные работы. Пожалуй, первый документ, направленный на то, чтобы «сделать легитимной» и унифицировать терапию инфекции H. pylori, был принят в феврале 1994 г. специальной конференцией Национального института здоровья США [1]. На конференции был достигнут консенсус по проблеме «Helicobacter pylori и язвенная болезнь»: больных язвенной болезнью с инфекцией H. pylori необходимо лечить антимикробными средствами и при обострении заболевания, и в период ремиссии, причем были рекомендованы определенные схемы терапии. Однако уже через 2 года эти рекомендации устарели, так как появились данные о более эффективных комбинациях лекарственных препаратов для эрадикации H. pylori. В нескольких странах Европы независимо друг от друга были разработаны аналогичные документы, но необходимость единого подхода к диагностике и терапии H. pylori, основанного на опыте лучших европейских исследователей, привела к созыву в городе Маастрихт в феврале 1996 г. специальной конференции. Конференция, организованная Европейской группой по изучению H. pylori, собрала ученых-экспертов в этой области, практикующих врачей и представителей Национальных обществ гастроэнтерологов. После серьезного обсуждения были приняты рекомендации по лечению инфекции H. pylori, отвечающие современным требованиям [2]. «Маастрихтский консенсус» является руководством для практикующих врачей европейских стран и дает ответы на вопросы о H. pylori, которые могут возникнуть в их повседневной деятельности и ведении гастроэнтерологических больных.
Таблица 1. H. pylori и патология человека
| Патологические состояния | Связь с инфекцией H. Pylori |
| Хронический гастрит, вызванный инфекцией H. pylori Язвенная болезнь желудка и двенадцатиперстной кишки Рак желудка MALT лимфома | Установлена |
| Неязвенная диспепсия Болезнь Менетрие Ишемическая болезнь сердца Задержка роста детей | Вероятна |
| Гастроэзофагоеюнальная рефлюксная болезнь Гастродуоденальные изъязвления, связанные с приемом нестероидных противовоспалительных препаратов | Спорна |
«Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки», разработанные Российской группой по изучению H. pylori, прошли обсуждение на научной конференции, посвященной 100-летию со дня рождения В.Х. Василенко в апреле 1997 г. и на III Национальной гастроэнтерологической неделе в ноябре 1997 г. Они опубликованы в Российском журнале гастроэнтерологии, гепатологии, колопроктологии [3] и с помощью Российской гастроэнтерологической ассоциации (РГА) распространены по различным регионам России. Рекомендации предельно конкретны и призваны помочь практикующим врачам и организаторам здравоохранения. Таблица 2. Показания к лечению инфекии H. pylori
| Показания | Степень научной очевидности | |
| Российская гастроэнтерологическая ассоциация Российская группа по изучению H. pylori, апрель 1997 г. | Европейская группа по изучению H. pylori Маастрихт, сентябрь 1996 г. | |
| Язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения и в стадии ремиссии | Обязательно | |
| язвенная болезнь | безусловная | |
| МАLTома желудка | безусловная | |
| гастрит | вероятная | |
| после операции резекции жедудка по поводу рака | вероятная | |
| Желательно | ||
| функциональная диспепсия | возможная | |
| наследственность, отягощенная раком желудка, | возможная | |
| долгий прием ингибиторов протонной помпы по поводу гастроэзофагоеюнальной рефлюксной болезни | вероятная | |
| терапия нестероидными противовоспали- тельными средствами | возможная | |
| после операций по поводу язвенной болезни | вероятная | |
| желание пациента | вероятная | |
| Возможно | ||
| для предотвращения рака желудка | возможная | |
| бессимптомные носители | возможная | |
| экстраалиментарные заболевания(ишемическая болезнь сердца, задержка роста у детей) | возможная | |
Принципиальное значение для практики имеет разделение методики диагностики H. pylori до лечения (первичная диагностика – обнаружение инфекции для обоснования назначения лечения) и после проведения эрадикационной терапии (диагностика эрадикации – контроль успешности антибактериальной схемы). Дело в том, что H. pylori обнаруживаются в 100% случаев при хроническом гастрите, язвенной болезни желудка и двенадцатиперстной кишки. Поэтому для того, чтобы начать антихеликобактерную терапию, достаточно подтвердить наличие бактерии одним из доступных методов (естественно, при соблюдении правил выполнения этих методов и надлежащей стерилизации эндоскопической аппаратуры). Эти методы перечислены в «Рекомендациях»: 1. Бактериологический: посев биоптата слизистой оболочки желудка на дифференциально-диагностическую среду. 2. Морфологические: – гистологический «золотой стандарт» диагностики H. pylori: окраска бактерии в гистологических препаратах слизистой оболочки желудка по Гимзе, толуидиновым синим, Вартину – Старри, Генте; – цитологический: окраска бактерии в мазках-отпечатках биоптатов слизистой оболочки желудка по Гимзе, Граму. 3. Дыхательный: определение в выдыхаемом больным воздухе изотопов 14С или 13С, которые выделяются в результате расщепления в желудке больного меченной мочевины под действием уреазы бактерии H. pylori. 4. Уреазный: определение уреазной активности в биоптате слизистой оболочки желудка путем помещения его в жидкую или гелеобразную среду, содержащую субстрат, буфер и индикатор. Таблица 3. Тройная терапия на основе препаратов висмута
| Препарат висмута | Антибактериальные препараты | |||
| Коллоидный субцитрат висмута или субсалицилат висмута или галлат висмута по 120 мг 4 раза в день(в пересчете на окись вимута) | + | Тетрациклин по 500 мг 4 раза в день | + | Метронидазол 250 мг 4 раза в день или тинидазол по 250 мг 4 раза в день |
| Продолжительность лечения – 7 дней | ||||
В «Рекомендациях» дано определение понятия «эрадикация» – это полное уничтожение бактерии H. pylori (как вегетативной, так и кокковидной форм) в желудке и двенадцатиперстной кишке человека. Эрадикационная терапия – серьезная задача для врача, и не всегда приводит к успеху. Для ведущих научных центров эрадикация H. pylori в 80% случаев является отличным показателем эффективности терапии.
Таблица 4. Соли висмута угнетают H. pylori in vitro
| Соль висмута | MIC90, нг/л |
| Висмута субцитрат | 4 – 32 |
| Висмута субсалицилат | 64 |
| Ранитидин-висмут-цитрат | 16 |
| Висмута субгаллат | 32 |
| Висмута субнитрат | > 128 |
Применение антибактериальных лекарственных препаратов резко снижает количество H. pylori в гастродуоденальной слизистой оболочке. Поэтому сразу после окончания эрадикационного лечения даже в случае его неудачи H. pylori не обнаруживается. Ложноотрицательные результаты обусловлены тем, что H. pylori может отсутствовать в случайно взятых единичных биоптатах слизистой оболочки или находится там в таких незначительных количествах, которые не воспринимаются диагностическими методами (морфологический, уреазный). С уменьшением количества H. pylori связаны сложности его обнаружения после монотерапии висмут-содержащими препаратами, метронидазолом, любыми антибактериальными препаратами, использованными по другим показаниям (например, аугментин по поводу ангины, фурадонин по поводу цистита и др.). Таблица 5. Тройная терапия на основе ингибиторов протонной помпы париетальных клеток
| Ингибиторы протонной помпы Антибактериальные препараты | ||
| Омепразол по 20 мг 2 раза в день | + | Кларитромицин по 250 мг 2 раза в день + метронидазол по 400 мг 3 раза в день |
| Или | или | |
| пантопразол по 40 мг 2 раз в день | амоксициллин по 1000 мг 2 раза в день + кларитромицин 500 мг 2 раза в день | |
| Или | или | |
| Лансопразол по 30 мг 2 раза вдень | Амоксициллин по 500 мг 3 раза в день + метронидазол по 400 мг 3 разав день | |
| Продолжительность лечения – 7 дней | ||
Таблица 6.
Квадротерапия
| Блокаторы протонной помпы | Препарат висмута | Антибактериальные препараты | ||
| Омепразол по 20 мг 2 раза в день | Коллоидный субцитрат висмута | Тетрациклин по 500 мг 4 раза в день | ||
| или | Или | + | ||
| Пантопразол по 40 мг 2 раза в день | Субсалицилат висмута | Метронидазол по 250 мг 4 раза в день | ||
| или | или | или | ||
| Лансопразол по 30 мг 2 раза день | Галлат висмута по 120 мг 4 раза в день | Тинидазол по 250 4 раза в день | ||
| Продолжительность лечения – 7 дней | ||||
Важно отметить, что применение любых ингибиторов протонной помпы (омепразола, пантопразола, лансопразола) в силу особенностей адаптации H. pylori к определенным значениям рН приводит к перераспределению H. pylori по слизистой оболочке: бактерии элиминируются из антрального отдела и в большем количестве обнаруживаются в теле желудка. Считается, что мощная антисекреторная терапия приводит и к уменьшению общего количества бактерий H. pylori. Таким образом, если проводить исследование на H. pylori во время или сразу после курса терапии ингибиторами протонной помпы не исключен ложноотрицательный результат, особенно если ограничиться биоптатами из антрального отдела [4]. Известен факт ложноотрицательной диагностики H. pylori после лечения омепразолом и с помощью дыхательного теста, для которого не требуется биопсия. Таблица 7. Терапия на основе ранитидин-висмут-цитрата
| Ранитидин-висмут-цитрат 400 мг 2 раза в день | Ранитидин-висмут-цитрат по 400 мг 2 раза в день | Ранитидин-висмут-цитрат по 400 мг 2 раза в день |
| + | + | + |
| тетрациклин по 500 мг 4 раза в день | кларитромицин по 500 мг 2 раза в день | Кларитромицин 250 мг 2 раза в день |
| + | + | |
| Метронидазол по 250 мг 4 раза в день | метронидазол по 500 мг 2 раза в день | |
| 14 дней | 14 дней | 7 дней |
Таблица 8. Принципы терапии инфекции H. pylori
| • Использование многокомпонентных схем лечения – тройная терапия – квадротерапия • Строгое соблюдение выбранной схемы лечения – определенные лекарственные препараты – определенные дозы – определенная продолжительность терапии • Учет синергизма лекарственных препаратов |
Поэтому контроль успешности проведения антибактериального лечения требует особого подхода. Правила диагностики эрадикации по «Рекомендациям» следующие: 1. Диагностика эрадикации должна осуществляться не ранее 4 – 6 недель после окончания курса антихеликобактерной терапии, либо лечения любыми антибиотиками или антисекреторными средствами сопутствующих заболеваний. 2. Диагностика эрадикации осуществляется, как минимум, двумя из указанных диагностических методов, причем при использовании методов непосредственного обнаружения бактерии в биоптате слизистой оболочки желудка (бактериологический, морфологический, уреазный) необходимо исследование 2 биоптатов из тела желудка и 1 биоптата из антрального отдела. 3. Цитологический метод для установления эрадикации неприменим. Особое место в диагностике инфекции H. pylori имеют иммуноферментный анализ и экспресс-тесты на основе иммунопреципитации, которые позволяют обнаруживать в сыворотке крови или в капиллярной крови пациентов антитела к H. pylori. Эти методы могут быть использованы в качестве скрининговых или в случае установленной болезни для первичной диагностики инфекции H. pylori. Понятно, что для обнаружения H. pylori после лечения серологические методы неприменимы, так как даже после эрадикации бактерии антихеликобактерные антитела продолжают циркулировать в крови. «Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки» устанавливают в качестве показания к эрадикационному лечению только язвенную болезнь как в стадии обострения, так и в стадии ремиссии. Значение H. pylori в патологии человека значительно шире, хотя результаты эрадикационной терапии действительно лучше изучены при этом заболевании. Маастрихтские рекомендации охватывают гораздо более широкий круг показаний для антихеликобактерного лечения, причем указывают степень важности проведения такого лечения и его научную обоснованность (табл. 2). Вероятно, по мере накопления новой информации показания к эрадикационной терапии в Российских рекомендациях будут расширены. Особенности терапии инфекции H. pylori нашли свое отражение в определенных принципах лечения, которые сформулированы в «Рекомендациях» следующим образом: Основой лечения является использование комбинированной (трехкомпонентной) терапии: • способной уничтожать бактерию H. pylori, как минимум, в 80% случаев; • не вызывающей вынужденной отмены терапии врачом, вследствие побочных эффектов (допустимо менее чем в 5% случаев) или прекращения пациентом приема лекарств по схеме, рекомендованной врачом; • эффективной при продолжительности курса не более 7 – 14 дней. Действительно, наиболее эффективные схемы эрадикационной терапии являются трехкомпонентными. К сожалению, лечение с помощью двух лекарственных препаратов оказывается недостаточным для того, чтобы уничтожить H. pylori как минимум у 80% пролеченных пациентов. Давно не используется в клинической практике сочетание де-нола с метронидазолом, эрадикация с помощью такой схемы практически недостижима. Исследования 1995 – 1996 гг. показали, что сочетание омепразола с одним антибиотиком дает слишком большой разброс результатов эрадикации H. pylori. Так, двойная терапия омепразолом с амоксициллином результативна, по данным разных авторов, в 29 – 92% случаев. В среднем эффективность двойной терапии оценивается в пределах 50 – 70%. Эрадикация в контролируемых исследованиях наступает менее чем у 80% пролеченных, и двойной режим лечения не может быть рекомендован для практического здравоохранения. Таким образом, эрадикационные схемы стали трехкомпонентными и даже четырехкомпонентными. Эрадикационная терапия – это терапия антибиотиками, поэтому естественными являются требования к безопасности и хорошей переносимости такого лечения. К сожалению, укороченный курс менее 7 дней, как правило, приводит к неудаче – эрадикация не наступает. Поэтому, если попытка эрадикационной терапии привела к побочным проявлениям, вынудившим прервать курс (например, аллергическая реакция), с уверенностью можно говорить о персистировании инфекции H. pylori. Рекомендуемые схемы для эрадикации H. pylori приведены в табл. 3, , , . Схемы лечения на основе препаратов висмута, в первую очередь коллоидного субцитрата висмута, раньше всего стали использовать по поводу инфекции H. pylori. Препараты висмута в сочетании с тетрациклином и метронидазолом называют даже классической тройной терапией. Дело в том, что соли висмута обладают бактерицидными свойствами в отношении Н.pylori: разрушают бактериальную стенку, ингибируют ферменты бактерий (уреазу, каталазу, липазу/фосфолипазу), предотвращают адгезию Н. рylori к эпителиальным клеткам желудка. Для солей висмута определены минимальные концентрации, ингибирующие Н. рylori (MIC) (табл. 4). В настоящее время оптимальной считается схема тройной терапии с ингибитором протонной помпы (табл. 5). Благодаря своим особенностям ингибиторы протонного насоса являются незаменимыми в антихеликобактерном лечении. В начале 90-х годов рядом авторов было показано, что монотерапия омепразолом приводит к подавлению Н. pylori (при исследовании биоптатов антрального отдела сразу после курса антисекреторной терапии ингибитором протонного насоса бактерию часто не обнаруживали). Как уже было описано, использование омепразола приводит к перераспределению микроорганизма в слизистой оболочке желудка: их число в антральном отделе снижается, причем часто значительно, а в теле желудка возрастает. Механизм такого регулирующего влияния ингибиторов протонного насоса связан с мощным угнетением желудочной секреции. Синтез АТФ Н. pylori осуществляется благодаря наличию электрохимического градиента ионов водорода. Уреаза бактерии, разлагая мочевину с выделением ионов аммония, приводит к защелачиванию микроокружения бактерии, предохраняющего ее от действия соляной кислоты желудочного сока; в этих условиях синтез АТФ продолжается. Но применение ингибиторов протонного насоса приводит к повышению рН, а эффект уреазы – к суммарному повышению рН, до уровня, который несовместим с жизнедеятельностью микроорганизма. Таким образом, Н. pylori является толерантным к кислым значениям рН (благодаря уникальной уреазной активности), но неустойчивым к щелочной реакции среды «нейтрофилом». При использовании ингибиторов протонного насоса бактерии приходится переселяться в отделы желудка с более низкими значениями рН, т. е. в тело желудка из антрального отдела. Самые мощные из известных на сегодняшний день антисекреторных препаратов – ингибиторы протонной помпы – не только угнетают Н. pylori в антральном отделе, но и стимулируют защитные механизмы макроорганизма в отношении бактерии. Антитела к Н. pylori, секретируемые на поверхность слизистой оболочки желудка, быстро деградируют под влиянием протеолитических ферментов желудочного сока. Сдвиг рН в щелочную сторону при использовании блокаторов Н+, К+-АТФазы заметно снижает протеолитическую активность содержимого желудка и удлиняет период полужизни антител и их концентрацию. Функциональная активность нейтрофилов также зависит от pH и возрастает при его сдвиге в щелочную сторону. Ингибиторы протонного насоса обладают синергизмом с антибактериальными препаратами. Активность многих антибиотиков повышается при сдвиге значений рН из кислой среды в щелочную. Кроме того, уменьшение объема секрета повышает концентрацию антибактериальных препаратов в желудочном соке [4]. Однако антихеликобактерный эффект ингибиторов протонного насоса объясняется не только подавлением секреции. Эти препараты обладают специфической, присущей только этому классу препаратов способностью подавлять H. pylori in vitro и, вероятно, in vivo. Имеются данные, свидетельствующие о том, что они угнетают уреазу бактерии и одну из ее АТФаз. Подавление уреазной активности микроорганизма не так давно показано не только in vitro, но и в клинических экспериментах. Все производные бензимидазола – омепразол, пантопразол, лансопразол – приводят к одинаковому перераспределению бактерии в слизистой оболочке желудка и обладают сходным бактериостатическим эффектом (известны минимальные ингибирующие концентрации каждого из этих препаратов). Таким образом, антихеликобактерный эффект – это свойство ингибиторов протонного насоса как класса лекарственных препаратов. Квадротерапию следует рассматривать как терапию резерва. Ее эффективность в отношении H. pylori оценивается как максимальная (табл. 6). Комбинацию четырех лекарственных препаратов целесобразно использовать как лечение «второй линии», после неудачи первого эрадикационного курса, или в особых случаях (например, при лечении MALTомы желудка.) Новая формула – ранитидин-висмут-цитрат – представляет собой соединение, сочетающее лекарственную активность антисекреторного агента и бактерицидные особенности висмута. Эффект этого комбинированного препарата превосходит суммарные возможности сочетания блокатора Н2-рецепторов гистамина и соли висмута, за счет особого синергизма, присущего данной химической структуре. Особые свойства ранитидин-висмут-цитрата позволяют комбинировать его только с одним антибиотиком – кларитромицином, хотя по сути это сочетание уже трехкомпонентно (табл. 7). Значительно снижает успешность эрадикационной терапии развитие резистентности H. pylori к антибиотикам. Наиболее распространена устойчивость микроорганизма к метронидазолу, хотя описаны штаммы H. pylori, устойчивые к кларитромицину и амоксициллину. Резистентность, как правило, возникает вследствие бесконтрольного неграмотного назначения антибактериального агента. К сожалению, ситуация с метронидазолом в России может быть описана именно таким образом. По данным Л.В. Кудрявцевой, доложенным на III Российской гастроэнтерологической неделе (1997), первичная резистентность H. pylori к метронидазолу обнаруживается в 30% случаев, при повторном курсе метронидазола бактерия устойчива к нему практически в 100% случаев. Самой серьезной и наиболее частой ошибкой в назначении антибактериальных препаратов при язвенной болезни является использование метронидазола не в составе описанных схем, а в качестве дополнительного препарата вместе с блокаторами Н2-рецепторов гистамина, де-нолом или в качестве монотерапии. Репаративные свойства метронидазола, если они и есть, настолько слабы, что при использовании современных ингибиторов Н2-рецепторов гистамина или протонной помпы, приводящих к заживлению язвы за 2 нед, рассчитывать на них просто бессмысленно. А вот устойчивость H. pylori к метронидазолу в случае его необоснованного применения возникает неизбежно. Именно в связи с проблемой резистентности в «Рекомендациях» выделены правила применения антихеликобактерной терапии: 1. Если использование схемы лечения не приводит к наступлению эрадикации, повторять ее не следует. 2. Если использованная схема не привела к эрадикации, это означает, что бактерия приобрела устойчивость к одному из компонентов схемы лечения (производным нитроимидазола, макролидам). 3. Если использование одной, а затем другой схемы лечения не приводит к эрадикации, то следует определять чувствительность штамма H. pylori ко всему спектру используемых антибиотиков. 4. Появление бактерии в организме больного спустя год после лечения следует расценивать как рецидив инфекции, а не реинфекцию*. При рецидиве инфекции необходимо применение более эффективной схемы лечения. Распространенной ошибкой является уменьшение дозы антибактериальных препаратов или продолжительности лечения, произвольная замена компонентов схемы. Даже замена тетрациклина на доксициклин приводит к уменьшению эффективности лечения, замена кларитромицина на эритромицин практически сводит на нет усилия врача по эрадикации инфекции H. pylori. В большинстве случаев неадекватной является замена ингибиторов протонной помпы антагонистами Н2-рецепторов гистамина (табл. 8). К сожалению, встречается даже «поэтапное» назначение компонентов схемы: сначала неделя омепразола с метронидазолом, а затем неделя приема кларитромицина. Итог один – эрадикация не наступает, больной принимает антибиотики без всякого смысла, число резистентных штаммов H. pylori возрастает. Таким образом, лишь строгое соблюдение отработанных схем терапии (вид лекарственных препаратов, их сочетание, дозы и продолжительность лечения) дает возможность добиться эрадикации H. pylori у большинства пациентов.
Литература:
1. NIH сonsensus development panel on Helicobacter pylori in peptic ulcer disease. JAMA 1994; 272:65–9. 2. Current European concepts in the management of Helicobacter pylori infection. The Maastricht Consensus Report. Gut 1997; 41(1):8–13. 3. Рекомендации по диагностике и лечению инфекции Helicobacter pylori у взрослых при язвенной болезни желудка и двенадцатиперстной кишки. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 1998; № 1. 4. Hunt R.H. The role of acid suppression in the treatment of H. pylori infection. In: Helicobacter pylori. Basic mechanisms to clinical cure. Ed. by R.H. Hunt, G.N.J. Tytgat. Kluwer academic publishers. Dordrecht, Boston, London, 1995; 584–93.
Диагностика хеликобактериоза
Диагностика хеликобактериоза подразумевает комплексную оценку состояния ЖКТ. Наиболее эффективными считаются такие методы обследования:
- Определение антител к патогену в крови посредством проведения иммуноферментного анализа. Если показатель концентрации антител выше 1,1 ед/мл, тест считают положительным. При концентрации от 0,9 до 1,1 ед/мл результат определяют как сомнительный, не исключающий развитие хеликобактериоза.
- Эзофагогастродуоденоскопия. Это инвазивный метод, позволяющий определить состояние эпителия. При патологии слизистые органов ЖКТ отечны и гиперемичны. Также дополнительно проводится эндоскопическая биопсия, во время которой берется маленький фрагмент слизистой для дальнейшего гистологического исследования.
- Дыхательный тест. Назначают для определения наличия микроорганизмов и для контроля лечения. Процедура простая и нетравматичная. Тест высоко информативен. С его помощью определяют, есть ли продукты жизнедеятельности хеликобактера в воздухе, выдыхаемом пациентом.
- Дополнительные исследования. Общий анализ крови при обострении хеликобактериоза показывает повышение СОЭ, сниженное значение гемоглобина и эритроцитов, а также макроцитоз. Также можно провести бактериологическое исследование посредством культивирования материала на особых питательных средах.
Способы заражения
Выделяют несколько основных пути заражения:
- контактно-бытовой. Плохо вымытые столовые приборы и посуда, предметы личной гигиены, полотенца являются косвенными переносчиками заболевания. Бактерия относительно устойчива к окружающей среде: при кипячении погибает практически сразу, при воздействии химических препаратов – через пару минут.
- орально-фекальный. Инфицироваться можно при контакте с пищевыми продуктами или загрязненной водой.