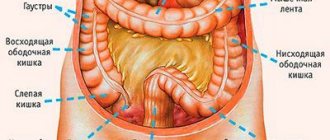
Новообразования кишечника зачастую характеризуются длительным бессимптомным течением и проявляют себя только по мере значительного роста.
Признаки такого заболевания зависят от типа опухоли и места возникновения. Так, тубулярная аденома прямой кишки может проявляться болевыми ощущениями и кровотечениями. При диагностике таких патологий важно отличить доброкачественную опухоль от онкологии.
Введение
Возможность эндоскопического лечения раннего рака толстой кишки обсуждается уже давно. Общепринятым фактом считается достаточность удаления опухоли в пределах здоровых тканей при раке ограниченном слизистой оболочкой. Мнения по эндоскопическому лечению раннего инвазивного колоректального рака (КРР) варьируют от полного отрицания такой возможности [2] до оценки эндоскопического удаления как радикального во всех случаях, когда опухоль удалена в пределах здоровых тканей [8]. Оба этих подхода в настоящее время имеют только историческое значение. Данный обзор посвящен современным взглядам на эндоскопическое лечение раннего инвазивного рака толстой кишки.
Как предотвратить рак прямой кишки?
Онкологического заболевания прямой кишки можно избежать. Болезнь развивается при наличии длительно существующих полипов. Их появление бессимптомно, поэтому чтобы вовремя обнаружить эти доброкачественные образования, людям после 45-ти лет необходимо проходить колоноскопию.
Если во время обследования врач обнаружит у пациента полипы, он сможет их безболезненно удалить. После такого удаления пациенту следует проходить колоноскопию ежегодно во избежание возникновения новых полипов.
Если же образования в прямой кишке не выявлены, колоноскопию можно повторить через 10 лет. В промежутке между этими обследованиями достаточно делать время от времени гемокультуральный тест на скрытую кровь.
Терминология
Ранний рак толстой кишки это аднокарцинома ограниченная слизистой или подслизистым слоем [7].
Согласно переработанной Венской классификации [4] в понятие ранний рак могут быть включены пункты 4-2, 4-3, 4-4 и 5 (рис. 1).
Венская классификация:
- Без интроэпителиальной неоплазии.
- Сомнительная интроэпителиальная неоплазия.
- Интроэпителиальная неоплазия низкой степени.
- Аденома/дисплазия.
- Неоплазия высокой степени без инвазии (интроэпителиальная или внутрислизистая). Аденома/дисплазия.
- Неинвазивная карцинома.
- Подозрение на инвазивную карциному.
- Внутрислизистая карцнома (инвазия в собственную пластинку).
Макроскопическая классификация раннего рака толстой кишки соответствует парижской классификации эпителиальных неоплазий приведенной на рис. 2.
Как в случае хирургического так и эндоскопического лечения рака толстой кишки опухоль должна быть удалена в пределах здоровых тканей. Однако, в отличие от хирургического лечения при эндоскопической резекции слизистой регионарные лимфатические узлы удалены быть не могут. Таким образом, местное удаление опухоли показано только пациентам с минимальным риском метастазирования в региональные лимфатические узлы.
Лечение
Основным методом лечения является удаление тубулярной аденомы. Иногда также требуется удаление части пораженного кишечника.
Возможные варианты хирургического вмешательства:
- Удаление отдельных полипов кишечника (полипэктомия). Показанием к такой операции является размер полипа более 1 см. Преимуществом такой операции является быстрая реабилитация.
- Лапароскопическое удаление полипов – малоинвазивная техника, позволяющая быстро и безопасно удалить аденому прямой кишки.
- Удаление части толстой и прямой кишки. Такое лечение требуется в редких случаях при тяжелом течении заболевания.
Перед выбором техники оперативного вмешательства проводят тщательное эндоскопическое и гистологическое исследование. Если злокачественное перерождение полипа подтвердится, может потребоваться более объемное вмешательство для полного удаления неопластических клеток.
Как проводится удаление тубулярной аденомы прямой кишки покажет видеосюжет:
Факторы риска
Лимфатические сосуды не распостраняются на слизистую оболочку толстой кишки, а присутствуют только в подслизистом и мышечном слое [6]. Таким образом не инвазивные (т.е. не распространяющиеся на мышечную пластинку слизистой) карциномы не могут давать метастазы в регионарные лимфатические узлы и следовательно для них эндоскопическое удаление всегда радикально (при условии, что местно опухоль удалена в пределах здоровых тканей).
Ряд факторов рассматривается в качестве возможных индикаторов наличия или отсутствия метастазов в региональные лимфатические узлы при раннем инвазивном КРР. Это качественные критерии, как: степень дифференцировки опухоли, наличие или отсутствие инвазии в сосуды, отсевы и макроскопический тип раннего КРР. Единственным количественным фактором риска поражения лимфатических узлов является глубина подслизистой инвазии.
Дифференцировка опухоли
Считается общепризнанным, что низкая дифференцировка опухоли является независимым фактором риска метастазирования в лимфатические узлы и гематогенной диссеминации [9, 11, 16, 17]. Правда, по некоторым данным, встречается она не более чем в 10 % случаев раннего рака толстой кишки и чаще всего в сочетании с другими факторами риска [11]. Наибольшую роль играет дифференцировка опухоли в месте наиболее глубокой полслизистой инвазии.
Инвазия в сосуды
Под инвазией в сосуды подразумевается инвазия в лимфатические или венозные сосуды (рис. 3).
По данному вопросу существует два противоположенных подхода. Так Nedzer считает, что венозная инвазия сама по себе не может рассматриваться в качестве изолированного фактора обуславливающего выполнение лапаротомии при раннем КРР [11]. Он также полагает, что изолированная инвазия в лимфатические сосуды встречается редко. Существует и мнение о сложности дифференциального диагноза между лимфатической и венозной инвазией или артефактами [18].
По другим данным необходимость дифференцировки между венозной или лимфатической инвазией отсутствует, а сосудистая инвазия сама по себе является фактором риска наличия метастазов в лимфатических узлах [17]. Подобного мнения придерживаются и Egashira et al. [5] и Yamamoto S., et al. [20].
Мы в своей работе также рассматриваем сосудистую (не зависимо лимфатическую или венозную) инвазию в качестве независимого фактора риска метастазирования в лимфатические узлы.
Отсевы
Отсевы это изолированные клетки опухоли или группы клеток расположенные в других отношениях здоровых тканях (рис. 4).
Отсевы могут рассматриваться в качестве начальной формы инвазии, предшествующей сосудистой инвазии. Она является независимым фактором риска поражения лимфатических узлов не только при раннем, но и распространенном КРР [12, 14].
Макроскопический тип опухоли
Ряд исследователей полагает, что плоские формы раннего КРР связанны с большим риском метастазирования в лимфатические узлы, чем полиповидные опухоли [10]. Однако по другим данным такая взаимосвязь отсутствует [1, 14].
Мы в своей практике не рассматриваем макроскопический тип в качестве независимого фактора риска метастазирования в лимфатические узлы, признавая однако, что опухоли с компонентом типа 0-IIc чаще имеют большую глубину инвазии в подслизистый слой, чем другие макроскопические типы. Однако большая вероятность метастазирования в этом случае будет связана с большей глубиной инвазии, а не с типом опухоли самой по себе.
Глубина инвазии
Глубина инвазии это расстояние от мышечной пластинки слизистой (или ее предположительного расположения) до наиболее глубоко лежащей границы опухоли (рис. 5).
Nagasako K., сообщал об отсутствии метастазов в лимфатические узлы при инвазии в подслизистый слой глубиной до 500мкм и шириной до 2000мкм (инвазия типа sm-s). Однако по другим данным даже такая минимальная степень инвазии может сочетаться с наличием метастазов в лимфатические узлы. Так Tanaka S., et al., выявил метастазы в лимфатические узлы у 4 % пациентов с таким типом инвазии [15].
Диагностика рака прямой кишки
Чтобы вовремя обнаружить колоректальный рак, в современной медицине используют различные виды диагностики:
- Пальцевое ректальное исследование.
- Анализ на скрытую кровь (гемокультуральный тест).
- Колоноскопию.
- УЗИ (ультразвуковое исследование).
- Онкомаркеры.
- МРТ (магнитно-резонансную томографию).
- Сигмоскопию.
- ПЭТ (позитронно-эмиссионную томографию).
- Ректоскопию.
- КТ (компьютерную томографию).
Самый простой метод – ректальное обследование при помощи пальцев. Специалист может нащупать указательным пальцем образования в кишке, оценить их характер и взять биопсию.
При подозрении на рак прямой кишки диагностика продолжается. Каловые массы исследуются на наличие в них скрытой крови. Если она выявлена, пациента направляют на колоноскопию.
Метод этот – единственный и самый информативный способ убедиться в присутствии новообразования в прямой кишке. Эндоскоп вводится в анус для обследования внутреннюю поверхность кишки, предварительно очищенной клизмой или слабительными. Во время процедуры врач не только берет образцы ткани, но и может удалить обнаруженные полипы.
При проведении колоноскопии специалист может исследовать сигмовидную (сигмоскопия) либо прямую кишку (ректоскопия).
На УЗИ орган исследуют с помощью ультразвукового датчика. Это обследование позволяет узнать, насколько опухоль приникла сквозь стенку кишки, есть ли новообразования в соседних тканях, метастазы в лимфоузлах.
Онкомаркеры дают возможность определить степень активности опухолевых клеток.
МРТ наиболее точно показывает картину наличия опухолевых процессов в малом тазу. Это исследование обязательно при подтверждении необходимости химиолучевого лечения перед операцией.
В ходе ПЭТ выявляются раковые клетки, которые становятся видимыми благодаря специальным средствам, вводимым внутривенно.
При проведении КТ используются контрастные вещества, которые помогают визуализировать злокачественные новообразования в прямой кишке, а также обнаружить пораженные метастазами органы.
Литература
- Ajioka Y., et al. Early Colorectal Cancer with Special Reference to the Superficial Nonpolypoid Type from a Histopathologic Point of View Online publication: 5 June 2000.
- Colacchio T.A., et al. Endoscopic polypectomy: inadequate treatment for invasive colorectal carcinoma. Ann Surg 1981;194:704–707.
- Cooper H.S., et al. Endoscopically removed malignant colorectal polyps: clinicopathologic correlations. Gastroenterology 995; 108: 1657–1665.
- Dixon M. F. Gastrointestinal epithelial neoplasia: Vienna revisited. Gut 2002;51:130-131.
- Egashira Y., et al. Analysis of pathological risk factors for lymph node metastasis of submucosal invasive colon cancer. Mod Pathol. 2004 May;17(5):503-11.
- Fenoglio C.M., et al. Distribution of human colonic lymphatics in normal hyperplastic, and adenomatous tissue. Gastroenterology 1973; 64: 51-66.
- Japanese Research Society for Cancer of the Colon and Rectum (1983) General rules for clinical and pathological studies on cancer of the colon, rectum and anus. Jpn. J. Surg. 13:574.
- Lipper S., et al. The significance of microscopic invasive cancer in endoscopically removed polyps of the large bowel. A clinicopathologic study of 51 cases. Cancer 1983;52: 1691–1699.
- Masaki T. Muto T. Predictive value of histology at the invasive margin in the prognosis of early invasive colorectal carcinoma.J Gastroenterol. 2000;35(3):195-200.
- Minamoto T., et al. Early invasive colorectal carcinomas metastatic to the lymph node with attention to their nonpolypoid development. Am. J. Gastroenterol. 1994; 88:1035
- Nedzer P., et al. Risk factor assessment of endoscopically removed malignant colorectal polyps. Gut 1998;43:669-674.
- Okuyama T., et al., Budding as a risk factor for lymph node metastasis in pT1 or pT2 well-differentiated colorectal adenocarcinoma. Dis Colon Rectum 2002;45:628–634.
- Sakuragi M. et al. Predictive factors for lymph node metastasis in T1 stage colorectal carcinomas. Dis Colon Rectum. 2003 Dec;46(12):1626-32.
- Shimomura T., et al. New Indication for Endoscopic Treatment of Colorectal Carcinoma With Submucosal Invasion. J Gastroenterol Hepatol 19(1):48-55, 2004.
- Tanaka S. Endoscopic treatment of submucosal invasive colorectal carcinoma with special reference to risk factors for lymph node metastasis.J Gastroenterol. 1995 Dec;30(6):710-7.
- Tanaka S., et al. Conditions of curability after endoscopic resection for colorectal carcinoma with submucosally massive invasion. Oncol Rep. 2000 Jul-Aug;7(4):783-8.
- Ueno H., et al. Risk Factors for an Adverse Outcome in Early Invasive Colorectal Carcinoma. Gastroent. 2004;127:385–394.
- Volk E.E., et al. Management and outcome of patients with invasive carcinoma arising in colorectal polyps. Gastroenterology 1995;109:1801–1807.
- Williams B. The Rational for Current Practice in the Management of Malignant Colonic Polyps. Endoscopy. — 1993. — 25.
- Yamamoto S., et al. The risk of lymph node metastasis in T1 colorectal carcinoma. Hepatogastroenterology. 2004 Jul-Aug;51(58):998-1000.
| назад |