Постхолецистэктомический синдром (ПХЭС) – явление не самое распространённое в гастроэнтерологии. Принято считать, что ПХЭС относится к группе заболеваний желчного пузыря. В действительности это даже не болезнь, а собирательное название комплекса симптомов, которые проявляются сразу или вскоре после операций на желчные протоки или удаления (резекции) желчного пузыря.
До сих пор как терапевты, так и хирурги затрудняются четко определить причины развития данного синдрома. Сам термин ПХЭС медики склонны использовать лишь для постановки предварительного диагноза у прооперированных пациентов1.
Симптомы постхолецистэктомического синдрома
По своей сути ПХЭС является следствием операции по резекции (удалению) желчного пузыря. Это значит, что после резекции у пациента могут проявиться неприятные симптомы, такие, как:
- диспепсия или нарушение нормальной деятельности желудка, проявляющееся в виде горечи во рту, тошноты, вздутия живота и расстройства кишечника;
- боль в правом подреберье с переходом в правую ключицу или плечо. Интенсивность боли может быть разной, от невыраженной ноющей до острой жгучей;
- общая слабость, бледность кожи (появляется на фоне плохого всасывания пищи и развивающегося витаминного дефицита).
При ПХЭС возможны и другие симптомы, обусловленные обострившимися болезнями:
- обострение холангита – воспаления желчных протоков – выражается в длительно сохраняющейся температуре в пределах 37,1—38,0 °C;
- Холестаз (застой желчи в ткани печени) может давать выраженную желтуху2.
Часто задаваемые вопросы
Обусловлено ли развитие ПХЭС хирургическими ошибками?
По мере изучения механизма развития данного процесса было установлено, что погрешности в проведении хирургического вмешательства стоят на последнем месте среди причин формирования данного состояния.
Лечится ли ПХЭС?
Заболевание имеет склонность к рецидивам, поэтому лечение должно проводится курсами, порой пожизненно.
Как часто развивается ПХЭС после удаления желчного пузыря?
В среднем, заболевание развивается у 30% лиц, подвергшихся холецистэктомии.
Можно ли ограничиться соблюдением диеты в лечении ПХЭС?
Соблюдение диетических рекомендаций обязательный, но не единственный этап в лечении данного состояния.
Применяются ли препараты желчных кислот в лечении ПХЭС?
Да, в случае, если имеются признаки нарушения состава, образования и выделения желчи.
Причины развития постхолецистэктомического синдрома
Причины постхолицистэктомического синдрома и его развития зачастую связаны с нарушением нормального функционирования сфинктера Одди (круговой мышцы). Сфинктер Одди – это гладкая мышца, которая находится в нижней части 12-перстной кишки и отвечает за регуляцию поставки желчи и сока поджелудочной железы в двенадцатиперстную кишку3.
Если учесть, что от ПХЭС страдают чаще всего пациенты, прошедшие операцию по удалению желчного пузыря4, то механизм появления этого синдрома можно объяснить следующим образом:
- после операции сфинктер, в нормальном состоянии раскрывающийся при наполненности желчного пузыря, не получает сигнала о наполнении, в результате чего почти постоянно находится в напряжении;
- из-за отсутствия пузыря желчь поступает в 12-перстную кишку в разведенном состоянии, что увеличивает давление внутри стенок кишки. Кроме того, желчь сама по себе обладает бактерицидным действием и изменение её состава может привести к инфицированию кишечника5.
Но дисфункция сфинктера Одди не всегда может быть обусловлена удалением желчного пузыря. Иногда причиной синдрома являются запущенные болезни ЖКТ* (хронический колит или гастрит, язвенная болезнь) и хронический панкреатит) — заболевание поджелудочной железы, а также ошибки в дооперационном обследовании.
Особенности диеты
Восстановление нормальных процессов выработки желчи возможно с помощью строгой диеты. Сбалансированный рацион и распорядок дня помогут избежать возможных осложнений. В первые сутки после операции рекомендуется полное голодание. Со второго дня врач разрешит употреблять легкие напитки, отвар шиповника. Затем вводится кисломолочная пища, бульоны и др. Обычно новое блюдо добавляют в рацион раз в два дня.
Существует несколько основных правил питания в восстановительном периоде:
- небольшие порции и 5−6 приемов пищи в сутки;
- только теплая еда и напитки — слишком холодные или горячие блюда могут раздражать пищеварительный тракт;
- прием достаточного количества жидкости — не менее 1,5−2 литров в сутки;
- отказ от жирной, острой пищи, маринадов и солений, копченостей;
- правильный выбор способов приготовления — тушение, запекание, варка;
- отказ от газировки, спиртного, свежего хлеба, выпечки и кондитерских изделий.
За основу может быть взят стол №5 по Певзнеру. Даже строгое соблюдение режима питания может не справиться с проблемой полностью, однако следовать рекомендациям врача очень важно. Именно нарушения режима питания становятся частой причиной осложнений.
Диагностика постхолицистэктомического синдрома
Сложности в точном определении причин, приведших к развитию ПХЭС, и размытость самого определения синдрома требуют тщательного обследования пациента. Чтобы правильно выбрать лечение, необходимо четко установить, что привело к появлению ПХЭС.
Вот почему эффективная диагностика постхолицистэктомического синдрома включает сразу несколько методов:
- сбор данных анамнеза – врач внимательно изучает старые медицинские заключения и записи, уделяя пристальное внимание дооперационной диагностике и протоколу проведенной операции;
- клинический осмотр пациента;
- лабораторные исследования — клинический и биохимический анализ крови, анализ кала на простейших и яйца глист, общий анализ мочи;
- ультразвуковое исследование;
- эндоскопию желчных протоков;
- магнитно-резонансная томография или компьютерная томография брюшной полости6.
Введение
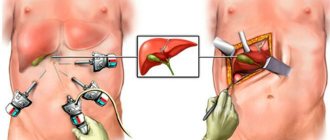
Желчнокаменная болезнь (ЖКБ) в последние несколько десятилетий стала, пожалуй, одним из ведущих гастроэнтерологических заболеваний (10–15 % в популяции взрослых), по поводу которого выполняется масса плановых и экстренных хирургических вмешательств во всем мире [3]. Только в США ежегодно выявляют около 1 млн новых случаев ЖКБ, затраты на лечение достигают 6 млрд долл. в год [3, 4]. В России ежегодно выполняется около 200 тыс. холецистэктомий, в основном лапароскопическим путем [1].
В среднем только у 20 % пациентов ЖКБ проявляется симптомами [5]. В случае симптомного течения ЖКБ хирургическое вмешательство приводит к уменьшению выраженности диспепсии и билиарной боли у значительного числа пациентов. Однако у многих из них (около 40 %) не отмечается облегчения после холецистэктомии либо симптомы могут появиться впервые [6–9]. Симптомы боли и диспепсии после холецистэктомии персистируют с большой вариабельностью (у 5,6–57,3 % пациентов) или же появляются впервые после операции (у 12,0–38,6 % пациентов) [10–13]. Таким образом, до половины пациентов, перенесших холецистэктомию в разные сроки от момента перенесенной операции, предъявляют жалобы на боли в животе и симптомы желудочной и кишечной диспепсии, объясняемые как органическими, так и функциональными причинами [1].
В настоящее время существует очевидный недостаток сведений о наиболее эффективных способах лечения постхолецистэктомических расстройств, вследствие чего существуют весьма различные терапевтические подходы к таким пациентам. Целью настоящего обзора стало суммирование имеющихся данных о лечении пациентов с болями и спазмами после удаления желчного пузыря (ЖП), а также обоснование актуальности проведения дополнительных клинических исследований в этой терапевтической области.
Определение постхолецистэктомического синдрома
Постхолецистэктомический синдром (ПХЭС) только на первый взгляд выглядит простой проблемой, сложности понимания синдрома начинаются уже непосредственно с определения. Первые работы, так или иначе описывающие патологические состояния после перенесенной холецистэктомии, появились за рубежом в конце 1930-х гг. [14–16]. Наиболее знаковой является первая серия наблюдений, представленная J. Hellstrom в 1938 г. (K.K. Nygaard), насчитывающая 1041 пациента, 30 % из которых имели спастические боли в животе после удаления ЖП, аналогичные тем, что были до хирургического вмешательства. Только у 9 пациентов удалось выявить холедохолитиаз, еще реже был диагностирован острый панкреатит. Причины болей в остальных случаях объяснить не удалось, выявленные боли автор назвал «постхолецистэктомической коликой» [16].
Следующая крупнейшая серия наблюдений была представлена H. Doubilet только в устном докладе на заседании хирургической секции Нью-Йоркской академии медицины в апреле 1943 г., что было подробно представлено в последующем обзоре R. Colp [17]. Серия насчитывала 253 пациента, перенесших холецистэктомию и наблюдавшихся в сроки от 1 года до 7 лет. Автор сообщает, что у 40 % пациентов присутствовала послеоперационная симптоматика, часто имевшая сходство с проявлениями до хирургического вмешательства. Именно в этих двух работах [16, 17] впервые встречается термин «постхолецистэктомический синдром», объясняющий комплекс различных расстройств после холецистэктомии, бóльшая часть из которых ввиду отсутствия органических причин (например, холедохолитиаза, стеноза терминального отдела холедоха и т. д.), по признанию авторов, являются функциональными. Такие расстройства сопровождаются рецидивными спастическими болями по типу «колик», в основе которых лежит дискинезия сфинктерного аппарата билиарного тракта, кишечника и пограничные расстройства психики у некото-рых больных.
Что интересно: еще тогда, в открытом наблюдательном исследовании, было отмечено, что чаще ПХЭС развивается при удалении функционирующего ЖП (бескаменный холецистит или калькулезный холецистит без выраженного фиброза стенки ЖП) [16, 17]. Выявленные факты легли в основу эмпирического применения нитратов и атропина для купирования спазма, лежащего в основе ПХЭС, в отсутствие органических причин боли после холецистэктомии [17]. Ряд простых описательных исследований тех лет позволил разработать показания и обсуждать теоретические возможности папиллотомии, опираясь на экспериментальные работы начала прошлого века.
В дальнейшем термин ПХЭС закрепился в научной литературе и регулярно встречался в работах 1940–1970-хх гг. [18–22], число которых к середине 1970-х гг. достигло 100. Интересно, что в первой реферируемой в международных базах данных отечественной работе [23] присутствует скепсис к этому термину. Что еще более любопытно: с конца 1960-х гг. число англоязычных статей на тему ПХЭС в наиболее авторитетных журналах начинает падать практически до нуля к 1980-м, в то время как число работ из Восточной Европы и СССР значительно увеличивается. Уже в 1980-х гг. в авторитетных англоязычных журналах термин ПХЭС заменяют на постхолецистэктомическую боль [24, 25], папиллярную дисфункцию [26] и даже используют терминологию 1930-х гг. – «билиарная дискинезия» [27].
На сегодняшний день абсолютно понятно, что сложность изучения и верификации постхолецистэктомических расстройств, схожесть симптоматики при органических изменениях и функциональных нарушениях привели к тому, что термин ПХЭС в странах Запада уже к середине 1980-х гг. перестал использоваться. В международной практике унифицированного термина «постхолецистэктомический синдром» до сих пор нет, поскольку невероятно сложно определить точный механизм и первопричину боли и диспепсии, возникающих в разные временные отрезки после проведенной холецистэктомии. Однако, как это ни парадоксально, термин ПХЭС вошел в Международную классификацию болезней 10-го пересмотра (Код К91.5) и был чрезвычайно популярен в СССР, а сейчас – и в России. Широкое признание этого термина в 1970–1980-е гг.
в СССР было не случайно ввиду растущего числа холецистэктомий и недостаточного представления о возможных последствиях вмешательства – от функциональной дезадаптации билиарного тракта и даже всей системы пищеварения до грубых органических изменений.
В России сегодня под ПХЭС мы понимаем множество различных заболеваний и состояний, которые возникают у больных после холецистэктомии и теоретически могут быть связаны с ней. Именно невозможность объединения органических изменений и функциональных расстройств под единым диагнозом привела к исчезновению термина за рубежом, где любые отклонения у пациента после холецистэктомии, теоретически связанные с ней, рассматриваются как «состояние после холецистэктомии» [28, 29]. По клиническим показаниям в группах риска и при наличии маркеров органических изменений осуществляется диагностический поиск причины, в противном случае устанавливается диагноз «дисфункция сфинктера Одди», согласно Римским критериям III пересмотра [30–33].
Для объективного представления о структуре нозологий, являющихся причиной гастроинтестинальных симптомов после холецистэктомии, следует обратиться к недавним клиническим исследованиям. Так, в исследовании, проведенном в Румынии [34], обследовались пациенты с симптомами боли и диспепсии после удаления ЖП. Всем пациентам проведено биохимическое обследование – определение уровней билирубина, щелочной фосфатазы, трансабдоминальное и эндоскопическое ультразвуковое исследование, эндоскопическая ретроградная холангиопанкреатография и манометрия, т. е. полный объем методов, позволяющих исключить грубую органическую патологию гепатопанкреатобилиарной зоны. Оказалось, что бóльшая часть пациентов так или иначе имели органическую патологию – холедохолитиаз, культю пузырного протока. У трети пациентов причиной спазмов были причины, не нуждавшиеся в каком-либо хирургическом вмешательстве: дисфункция сфинктера Одди или синдром раздраженного кишечника (СРК).
В другом исследовании, проведенном в Великобритании [35] с целью оценки частоты диареи у пациентов после холецистэктомии, было сообщено, что у 17 % после операции отмечается впервые появившаяся диарея. Как один из наиболее достоверных факторов риска развития диареи авторы приводят молодой возраст. Одной из причин вторичных функциональных нарушений со стороны кишечника после холецистэктомии является мальабсорбция желчных кислот и развитие секреторной диареи за счет избыточного и асинхронного поступления неконцентрированной желчи в просвет кишечной трубки. В основе патофизиологии секреторной диареи лежит и ускоренный пассаж содержимого по тонкой и толстой кишке, сопровождающийся гипермоторикой гладкой мускулатуры кишечника. Гипермоторика и спазм с появлением боли – очень близкие в патофизиологическом плане состояния. Висцеральная гиперчувствительность, спазм (боль) и диарея формируют СРК-подобную симптоматику у некоторых больных после холецистэктомии. Особенности личности у части таких пациентов являются фактором риска закрепления симптоматики.
Важно отметить еще одну работу, оценившую качество жизни пациентов после холецистэктомии с использованием опросника GQL (Gastrointestinal Quality of Life) у 158 пациентов, запланированных на холецистэктомию [36]. Контроль за ними через 6, 12 недель и 2 года после холецистэктомии показал, что операция в общем улучшает качество жизни пациентов: средний балл значительно увеличился через 6 недель после операции, картина сохранялась и через 3 месяца. Однако через 2 года после операции авторы отметили ухудшение качества жизни, по всей видимости, за счет развития у части пациентов тех или иных отклонений, которые можно обозначить как ПХЭС.
Помимо этого с целью определения, как симптомы СРК влияют на исходы холецистэктомиии, все пациенты до холецистэктомии были оценены на соответствие его критериям. Оказалось, что у 32 (20,3 %) пациентов СРК был до холецистэктомии. Качество жизни этих больных после операции было значительно хуже по сравнению с остальными пациентами, и положительный результат от холецистэктомии у них был намного меньше. Наличие каждого симптома Маннинга уменьшало качество жизни на 5 баллов по сравнению с основной группой (статистически достоверно). Соответствие критериям СРК по Римским критериям II уменьшало качество жизни на 12 баллов по сравнению с общей группой пациентов. Таким образом, если у пациента есть СРК до операции, то, весьма вероятно, он сохраняется и, возможно, усугубляется после операции. Именно от такого пациента с большей вероятностью можно ожидать повторных визитов к хирургу и гастроэнтерологу после операции с жалобами на симптомы боли и диспепсии, расстройства стула и ухудшение качества жизни [36].
Патофизиология ПХЭС
Исходя из множества органических и функциональных причин боли и диспепсии после холецистэктомии, в патофизиологии ПХЭС необходимо выделить пять основных блоков факторов с разной патофизиологией, но рядом общих механизмов:
- боль, диспепсия и прочие симптомы, обусловленные органической патологией, связанной с ЖКБ и/или холецистэктомией (культя пузырного протока, холедохолитиаз, острый билиарный панкреатит, стриктуры холедоха и большого дуоденального сосочка и др.);
- клинические проявления другой органической патологии, теоретически не связанной с холецистэктомией (опухоли de novo органов пищеварения);
- дисфункция (спазм) сфинктера Одди, имевшая место исходно или появившаяся/усугубившаяся после холецистэктомии (т. н. истинный ПХЭС);
- нарушение пищеварения вследствие изменения свойств и выделения желчи, получившее название «билиарная недостаточность». Пусть данный термин не является пока общепринятым, однако дефицит желчных кислот и асинхронизм выделения желчи могут способствовать развитию различных патологических состояний, определяющих клиническую картину постхолецистэктомических расстройств (экзокринная панкреатическая недостаточность, дуоденогастральный рефлюкс, синдром избыточного бактериального роста [СИБР] в тонкой кишке и др.);
- другие функциональные нарушения органов пищеварения (СРК, функциональная диспепсия, гастроэзофагеальная рефлюксная болезнь).
Для лучшего представления патофизиологии постхолецистэктомических расстройств следует остановиться на функциях ЖП (выпадающих после холецистэктомии) [1]:
- эвакуаторная (в пищеварительный период обеспечивает выделение желчи в двенадцатиперстную кишку);
- концентрационная и резервуарная (только концентрированная желчь обладает наилучшей способностью участвовать в пищеварении и обеспечивать бактерицидный эффект);
- абсорбционная (поглощение отдельных компонентов желчи как компен-
- саторная реакция при их избытке);
- секреторная (секреция слизи железами шеечного отдела, что облегчает поступление желчи в ЖП, эвакуацию желчи из него);
- гормональная (секреция антихолецистокинина, оказывающего моделирующее влияние на сфинктер Одди).
Сфинктер Одди также несет важные функции, связанные с работой ЖП: регулирует отток желчи и панкреатического сока в двенадцатиперстную кишку, предотвращает рефлюкс содержимого двенадцатиперстной кишки в холедох и главный панкреатический проток, обеспечивает накопление желчи в ЖП в период между приемами пищи, т. к. способен преодолевать секреторное давление печени и осуществляет синхронную работу с ЖП [1].
В патофизиологии постхолецистэктомических расстройств, как это ни странно, до сих пор существует ряд следующих неосвещенных вопросов:
- изменяется ли объем, состав и вязкость вырабатываемой желчи после того, как выполнена холецистэктомия;
- как меняется давление в желчевыводящих протоках после холецистэктомии, особенно в ночное время, когда при функционирующем пузыре реализуется накопительная и концентрационная функции;
- как меняется моторика желчных путей и верхних отделов пищеварительного тракта;
- реагирует ли сфинктер Одди на отсутствие ЖП;
- как влияет отсутствие ЖП на функцию поджелудочной железы?
Для того чтобы ответить на эти вопросы, требуются серьезные исследования, которые, по всей видимости, очень сложно выполнить методологически, а в свете широты индивидуальных особенностей каждого человека и массы других параметров представляются вообще малореальными.
В отдельных исследованиях отмечается, что после холецистэктомии повышается тонус сфинктера Одди, причем гипертонус сохраняется достаточно длительное время – два года и, вероятно, более. В случае длительного спазма сфинктера Одди можно предполагать развитие билиарной гипертензии, холестаза, болевых ощущений. Однако клинически это не всегда наблюдается. Вероятно, речь идет о вариабельной выраженности спазма и связанных с ним процессов.
Итак, утрата ЖП с потерей его функций и развитием вследствие этого дисфункции сфинктера Одди приводит к снижению качества и количества оттекающей желчи и панкреатического секрета в двенадцатиперстную кишку, что не всегда полноценно компенсируется работой других органов пищеварения. В связи с этим создаются реальные условия для нарушения процесса пищеварения. Отчасти патогенез ПХЭС обусловлен выпадением функций ЖП – отсутствие эвакуаторной и концентрационной функций будет определять нарушение процессов липолиза в тонкой кишке, уменьшение бактерицидных свойств желчи. Непрерывное желчеистечение также будет обусловливать дисфункцию пищеварения, а также формирование билиарных рефлюксов и развитие гипертонуса сфинктера Одди [1].
Под влиянием измененной микрофлоры тонкой кишки желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается повреждением слизистой оболочки, развитием дуоденита, рефлюкс-гастрита и эзофагита. В свою очередь дуоденит сопровождается дуоденальной гипертензией и дискинезией двенадцатиперстной кишки, что способствует персистированию патологических рефлюксов.
Необходимо также отметить, что холелитиаз, течение которого в итоге привело к холецистэктомии, часто сопровождается другими сопутствующими заболеваниями органов пищеварения, в первую очередь панкреатодуоденальной зоны, что дополнительно усугубляет качество пищеварительных процессов. Так, длительно протекающая ЖКБ в 60–80 % случаев сопровождается билиарным панкреатитом [2]. После холецистэктомии, как известно, снижается уровень холецистокинина. Начиная с первых суток и в сроки до 5 лет после холецистэктомии отмечается его снижение в 50 раз, что более чем в 2 раза повышает риск развития дисфункции сфинктера Одди [1].
Клиническая картина
Таким образом, болевой синдром после холецистэктомии, являющийся главной причиной снижения качества жизни больных после операции, исходит из многогранной патофизиологии ПХЭС, представленной выше. Основная причина болевого синдрома – функциональная перестройка сфинктерного аппарата желчных путей после холецистэктомии. Уже в течение первого месяца после операции гипертонус сфинктера Одди выявляется в 80–90 % случаев [1].
На сегодняшний день Римским консенсусом хорошо представлена клиника трех типов дисфункции сфинктера Одди: билиарного, панкреатического и смешанного [33].
При изолированной дисфункции сфинктера холедоха возникают билиарные боли, локализующиеся в эпигастральной области или правом подреберье с иррадиацией в спину, правую лопатку. При преимущественном поражении сфинктера панкреатического протока появляются панкреатические боли, локализующиеся в эпигастрии и левом подреберье, иррадирующие в поясничную область. При спазме общего сфинктера отмечаются сочетанные билиарнопанкреатические боли, часто описываемые как «опоясывающие».
Лечебная тактика
В основе подходов к лечению лежит своевременное и правильное установление причины боли и диспепсических расстройств после холецистэктомии. Первоочередная задача – исключение органической патологии билиарного тракта, которая может служить причиной жалоб: холедохолитиаз, билиарные стриктуры, опухолевое поражение и др. Наличие подобных изменений диктует необходимость хирургического лечения.
При исключении органических причин болевого синдрома и явлений диспепсии у больных, перенесших холецистэктомию, в сочетании с рядом косвенных признаков следует думать о функциональном характере боли:
- текущие симптомы имели место и до операции, и в послеоперационном периоде появились вновь с той же или большей выраженностью;
- имеется длительное непрогрессирующее течение;
- применение психотропных препаратов до операции;
- соответствие жалоб критериям функциональных расстройств желудочно-кишечного тракта – ЖКТ (дисфункция сфинктера Одди, СРК).
Исключение органических причин болевого синдрома и явлений диспепсии у больных, перенесших холецистэктомию, служит показанием к консервативному лечению – как правило, всегда комбинированному и в настоящее время до конца не закрепленному рекомендациями.
Основными средствами, по сообщениям различных авторов [37–39], должны быть средства, вляющие на моторику кишечника и сфинктера Одди, в т. ч. спазмолитики. Имеются сообщения о высокой эффективности антагонистов кальция (нифедипин) и нитратов [40], однако эти средства не имеют зарегистрированных показаний к лечению гастроэнтерологических заболеваний на территории Российской Федерации.
Дополнительно могут назначаться средства лечения СИБР, дуоденогастрального рефлюкса, панкреатические ферменты и др. Унифицированных схем фармакотерапии не существует вследствие частого сочетания различных функциональных расстройств в самых разных комбинациях, способных чередоваться во времени, наличии необязательных, но частых сопутствующих синдромов (СИБР и др.). Следует признать, что в случае доказанной дисфункции сфинктера Одди, резистентной к консервативному лечению в течение 3 месяцев, возможно эндоскопическое лечение (папиллотомия и стентирование).
Выбор спазмолитика осуществляется в рутинной практике эмпирическим путем, т. к. верифицировать тип моторных нарушений и проводить фармакологические пробы с разными препаратами невозможно. Более того, за счет комбинации функциональных расстройств у одного больного трудно бывает разделить жалобы, обусловленные дисфункцией сфинктера Одди, дуоденогастральным рефлюксом, сопутствующим СРК. Поэтому выбираются средства, способные ликвидировать спазм как в билиарном тракте, так и в кишечнике.
Предпосылки и актуальность проведения постмаркетингового клинического исследования
В Москве 18 июня 2013 г. состоялось совещание с целью обсуждения и согласования протокола клинического исследования, посвященного изучению эффектов мебеверина в отношении пациентов, имеющих симптомы спастической боли в животе и диспепсии после холецистэктомии. Все соавторы данной статьи создали рабочую группу, в ходе работы которой были освещены нижеизложенные факты.
Итак, ПХЭС – это гетерогенная группа заболеваний, которые в основном проявляются абдоминальной болью и так или иначе связаны с холецистэктомией. Термин «постхолецистэктомический синдром» не до конца точен, потому что описывает как билиарные, так и небилиарные заболевания, органические и функциональные. Симптомы ПХЭС также неспецифичны, они проявляются болью в эпигастрии и правом подреберье, диспепсией и нарушениями стула, связанными с болями в животе.
На российском фармакологическом рынке существует оригинальный мебеверин (Дюспаталлин®, Эбботт). Согласно инструкции по медицинскому применению, у него имеется два показания к назначению: СРК и симптоматическое лечение спазмов органов ЖКТ (в т. ч. обусловленных органическими заболеваниями). Таким образом, спазм сфинктера Одди, обусловленный холецистэктомией, также является показанием к применению мебеверина. В клинических исследованиях препарат продемонстрировал эффективность при СРК [41–44] в силу известного механизма действия купирования спазма в сочетании с дополнительным механизмом, препятствующим полному расслаблению клетки за счет блокады кальциевого тока [45]. В плацебо-контролируемом исследовании было доказано, что мебеверин достоверно ослабляет моторику толстой кишки [46]. На основании этих данных мы можем предполагать, что применение мебеверина способно не только уменьшать выраженность боли, вызванной спазмом, но и замедлять транзит по толстой кишке, тем самым уменьшать кишечные проявления постхолецистэктомических расстройств.
Среди опубликованных исследований по применению мебеверина при билиарной патологии существуют только небольшие открытые отечественные исследования больных ПХЭС, ЖКБ и хроническим холециститом [37–39, 47]. Наибольший интерес представляет исследование [39] применения мебеверина для профилактики развития ПХЭС до и после холецистэктомии, в котором было показано уменьшение выраженности симптоматики. К сожалению, несмотря на положительные данные по возможности применения мебеверина при билиарной патологии, ни одно из цитируемых выше исследований не было многоцентровым.
Таким образом, мы сегодня понимаем необходимость получения дополнительных научных данных на широкой популяции пациентов в рамках многоцентрового исследования. Это тем более важно, что с позиций современной науки мы имеем недостаточно данных для формирования базиса фармакотерапии постхолецистэктомических расстройств. Разработанные на сегодняшний день за рубежом подходы базируются преимущественно на методиках эндоскопического лечения – папиллосфинктеротомии и стентировании холедоха при откровенном дефиците публикаций по консервативному ведению таких пациентов. Поэтому в планируемом исследовании нам очень важно показать влияние консервативной терапии на качество жизни пациента, а также получить дополнительные данные по эффективности и безопасности мебеверина для пациентов с сопутствующими холецистэктомии расстройствами кишечника. Поскольку нет международных публикаций на эту тему, полученные в ходе планируемого исследования результаты будут опубликованы в 2014–2015 гг. не только в России, но и за рубежом.
Предварительное название протокола исследования: «Постмаркетинговое обсервационное исследование эффективности мебеверина (Дюспаталин®) у пациентов с дисфункциями сфинкетера Одди после холецистэктомии (исследование Odissey)».
Заключение
В завершение необходимо сделать следующее заключение. Во-первых, имеется много больных с неудовлетворительными результатами качества жизни после перенесенной холецистэктомии ввиду рецидивирующей спастической боли в животе, число которых продолжает увеличивается. Именно для таких пациентов необходимо оценить возможность применения мебеверина. Если у больного есть типичные клинические проявления, отсутствие признаков органической патологии, предполагается оценить влияние мебеверина на симптомы и качество жизни, что позволит нам ответить на вопрос, насколько эффективна консервативная терапия таких пациентов. Это исследование особенно актуально, поскольку в настоящее время недостаточно данных о ведении пациентов со спастическими нарушениями ЖКТ после удаления ЖП.
Нам представляется, что результаты данного исследования будут реально востребованы в рутинной клинической практике, эти данные будут жить и использоваться врачами во благо наших пациентов.
Авторы статьи являются членами Совета экспертов по теме «Рабочая группа: качество жизни после холецистэктомии», организованного . Авторы благодарят за оказанную помощь при публикации результатов Совета экспертов (оплата публикационного взноса).
Лечение постхолицистэктомического синдрома
Так как ПХЭС – это не самостоятельное заболевание, лечение синдрома всегда определяется его причинами. Не зная, как правильно лечить постхолицистэктомический синдром, можно лишь усугубить состояние и усилить неприятную симптоматику.
Принципы лечения ПХЭС включают два ключевых момента:
- сбор данных анамнеза – врач внимательно изучает старые медицинские заключения и записи, уделяя пристальное внимание дооперационной диагностике и протоколу проведенной операции;
- устранение причин синдрома;
- профилактику и лечение предполагаемых осложнений.
Лечение в основном строится на:
- диетотерапии;
- медикаментозном лечении;
- хирургии (по показаниям)7.
Вместе с комплексным лечением эти меры могут уменьшить выраженность симптомов ПХЭС8.
Лечение хологенной диареи
Основные цели терапии – восстановить нормальный биохимический состав желчи, функцию желчевыводящих путей и минимизировать непрерывное воздействие желчных кислот на тонкий кишечник. В большинстве случаев соблюдение рекомендованного режима и диеты приводит к выздоровлению. Необходимость назначения препаратов определяется врачом в каждом конкретном случае.
Послеоперационный режим
После лапароскопической операции на первые-вторые сутки разрешается делать прогулки по 30-40 минут ежедневно, дыхательная гимнастика и лечебная физкультура. Поднимать тяжести более 5 кг в первые 7-10 дней противопоказано. Через 4-6 месяцев расширяется диапазон физических нагрузок, добавляется бег и проработка мышц живота. Сроки восстановления определяются наличием или отсутствием осложнений, исходным уровнем физической подготовки, сопутствующей патологией.
Особенности питания при удалённом желчном пузыре
Чтобы желчь не накапливалась в протоках, еда должна поступать часто и небольшими порциями. Оптимальное количество приёмов пищи 5-7 в сутки. Объем основной порции – 200-250 мл. Обязательно 2-4 перекуса. Жиры ограничивают до 60-70г в сутки.
При хологенной диарее в раннем послеоперационном периоде американские терапевты рекомендуют диету «BRATTY». Она включает бананы, рис, яблоки (предпочтительно запечённые), чай некрепкий, сухой вчерашний хлеб и галетное печенье, йогурт натуральный. Важно пить достаточно жидкости, чтобы не допустить противоположной проблемы – запора.
Соблюдение ряда рекомендаций поможет улучшить качество жизни после операции:
- Уменьшить количество жирной и жареной еды. Пищу готовить на пару, тушить или отваривать. Совсем исключать жиры из рациона не нужно. За один приём пищи переваривается 3 грамма жиров. Большее количество вызывает нарушение моторики и вздутие.
- Увеличить количество клетчатки в течение 2-4 недель. В рацион включить крупяные каши, продукты из цельнозерновой муки, добавлять сливочное и растительное масло. Резкое увеличение клетчатки приводит к газообразованию.
- Из белковых продуктов рекомендуется рыба нежирных сортов (хек, минтай) и нежирное мясо (курица, перепёлка, кролик, говядина) 1-2 раза в неделю. На перекус и ужин предлагаются молочные продукты со сниженным содержанием жира (творог, кефир, йогурт).
- В рационе должны присутствовать овощи, свежие тушёные и запечённые. Квашеные и соления не рекомендуются, чтобы предотвратить вздутие.
- Кофе ухудшает проявления диареи, поэтому от него лучше отказаться. Сладости заменить на не кислые фрукты и мёд.
Медикаментозная коррекция поноса
Лечить диарейный синдром нужно в зависимости от выраженности и сопутствующих жалоб. Для предотвращения электролитных нарушений в остром периоде назначают регидратационные растворы (Регидрон, Ионика, Био Гая ОРС). Нормализовать микрофлору кишечника помогают пробиотики (Энтерожермина, Энтерол, Линекс). Для лечения болезненных спазмов назначают спазмолитики (Мебеверина гидрохлорид) и желчегонные препараты. Нормализуют функцию печени растительные препараты, содержащие силимарин (Гепабене, Эссенциале, Карсил, Дарсил).
При выявлении признаков воспаления требуются антибиотики (Эритромицин, Кларитромицин, Ципрофлоксацин). Для ослабления моторики применятся лоперамид (Имодиум, Лопедиум). Ферментная недостаточность может вызывать диарею, метеоризм и тяжесть в желудке. Восполнить дефицит ферментов и облегчить переваривание пищи помогают Креон (Пангрол, Панзинорм, Эрмиталь). При диарее всасывание полезных веществ ограничено, поэтому назначаются витаминно-минеральные комплексы, содержащие омега 3-жирные кислоты, магний, витамины группы В, С.
Без пожизненного соблюдения диеты и режима лекарственная терапия малоэффективна.
Раздражение от диареи
Хологенная диарея вызывает повреждение кожи заднего прохода желчью и кислотами с раздражающим действием. Несколько правил помогут облегчить болезненное состояние.
- После опорожнения кишечника не тереть, а промачивать. Использовать вместо туалетной бумаги детские влажные салфетки.
- Нанести тонким слоем детский защитный крем от пелёночного дерматита на область заднего прохода. Барьер оградит раздражённую кожу от действия желчных кислот.
- Избегать жгучих специй и пряностей. Стимуляция выделения желчи приведёт к большему раздражению.
- Вести пищевой дневник. Так можно отметить блюда, провоцирующие неприятный симптом.
Применение ферментных препаратов при постхолицистэктомическом синдроме
В некоторых случаях ПХЭС может сопровождаться нарушениями со стороны пищеварительной системы. Это связано с тем, что сигналом для выработки желчи и панкреатических ферментов становится приём пищи. Если сигнал не поступает или поступает с перебоями, последующие события также нарушаются. В результате пища не обрабатывает должным образом, и организм недополучает полезные вещества. Это может сказываться на общем состоянии организма и проявляться тяжестью после еды, дискомфортом, вздутием или диареей.
Для поддержания пищеварения разработаны ферментные препараты, они доставляют ферменты извне, чтобы компенсировать их нехватку в организме. Флагманом среди таких препаратов является Креон®.
Препарат выпускается в форме капсул, содержащих сотни маленьких частиц – минимикросфер. Они не превышают по размеру 2-х мм, который зафиксирован как рекомендованный в мировых и российских научных работах9,10. Маленький размер частиц позволяет препарату Креон® воссоздавать процесс пищеварения, каким он был задуман в организме, и тем самым справляться с неприятными симптомами. Дозировки препарата обычно подбираются врачом, однако, в соответствии с современными рекомендациями стартовой дозировкой считается 25 000 единиц10.
Узнать больше
Важным этапом лечения ПХЭС является ферментотерапия, т.к. во многих случаях ПХЭС имеет место нарушение функции поджелудочной железы и возникновение ферментной недостаточности11. Из-за этого возникают проблемы с пищеварением, проявляющиеся в виде неприятных симптомов, таких как боль в животе, тяжесть в желудке, метеоризм и диарея. Кроме того, нехватка ферментов сказывается на качественном усваивании питательных веществ: организм не получает необходимые витамины и минералы.
Креон® — современный ферментный препарат, восполняя дефицит собственных ферментов способствует лучшему усваиванию пищи и улучшению пищеварения. Подробнее о препарате можно узнать здесь.
Средства борьбы с диареей после холецистэктомии
Неправильное питание приводит к поносу.
После операции пациент находится в стационаре, за ним наблюдают врачи и вовремя корректируют все возникающие осложнения.
Питание там исключительно диетическое, больным дают средства, замедляющие работу кишечника, вводят средства, которые помогают восстановить объем потерянной жидкости, восполнить запас витаминов, минералов.
Поэтому первые недели после операции проходят нормально. А вот после выписки начинаются проблемы. Обычно пациенты, уставшие от однообразного рациона, позволяют себе многое.
Они считают, что проблемы позади, поэтому начинают употреблять много лишнего в пищу. Они попросту возвращаются к привычному питанию. Надо напомнить, что в большинстве случаев данной операции подвергаются люди с лишним весом.
Значит, они уже много лет не ограничивают себя в пище, считая, что все пройдет бесследно. Даже после операции им сложно перестроиться, они просто не могут отказать своему аппетиту и едят много вредной жирной пищи.
После выписки они сразу набрасываются на пищу, желая наверстать упущенное. Поедая запрещенную пищу, они делают понос просто неизбежным.
Вместе с диареей приходит ухудшение состояния, потеря жидкости и прочие негативные последствия.
Поскольку при поносе пища не усваивается, голод не проходит. Это ведет к дальнейшему неконтролируемому потреблению пищи и, как следствие, отягощению ситуации в целом следовательно, главным «лекарством» можно считать только строжайшую диету.