Что это
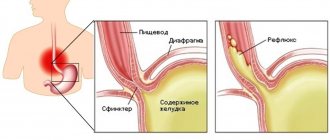
Это одна из форм гастроэзофагеальной рефлюксной болезни (ГЭРБ). Соляная кислота, которая содержится в желудочном соке, оказывает постоянное агрессивное воздействие на слизистую оболочку пищевода. Такое повреждение пищевода приводит к образованию рефлюкс-эзофагита.
Причины
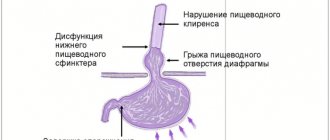
Обратный заброс содержимого желудка и двенадцатиперстной кишки в пищевод происходит из-за нарушения моторно-эвакуаторной функции пищевода, желудка и двенадцатиперстной кишки. В норме нижний сфинктер пищевода предотвращает рефлюкс. Однако в некоторых ситуациях этот защитный механизм не срабатывает. Причин может быть несколько:
- ослабление тонуса нижнего сфинктера пищевода;
- ухудшение способности пищевода к самоочищению;
- повышенное внутрибрюшное давление;
- ожирение;
- беременность;
- сужение пищевода возле нижнего сфинктера;
- стресс;
- грыжа пищеводного отверстия диафрагмы;
- наклон корпуса вперед (в этом случае рефлюкс будет физиологическим).
Существуют и другие факторы, которые способствуют ослаблению тонуса нижнего сфинктера пищевода:
- курение;
- алкоголь;
- употребление сладостей и специй;
- прием медикаментов (блокаторы кальция, антидепрессанты, антигистаминные и противовоспалительные средства);
- ослабленный иммунитет³.
Рефлюкс-эзофагит и астма
Исследование одной американской клиники показало, что 75% пациентов с рефлюкс-эзофагитом также страдают от астмы⁴. Действительно, у них есть общие симптомы — хрипы, затрудненное дыхание и кашель. Однако это не астма провоцирует рефлюкс-эзофагит, а наоборот. ГЭРБ способна вызвать астму у людей, предрасположенных к ее появлению.
Симптомы
При рефлюксе-эзофагите части пищи и воды продвигаются не вниз по желудочно-кишечному тракту, а, наоборот, обратно наверх — в пищевод и глотку. Фото: brgfx / freepik.com
Наиболее характерные проявления рефлюкс-эзофагита:
- изжога;
- тошнота;
- заброс желудочного сока и остатков пищи в ротовую полость;
- гиперсаливация (избыточное выделение слюны);
- неприятный привкус во рту после пробуждения;
- затрудненное и/или болезненное глотание как следствие спазма пищевода;
- чувство жжения в загрудинной области.
Важно!
Часто чувство жжения за грудиной отдает в шею и левую часть груди. Поэтому иногда рефлюкс-эзофагит ошибочно принимают за стенокардию и другие заболевания сердца.
Существуют также вторичные симптомы рефлюкс-эзофагита:
- осиплость голоса;
- чувство кома в горле;
- ухудшение состояния зубов из-за повреждения зубной эмали;
- воспаление десен;
- неприятный запах изо рта.
Совсем не обязательно, чтобы все эти клинические признаки проявлялись единовременно: даже двух-трех симптомов из этого списка вполне достаточно для того чтобы посетить гастроэнтеролога.
Классификация по степени поражения
В современной клинической практике используется несколько классификаций, основанных на разных критериях. Базовая классификация по степени поражения выглядит следующим образом:
1. Неэрозивный рефлюкс-эзофагит. На внутренней стенке пищевода отмечается только покраснение слизистой оболочки.
2. Эрозивный рефлюкс-эзофагит. Отмечаются эрозивные поражения.
Эту классификацию большинство специалистов считают слишком примитивной, поскольку она отражает степень прогрессирования болезни лишь в самых общих чертах.
По мере сбора данных, полученных при эндоскопических исследованиях, гастроэнтерологи разных стран вывели собственные классификации с расширенными морфологическими критериями.
Классификация А.Ф. Черноусова
Ученый разделил эзофагит на три формы:
1. Легкий эзофагит. Нижняя треть пищевода умеренно гиперемирована и отечна, складки слизистой оболочки утолщены, сам пищевод слегка расширен.
2. Эзофагит средней тяжести. Более сильная отечность и гиперемия в нижней трети пищевода, его просвет расширен (но при этом в очаге воспаления сужен), присутствуют эрозивные поражения слизистой оболочки, сопровождающиеся кровоточивостью.
3. Тяжелый эзофагит. Ярко выраженная гиперемия и отечность нижней трети пищевода, значительно расширенный просвет пищевода (одновременно отмечается спазм в зоне поражения), слизистая оболочка изъязвлена, под фибринозными налетами обнаруживаются кровоточащие очаги эрозии.
Классификация А.Ф. Черноусова была принята еще в 1973 году и на протяжении более 20 лет была достаточно популярна среди отечественных специалистов.
Классификация Хетцеля-Дента
По данной классификации существуют четыре степени болезни:
- I степень: отмечается гиперемия (покраснение) и рыхлость слизистой оболочки при отсутствии эрозивных поражений.
- II степень: в эрозивный процесс вовлечено не более 10% слизистой.
- III степень: эрозии поражают не более 50% слизистой.
- IV степень: эрозивное поражение большей части слизистой или глубокая пептическая язва в любой части пищевода.
Эту классификацию использовали до середины 90-х годов. Затем ей на смену пришла классификация из Лос-Анджелеса, и про критерии Хетцеля-Дента стали понемногу забывать.
Лос-Анджелесская классификация
В 1996 году в Лос-Анджелесе прошел конгресс Всемирной гастроэнтерологической организации. На конгрессе была принята новая классификация, которая получила широкое распространение в зарубежной клинической практике².
| Степень | Клинические проявления |
| A | Один или несколько разрывов слизистой оболочки длиной не более 5 мм, ни один из которых не проходит между верхушками складок слизистой оболочки |
| B | Длина одного или нескольких разрывов слизистой оболочки превышает 5 мм, при этом ни один них не проходит между верхними частями двух складок слизистых оболочек |
| C | Разрывы слизистой оболочки проходят между вершинами двух или более складок слизистой оболочки, но занимают менее 75% окружности пищевода |
| D | Разрывы слизистой оболочки проходят между вершинами двух или более складок слизистой оболочки, занимая при этом более 75% окружности пищевода |
Классификация по А.Н. Окорокову
В отечественной клинической практике больше прижилась классификация Окорокова, которая тоже выделяет четыре степени тяжести болезни, однако с более понятными критериями:
- I степень: отечная и гиперемированная слизистая, отмечаются обильные слизистые выделения.
- II степень: помимо отека и гиперемии на слизистой отмечаются единичные эрозии.
- III степень: отечность, гиперемия и кровоточивость слизистой, множественные эрозии.
- IV степень: большая часть пищевода поражена эрозиями, выделяемая слизь приобретает вязкую консистенцию.
Классификация по Савари-Миллеру
Следует также упомянуть о классификации по Савари-Миллеру, принятой в 1994 году и получившей широкое распространение как в зарубежной, так и в отечественной клинической практике. По своей сути она представляет слегка модифицированную версию классификации Хетцеля-Дента:
- I степень: на фоне отека и гиперемии слизистой оболочки отмечаются линейные эрозии, которые занимают не более 10% окружности нижней трети пищевода.
- II степень: эрозии сливаются, занимая до 50% окружности нижней трети пищевода.
- III степень: множественные эрозивные поражения, которые занимают более половины окружности нижней трети пищевода.
- IV степень: глубокие язвы, стриктуры (сужения) пищевода в области поражения, цилиндрическая метаплазия слизистой оболочки.
Оппортунистические инфекции – актуальная проблема современной гастроэнтерологии. Микозы органов пищеварения могут быть вызваны различными микроскопическими грибами, однако первое место по частоте поражений желудочно-кишечного тракта, безусловно, занимает кандидоз. Диагностика и лечение кандидоза пищевода в ряде случаев сопряжены с определенными трудностями.
Дрожжеподобные грибы рода Candida – это одноклеточные микроорганизмы размерами 6–10 мкм. Эти микромицеты диморфны: в различных условиях они образуют бластомицеты (клетки-почки) и псевдомицелий (нити удлиненных клеток). Эта морфологическая особенность имеет, как будет показано ниже, важное клиническое значение.
Микромицеты рода Candida широко распространены в окружающей среде. Жизнеспособные клетки Candida spp. обнаруживаются в почве, питьевой воде, пищевых продуктах, на коже и слизистых оболочках человека и животных. Таким образом, контакт “открытых систем” индивида (кожи и слизистых оболочек) с этими микромицетами можно охарактеризовать как вполне ординарное событие.
Исход контакта с дрожжеподобными грибами рода Candida обусловлен состоянием системы антифунгальной резистентности индивида. В большинстве случаев такой контакт формирует так называемое транзиторное кандидоносительство, когда структуры и механизмы антифунгальной резистентности обеспечивают деконтаминацию макроорганизма. В то же время у лиц с нарушениями в системе антифунгальной резистентности контакт может сформировать как персистирующее носительство, так и кандидоз. Таким образом, кандидоз пищеварительного тракта имеет типичные черты оппортунистический инфекции.
Заболевание кандидозом пищевода опосредуется и предопределяется факторами патогенности Candida spp. В частности, клетки гриба могут прикрепляться к эпителиоцитам (адгезия), а затем через трансформацию в нитевидную форму (псевдомицелий) внедряться в тканевые пространства (инвазия) и вызывать некроз тканей макроорганизма за счет секреции аспартилпротеиназ и фозфолипаз [1]. Перечисленным факторам патогенности естественным образом противостоят многочисленные факторы антифунгальной резистентности. В частности, большое значение имеют целостность слизистой оболочки пищеварительного тракта и мукополисахариды слизи. Защитную роль играют также антагонизм дрожжеподобных грибов и облигатных бактерий пищеварительного тракта, активность пищеварительных ферментов, фунгистатическое действие неспецифических гуморальных факторов, таких как лизоцим, комплемент, секреторный IgA, трансферрин и др. Однако наибольшее значение в системе антифунгальной резистентности имеет функция клеток фагоцитарного ряда – в первую очередь, полиморфноядерных лейкоцитов, в меньшей степени — мононуклеарных фагоцитов и естественных киллеров. Специфический антифунгальный гуморальный ответ реализуется за счет синтеза В-клетками специфических противокандидозных антител классов IgA, IgM, IgG и в определенной степени IgE. Наконец, сложная кооперация CD4- и CD8-лимфоцитов и активность цитотоксических клеток обеспечивают адекватный специфический клеточный иммунный ответ.
Дефекты в описанной выше системе антифунгальной резистентности являются факторами, способствующими возникновению кандидоза, или так называемыми факторами риска. Группы риска по развитию кандидоза пищеварительного тракта:
- физиологические иммунодефициты (ранний детский период, старческий возраст, беременность);
- генетически детерминированные (первичные) иммунодефициты;
- СПИД;
- онкологические заболевания, особенно на фоне лучевой и химиотерапии;
- аллергические и аутоиммунные болезни, особенно на фоне лечения глюкокортикостероидами;
- заболевания эндокринной системы, в первую очередь сахарный диабет, аутоиммунный полиэндокринный синдром, гипотиреоз, ожирение и др.;
- дисбиоз слизистых оболочек на фоне антибиотикотерапии;
- хронические “истощающие” заболевания;
- нарушения нутритивного статуса;
- трансплантация органов и тканей.
В указанных группах кандидоз выявляют чаще обычного. Отметим, что иногда причину нарушения антифунгальной резистентности определить не удается.
Патогенез кандидоза пищеварительного тракта характеризуется последовательным прохождением грибами следующих этапов – адгезии, инвазии, кандидемии и висцеральных поражений (рис. 1). На первом этапе микромицеты адгезируются к эпителиоцитам какого-либо участка слизистой оболочки. В дальнейшем — дефекты в системе резистентности позволяют микромицетам через трансформацию в псевдомицелий внедряться (инвазироваться) в слизистую оболочку и подлежащие ткани. Цитопения – решающий фактор, позволяющий инвазирующимся грибам достигать стенки сосудов, разрушать ее и циркулировать в сосудистом русле. Этот этап называют “кандидемией». В отсутствие адекватной терапии кандидемия приводит к образованию очагов инвазивного кандидоза в висцеральных органах, например печени, легких, центральной нервной системе и др.
Парадоксально, но инвазия грибов рода Candida чаще наблюдается в участках, представленных многослойным эпителием (полость рта, пищевод), значительно реже они внедряются в однослойный эпителий (желудок, кишечник).
На практике клиницисту приходится сталкиваться преимущественно с кандидоносительством, частота которого у здоровых лиц достигает в полости рта 25 %, а в кишечнике – 80 %. В то же время тревогу вызывает рост числа случаев кандидоза.
Обследование при кандидозе органов пищеварения включает изучение анамнеза и клинической картины, оценку рутинных клинических тестов, эндоскопические исследования, микологические (культуральные, морфологические, серологические) и иммунологические тесты.
Кандидоз пищевода встречается у больных общего профиля в 1–2 % случаев, у страдающих сахарным диабетом 1 типа – в 5–10 %, у больных СПИДом – в 15–30 % [2]. Среди местных факторов риска могут быть ожог, ахалазия, дивертикулез, полипоз пищевода и др. Характерными жалобами являются дисфагия, одинофагия, ретростернальный дискомфорт, однако встречается и латентное течение заболевания. Симптомы кандидоза пищевода могут нарушать акт глотания, что в свою очередь приводит к нарушению питания и значительному снижению качества жизни.
Показаниями для эндоскопического исследования с целью исключения кандидоза пищевода являются: группа риска, клинические признаки эзофагита и верифицированный кандидоз других локализаций (например, орофарингеальный; кандидоз урогенитальной системы; диссеминированный кандидоз).
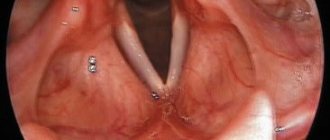
Эндоскопические признаки кандидоза пищевода – гиперемия и контактная ранимость слизистой оболочки, а также фибринозные налеты различной локализации, конфигурации и размеров. Среди всего разнообразия визуальных признаков кандидоза пищевода можно выделить три группы типичных изменений:
- Катаральный эзофагит. Наблюдают диффузную гиперемию различной степени (от слабовыраженной до яркой) и умеренный отек слизистой оболочки. Характерным эндоскопическим признаком является контактная кровоточивость слизистой оболочки, иногда – с образованием нежного, белесоватого (“паутинообразного”) налета на слизистой оболочке. Эрозивных изменений не отмечают.
- Фибринозный (псевдомембранозный) эзофагит. Наблюдают бело-серые или бело-желтые рыхлые налеты в виде округлых бляшек диаметром 1–5 мм, выступающие над ярко гиперемированной и отечной слизистой оболочкой. Контактная ранимость и гиперемия слизистой оболочки заметно выражены (рис. 2).
- Фибринозно-эрозивный эзофагит. Характерно наличие грязно-серых “бахромчатых” налетов в виде “лент”, расположенных на гребне продольных складок пищевода.
При инструментальном отделении таких налетов обнажается эрозированная слизистая оболочка. Эрозии могут быть округлой или линейной формы, чаще от 0,1 до 0,4 см в диаметре. Слизистая оболочка пищевода крайне ранима, отечна и гиперемирована. Выраженные изменения слизистой оболочки иногда препятствуют полноценному эндоскопическому осмотру пищевода (кровотечение, боль и беспокойство пациента, стеноз пищевода, вызванный отеком) [3].
Напомним, что схожие эндоскопические изменения могут наблюдаться при рефлюкс-эзофагите, пищеводе Барретта, герпес-эзофагите, плоских лейкоплакиях, красном плоском лишае, ожоге или опухоли пищевода. Поэтому диагностика кандидоза пищевода основана на эндоскопическом исследовании и лабораторном изучении биопсийных материалов из пораженных участков. Необходимо учитывать, что при однократной биопсии чувствительность лабораторных методов недостаточна.
“Золотой стандарт” диагностики кандидоза слизистых оболочек – обнаружение псевдомицелия Candida spp. при морфологическом исследовании ( рис. 3).
С целью обнаружения псевдомицелия используют морфологические микологические методы: цитологический – с окраской мазков по Романовскому-Гимза и гистологический – с окраской биоптатов ШИК-реакцией. Таким образом, учет диморфности микромицетов Candida spp. является ключом к дифференциальному диагнозу между кандидозом и кандидоносительством. В современных условиях клиницист должен требовать от морфолога точного описания морфологических структур гриба – ведь обнаружение бластомицетов, как правило, свидетельствует о кандидоносительстве, а обнаружение псевдомицелия позволяет подтвердить диагноз “кандидоза”.
К недостаткам морфологических методов можно отнести их ограниченную чувствительность при эндоскопической биопсии. Хорошо известно, что биопсионные щипцы позволяют получить для изучения миниатюрный фрагмент ткани и вероятность обнаружения информативного признака при однократной биопсии недостаточна.
Культуральный микологический метод основан на посеве биоматериалов слизистых оболочек на среду Сабуро. Преимущество данного метода состоит в возможности видовой идентификации грибов рода Candida и тестирования культуры на чувствительность к антимикотикам. Актуальность таких исследований обусловлена тем, что различные виды Candida, в частности C. albicans, C. tropicalis, C. parapsilosis, C. krusei, C. glabrata, имеют различную чувствительность к современным антимикотическим препаратам. Недостаток культурального метода – невозможность дифференцировать кандидоносительство и кандидоз при исследовании материалов “открытых систем”, поскольку слизистые оболочки и в норме могут быть контаминированы колониеобразующими единицами Candida spp.
Культуральное исследование биоматериалов слизистых оболочек с определением вида возбудителя становится абсолютно необходимым при рецидивирующем течении кандидоза или резистентности к стандартной антимикотической терапии [4, 5].
Чувствительность и специфичность серологических тестов диагностики кандидоза пищевода (иммуноферментный анализ с антигеном Candida, уровень специфического IgE, тест латекс-агглютинации Platelia) пока не достигли требуемой точности и в практике применяются редко.
Кандидоз пищевода, даже протекающий субклинически, опасен своими осложнениями – стриктурой, кровотечением, перфорацией и диссеминацией микотического поражения.
Рентгенографический метод при кандидозе органов пищеварения малоинформативен, так как не уточняет этиологию процесса, но при развитии осложнений (например, при стриктуре, язве, перфорации) приобретает решающее значение.
Развитие стриктур пищевода отмечают у 8–9 % пациентов с кандидозным эзофагитом. Чаще они локализованы в верхней или средней трети грудного отдела пищевода и вызывают перманентную дисфагию [6]. Другим частым осложнением кандидоза верхних отделов пищеварительного тракта является кровотечение, вызванное контактной ранимостью слизистой оболочки. Хроническое малоинтенсивное кровотечение приводит к анемии, а у пациентов с цитопенией кровотечение может развиваться стремительно (нередко наблюдается рвота алой кровью и псевдомембранозными массами) и вследствие кровопотери приводить к шоку. Клиническая картина перфорации пищевода, помимо интенсивного болевого синдрома, характеризуется развитием пневмомедиастинума и подкожной эмфиземы в области шеи.
В план ведения пациентов с кандидозом пищевода необходимо включить диагностику и коррекцию фоновых заболеваний, санацию других очагов кандидозной инфекции, рациональную антифунгальную терапию и иммунокоррекцию. В клинике НИИ медицинской микологии СПбМАПО у пациента с кандидозом пищевода исследуется кровь на антитела к ВИЧ, проводятся тесты для исключения толерантности к глюкозе, а также тесты по определению числа и функции циркулирующих иммунокомпетентных клеток. Поскольку кандидоз пищевода может быть маркером онкологических заболеваний, в план обследования включают рентгенологическое исследование органов грудной клетки и фибросигмоскопию, а также дополнительно – для мужчин УЗИ предстательной железы, для женщин – УЗИ молочных желез и органов малого таза с консультацией гинеколога.
Лечение кандидоза пищевода основано на применении антифунгальных препаратов. Общий принцип действия всех антифунгальных средств – угнетение биосинтеза эргостерина клеточной стенки микромицетов. Антифунгальные средства, используемые для лечения кандидоза пищевода, можно разделить на три группы. Первая группа – полиеновые антимикотики, практически нерезорбируемые при пероральном приеме. Из их числа применяется амфотерицин В. Другие полиеновые средства, например нистатин и натамицин, при лечении кандидоза пищевода неэффективны. Вторая группа – азольные антимикотики, относительно хорошо резорбируемые при приеме внутрь. К ним относятся: кетоконазол, флуконазол, итраконазол, вориконазол, албаконазол, позаконазол. Третья группа – самые современные антимикотики-эхинокандины: каспофунгин, анидулафунгин, микафунгин.
Цель лечения кандидоза слизистых оболочек верхних отделов пищеварительного тракта – устранить симптомы и клинико-лабораторные признаки заболевания, а также предотвратить рецидивы.
При кандидозе пищевода местная терапия неэффективна. У пациентов с выраженной одинодисфагией, которые не способны глотать, необходимо применять парентеральную терапию.
Препаратом выбора для лечения кандидоза слизистых оболочек верхних отделов пищеварительного тракта является флуконазол в дозе 2,5–3 мг/кг/сут (100–200 мг/сут), назначаемый в течение 14–21 суток [7–9]. Следует отметить, что как средство лечения кандидоза пищевода флуконазол превосходит по эффективности и кетоконазол, и итраконазол в капсулах из-за непостоянной абсорбции последних.
Известно, что как при ВИЧ-инфекции, так и у ВИЧ-неинфицированных пациентов самыми частым возбудителем кандидоза пищевода является C. albicans. Однако также описаны инфекции, вызванные C. Glabrata, C. krusei и другими видами Сandida, иногда резистентными к лечению флуконазолом.
В случаях неэффективности стандартной терапии флуконазолом может быть использован один из альтернативных методов лечения: пероральный раствор итраконазола 200 мг/сут, амфотерицин B 0,3–0,7 мг/кг/сут внутривенно, вориконазол 4 мг/кг 2 раза в сутки внутривенно, микафунгин или каспофунгин 50 мг/сут внутривенно. Продолжительность терапии обычно составляет 2–3 недели.
Несмотря на высокую эффективность флуконазола, у пациентов с сохраняющимся иммунодефицитным состоянием высока вероятность рецидивов кандидоза пищевода. Необходимо помнить, что безрецидивного течения кандидоза можно достичь только у больных с полной коррекцией фонового состояния. Так, при СПИДе рецидивы кандидоза прекращаются только при успешной высокоактивной антиретровирусной терапии, обеспечивающей снижение вирусной нагрузки и увеличение числа CD4-лимфоцитов.
В клинике НИИ медицинской микологии СПбМАПО были обследованы 128 больных кандидозом пищевода в возрасте от 16 до 72 лет, в т. ч. 41 (32 %) мужчина и 87 (68 %) женщин. Отсутствие ВИЧ-инфицированности у пациентов доказывалось по меньшей мере двукратным исследованием сыворотки. Диагноз “кандидоз пищевода” подтверждался обнаружением эзофагита при эндоскопическом исследовании, а также выявлением псевдомицелия Candida spp. при микроскопии мазков и роста при посеве биоптатов слизистой оболочки пищевода.
При обследовании пациентов были выявлены следующие фоновые заболевания: ревматологические болезни, преимущественно ревматоидный артрит – 19 (14,8 %) случаев, гормонозависимая бронхиальная астма – 14 (10,9 %), сахарный диабет 1 типа – 12 (9,4 %), злокачественные опухоли, преимущественно желудка – 10 (7,8 %). У 73 (57 %) больных типичных факторов риска развития кандидоза слизистых оболочек выявить не удалось. Все пациенты получили курс антифунгальной терапии флуконазолом (100–200 мг/сут 14 дней) или кетоконазолом (200 мг/сут 20 дней). Контрольные эндоскопические и лабораторные микологические тесты подтвердили полное излечение первичного эпизода кандидоза пищевода.
Однако контрольные эндоскопические и лабораторные исследования, произведенные в течение первых 6 месяцев после излечения первичного эпизода, выявили рецидив кандидоза пищевода у 49 (38,3 %) пациентов. Из них с рецидивирующим кандидозом пищевода страдали сахарным диабетом 1 типа – 10 (20,4 %) человек, ревматологическими болезнями – 16 (32,7 %), злокачественными опухолями – 7 (14,3 %), гормонозависимой бронхиальной астмой – 9 (18,4 %). У 7 (14,3 %) пациентов факторов, предрасполагающих к рецидивированию кандидоза пищевода, выявить не удалось [10].
В качестве профилактики рецидивов может быть эффективна длительная поддерживающая терапия флуконазолом (100 мг/сут) или назначение флуконазола по 200 мг еженедельно [11, 12]. Следует, правда, отметить, что повторные курсы лечения или использование длительной терапии для ведения больных с рецидивирующим кандидозом – главные факторы риска развития азоло-рефрактерных штаммов грибов.
Диагностика
При симптомах рефлюкса-эзофагита нужно обратиться к гастроэнтерологу. Фото: Shidlovski / Depositphotos
В первую очередь врач проводит сбор анамнеза (истории болезни): необходимо собрать жалобы, получить информацию о сопутствующих и перенесенных ранее заболеваниях, а также составить представление о рационе пациента.
Общий анализ крови
Повышенное содержание лейкоцитов говорит о воспалительных процессах. При эрозии и язвах пищевода возникают кровотечения, которые при общем анализе крови проявляются железодефицитной анемией.
Важно!
Недостаток общего анализа крови в том, что он дает лишь общее представление о происходящих в организме процессах, не давая четкого представления об их локализации.
Фиброэзофагогастродуоденоскопия (ФЭГДС)
Исследование осуществляется при помощи эндоскопа — тонкой гибкой трубки с миниатюрным объективом на конце. Помимо пищевода врач может для полного прояснения клинической картины исследовать желудок и двенадцатиперстную кишку. Иногда исследование ограничивается только осмотром пищевода (эзофагоскопия).
Именно при ФЭГДС можно визуально определить те самые изменения, которые рассматриваются в качестве основных критериев при классификации степени тяжести рефлюкс-эзофагита.
Как подготовиться к ФЭГДС?
Процедура малоприятная, но в целом безболезненная. Обычно все исследование занимает не более 10 минут. Нужно придерживаться простых правил:
- Не есть и не пить (должно пройти не менее 8 часов после последнего приема пищи).
- Не курить (за 3–4 часа до исследования).
- Не принимать лекарства (за исключением тех, прием которых нельзя пропускать, — этот момент нужно обсудить с лечащим врачом. Как правило, разрешено делать лекарственные инъекции и принимать рассасывающие таблетки).
- За сутки нужно отказаться от жирной пищи (сыры, колбасы, жирное мясо и рыба, жареные на масле блюда и т.д.).
- За 2–4 часа можно выпить пару глотков обычной воды без газа.
- Непосредственно перед процедурой снять очки и зубные протезы.
Биопсия
Это исследование проводится одновременно с эндоскопией. Для гистологического исследования берется небольшой участок ткани пищевода. Биопсию назначают не всем пациентам: она необходима при подозрении на злокачественные образования.
Рентгенография
Это исследование помогает выявить язвы, отеки и скопления слизи. Для улучшения визуализации пациенту предлагают выпить контрастное вещество — барий. На вкус это вещество напоминает разжиженный мел. Эта жидкость нетоксична и свободно всасывается в кишечнике.
Суточная pН-метрия
Это исследование назначается для определения уровня кислотности в пищеводе. У здорового человека уровень pH всегда выше 4,0 (иными словами, преобладает щелочная среда). При частом забросе желудочного сока в пищевод происходит сдвиг в сторону повышения кислотности.
В пищевод пациента вводится тонкий зонд через ноздрю. Наружный конец зонда соединен с датчиком, считывающим информацию об изменениях pH-среды. За несколько дней до исследования врач дает пациенту список препаратов (антациды, нитраты, блокаторы кальциевых каналов), от приема которых следует воздержаться за 2–3 дня до исследования для получения объективного результата. Примерно за 5 часов до начала исследования следует воздержаться от приема пищи.
Дополнительные исследования
Иногда проводится дифференциальная диагностика, которая позволяет исключить другое заболевание со сходными симптомами. Например, при подозрении на бронхит назначается рентгенография грудной клетки, а для исключения стенокардии из списка возможных заболеваний проводят ЭКГ.
Воспалительные заболевания пищевода
К воспалительным заболеваниям пищевода относятся:
- Острые эзофагиты.
- Хронические эзофагиты.
- Рефлюксэзофагит.
- Пептическая язва пищевода.
Последние два заболевания являются результатом систематического раздражения слизистойоболочки пищевода кислым содержимым желудка, вызывающим воспаление и дистрофию тканей.
Острые эзофагиты.
Острые эзофагиты острые возникают в результате острой бактериальной или вирусной инфекции. Они не имеют практического значения в течении болезни и исчезают вместе с другими признаками заболевания, если не приобретают самостоятельного хронического течения.
Острые эзофагиты могут быть:
- Катаральными эзофагитами.
- Геморрагическими эзофагитами.
- Гнойными эзофагитами (абсцесс и флегмона пищевода).
Причины возникновения острых эзофагитов — химический ожог (эксфолиативный эзофагит) или травма (заноза костью, ранение при проглатывании острых предметов, косточек).
Клиническая картина острого эзофагита. Больные жалуются при остром эзофагите на боль за грудиной, усиливающуюся при глотании, иногда отмечается дисфагия. Заболевание возникает остро. Оно сопровождается также другими признаками, свойственными основному процессу. При гриппе — это повышение температуры, головная боль, боль в глотке и т. д. При химическом ожоге имеются указания на прием внутрь щелочи или кислоты, обнаруживаются следы химического ожога на слизистой полости рта, в глотке. Абсцессу или флегмоне пищевода свойственны сильная боль за грудиной при глотании, затруднение проглатывания плотной пищи, тогда как теплая и жидкая пища в нем не задерживается. Появляются признаки инфекции и интоксикации — повышение температуры тела, лейкоцитоз в крови, СОЭ увеличена, имеет место протеинурия.
Рентгенологическое исследование позволяет обнаружить инфильтрат, вызывающий некоторую задержку пищевого комка, установить его локализацию и степень повреждения стенки пищевода.
Эзофагоскопия: слизистая в области инфильтрата гиперемирована, отечна. При внимательном исследовании можно найти занозу — рыбную кость или острую косточку, застрявшую в ткани пищевода. При помощи щипцов инородное тело извлекается. Краем аппарата возможно прощупать плотность инфильтрата. Если абсцесс созрел, в центре выявляется ткань мягкой консистенции.
Диффузные эзофагиты сопровождаются гиперемией и отеком слизистой. Она покрыта бело-серым налетом, легко кровоточит. Эрозии имеют неправильную форму, чаще продольную, покрыты серым налетом. Перистальтика сохранена.
Острые эзофагиты могут протекать без последствий. После химического ожога развиваются мощные рубцы, вызывающие сужение пищевода.
Хронические эзофагиты.
Хронические эзофагиты вызываются туберкулезными бактериями, возбудителями сифилиса, грибками (кандидамикоз, бластомикоз). Особую форму составляет пептический эзофагит, развивающийся в результате рефлюкса желудочного содержимого в пищевод. Хронические поражения пищевода формируются на фоне коллагенозов (склеродермия), авитаминозов, железодефицитной анемии (синдром Пламмера — Винсона), тяжелой сердечной недостаточности, портальной гипертензии. Иногда находят хронический идиопатический язвенный эзофагит.
Клиническая картина хронического эзофагита. Во всех случаях при хроническом эзофагите возникают жжение, боли за грудиной, у мечевидного отростка, усиливающиеся при глотании. Дисфагия бывает редко. Вместе с тем у больных выявляются признаки основного заболевания: длительная лихорадка, интоксикация, лейкоцитоз, увеличенная СОЭ, эритроцмтоз, анемия и ряд других признаков. Эти обстоятельства заставляют врача произвести более тщательное обследование больного.
Большую помощь в диагностике хронического эзофагита оказывают рентгенологическое и эзофагоскопическое исследование.
Пептический эзофагит (рефлюксэзофагит).
Пептический эзофагит (рефлюксэзофагит) — это заболевание является результатом систематического рефлюкса кислого содержимого желудка в пищевод. Причины возникновения пептического эзофагита изучены недостаточно. В некоторых случаях находят диафрагмальную грыжу, выхождение желудка в грудную клетку, присасывающее действие грудной клетки при дыхательных движениях. Основное в механизме заболевания — нарушение функции кардиального жома.
Клиническая картина рефлюксэзофагита. Наиболее частая жалоба при рефлюксэзофагите — указание на изжогу, чувство жжения в эпигастральной области, за грудиной или по всему животу. Нередко вслед за изжогой возникает боль приступообразного характера, которая связывается со спастическим сокращением пищевода. Боль может появиться при глотании под влиянием раздражающего действия пищи. Регургитация — второй наиболее частый признак. Она может наблюдаться днем и ночью, во время сна. Провоцируют срыгивание кашель, переедание, наклон туловища. Изжоги, регургитация, боли за грудиной угнетают психику больного. Начинаются признаки депрессии.
Рентгенологическое исследование: обнаруживают спазм пищевода или рефлекторный спазм в кардиальной части. Перистальтика не нарушена. Продвижение бариевой взвеси замедлено. Слизистая пищевода на определенных участках диффузно утолщена, эластичность ее понижена. Наблюдается регургитация содержимого желудка в пищевод. Контур пищевода может быть неровным, складки сглажены, деформированы.
Эзофагоскопия: обнаруживается картина очагового или диффузного воспаления. Обычно поражена слизистая кардиальной части пищевода. Изменения носят в основном катаральный характер. Реже выявляются эрозии.
Пептическая язва пищевода.
Язвы и эрозии пищевода встречаются довольно часто и при многих заболеваниях — доброкачественных и злокачественных опухолях, хронических воспалительных процессах и др. Однако под пептической язвой пищевода понимается совершенно своеобразное заболевание, которое по некоторым признакам напоминает пептические язвы желудка и двенадцатиперстной кишки. Язвы пищевода и желудка или двенадцатиперстной кишки часто сочетаются. Определенное значение в возникновении пептической язвы придается нервному механизму, связанному с травмами и заболеваниями головного мозга (менингиты, менингоэнцефалиты, поражение гипоталамической области). Впрочем, местные механизмы язвообразования (нарушение кровообращения в тканях, дистрофия, снижение функции защитных факторов, нарушение функции запирательного механизма кардии и несогласованность в его работе с перистальтикой желудка) также имеют большое патогенетическое значение.
Клиническая картина. Важнейшими признаками пептической язвы пищевода являются боль, возникающая и усиливающаяся во время еды, дисфагия, изжога, могут быть рвоты. Боли локализуются в области мечевидного отростка, реже выше, за грудиной. Иногда они появляются через 10—30 мин после еды на высоте пищеварения. Дисфагия связывается со спазмом пищевода, но может быть обусловлена рубцовым сужением кардии.
Рентгенологическое исследование позволяет выявить депо контрастного вещества — «нишу» с воспалительным валом вокруг. Ее форма и размеры разные — от 0,2 мм до 20—30 мм. Перистальтика пищевода усилена. Над язвой пищевод расширен, складки слизистой грубые, ориентированы к основанию «ниши». В зоне язвы может обнаруживаться спазм. Язвы пищевода бывают как единичные, так и множественные.
Эзофагоскопия: пептические язвы располагаются в дистальных отделах, имеют круглую или удлиненную неправильную форму, чаще поверхностные. Дно покрыто жёлто-серым налетом, после снятия которого обнажается кровоточащая поверхность. Края инфильтрированы, слегка возвышаются над поверхностью. Слизистая вокруг язвы гиперемирована. После заживления язвы остается белесоватый рубчик. Реже рубцы вызывают сужение просвета пищевода.
По клиническому течению выделяют язвы пищевода:
- Нервнотрофические язвы пищевода. Они возникают у лиц с заболеваниями головного мозга (опухоли, воспаления).
- Декубитальные язвы пищевода, развивающиеся у стариков с пониженной резистентностью организма к инфекции и со спондилоартрозами.
- Пептическая язва пищевода протекает вяло, рецидивирует. Ее течение определяется течением заболевания желудка — язвенной болезнью, гиперсекрецией и течением расстройств функции нервных центров, регулирующих работу кардии.
Наблюдаются серьезные осложнения: рубцовый стеноз пищевода, прободение язвы в брюшную или грудную полость с образованием гнойного перитонита или плеврита, перикардита.
Диагноз пептической язвы пищевода основан на характерных клинических признаках, наличии «ниши» на рентгенограмме и данных эзофагоскопии. От раковой опухоли рассматриваемое заболевание позволяют отдифференцировать микроскопические исследования соскоба из «ниши» (при раке обнаруживаются атипичные клетки). Послеязвенный рубец имеет характерную звездчатую форму. От сифилитического рубца послеязвенный рубец позволяют отличить показатели проб Вассермана, Кана, цитохолевой пробы. При грыже диафрагмы выявляются эзофагит и пептическая язва пищевода. Грыжа обнаруживается посредством рентгенологического исследования. Стенозы пищевода в большинстве случаев являются следствием ахалазии, химических ожогов, воспалительных заболеваний пищевода (туберкулез, ранение, флегмоны, медиастинит, сифилис). Они могут возникать при заболеваниях других органов — опухолях легких и средостения, аневризме аорты и др., что связывается сдавливанием органа извне. Изредка встречаются аномалии развития пищевода, которые приводят к сужению его просвета. Рубцовые изменения в пищеводе сопровождаются мощными отложениями соединительной ткани в стенке, данное обстоятельство ограничивает ее растяжимость при глотании. Задержка пищи выше сужения приводит к растяжению пищеводной стенки, воспалению и изъязвлению слизистой оболочки. Послеожоговые стенозы обычно имеют значительную протяженность и чаще всего располагаются в местах физиологических сужений: аортального, глоточно-пищеводного или диафрагмального.
Основными клиническими симптомами стеноза пищевода являются дисфагия, пищеводные рвоты, похудание. Дисфагия может быть выражена различно — от неприятных ощущений при глотании пищи до полной невозможности принимать пищу. Раньше возникают затруднения с проглатыванием сухой пищи, позже — затруднения с глотанием жидкой пиши. Появляются срыгивания, затем пищеводные рвоты. Возможна аспирация пищеводного содержимого.
Диагноз подтверждается результатами рентгенологического или эзофагоскопического исследования.
Лечение воспалительных заболеваний пищевода.
В лечении эзофагитов применяется щадящая диета. При химических ожогах пищевода после промывания желудка дается лишь теплая (36°С) жидкая пища. В случае тяжелых ожогов несколько дней применяется парентеральное питание (гидролизаты, растворы глюкозы, полиглюкин). Больному вводится внутривенно до 2л жидкости, кровезаменителей. В дальнейшем, если позволяет состояние, диетический режим расширяется постепенно. Борьба с инфекцией осуществляется лишь в том случае, если она является причиной эзофагита. При абсцессе и флегмоне пищевода стараются извлечь занозу, вызвавшую воспаление. Антибиотики широкого спектра (оксациллин, ампициллин, левомицетин, олеморфоциклин, канамицин, гентамицин и др.) применяются в достаточной суточной дозе. Лечение антибиотиками начинается рано. Так, ампициллин назначается внутримышечно по 0,5г 4 раза в день, канамицин — по 0,5г 6 раз в сутки. Продолжительность лечения — не менее 7—10 дней при условии, если на вторые третьи сутки от начала лечения температура тела нормализовалась и уменьшились признаки интоксикации. При химическом ожоге пищевода антибиотики показаны с профилактической целью, так как химические язвы очень быстро начинают нагнаиваться. В случаях наличия у больных повышенной желудочной секреции, высокой кислотности желудочного сока необходима ощелачивающая терапия. Алмагель А применяется по одной чайной ложке 3—4 раза в день. Назначаются также гидроокись алюминия, белая глина или трисиликат магния с добавлением бикарбоната натрия. Спазм пищевода устраняется при помощи препаратов атропина, папаверина, но-шпы. Применяются также спазмолитин, арпенал, метацин. У ряда больных используются те способы лечения, которые показаны при язвенной болезни желудка или двенадцатиперстной кишки, в том числе ганглиоблокаторы (бензогексоний).
Физиотерапия заболеваний пищевода проводится гальваническими процедурами, делаются индуктотерапия, микроволновая терапия, а также грязелечение, парафинолечение. Выбор метода и способ применения процедур определяются характером, стадией болезни пищевода и желудка. От тепловых процедур воздерживаются при подозрении на глубокую язву пищевода, при которой возможно кровотечение.
Больные с хроническим ззофагитом и пептической язвой пищевода должны находиться на диспансерном учете у участкового врача. Больные обследуются клиническим, рентгенологическим и эзофагоскопическим методами 1—2 раза в год. При наличии активного язвенного процесса лечение осуществляется в стационаре. Периодически с целью предупреждения обострения болезни проводятся курсы профилактического лечения и физиотерапии. Такое же профилактическое значение имеет лечение в санатории на курортах с питьевыми минеральными водами. Рубцовые сужения пищевода лечатся методом дилатации, бужированием, чаще гибкими пластмассовыми бужами. Хирургическое лечение используется в случае стеноза пищевода, а также при прободении или раковом перерождении органа.
Если у Вас остались вопросы. То Вы можитеполучить консультацию ведущихспециалистов многопрофильного медицинского
Лечение рефлюкс-эзофагита
Для заболевания характерно хроническое течение. Поэтому нужно будет не только пропить курс таблеток, но и включить в свою жизнь грамотное и здоровое питание. Фото: katemangostar / freepik.com
Лечение болезни предполагает комплексный подход, и рефлюкс-эзофагит в этом смысле не исключение. Необходимо правильно подобрать медикаменты, нормализовать образ жизни и скорректировать рацион. Каждый из этих элементов комплексной терапии по-своему важен, но по отдельности недостаточно эффективен.
Важно!
Лечение рефлюкса предполагает комплексный подход: лекарства, диета и здоровый образ жизни. Поэтому людей, рассчитывающих исключительно на таблетки, ждет разочарование: придется отказаться от некоторых вредных привычек и любимых блюд.
Коррекция образа жизни
В первую очередь необходимо нормализовать внутрибрюшное давление. Для этого придется ограничить физическую нагрузку и отказаться от обтягивающей одежды (особенно от поясов).
Важно понимать, что при стабильно повышенном внутрибрюшном давлении медикаментозные препараты и диета не дадут ожидаемого результата. Нужно еще скорректировать образ жизни.
Образ жизни при рефлюксе
- Избегайте стрессов и нервных перегрузок.
- Спите не менее 8 часов в сутки — именно столько необходимо для полноценного отдыха и восстановления ресурсов нервной системы.
- Чтобы снизить вероятность ночных рефлюксов, выбирайте небольшую подушку, которая обеспечит угол наклона головы около 30 градусов.
- Откажитесь от привычки лежать после еды. Это, конечно, удобно, новредно для пищеварения. В положении лежа вероятность рефлюкса возрастает многократно.
Диета
Практически любая диета предполагает изъятие из рациона наиболее вкусных блюд. С этим остается лишь смириться и призвать на помощь силу воли. В противном случае лечение не даст нужного эффекта. Из меню следует исключить:
- алкоголь: спиртные напитки не только расслабляют нижний сфинктер пищевода, но и усиливают секрецию желудочного сока. В результате его количество увеличивается, что в сочетании с расслабленностью сфинктера приводит к рефлюксам;
- газированные напитки: они также увеличивают секрецию соляной кислоты, составляющей основу желудочного сока, и раздражают слизистую оболочку желудка;
- шоколад: расслабляет нижний эзофагеальный сфинктер;
- кислотообразующие продукты: кетчуп, майонез, горчица, томатные соусы.
- бобовые и капусту: увеличивают газообразование и повышают внутрибрюшное давление;
- жирные (колбасы, сыры, жирное мясо и рыбу), острые продукты (специи) и жареную пищу (особенно с большим количеством масла: картошка фри, луковые кольца и др.);
- сдобы, торты, пирожные;
- консервированные блюда;
- фастфуд.
Важно!
Врачи пока не пришли к выводу о том, полезна ли безглютеновая диета при рефклюкс-эзофагите. Самым правильным будет воздержаться от пищи, содержащей глютен, и посмотреть на результат. Возможно, для вашего организма — это правильное решение.
Особенности режима питания
Предпочтение следует отдавать:
- отварным блюдам;
- запеченным;
- тушеным;
- приготовленным на пару.
Главное – не перенаполнять желудок: это поможет снизить количество вырабатываемого желудочного сока.
Как правильно питаться при рефлюкс-эзофагите
- Дробное питание (4–5 раз в день).
- Тщательное пережевывание пищи.
- Жидкость: не больше 1,5 л в сутки.
- Соль: максимум 10 г в сутки.
- Исключить: алкоголь, газировку, шоколад, бобовые, капусту.
- Жирные жареные блюда заменить на отварные, тушеные, запеченные.
- Не лежать после еды!
- Не есть перед сном!
Энергетическая ценность рациона
Верхняя рекомендуемая граница по употреблению белков, жиров и углеводов выглядит следующим образом:
- белки — 90 г (из них примерно половина – животного происхождения);
- жиры — 80 г;
- углеводы — 300 г.
Суточный рацион и калории
Энергетическая ценность суточного рациона не должна превышать 2 500 килокалорий в сутки. Это достаточно комфортная норма для человека, не склонного к перееданию.
Например:
- тарелка куриного супа содержит примерно 360 ккал, 15 г белка, 30 г жиров и 20 г углеводов;
- тарелка отварного картофеля с одной большой котлетой — около 20 г белка, 10 г жиров, 35 г углеводов и 280 ккал.
А вот калорийность одного небольшого заварного пирожного составляет примерно 400 ккал. Таким образом, если не злоупотреблять сладостями, то рекомендуемая суточная калорийность рациона не накладывает на пациента существенных ограничений.
Пищу нужно тщательно пережевывать. Это способствует не только лучшему перевариванию: когда человек ест второпях, это неизбежно приводит к попаданию воздуха в желудок и провоцирует рефлюкс.
Медикаментозное лечение
При лечении рефлюкс-эзофагита применяется несколько групп препаратов:
1. Прокинетики. Препараты этой группы улучшают двигательную активность ЖКТ и повышают тонус нижнего сфинктера пищевода (домперидон, генатон).
2. Антациды. Препараты на основе алгелдрата и гидроксида магния нейтрализуют повышенную кислотность желудочного сока.
3. Антисекреторные препараты. Уменьшают образование желудочного сока (омепрозол, фамотидин).
Хирургическое лечение
Если комплексное консервативное лечение не дает желаемого результата в течение полугода, пациенту рекомендуют хирургическое лечение. Его суть заключается в прошивании сфинктеров пищевода для нормализации их барьерной функции. Эти операции могут проводиться как полостным (классическим), так и эндоскопическим методом. Преимущество второго варианта заключается в том, что у пациента не остается шрамов на животе и грудной клетке.
Дополнительным показанием считается развитие осложнений, к числу которых относят:
- пневмонию (развивается как результат регулярного заброса желудочного сока в дыхательные пути);
- кровотечения;
- пищевод Барретта (предраковое состояние, при котором происходят патологические изменения в эпителиальных тканях пищевода);
- стойкая стриктура (сужение) пищевода³.
Профилактика заболевания
Пациенты зачастую сами замечают, какая именно еда или какие привычки приводят к ухудшению ситуации. Важно прислушиваться к своему организму. Фото: ponomarencko / freepik.com
Профилактика эзофагита, вызванного регулярными рефлюксами, направлена на их предотвращение и тесно связана с коррекцией образа жизни, о которой мы уже говорили выше.
7 правил профилактики рефлюкс-эзофагита
- Соблюдать диету.
- По возможности избегать приема препаратов, снижающих тонус нижнего сфинктера пищевода (антидепрессанты, транквилизаторы, седативные и антихолинергические средства).
- Сразу после еды не принимать лежачее положение — лучше немного постоять, пройтись или помыть посуду.
- После еды врачи также не рекомендуют заниматься спортом или другими физическими нагрузками, чтобы не повышать внутрибрюшное давление.
- Свести количество употребляемого алкоголя к минимуму.
- Бросить курить.
- Не переедать.