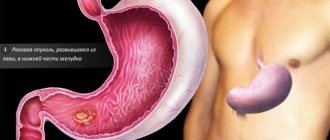
Ежегодно в России выявляют до 50 000 случаев заболевания раком желудка. При обследовании у 5–10% пациентов обнаруживается отягощенный семейный анамнез: от злокачественных опухолей пищеварительного тракта когда-то страдали их близкие кровные родственники. Это позволяет врачам предположить диагноз “наследственный рак желудка”. Генетическая предрасположенность к онкологическим заболеваниям действительно существует. Новообразования в этом случае имеют свои особенности.
Что такое наследственный рак
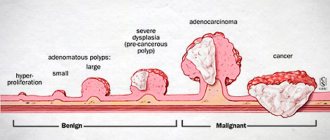
Рак желудка может быть обусловлен не только дисплазией слизистой оболочки, неправильным питанием и вредными привычками. Иногда процесс озлокачествления клеток в организме запускается из-за мутаций одного или нескольких генов. Эта особенность передается по наследству, от старших членов семьи к младшим, и вероятность развития болезни повышается. При неблагоприятном развитии событий в одной семье заболеть раком могут до 40% кровных родственников. Наследственные формы опухолей составляют 7% от общего количества онкологических патологий.
По статистике, новообразования желудка диагностируются чаще у мужчин, чем у женщин. Но при наследственной форме патологии вероятность заболеть становится одинаковой у обоих полов. Также наследственное заболевание отличается довольно ранней манифестацией – средний возраст пациентов составляет всего 38–40 лет.
Возможности современной медицины позволяют выявить у человека наличие дефектных генов и тем самым определить группу риска. Таким людям необходимо особое внимание уделять профилактическим обследованиям.
Как собрать мед. историю своей семьи?
Наибольшей пользой обладает информация, собранная очень тщательно. Нужно собирать сведения обо всех родственниках: родителях, бабушках и дедушках, братьях и сестрах. Семьям с повышенным раковым риском рекомендуется проделать следующее:
• Подготовить сведения минимум о трех поколениях родственников. • Хорошо проанализировать данные о здоровье представителей материнской и отцовской линии. Такая необходимость обусловлена тем, что некоторые генные синдромы передаются исключительно по женской линии, а некоторые – только по мужской. • Указать подробные сведения, касающиеся этнической принадлежности (по линиям обоих родителей), ведь определенные патологии в большей степени свойственны конкретным расам и этногруппам. • Записать информацию, касающуюся мед. проблем каждого родственника. Нужно упомянуть все проблемы, ведь то, что кажется маловажным, может быть фундаментом для развития онкопатологии.
Для каждого представителя своей родственной линии, страдавшего раком, надо указать такие сведения: • местонахождение онкоочага (если есть мед. документы, рекомендуется приложить ксерокопию гистологического заключения); • в каком возрасте был выявлен рак (это крайне важно для установления потенциально опасного возрастного промежутка); • влияние канцерогенов (наличие вредных привычек, плохие условия труда, плохое состояние экологии в месте постоянного проживания конкретного родственника); эти факторы провоцируют формирование рака в огромном количестве случаев; • методики диагностирования и последующего лечения.
Причины развития
Абсолютно все формы опухолей – результат различных мутаций ДНК, в результате которых образуются “неправильные” клетки, способные к бесконтрольному размножению. Чаще встречаются спорадические формы, когда у человека были изначально здоровые гены и под влиянием внутренних и внешних факторов со временем они мутировали. Наследственная форма говорит о том, что “сломанный” ген был передан человеку от родителей.
Даже если генетическое исследование подтвердило предрасположенность к раку, риск заболеть не будет равен 100%. Вероятность болезни всего лишь повышается. В какой степени это происходит, зависит в том числе и от образа жизни пациента, его возраста, наличия сопутствующих заболеваний. Известны случаи, когда совершенно здоровый человек имеет 1 – 2 родственников, страдающих онкологией, но это результат не наследственных мутаций, а неудачного стечения обстоятельств.
Наследственный рак желудка чаще всего образуется вследствие мутаций в гене CDH1. В норме он действует как супрессор – подавляет случайные мутации и развитие патологических клеток. Если ген “ломается”, создаются благоприятные условия для процесса малигнизации (озлокачествления) клеток. CDH1 действует на молекулу белка, обеспечивающую прочность межклеточных связей. При неправильной работе гена межэпителиальные соединения нарушаются, возникает неравномерное клеточное деление. Так возникает опухоль, со временем она прорастает в подслизистый и мышечный слой желудочных стенок. Известно более 80 вариантов мутаций гена CDH1. Каждая из них повышает риск рака желудка на 80%.
К предрасполагающим факторам относят привычку к приему алкогольных напитков и курению, длительному употреблению жирной, жареной пищи с канцерогенами. Возникновению злокачественного образования часто предшествуют различные формы гастрита и желудочные полипы.
Срок выполнения
Мы проводим полное исследование и формируем заключение в течение 35 рабочих дней.
Сроки могут показаться значительными, но это не так. Это самая высокая скорость на рынке для подобных исследований такого объёма, проводимых с использованием технологии NGS.
Указанное время требуется для выполнения многоступенчатого высокотехнологичного исследования, включающего в себя большое количество лабораторных этапов и промежуточного контроля их качества. В результате получается большой массив генетических данных, требующих отдельного анализа и интерпретации с помощью методов биоинформатики, на что тоже необходимо время.
Симптомы
Рак по своему течению – коварное заболевание. На начальных стадиях, когда опухоль еще не проникла в подслизистую оболочку, специфические симптомы полностью отсутствуют. Диагностика новообразований на этом этапе чаще всего случайность.
По мере прогрессирования болезни возникают следующие симптомы:
- боли в области эпигастрия;
- тошнота;
- быстрая насыщаемость малыми объемами пищи;
- желудочные кровотечения.
Болевой синдром имеет свои особенности: распространяется на всю область эпигастрия, не локализуясь в конкретных точках, не купируется при приеме обычных болеутоляющих, не связан со временем суток и приемами пищи.
При поражении метастазами внутренних органов возникают симптомы, связанные с этими органами, например, желтуха при метастазах печени, кровохарканье при метастазах легких.
На 4 стадии заболевания присоединяются симптомы общей интоксикации организма, поскольку опухоль отравляет его продуктами распада. Наблюдаются головные боли, слабость, анемия, повышенная утомляемость, потливость, боли в костях и суставах.
Анатомия пищевода
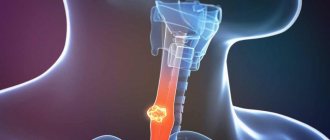
Пищевод (esophagus) имеет вид трубки, соединяющей глотку с желудком. Место перехода глотки в пищевод у взрослого соответствует уровню VI шейного позвонка или нижнему краю перстневидного хряща, место перехода в желудок проецируется на уровне XI грудного позвонка. Длина пищевода у взрослого достигает 25 см. Залегая небольшой частью в области шеи, пищевод через apertura thoracis superior опускается в грудную полость, а затем, пройдя последнюю, через hiatus esophageus диафрагмы проникает в полость живота, переходя в кардиальную часть желудка. В связи с этим в пищеводе различают три отдела: шейную часть, грудную часть и брюшную часть.
Шейный отдел пищевода простирается от уровня VI шейного позвонка до I-II грудного. Длина его колеблется от 5 до 8 см.
Грудной отдел имеет наибольшую длину — 15-18 см и заканчивается в уровне X-XI позвонка, то есть у места вхождения пищевода в диафрагмальное отверстие.
Брюшной отдел наиболее короткий, достигает в длину 1-3 см. У места перехода в желудок пищевод несколько расширяется.
Просвет пищевода неодинаков, и на всем его протяжении принято различать три сужения и два расширения. Первое сужение находится на месте перехода глотки в пищевод, второе — там, где пищевод прилегает к аорте, и третье — в месте прохождения через hiatus esophageus. Между указанными сужениями имеются два расширения.
Стенка пищевода имеет три оболочки: внутреннюю (слизистую), среднюю (мышечную) и наружную (адвентициальную); брюшная часть, кроме того, покрыта серозной оболочкой.
Слизистая оболочка представлена многослойным плоским эпителием. Толща истого слоя образована рыхлой клетчаткой и развитой lamina muscularis mucosae состоящей из гладких волокон, роль которых сводится к сокращению слизистой оболочки при уменьшении просвета пищевода.
На поперечном срезе просвет пищевода имеет вид звездчатой щели благодаря сжатым стенкам и хорошо выраженным продольным складкам. Величина последних связана со значительным развитием рыхлой соединительной ткани, образующей подслизистую основу, залегающую между слизистой и мышечной оболочкой. В подслизистой основе располагается множество сосудов, слизистых пищеводных желез.
Мышечная оболочка состоит из двух слоев: внутреннего (циркулярного) и наружного (продольного). В межмышечном слое, в его рыхлой соединительной ткани, располагаются сосудистые сети и нервные сплетения. В верхней части пищевода мышечные слои представлены поперечно-полосатой мускулатурой, которая в средней трети переходит в гладкую, и, наконец, в нижней трети состоит исключительно из гладкой мускулатуры.
Адвентициальная оболочка пищевода образована рыхлой соединительной тканью, содержащей незначительное количество эластических волокон. В толще адвентиции проходят основные кровеносные сосуды, лимфатические сосуды, а также нервные стволы. Кровоснабжение пищевода в шейном отделе осуществляется за счет нижней щитовидной артерии, в грудном — за счет пищеводных, бронхиальных сосудов, в брюшном отделе — за счет левой желудочной и диафрагмальной левой артерий.
Особенности наследственных опухолей ЖКТ
Выделяют две формы наследственных опухолей желудка:
- Диффузная
. Представлена недифференцированным и перстневидно-клеточным раком и малодифференцированными аденокарциномами. Опухоль не имеет четких границ, для нее характерен инфильтрирующий рост в слизистой оболочке на большом протяжении. Диффузной форме присущ высокий уровень злокачественности и длительный бессимптомный период, что объясняет низкий процент 5-летней выживаемости. Передаётся при мутациях CDH1.
- Интестинальная
. Представлена дифференцированными аденокарциномами. Образование имеет четкие границы, характеризуется относительно низким уровнем злокачественности. Часто развивается на фоне атрофического гастрита, может сопровождать синдром Линча – неполипозный рак прямой кишки и других отделов толстого кишечника.
Синдром Линча обусловлен мутацией генов MLH1, MSH2, MSH6. Этот рак передается по аутосомно-доминантному типу. Попутно у пациентов часто выявляются опухоли мочеточника и тонкой кишки, у женщин – тела матки.
Также отягощенная наследственность влияет на рак кишечника. Нередко у пациентов диагностируют САТК, семейный аденоматоз толстой кишки. Наследственное заболевание провоцирует мутация гена АРС.
Онкология яичников
Наследственный тип этого отклонения диагностируется в 10% случаев. Данный дефект сочетается с онкологией молочной железы либо же толстого кишечника. Подобно грудному раку, такое заболевание проявляется у молодых женщин, родственницы которых также от него страдают. Важно отметить тот факт, что наследственный рак яичников изучен лучше, нежели генные мутации при спонтанно формирующихся опухолях.
За появление онкопатологии яичников отвечают такие генные элементы: BRCA1, BRCA2, PMS1, PMS2, MSH1, MSH6, MLH1. В целях контроля и своевременного обнаружения рассматриваемого заболевания рекомендуется систематически проходить гинекологический осмотр; также, надо периодически делать УЗИ. Сегодня наиболее действенным методом профилактики считается удаление органа.
Какой еще рак передается генетически
Существует семейная предрасположенность к онкологии женской репродуктивной системы: яичников, матки, молочной железы, а также к новообразованиям легких. Как и в случаях с пищеварительной системой, она обусловлена генетическими аномалиями. Чаще всего это мутация генов BRCA1 и BRCA2. Они ответственны за подавление роста злокачественных клеток.
Также к наследственным новообразованиям относятся:
- ретинобластома – внутриглазная опухоль, по наследству передается по аутосомно-доминантному типу;
- нефробластома – высокозлокачественный рак почек, выявляется в детском возрасте до 5 лет;
- синдром Ли-Фраумени – опухолевый синдром, проявляется опухолями ЦНС, развитием сарком, острого лейкоза.
Эти новообразования часто выявляются в молодом возрасте, до 30 лет.
Источники
- Allgayer H., Redher H., Fulda S. Hereditary Tumors: From Genes to Clinical Consequences. Weinheim: Wiley-VCH, 2009.
- Ferguson L.R., Chen H., Collins A.R., Connell M., Damia G., Dasgupta S., etal. Genomic instability in human cancer: Molecular insights and opportunities for therapeutic attack and prevention through diet and nutrition. Seminars in Cancer Biology. December, 2015. 35 Suppl: S5–S24.
- Genetic risk, race and ethnicity. Cancer Fighters Thrive Magazine. CancerCenter.com. Archived Last reviewed: 2018-02-21
- Genetics. National Cancer Institute. 2015-04-22. Last reviewed: 2018-02-20.
- Hodgson S. Mechanisms of inherited cancer susceptibility. Journal of Zhejiang University Science. 2022, B. 9 (1): 1–4.
- Roukos D.H. Genome-wide association studies: how predictable is a person’s cancer risk?. Expert Review of Anticancer Therapy. April, 2009, 9 (4): 389–92.
- Stewart B.W., Wild C.P. Cancer etiology. World Cancer Report 2014. World Health Organization. 2014, pp.16–54.
- Афанасьев А. Наследственные опухолевые синдромы: генетика и диагностика. Издательство: Аврора, 2022.
Как выявить предрасположенность к онкологическим заболеваниям
Если пациента беспокоит вероятная передача мутировавшего гена, он может выполнить генетический анализ. Это простое исследование, способное выявить мутации в генах CDH1, MLH1, MSH2.
Показания к анализу:
- более 3 случаев опухолей желудка в семье по линии отца или матери;
- рак желудка у кровного родственника младше 40 лет;
- 2 случая злокачественных новообразований у близких родственников младше 50 лет.
Материалом для исследования служит венозная кровь. Сдавать анализ нужно натощак. Носителям выявленных онкогенных мутаций рекомендуется встать на диспансерный учет.
Как обследоваться здоровым родственникам онкобольного?
При доказанном носительстве злокачественной наследственности такого вопроса возникать не должно, пациент всю жизнь следует определенной программе диагностики и прикрепляется к государственному лечебному учреждению.
Подавляющее большинство родственников 95% больных раком должны проходить регулярный скрининг на злокачественные процессы, включённый в стандартную программу диспансеризации, которая предполагает обследование каждые 3 года.
Для своевременного выявления злокачественных процессов женщинам необходимо:
- каждые 2 года выполнять УЗИ молочных желез или маммографию;
- при исходной патологии груди целесообразна МРТ молочных желез;
- ежегодно осматриваться гинекологом с применением кольпоскопии и взятием Пап-теста.
Для мужчин важен уровень ПСА и чем старше, тем чаще его определяют, разумеется с урологическим осмотром.
Вне зависимости от половой принадлежности ежегодно следует проходить:
- Рентгенографию органов грудной клетки, часто в государственных учреждениях подменяемую вредной и бесполезной флюорографией, при том что идеальное обследование легких — только КТ, именно она способна выявить ранний рак.
- УЗИ брюшной полости и органов малого таза специальными датчиками.
- Колоноскопию с интервалом в соответствии с возрастом и имеющимися заболеваниями кишечника.
- Гастроскопию с анализами на хеликобактер можно делать и реже, и чаще в зависимости от наличествующей патологии.
Анализ на опухолевые маркеры не применяется для профилактической диагностики, используется только для контроля динамики и эффективности лечения рака.
Большое значение придается диагностическому оборудованию, оно должно быть не просто современным, а высокоточным. Не разумно каждый год проходить КТ или МРТ в разных учреждениях, разрешающая способность аппаратуры может существенно отличаться, не позволяя ни увидеть патологии, ни сравнить прошлую картину с настоящей.
Польза регулярного обследования нивелируется некачественным его выполнением, поэтому желательно проводить профилактический осмотр в специализированных онкологических учреждениях, где делаются тысячи таких исследований, а врачи не только прошли обучение, но и имеют богатый клинико-диагностический опыт.
Высокопрофессиональное онкологическое обследование — неотъемлемая характеристика «Евроонко», мы успешно лечим злокачественные процессы и умеем видеть опухоль на ранней стадии роста. Мы знаем, что ещё необходимо приложить к отлично проведенному обследованию, чтобы долго жить и не бояться рака.
Запись на консультацию круглосуточно
+7+7+78
Профилактические меры
Чтобы вовремя заметить малейшие изменения в слизистой оболочке органа, рекомендуется выполнять профилактическую фиброгастродуоденоскопию (ФГДС). Процедура проводится с местной анестезией, врач обезболивает ротоглотку лидокаином.
В организм через ротовую полость вводится специальный инструмент – гастроскоп. С его помощью врач исследует состояние слизистой оболочки пищевода и желудка. Могут быть обнаружены полипы, язвенные поражения, рефлюксная болезнь.
Однозначным показанием к процедуре при предрасположенности к раку желудка считаются следующие симптомы:
- интенсивные боли в области эпигастрия;
- желудочные кровотечения;
- расстройства акта глотания;
- длительные расстройства желудка;
- потеря веса без очевидных причин.
Проводить ФГДС в профилактических целях можно раз в 6–12 месяцев. Можно ли по этому исследованию заподозрить онкологию – если у врача будут основания предположить злокачественную опухоль, во время процедуры он сможет выполнить биопсию – забор образца тканей. Материал направят в лабораторию на гистологическое исследование. По его результатам установят точный диагноз.
Также можно сдать анализ на Helicobacter pylori. Это бактерия, инфицирующая желудок и двенадцатиперстную кишку. Helicobacter не вызывает онкологию, но провоцирует различные формы дисплазии слизистой оболочки органа, являющиеся, по сути, предраковыми состояниями. Анализ на Helicobacter проводится методом ПЦР, материал исследования – венозная кровь.