Метронидазол (МТ) является широко используемым противомикробным и противопаразитарным препаратом [3—6]. При этом в клинической практике область его применения зачастую связана не только с действием на микроорганизмы, но и с его электронно-акцепторным свойством [7]. Последнее его свойство наиболее широко используется в онкологии для увеличения эффективности радиотерапии злокачественных новообразований. Так, для повышения эффективности лучевой терапии опухолей прямой кишки больным на фоне облучения вводят 5-фторурацил (5-ФУ) и МТ [8]. Кроме того, онкологическим больным после хирургического лечения и на фоне адъювантной химиотерапии назначают МТ для профилактики местных инфекционных осложнений [9]. Вместе с тем в литературе имеются сведения о влиянии МТ на токсичность цитостатиков. В частности, было показано, что МТ повышает токсичность метотрексата и 5-ФУ при совместном ведении мышам с привитыми опухолями [10]. В клинических исследованиях установлено, что введение алкилирующего агента бисульфана на фоне МТ приводило к значительному повышению печеночных ферментов по сравнению с контрольной группой, получавшей цитостатик в монорежиме [11]. Также было показано, что МТ способен влиять на фармакокинетику иммунодепрессанта такролимуса, существенно повышая его биологическую активность и параллельно токсичность. Так, чтобы избежать передозировки препарата на фоне применения МТ курсовую дозу иммуносупрессанта такролимуса пришлось уменьшить в 4 раза [12]. Хотя сам факт увеличения токсичности препаратов при их совместном применении с МТ и необходимость использования МТ у онкологических больных не вызывает сомнений. Одним из перспективных направлений, обеспечивающих снижение влияния МТ на токсические свойства цитостатиков, может быть разработка оптимальных режимов введения этих препаратов друг относительно друга [13].
Целью настоящей работы явилось изучение влияния различных временных промежутков между введением МТ и 5-ФУ на их биологическое действие. Выбор препаратов обусловлен широтой их применения в онкологической практике при различных формах онкологических заболеваний.
Материал и методы
Животные
. Мыши линии СВА/Lac самцы и C57Bl/6 самки массой 18—20 г в возрасте 1,5 мес получены из питомника «Столбовая» Московской области. МТ и 5-ФУ — официнальные препараты . Использованные дозы являлись максимально переносимыми или были близки к таковым, что было обусловлено необходимостью зарегистрировать эффект увеличения токсичности комбинированного использования препаратов. МТ использовали однократно в дозе 1 г на 1 кг массы тела животного (максимально переносимая доза 1,4 г/кг). Противоопухолевую эффективность комбинированного действия препаратов исследовали в следующих режимах: 5-ФУ вводили в дозе 100 мг/кг подкожно, а МТ — в дозе 1 г/кг внутрибрюшинно за 20 мин, 1 ч, 4 ч, 12 ч до введения 5-ФУ. В каждой группе было по 10 животных. При оценке токсичности изучаемой комбинации МТ вводили внутрибрюшинно в дозе 1 г/кг за 20 мин, 1 и 4 ч до подкожного введения 5-ФУ. Лечение начинали через 7 дней после трансплантации опухолевых клеток. В каждой группе было по 10 животных мышей линии СВА/Lac. Фиксировали гибель животных в течение 30 дней после введения препаратов, оценивая достоверность различий в продолжительности их жизни в группах, получивших один антиметаболит и антиметаболит с модификатором. В каждой группе было по 10 животных. В контрольных группах мышам вводили в монорежиме 5-ФУ или М.Т. Группа «чистого» контроля получала изотонический раствор натрия хлорида.
Перевиваемые опухоли
. Меланома В16 и муцинозный рак яичников СаО-1 получены из банка опухолевых штаммов ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России. Перевиваемая карцинома яичников СаО-1 описана как высокочувствительная к действию 5-ФУ [1, 2]. Меланома В16 резистентная к 5-ФУ. В опытах использовали 3-й пассаж опухоли
in vivo
. Взвесь опухолевой ткани выполняли по 105 клеток в 0,1 мл питательной среды 199. Клетки меланомы В16 перевивали мышам линии C57Bl/6, карциному яичников СаО-1 перевивали мышам линии СВА/Lac. Противоопухолевый эффект оценивали по объему опухоли и торможению роста опухоли (ТРО). Объем опухоли в динамике (в мм3) определяли по формуле
V=a
2
b
, где
а
— наименьший линейный размер опухоли в миллиметрах;
а, b
— наибольший линейный размер опухоли в миллиметрах. Торможение роста опухоли рассчитывали по формуле: ТРО =
V
ср. опыт –
V
ср.контроль /
V
ср.контроль. Токсический эффект препаратов и их комбинации оценивали по количеству лейкоцитов в периферической крови животных, изменению их массы тела и динамике их гибели.
Инструкция по применению МЕТРОНИДАЗОЛ (METRONIDAZOLE) таблетки
Во избежание развития резистентности микроорганизмов метронидазол должен применяться только для лечения инфекций, вызванных метронидазолчувствительными штаммами (по данным микробиологического исследования материала или эпидемиологическим данным).
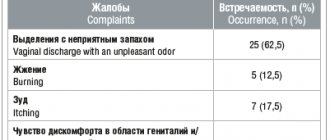
Трихомониаз с клиническими симптомами.
Метронидазол показан для лечения трихомониаза с клиническими симптомами у женщин и мужчин, если наличие трихомонад было подтверждено соответствующими лабораторными исследованиями (исследование мазка и/или культуры).
Асимптомный трихомониаз.
Метронидазол показан для лечения женщин с асимптомным трихомониазом (эндоцервицит, цервицит или эрозии шейки матки). Поскольку существуют доказательства того, что наличие трихомонад может помешать точной оценке цитологических мазков, дополнительные мазки должны быть выполнены после эрадикации паразита.
Лечение супруга без клинических проявлений.
Инфекция Т. vaginalis является венерическим заболеванием. Таким образом, сексуальные партнеры без симптомов заболевания должны быть пролечены одновременно в целях предотвращения повторного заражения от партнера, даже если возбудитель не выделен. Решение о том, следует ли лечить партнера-мужчину без клинических проявлений, у которого трихомонады не обнаружены, или в случае, если анализ не был проведен, является индивидуальным. Принимая это решение, следует отметить, что есть доказательства того, что женщина может инфицироваться повторно, если ее супруг не был пролечен. Кроме того, поскольку существуют значительные трудности в выделении возбудителя у пациента без клинических проявлений, не следует полагаться на отрицательный результат исследования мазков и культуры. В любом случае, в случае повторного инфицирования супруги должны быть пролечены метронидазол ом одновременно.
Амебиаз.
Метронидазол показан для лечения острого кишечного амебиаза (амебной дизентерии) и абсцесса печени, вызванного амебами. При лечении метронидазолом абсцесса печени, вызванного амебами, не исключена необходимость аспирации или дренирования гноя.
Анаэробные бактериальные инфекции.
Метронидазол показан для лечения тяжелых инфекций, вызванных чувствительными анаэробными бактериями. Необходимые хирургические процедуры должны быть выполнены в сочетании с терапией метронидазолом. В случае смешанной аэробной и анаэробной инфекции, соответствующие противомикробные средства должны быть использованы в дополнение к метронидазолу. При лечении тяжелых анаэробных инфекций метронидазол обычно назначают вначале. Интраабдоминальные инфекции, включающие перитонит, внутрибрюшной абсцесс и абсцесс печени, вызываются Bacteroides, включая группу В. fragilis (В. fragilis, В. distasonis, В. ovatus, В. thetaiotaomicron, В. vulgatus), Clostridium, Eubacterium, Peptococcus niger и Peptostreptococcus.
Инфекции кожи и кожных структур,
вызванные Bacteroides (включая группу В. Fragilis), Clostridium, Peptococcus niger, Peptostreptococcus и Fusobacterium.
Гинекологические инфекции,
включая эндометрит, эндомиометрит, трубно-яичниковой абсцесс и инфекции после гинекологических операций, вызванные Bacteroides (включая группу В. Fragilis), Clostridium, Peptococcus niger и Peptostreptococcus.
Бактериальная септицемия,
вызванная Bacteroides (включая группу В. Fragilis) и Clostridium.
Инфекции костей и суставов,
вызванные видами Bacteroides(включая группу В. Fragilis) в качестве дополнительной терапии.
Инфекции ЦНС,
включая менингит и абсцесс мозга, вызванные Bacteroides (включая группу В. Fragilis).
Инфекции нижних дыхательных путей,
включая воспаление легких, эмпиему и абсцесс легкого, вызванные Bacteroides (включая группу В. Fragilis).
Эндокардит,
вызванный Bacteroides (включая группу В. Fragilis).
Результаты исследований
На рис. 1 показана динамика роста опухоли карциномы яичников СаО-1 в контроле и на фоне воздействия препаратами 5-ФУ и М.Т. Введение М.Т. внутрибрюшинно в дозе 1 г/кг на 7-е сутки после перевивки опухоли не оказывало достоверного влияния на динамику ее роста. Введение подкожно 5-ФУ в дозе 100 мг/кг на 7-е сутки после перевивки опухоли вызывало задержку выхода опухоли более чем на 2 нед. Подкожное введение 5-ФУ через 1 ч после внутрибрюшинной инъекции МТ усиливало эффект цитостатика, увеличивая время выхода опухоли с 14 сут при воздействии 5-ФУ в монорежиме до 17 сут. Аналогичный эффект наблюдался при воздействии МТ за 20 мин до инъекции цитостатика. Однако при данной схеме введения 5-ФУ и МТ наблюдалась гибель до 40% животных. Гибель животных позволяет предположить усиление токсичности данной комбинации препаратов. Введение цитостатика через 4 и 12 ч не влияло на эффект цитостатика.
Рис. 1. Влияние М.Т. на противоопухолевое действие 5-ФУ на примере динамики роста карциномы СаО-1. По оси абсцисс — дни после перевивки опухоли; по оси ординат — объем опухоли в мм3.
На рис. 2 показана динамика роста карциномы яичников СаО-1 в контроле и на фоне воздействия препаратами при увеличении интервала между введения антиметаболита и МТ до 12 ч. Как видно из приведенного рисунка, в контрольной группе отмечается быстрый рост первичного узла. Введение М.Т. внутрибрюшинно в дозе 1 г/кг на 7-й день после перевивки опухоли не оказывает никакого достоверного влияния на рост опухоли. Введение подкожно 5-ФУ в дозе 100 мг/кг на 7-й день после перевивки опухоли вызывало более короткую задержку выхода опухоли. Совместное введение МТ и через 12 ч 5-ФУ не увеличивало противоопухолевый эффект антиметаболита. Однако увеличение интервала введения до 12 ч приводило к гибели не более 10% животных в этой экспериментальной группе. Отсутствие гибели животных свидетельствует об уменьшении токсичности комбинации препаратов при данной схеме введения по сравнению с предыдущей.
Рис. 2. Влияние М.Т. на противоопухолевое действие 5-ФУ на примере динамики роста карциномы СаО-1 при интервале введения препаратов 12 ч. По оси абсцисс — дни после перевивки опухоли; по оси ординат — объем опухоли в мм3.
На рис. 3 представлена динамика роста меланомы В16 в контрольной группе и на фоне воздействия препаратами. Введение М.Т. в дозе 1 г/кг массы тела животных на 7-й день после перевивки опухоли не оказывало значимого влияния на рост опухоли. 5-ФУ в дозе 100 мг/кг на 7-й день после перевивки опухоли не вызывал торможение роста опухоли. Подкожное введение 5-ФУ через 20 мин после МТ также не приводило к появлению противоопухолевого эффекта антиметаболита. Эти данные свидетельствуют, что МТ не оказывает модифицирующего действия на клетки меланомы, которое позволило бы преодолеть исходную резистентность опухоли к этому противоопухолевому препарату.
Рис. 3. Влияние М.Т. на противоопухолевое действие 5-ФУ на примере динамики роста меланомы В16. По оси абсцисс — дни после перевивки опухоли; по оси ординат — объем опухоли в мм3.
В специальной серии опытов было оценено влияние МТ на токсичность 5-ФУ. В табл. 1 представлены результаты экспериментов по изучению влияния интервала между введением 5-ФУ и МТ на гибель животных. Как следует из данных табл. 1, 5-ФУ не вызывал гибели мышей в дозе 200 мг/кг. Однако введение модификатора МТ за 20 мин до инъекции противоопухолевого препарата приводило к гибели 70% животных, что свидетельствует об увеличении токсичности химиопрепарата под воздействием МТ. 5-ФУ в дозе 300 мг/кг приводил к летальным эффектам 70% особей, а его применение через 20 мин после введения МТ (1 г/кг) вызывало 100% гибель. При этом отмечается достоверное уменьшение средней продолжительности жизни погибших животных с 14 до 9,9 сут. Увеличение интервала между введением модификатора и 5-ФУ до 1 ч снижало гибель животных в данной группе до 90%. Снижение токсичности комбинации препаратов можно объяснить быстрым метаболизмом МТ в организме мыши. Очевидно, что за этот период концентрация МТ в крови снижается и уменьшается ее влияние на токсичность 5-ФУ.
Таблица 1. Влияние различных режимов введения модификатора МТ на токсичность 5-ФУ Таблица 1. Влияние различных режимов введения модификатора МТ на токсичность 5-ФУ
Это предположение подтверждается данными, свидетельствующими, что дальнейшее увеличение интервала между введением препаратов до 4 ч приводит к еще большему уменьшению токсичности комбинированного действия МТ и 5-ФУ. Сам модификатор в монорежиме не вызывал гибели животных.
В табл. 2 представлены результаты экспериментов по изучению влияния противоопухолевого препарата и МТ, а также их комбинации на количество лейкоцитов в периферической крови мышей. В контрольной группе животных количество лейкоцитов в периферической крови было стабильным на протяжении всего периода наблюдения со средними показателями от 9,6 до 11,2∙103 кл/мкл. Введение модификатора МТ в дозе 1 г/кг вызывало снижение количества лейкоцитов в периферической крови до 7,6∙103 кл/мкл на 4-е сутки после введения МТ. В последующие дни наблюдалось восстановление количества клеток в периферической крови практически до исходных уровней. В группе животных, получивших 5-ФУ в дозе 100 мг/кг, также отмечалось снижение количества лейкоцитов в периферической крови до 7,0∙103 кл/мкл на 4-е сутки после введения противоопухолевого препарата. В последующие дни также наблюдалось восстановление количества клеток в периферической крови практически до исходных уровней. В группе животных, которым вводили модификатор за 2 ч до инъекции противоопухолевого препарата, также отмечалось снижение количества лейкоцитов в периферической крови до 6,1∙103 кл/мкл на 4-е сутки после введения противоопухолевого препарата. В последующие дни наблюдалось восстановление количества клеток в периферической крови. Однако восстановления до исходного количества клеток в периферической крови мышей в изученный период времени не произошло. Последнее обстоятельство можно объяснить увеличением токсичности данной комбинации препаратов по сравнению с их раздельным применением. Увеличение интервала между введением модификатора и противоопухолевого препарата до 4 ч привело к тому, что динамика изменения количества лейкоцитов в периферической крови была сходной с таковой в группе мышей, получивших 5-ФУ в монорежиме.
Таблица 2. Влияние 5-ФУ и его комбинации с МТ на среднее количество лейкоцитов в периферической крови мышей (∙103 кл/мкл) Примечание. Здесь и в табл. 3:* — p<0,05 достоверные различия между экспериментальными группами и контролем (М±m).
Как следует из табл. 3, в контрольной группе животных средняя масса тела была стабильна на протяжении всего периода наблюдения. Введение модификатора МТ в дозе 1 г/кг вызывает снижение массы примерно на 5% (с 21, 5 до 20,5 г). В группе животных, получивших 5-ФУ в дозе 100 мг/кг, также отмечается снижение массы тела животных примерно на 5%. В группе животных, которые получили модификатор за 2 ч до введения противоопухолевого препарата, отмечается достоверное снижение массы тела животных, достигая к 7-му дню 16,1 г (снижение на 25%), что свидетельствует об усилении общетоксического действия комбинации препаратов по сравнению с раздельным их применением. При увеличении интервала между введением модификатора и противоопухолевого препарата до 4 ч потеря массы тела животных не отличается от данного показателя в группах животных при раздельном применении этих препаратов.
Таблица 3. Влияние 5-ФУ и его комбинации с МТ на среднюю массу тела мышей, г
Обсуждение
В настоящем исследовании приведены данные по влиянию МТ на специфическую активность противоопухолевого препарата 5-ФУ. Лечебное действие препарата и его комбинации с МТ оценивали по влиянию на динамику роста опухолей у мышей — меланомы В16 и карциномы яичников СаО-1.
5-ФУ тормозил рост карциномы яичников СаО-1. Влияние М.Т. на противоопухолевую эффективность 5-ФУ зависело от интервала между введением МТ и цитостатика. Усиление противоопухолевого действия 5-ФУ отмечалось при введении модификатора через 20 мин и 1 ч после цитостатика. МТ и эффект синергизма комбинации уменьшался при увеличении интервала между введениями этих препаратов.
Отсутствие усиления противоопухолевого эффекта комбинации у мышей с привитой меланомой В16, резистентной к 5-ФУ, указывает, что МТ не является модификатором устойчивости меланомы В16 к 5-ФУ. Вышеизложенное позволяет предположить, что МТ оказывает влияние на метаболизм 5-ФУ. Это положение подтверждается серией опытов, посвященных исследованию токсичности комбинации от дозы 5-ФУ и временнóго интервала между введениями МТ и цитостатика. Согласно полученным данным, временнóй интервал 5-ФУ должен быть не менее 4 ч. При меньшем интервале (в частности, через 2 ч) токсичность цитостатика возрастает в 1,5—2 раза, что приводит к увеличение гибели животных.
Метронидазол (Metronidazole)
Нарушения со стороны желудочно-кишечного тракта: боли в эпигастрии. тошнота, рвота. диарея, глоссит, стоматит, «металлический» привкус во рту, снижение аппетита, анорексия, сухость слизистой оболочки полости рта. запор, панкреатит (обратимые случаи), изменение цвета языка, обложенный язык» (из-за разрастания грибковой микрофлоры).
Нарушения со стороны иммунной системы: ангионевротический отек, анафилактический шок.
Нарушения со стороны нервной системы: периферическая сенсорная нейропатия, головная боль, судороги, головокружение, сообщалось о развитии энцефалопатии и подострого мозжечковою синдрома (нарушение координации и синергизма движений, атаксия, дизартрия, нарушения походки, нистагм, тремор), которые являются обратимыми после отмены метронидазолa, aceптический менингит.
Нарушения психики: психотические расстройства, включая спутанность сознания, галлюцинации; депрессия, бессонница, раздражительность, повышенная возбудимость.
Нарушения со стороны органа зрения: преходящие нарушения зрения, такие как диплопия, миопия, расплывчатость контуров предметов, снижение остроты зрения, нарушение цветового восприятия: нейропатия/неврит зрительного нерва.
Нарушения со стороны крови и лимфатической системы: агранулоцитоз, лейкопении, нейтропения, тромбоцитопения.
Нарушения со стороны печени и желчевыводящих путей: повышение активности «печеночных» ферментов (аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы), развитие холестатического или смешанного гепатита и гепатоцеллюлярного поражения печени, иногда сопровождавшегося желтухой; у пациентов, подучавших лечение метронидазолом в комбинации с другими антибактериальными средствами, наблюдались случаи развития печеночной недостаточности, потребовавшей проведения трансплантации печени.
Нарушения со стороны кожи и подкожных тканей: сыпь, зуд, гиперемия кожи, крапивница, пустулезная кожная сыпь, синдром Стивенса-Джонсона. токсический эпидермальный некролиз.
Нарушения со стороны почек и мочевыводящих путей: окрашивание мочи в коричневато- красноватый цвет, обусловленной наличием в моче водорастворимого метаболита метронидазола, дизурия, полиурия. цистит, недержание мочи, кандидоз.
Общие расстройства и нарушения в месте введения: лихорадка, заложенность носа, артралгия, слабость.
Лабораторные и инструментальные данные: уплощение зубца Т на электрокардиограмме.