Быстрый переход Лечение гастрита
Гастрит — это общий термин, объединяющий несколько патологических состояний, для которых характерны воспаление и дистрофия слизистой оболочки желудка.
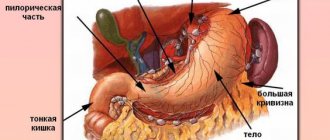
Слизистая оболочка покрывает всю поверхность желудка и выполняет важную роль в пищеварении. Ее железы вырабатывают желудочный сок, фермент пепсин, соляную кислоту, липазу, гормоноподобные компоненты, слизь и бикарбонат. Эти вещества отвечают за расщепление белков и жиров, защищают организм от болезнетворных бактерий, активируют обменные процессы.
Воспаляясь, слизистая вырабатывает меньше кислоты, ферментов, слизи и других веществ, которые необходимы для правильной работы ЖКТ. Возникает риск развития гастрита.
Гастрит может протекать в острой и хронической форме. Важно вовремя обратиться к врачу, чтобы получить диагноз и лечение, не допустить осложнений.
Формы и осложнения гастрита
При отсутствии адекватного и своевременного лечения гастрит может вызвать осложнения. К ним относятся:
- Язва желудка. Пептические язвы, поражающие слизистую оболочку желудка или двенадцатиперстной кишки. Язвенную болезнь провоцирует чрезмерное употребление обезболивающих препаратов (НПВП), и гастрит, вызванный H. pylori. Трудно сказать, где заканчивается гастрит, особенно с эрозими, и начинается язвенная болезнь. Видимо, это разные формы одного процесса.
- Атрофия слизистой оболочки желудка — атрофический гастрит. Возникает вследствие истончения слизистой , формирования фиброза (микрорубцов) оболочки при хроническом гастрите. При атрофии уменьшается количество активных клеток слизистой желудка, производящих ферменты и кислоту. Нарушается всасывание некоторых витаминов. Атрофический гастрит – фактор риска онкологической трансформации, поэтому требует особого внимания.
- Желудочное кровотечение при эрозивном гастрите и язве. Для него характерны сбивчивое дыхание, слабость, головокружение, кровь в рвоте и стуле, стул черного цвета, бледность кожных покровов. При проявлении этих симптомов необходимо немедленно обратиться за медицинской помощью.
- Анемия. Чаще всего возникает вследствие острой (как описано выше) или хронической кровопотери, например, при множественных повторяющийся эрозиях желудка. Исследования показывают, что гастрит, ассоциированный с H. pylori, и аутоиммунный гастрит могут влиять на усваивание организмом железа и витамина В12 из пищи, что также может вызывать анемию.
- Дефицит витамина B12 и пернициозная анемия (злокачественное малокровие). При аутоиммунном гастрите не вырабатывается определенный белок, который помогает усваивать витамин B12, необходимый для выработки эритроцитов и нервных клеток. Недостаточная усвояемость витамина B12 может привести к развитию пернициозной анемии. Такие же изменения, происходят в продвинутой стадии атрофического гастрита любого происхождения.
- Рак желудка. Хронический гастрит увеличивает вероятность развития доброкачественных или злокачественных новообразований в слизистой желудка. Например, гастрит, ассоциированный с H. pylory, увеличивает риск аденокарциномы и лимфомы слизистой оболочки желудка.
Симптомы
В общем, хронический гастрит протекает практически бессимптомно, заподозрить его наличие предоставляется возможным в периоды обострения (когда наиболее ярко раскрывает себя клиническая симптоматика) или же во время профилактического ФГДС-исследования. Клиническая картина каждого типа хронического гастрита не отличается коренным образом. Имеются «классические» симптомы, которые позволяют заподозрить наличие данной патологии. Среди основных симптомов следует выделить следующие: 1) боли в эпигастральной области, которые могут возникать как натощак, так и после непосредственного приёма пищи (или спустя 1/2- 1,5 часа). Боль может носить тупой, ноющий характер, а может быть периодическая режущая, схваткообразная. Характерной чертой является снижение болевых ощущений после приёма антацидных или антисекреторных лекарственных средств; 2) ощущение тяжести и дискомфорта в области эпигастрия, чувство переполнения желудка после приёма пищи; 3) отрыжка воздухом или кислым, неприятный вкус во рту; 4) снижение аппетита (характерно для гастритов с пониженной кислотностью); 5) тошнота, реже рвота; 6) неустойчивый стул.
Причины и факторы риска гастрита
- Бактериальная инфекция Helicobacter pylori. Является одним из самых распространенных видов инфекций, передается инфекция фекально-оральным путем, например, через загрязненную пищу и воду. Для развития гастрита наличия одной лишь инфицированности Helicobacter pylori недостаточно. Считается, что уязвимость к бактерии наследуется или возникает из-за неправильного образа жизни (курение, плохое питание), лекарства.
- Обезболивающие препараты (нестероидные противовоспалительные, НПВП). Регулярный и чрезмерный прием аспирина, ибупрофена или напроксена может вызвать как острый, так и хронический гастрит, их токсическое воздействие снижает выработку основных протекторов слизистой оболочки желудка. Чтобы отличить эту ситуацию от других видов гастрита, ее называют НПВП-гастропатией.
- Алкоголь. Раздражает и постепенно разрушает слизистую оболочку желудка, подвергая ее агрессивному воздействию желудочного сока. Алкоголь чаще всего провоцирует острый гастрит.
- Возраст. У пожилых людей повышенный риск развития гастрита, поскольку с возрастом слизистая оболочка желудка истончается. Пожилые люди также наиболее уязвимы в отношении инфекций (H. pylori) или аутоиммунных расстройств.
- Стресс. Сильный стресс, связанный с травмами, ожогами, тяжелыми операциями и инфекциями, может спровоцировать острый гастрит.
- Воздействие радиации или лучевая терапия (в связи с другим заболеванием).
- Желчный рефлюкс после резекции желудка.
- Аллергия на продукты питания, такие как коровье молоко и соя (особенно у детей).
- Аутоиммунные заболевания. В результате аутоиммунных процессов в организме вырабатываются антитела, которые атакуют клетки, образующие слизистую оболочку желудка. Возникает аутоиммунное воспаление, снижаются функции защитного барьера слизистой. Гастрит, связанный с аутоиммунными нарушениями, называют аутоиммунный гастрит. Он чаще встречается у людей с другими аутоиммунными расстройствами, включая болезнь Хашимото и диабет 1 типа. Аутоиммунный гастрит также может быть связан с дефицитом витамина B12.
- Другие заболевания. Риск гастрита может увеличиваться из-за других патологических состояний, включая болезнь Крона, саркоидоз, паразитарные инфекции, ВИЧ/СПИД.
Режим питания
- При обострении гастрита необходима щадящая диета. Больным гастритом противопоказаны шоколад, кофе, газированные напитки, алкоголь, консервы, концентраты и суррогаты любых продуктов, пряности, специи, а также продукция предприятий быстрого питания, блюда, провоцирующие брожение (молоко, сметана, виноград, чёрный хлеб и т. п.), копчёная, жирная и жареная пища, изделия из сдобного теста. При этом питание должно быть разнообразным и богатым белками и витаминами.
- По окончании острого состояния питание должно становиться полноценным с соблюдением стимулирующего принципа в период ремиссии у больных с пониженной кислотностью. Рекомендуется дробный приём пищи, по 5-6 раз в сутки.
Стадии протекания гастрита
- Гиперемия. На первом этапе развития гастрита наблюдается гиперемия (покраснение) слизистой оболочки желудка. Это защитная вегетососудистая реакция — расширение сосудов и усиление притока крови в ответ на негативное воздействие на слизистую. Гиперемия сопровождается отеком, это признак развития воспаления.
- Хроническое воспаление, метаплазия, дисплазия. Снижается выработка соляной кислоты, оболочка слизистой утолщается. Гипертрофия характерна для людей, злоупотребляющих алкоголем. Воспаление характеризуется накоплением в стенке желудка лейкоцитов, длительное воспаление может изменить структуру эпителия желудка, он может стать похож на кишечный, такое явление называется метаплазией и может быть связано с повышением онкологического риска. Но особенно риск высок, если при биопсии находят нарушение строение ткани и клеток желудка – дисплазию.
- Атрофия. Длительное воспаление вызывает истончение слизистой желудка, восстановительные процессы замедляются, наблюдаются атрофические изменения слизистой — клетки эпителия отмирают и заменяются рубцовой тканью.
- Эрозии и язвы – частый спутник гастрита. Очаговые и глубокие изменения развиваются из-за снижения работоспособности слизистых желез, истончения защитного слоя, в большинстве случаев это следствие воздействия H.pylori.
Хронический гастрит с нормальной и повышенной секреторной функцией желудка
Подобный тип заболевания характерен для молодых мужчин. Поражается поверхностный эпителий желудка, разрушений в слизистой, как правило, не происходит. Больные ощущают боль, подобную той, что бывает при язве. После еды у них возникает чувство внутренней тяжести. Пациенты жалуются постоянно на изжогу и неприятную отрыжку. Основная масса из них страдает запорами. Все эти явления усиливаются в ночное время суток.
Лечение гастрита
Лечение гастрита зависит от причины. Острый гастрит, вызванный приемом НПВП или злоупотреблением алкоголем, не требует медикаментозной терапии, достаточно исключить эти триггеры.
В других случаях врач может порекомендовать:
- Аантибиотикотерапию против H. pylori.
- Препараты, блокирующие выработку соляной кислоты (компонента желудочного сока) и способствующие заживлению слизистой (ингибиторы* протонной помпы — омепразол, лансопразол, рабепразол, эзомепразол, дексланзопразол, пантопразол.
- Антациды** (нейтрализуют желудочную кислоту, обезболивают).
* — Длительное использование ингибиторов протонной помпы, особенно в высоких дозах, может увеличить риск переломов бедра, запястья и позвоночника, возможно, потребуется программа профилактики остеопороза. ** — Побочные эффекты — запор, диарея.
Особенности и преимущества методики лечения гастрита в клинике Рассвет
Диагностика и лечение гастрита в клинике «Рассвет» проводится в отделении гастроэнтерологии. Мы используем доказательные методики, основанные на международных клинических рекомендациях. Ваше основное лечение начнется только после физикального осмотра и проведения всех необходимых анализов и диагностических тестов.
Важно. Влияние определенных продуктов или систем питания на риск возникновения гастрита не доказано исследованиями.
В клинике Рассвет мы в первую очередь отличим гастрит от функциональной диспепсии. Гастрит часто бессимптомный, но лечить его необходимо, поскольку он – медленная, но верная дорога к раку желудка. Функциональная диспепсия, напротив, сопровождается множеством жалоб, но эндоскопическое исследование и биопсия патологии не выявляют.
Как происходит лечение гастрита в клинике Рассвет
Для уточнения диагноза мы используем самое современное и точное оборудование и логистические методы. Например, нами выстроена система диагностики гастрита и определения онкологического риска по классификации OLGA. Наши эндоскопы позволяют провести гастроскопию с многократным увеличением и рассмотреть слизистую через светофильтры, брать биопсию из наиболее подозрительных участков. Сами биоптаты оцениваются гистологом также по шкале OLGA и в результате мы получаем цифру, которая отражает риск онкологической трансформации на ближайшие годы. От величины этой цифры зависит дальнейшая лечебная тактика.
Мы ценим комфорт пациентов, поэтому в Рассвете вы можете пройти обследование под наркозом и в кратчайшие сроки.
Рекомендации врача-гастроэнтеролога клиники Рассвет пациентам с гастритом
Своевременное обращение к врачу и правильное лечение помогут держать болезнь под контролем. Жесткая диета не нужна. Однако правила здорового питания следует соблюдать — не переедайте, избегайте продуктов, раздражающих слизистую (копченого, жареного, жирного), откажитесь от алкоголя. Если вы вынуждены принимать обезболивающие препараты, повышающие риск гастрита, уточните, можно ли их заменить на препарат, который менее агрессивно воздействует на слизистую желудка (ацетаминофен, парацетамол).
Автор:
Амеличева Алена Александровна медицинский редактор
Профилактика заболевания
Никто на 100% не знает, как вылечить гастрит, но рекомендации, как избежать этого заболевания, врачи определили точные. Рациональное, полноценное и здоровое питание; «нет» алкоголю и другим вредным привычкам; гигиена полости рта; своевременное лечение болезней желудочно-кишечного тракта; щадящий режим; смена работы, если условия труда связаны с вредным производством — вот несложные правила, которые обезопасят любого человека от тяжелых последствий. При первых признаках нарушений в работе пищеварительного тракта следует обращаться к врачам. Оперативное и грамотное лечение, в том числе и лечение атрофического гастрита, может быть достаточно эффективным. Регулярное обследование — вообще можно считать знаком уважения человека к самому себе и заботой о собственном здоровье.
Всевозможной литературы о том, как вылечить гастрит, и обещаний псевдоспециалистов избавить от болезни, конечно, немало. Но доверять нужно лишь проверенным врачам и клиникам. Любое лечение должно проходить только под их строгим контролем. В момент затихания болезни рекомендуется санаторное пребывание.
Аутоиммунный гастрит
(АИГ) – это, как правило, бессимптомное заболевание, чаще всего выявляемое при прогрессировании атрофии слизистой оболочки тела желудка и развитии дефицита железа или B12-дефицитной (пернициозной) анемии (ПА) [1].
Впервые «выдающуюся форму анемии», позднее названную ПА, описал в 1849 г. Томас Аддисон. В 1860 г. Флинт связал ее развитие с атрофией слизистой оболочки желудка (СОЖ). Успешное лечение сырой печенью позволило предположить, что мегалобластная анемия вызвана недостаточностью внешнего (витамин В12) и внутреннего факторов Кастла в желудочном соке. В 1960 г. Шварц открыл антитела к внутреннему фактору, а в 1962 г. Ирвин обнаружил антитела к париетальным клеткам (ПК), что указало на аутоиммунную природу атрофического гастрита, приводящего к ПА. АИГ был описан в 1965 г. McIntyre и соавт. у пациентов с ПА, у которых выявляли гистаминоустойчивую ахлоргидрию, атрофию СОЖ и антитела к внутреннему фактору Касла [2]. В 1973 г. Strickland и Mackay выделили два основных варианта хронического гастрита – А и В, при этом гастрит А (аутоиммунный) характеризовался первичными атрофическими изменениями слизистой оболочки фундального отдела желудка [3].
АИГ – это хронический атрофический гастрит, по мере прогрессирования которого снижается кислотопродукция желудка. При АИГ в крови выявляются циркулирующие антитела к ПК и внутреннему фактору Касла. Точных данных о распространенности АИГ нет, что определяет актуальность широкомасштабных популяционных исследований [4].
АИГ – наиболее распространенная причина тяжелого дефицита витамина B12 из-за нарушения всасывания кобаламина у пожилых людей. Частота дефицита витамина B12 при АИГ варьируется от 37 до 69% [5], что, вероятно, связано с высокой гетерогенностью рассматриваемых популяций и ограниченным доступом к проспективным исследованиям. Распространенность ПА в общей популяции около 0,1%, но достигает 2% у лиц старше 60 лет [1]. В одном из исследований анализировалось содержание витамина B12 в крови у 729 американцев в возрасте ≥60 лет и было показано, что 1,9% обследованных имели неверифицируемую и нелеченую ПА. Ее распространенность составила 2,7% у женщин, 1,4% у мужчин, а у чернокожих и европеоидов – 4,3 и 4,0% соответственно [7].
В Китае проведено обследование 181 пациента с мегалобластной анемией. ПА была диагностирована в 61% случаев, у 70% пациентов была выявлена атрофия желез желудка по данным гистологического исследования. Сывороточные антитела к внутреннему фактору Касла встречались чаще (73%), чем сывороточные антитела к ПК желудка (65%). Антитела к ПК у мужчин выявлялись чаще (78%), чем у женщин (53%; p=0,018) [8].
Следует отметить, что на всасывание витамина B12 влияет прием некоторых лекарств (ингибиторы протонной помпы, блокаторы Н2-гистаминовых рецепторов, метформин). Известно, что Helicobacter pylori вызывает хронический активный гастрит, а его прогрессирование ведет к атрофическому гастриту [9, 10]. При этом H. pylori был выявлен у 56% людей с дефицитом витамина B12 [11].
В пяти исследованиях получены данные о распространенности АИГ у пациентов с дефицитом железа. Dickey и соавт. обследовали 41 пациента с железодефицитной анемией (ЖДА). Атрофический гастрит, по данным гистологического исследования, обнаружен у 8 (20%) пациентов, и у 6 из них выявлены антитела к фактору Касла или ПК, у 1 – обнаружен H. pylori [12]. Исследование Hershko и соавт. включало 150 пациентов с ЖДА неизвестной этиологии. Антитела к ПК в сочетании с гипергастринемией, указывающие на АИГ, были найдены в 27% случаев [13]. В британском исследовании у 12 из 44 (27%) пациентов с анемией и дефицитом железа были выявлены антитела к ПК [14]. Kulnigg-Dabsch и соавт. при оценке причины дефицита железа у 409 пациентов с анемией или без нее выявили антитела к ПК в 18,5% случаев. При этом наличие антител сочеталось с более низкими уровнями гемоглобина и ферритина [15].
Патогенез АИГ
Определенную роль в развитии АИГ играют как генетические, так и экологические (внешние) факторы. На мышиных моделях были обнаружены гены восприимчивости АИГ (Gasa 1, 2, 3 и 4) на хромосомах 4, 6 и в области Н2. Интересно, что 3 из этих генов расположены в том же локусе, что и гены восприимчивости сахарного диабета (СД), что может объяснить ассоциацию между АИГ и СД 1 типа (СД1) [16].
При АИГ гистологически определяется мононуклеарный инфильтрат в СОЖ, затрагивающий собственную пластинку между железами желудка, который включает плазматические клетки, Т-лимфоциты и большую популяцию не-Т-клеток (вероятно, В-клетки), в результате чего происходит выработка антител к антигенам протонной помпы ПК и внутреннему фактору [1]. Повреждение СОЖ – результат опосредованного разрушения циркулирующими аутоантителами протонной помпы насоса (H+/K+-АТФазы) ПК желудка. Предполагают, что этот неограниченный процесс также индуцирует прогрессирующую потерю главных клеток [17]. В результате ПК СОЖ заменяются слизистыми и метапластическими клетками как кишечного, так и псевдопилорического типа. На поздних стадиях заболевания СОЖ представляет собой атрофический и метапластический эпителий.
В нескольких исследованиях сообщалось, что значительное число пациентов с инфекцией H. pylori также экспрессировали аутоантитела против H+/K+-АТФазы. Присутствие этих аутоантител у лиц, инфицированных H. pylori, часто сочеталось с более высоким уровнем гастрина сыворотки, более низким соотношением пепсиноген I/II и выраженным снижением секреции соляной кислоты. Кроме того, показано, что ПА, которая ранее считалась исключительным осложнением АИГ, сопровождалась инфекцией H. pylori. На основании этих гистологических и клинических данных высказана гипотеза, согласно которой классический АИГ может быть вызван инфекцией H. pylori. Однако эти предположения основаны на относительно небольшом количестве клинических исследований. Напротив, в исследовании, проведенном Zhang и соавт., включившем 9684 больных, 53% из которых были инфицированы H. pylori, связь между антителами к ПК и хроническим атрофическим гастритом была более высокой среди пациентов с отсутствием H. рylori (отношение рисков [ОР]– 11,3; 95% доверительный интервал [ДИ] – 7,5–17,1), чем среди позитивных (OР=2,6, 95% ДИ – 2,1–3,3). Общая распространенность антител к ПК составила 19,5% [18].
Связь АИГ с другими аутоиммунными заболеваниями хорошо известна. Опубликованы данные о сочетании АИГ с витилиго, алопецией, целиакией, миастенией гравис и аутоиммунным гепатитом [18]. В нескольких исследованиях отмечено его частое сочетание с СД1 [19], а также с аутоиммунными полигландулярными синдромами (АПГС). ПА встречается среди 10–15% пациентов с АПГС типа I (гипопаратиреоз, болезнь Аддисона, СД и кандидоз слизистой оболочки) и у 15% пациентов с АПГС типа III (СД и аутоиммунные заболевания щитовидной железы) [20, 21].
Наиболее часто АИГ сочетается с аутоиммунным тиреоидитом: более 50% пациентов с АИГ имеют циркулирующие антитиропероксидазные антитела [22]. Связь между аутоиммунным заболеванием щитовидной железы и АИГ впервые была описана в начале 1960-х гг. Совсем недавно эта ассоциация была включена в АПГС типа IIIb, в котором аутоиммунный тиреоидит представляет собой основное заболевание. Тиреоидит Хашимото является наиболее частым аутоиммунным заболеванием, он ассоциируется с заболеваниями пищеварительного тракта у 10–40% пациентов, с другой стороны, им страдают около 40% пациентов с АИГ. В патогенезе этих двух заболеваний выявлено некоторое сходство, включая сложное взаимодействие между генетическими, эмбриологическими, иммунологическими и экологическими факторами. Несмотря на различные локализацию и функцию, щитовидная железа и желудок имеют сходные морфологические и функциональные характеристики, вероятно, из-за их общего эмбриологического происхождения [23]. Фактически щитовидная железа развивается из примитивной кишки, поэтому ее фолликулярные клетки имеют такое же эндодермальное происхождение, как и ПК. Кроме того, клетки желудка и фолликулярные клетки щитовидной железы демонстрируют способность концентрировать и переносить йод через клеточную мембрану [24]. Йод помимо его существенной роли в синтезе гормонов щитовидной железы регулирует пролиферацию клеток СОЖ. Фактически в присутствии пероксидазы желудка йод действует как донор электронов и участвует в удалении свободных радикалов кислорода, оказывая антиоксидантное действие. Эти эффекты могут объяснить регуляторную роль йода в пролиферации клеток СОЖ и его защитную роль против канцерогенеза в желудке. Эту гипотезу подтверждает связь между дефицитом йода, зобом и повышенным риском развития рака желудка [25].
Частота развития АИГ у больных аутоиммунными заболеваниями щитовидной железы была оценена в ходе проспективного исследования, исходно включившего 208 взрослых пациентов. У 166 из них был установлен тиреоидит Хашимото, у 42 – болезнь Грейвса. У 51 (24,5%) больного были выявлены антитела к ПК, у 10 (4,8%) – к внутреннему фактору. Двадцать пять пациентов с положительным анализом на антитела согласились принять участие в последующем обследовании. На момент начала наблюдения ни у кого из них не были выявлены гастроинтестинальные и гематологические симптомы. Через 5 лет у 6 (24%) из них гистологически был диагностирован АИГ (лимфоцитарная инфильтрация и/или атрофия слизистой оболочки тела желудка). При анализе тенденций концентрации антител к ПК отмечено, что их уровни аутоантител постепенно нарастают, достигают пикового значения и затем падают в соответствии с прогрессирующим развитием атрофии СОЖ и исчезновением целевого аутоантигена (протонной помпы). Авторы пришли к заключению, согласно которому наличие антител к ПК служит предиктором развития АИГ у пациентов с аутоиммунными заболеваниями щитовидной железы. Следовательно, уровни антител, измеренные с помощью чувствительного количественного иммунометрического метода, значимы для ранней диагностики АИГ [26].
В другом исследовании продемонстрировано, что ЖДА, резистентная к пероральной терапии железом, у пациентов с тиреоидитом Хашимото может быть связана с хроническим атрофическим гастритом [27].
АИГ и СД1
Частота АИГ в 3–5 раз увеличивается у больных СД1 [28]. Известно, что СД1 развивается главным обра-зом в результате разрушения β-клеток поджелудочной железы специфическими аутоиммунными клетками. Предполагают, что аутоиммунные механизмы при развитии СД1 и АИГ могут быть схожими, поэтому высока вероятность, что у одного и того же пациента могут быть оба заболевания. Проведен крупный мета-анализ опубликованных с 1980 по 2014 г. работ, в котором оценивалась связь между наличием аутоантител к ПК и СД1. В мета-анализ были включены 3584 пациента с СД1, в контрольную группу вошли 2650 здоровых лиц. Анализ показал, что наличие антител к ПК было более распространено среди больных СД1, чем среди здоровых людей [29].
Ассоциация АИГ с H. pylori
Хорошо известно, что H. pylori сам по себе может вызывать атрофический гастрит. С другой стороны, важно помнить, что во многих случаях пациенты с АИГ могут одновременно иметь инфекцию H. pylori [30]. Третьим возможным сценарием является прогрессирование гастрита, вызванного H. pylori при АИГ.
Инфицирование H. pylori постепенно ведет к развитию атрофического гастрита [31]. Этот тип гастрита наиболее часто локализуется в антральном отделе желудка, но и может перейти на тело или иметь мультифокальный характер. Тяжелая атрофия развивается на протяжении многих лет, после чего H. pylori нередко исчезает из СОЖ. У некоторых пациентов при этом появляются антитела к ПК, в результате чего заболевание становится похожим на классический АИГ [30]. При индуцированном H. pylori атрофическом гастрите активированные клетки CD4+-Th1, проникающие в СОЖ, перекрестно распознают протонную помпу этих клеток и различные белки H. pylori. Однако не ясно, является ли H. pylori фактором активации Th1-клеток, приводящей к воспалению и апоптозу [32].
У многих пациентов, инфицированных H. pylori, вырабатывается широкий спектр антител – антифовеолярных, антиканаликулярных и классических к ПК. Наиболее часто обнаруживаются антиканаликулярные антитела, которые, как и антитела к ПК, направлены против H+/K+-АТФазы [33].
Несмотря на множество перекрестов, важно дифференцировать АИГ и ассоциированный с H. pylori гастрит. Прежде всего следует помнить, что АИГ поражает тело и дно желудка, в то время как вызванный H. pylori гастрит преимущественно локализуется в антральном отделе желудка.
Другие дифференциально-диагностические критерии:
- гиперплазия энтерохромаффиноподобных клеток чаще встречается при АИГ;
- псевдогипертрофия ПК более характерна для АИГ, однако она может наблюдаться и при ассоциированном с H. pylori гастрите при длительном использовании ингибиторов протонной помпы;
- вовлечение фундальных желез более характерно для АИГ;
- инфильтрация лимфоцитами и плазматическими клетками СОЖ с вовлечением глубоких слоев служит признаком АИГ, с поражением поверхностных слоев и активным воспалением ассоциированного с H. pylori атрофического гастрита;
- высокий уровень гастрина-17 характерен для АИГ и, как правило, низкий при инфекции H. pylori; уровень простагландинов низкий при АИГ и может быть нормальным при инфекции H. pylori [34].
Клинические симптомы АИГ
АИГ длительно протекает бессимптомно. Его клинические проявления, как правило, возникают после развития тяжелой атрофии желез, когда клетки желудка становятся неспособными продуцировать в достаточном количестве соляную кислоту, пепсиногены и внутренний фактор Кастла. Желудочно-кишечные симптомы АИГ не специфичны. В исследовании, включившем 99 пациентов, Miceli и соавт. [4] показали, что наиболее часто к постановке диагноза АИГ привели гематологические расстройства (различные формы анемии; в 37% случаев) и гистологически подтвержденный гастрит – в 34%. Менее чем у 10% пациентов подозрение на АИГ вызвано наличием других сопутствующих аутоиммунных заболеваний, целиакии, неврологических симптомов или семейного анамнеза.
ЖДА – одно из самых ранних проявлений АИГ, развивается вследствие ахлоргидрии на фоне атрофии фундальных желез. В нескольких исследованиях показано, что причиной рефрактерной или необъяснимой ЖДА нередко является АИГ, причем не только во взрослой, но и в детской популяции [35].
ПА служит следствием дефицита кобаламина. Несмотря на то что основные механизмы развития мегалобластоза выяснены не полностью, считается, что во многом это связано с существенной ролью кобаламина в синтезе ДНК [36]. Сначала выявляется бессимптомное увеличение среднего объема гиперсегментированных нейтрофилов. По мере прогрессирования болезни пациенты могут жаловаться на слабость, рассеянность и сердцебиение. На поздних стадиях могут проявляться симптомы стенокардии и застойной сердечной недостаточности (периферические отеки и одышка). Помимо характерного изменения эритроцитов обнаруживают тромбоцитопению, повышенные уровни лактатдегидрогеназы и билирубина (признаки гемолиза). Недостаток кобаламина приводит к гипергомоцистеинемии и эндоваскулярной дисфункции, результатом чего является активация системы коагуляции, усиление агрегации тромбоцитов, сужение сосудов и повышенный риск развития тромбоза. У молодых пациентов с тяжелой гипергомоцистеинемией, вторичной по отношению к ПА, описаны острый инфаркт миокарда и легочная эмболия [37, 38].
Неврологические симптомы дефицита кобаламина связаны с демиелинизацией, последующим повреждением аксонов и в конечном итоге – с гибелью нейронов [39]. Интересно, что неврологические проявления, обусловленные дефицитом кобаламина, могут наблюдаться в отсутствие гематологических нарушений [40]. Клинически выявляют сенсорные аномалии, такие как потеря вибрационной чувствительности и дистальные парестезии. Поскольку неврологические поражения необратимы, крайне важно обеспечить своевременное парентеральное введение витамина B12, способное остановить прогрессирование процесса [41]. Периферическая невропатия служит другим неврологическим проявлением ПА. Первоначальные симптомы включают парестезию и онемение нижних конечностей. В этом отношении клинически можно отличить периферическую невропатию и подострую комбинированную дегенерацию [42]. Нейропсихиатрические состояния, связанные с ПА, включают манию, депрессию, обсессивно-компульсивное расстройство, психоз и слабоумие. Следует отметить, что использование высоких доз витаминов В12, В6 и фолиевой кислоты замедляет и уменьшает атрофию головного мозга [43].
После развития гипо- и ахлоргидрии АИГ обычно проявляется только нечеткими диспепсическими симптомами, такими как вздутие живота, раннее чувство насыщения и дискомфорт в эпигастральной области [44]. Одним из следствий дефицита кобаламина является атрофический глоссит, проявляющийся ощущением жжения языка [45]. В Италии в период с 1995 по 2013 г. проведено обследование 379 больных АИГ, у которых оценивались гастроинтестинальные симптомы в соответствии с Римскими критериями-III, связь между ними и признаками анемии, наличие аутоантител к ПК и внутреннему фактору, инфекции H. pylori и сопутствующих аутоиммунных заболеваний. Преобладали женщины (70,2%), средний возраст пациентов составил 55 лет (диапазон – 17–83). ПА была выявлена у 53,6% больных, ЖДА – у 34,8%, антитела к ПК – у 68,8%, сочетание с другими аутоиммунными заболеваниями – у 41,7%. Доминировали заболевания щитовидной железы (89%), среди других – витилиго, алопеция, СД, ревматоидный артрит, гемолитическая анемия, синдром Шегрена, псориаз, аутоиммунный гепатит и миастения.
В 26,1% случаев была диагностирована инфекция H. pylori. Ни у одного из пациентов не был выявлен рак желудка. Желудочно-кишечные симптомы отмечены у 56,7% больных, 69,8% из них предъявляли жалобы исключительно в отношении верхних отделов пищеварительного тракта, 15,8% – нижних его отделов, а 14,4% – их сочетание. Наиболее выражена была постпрандиальная диспепсия, присутствовавшая у 60,2% пациентов [46].
Диагностика АИГ
Определение антител к ПК желудка считается оптимальным скрининговым тестом для АИГ, а определение антител к внутреннему фактору – резервной методикой для подтверждения диагноза. Уровень витамина В12 не коррелирует с титрами антител. Уровни антител к ПК и гипергастринемия значительно коррелируют с воспалением фундальных желез СОЖ, а уровни аутоантител к внутреннему фактору – с ее атрофией [47].
Потеря ПК приводит к серьезным функциональным изменениям. Гипергастринемия, выявляемая практически у всех пациентов, служит результатом стимуляции гастринпродуцирующих G-клеток в условиях ахлоргидрии. Потеря главных клеток фундальных желез ведет к постепенному снижению в сыворотке уровня пепсиногена I, тогда как уровень пепсиногена II (поддерживаемый нормальной секрецией незатронутых антральных желез) существенно не меняется. Это приводит к уменьшающемуся соотношению пепсиноген I/II. Таким образом, типичным серологическим профилем АИГ является гипергастринемия и постепенное снижение соотношения пепсиноген I/II [34].
Биопсия с последующим гистологическим исследованием считается наиболее надежным методом диагностики метапластического атрофического гастрита. Однако в условиях выраженного воспаления достоверно оценить атрофию фундальных желез трудно. Другой причиной неправильной интерпретации гистологических результатов могут послужить ранние стадии АИГ. Для морфологической картины АИГ характерны: 1) инфильтраты лимфоцитов и плазматических клеток в собственной пластинке, 2) фокальная атрофия фундальных желез СОЖ вместе с субэпителиальной капиллярной сетью, 3) псевдогипертрофия ПК и 4) гиперплазия энтерохромафиноподобных клеток. Поскольку гиперплазия – предшественник нейроэндокринных опухолей желудка, важно окрашивать образцы с помощью CgA и синаптофизина [48].
Долгосрочные исследования свидетельствуют о том, что при раннем АИГ не происходит никаких существенных изменений в антральном отделе желудка в отсутствие инфекции H. pylori: эпителий либо нормальный, либо выявляется фовеолярная гиперплазия («реактивная гастропатия»), вероятно, связанная с трофическим эффектом гипергастринемии [49]. При прогрессировании АИГ происходит неравномерная потеря фундальных желез, что приводит к появлению псевдополипоза. Такая макроскопическая картина предполагает необходимость взятия биопсии при эндоскопическом исследовании как из полиповидно измененной СОЖ, так и из видимо неизмененных ее участков. Атрофия СОЖ может возникать в двух разных формах. При одной из них исчезающие железистые клетки заменяются фиброзной тканью, что не сопровождается изменением железистого фенотипа. При второй форме железы СОЖ заменяются метапластическими железами [50]. Прогрессирующая замена функционально специализированных желез желудка нефункционирующей фиброзной тканью или метапластическими клетками приводит к потере основных функций фундальных желез СОЖ, одной из которых является производство соляной кислоты.
Нейроэндокринные опухоли желудка (эндокринные карциномы)
Рецепторы к гастрину имеются на мембранах не только ПК, но и энтерохромаффиноподобных клеткок. При длительном существовании АИГ происходит прогрессирование атрофических изменений слизистой оболочки тела желудка, где и сосредоточены ПК. Уменьшение количества ПК приводит к снижению секреции соляной кислоты. Гипо- и ахлоргидрия приводят к гипергастринемии, гастрин стимулирует рецепторы на энтерохромаффиноподобных клетках, что ведет к гиперплазии с последующей дисплазией, считающейся предраковым поражением, которое может прогрессировать до эндокринной карциномы 1-го типа [51]. Существует 3 типа эндокринных карцином желудка: тип I связан с АИГ, тип II может присутствовать у пациентов с множественной эндокринной неоплазией I типа и синдромом Золлингера–Эллисона, а тип III, наиболее агрессивный вариант, обычно возникает спорадически. Уровни гастрина в сыворотке варьируются в зависимости от типа карциномы: для типов I и II характерны высокие, для типа III – нормальные [52]. Полиповидные образования тела желудка у больных АИГ нередко представляют собой нейроэндокринные опухоли. Эти поражения, как правило, бессимптомны, хотя могут наблюдаться диспепсия и ЖДА. Диагноз обычно устанавливается при эндоскопическом и морфологическом исследованиях [53].
Лечение АИГ
Патогенетической терапии АИГ не разработано. Симптоматическое лечение АИГ зависит от клинических проявлений и результатов лабораторных исследований. На ранних стадиях заболевания до прогрессирования ПА рекомендуется прием железа, фолиевой кислоты и кобаламина. Возможен пероральный прием витамина В12, т. к. показано, что 1% свободного витамина В12 может абсорбироваться в тонкой кишке с помощью пассивной диффузии. Однако пациентам с неврологическими проявлениями рекомендуется парентеральное введение витамина В12.Поскольку АИГ часто сочетается с другими аутоиммунными заболеваниями, необходимы соответствующие диагностический поиск и лечение [54].
Также было показано, что эрадикационная терапия пациентов с наличием H. pylori ведет к уменьшению активности и выраженности гастрита и в 80% случаев тормозит прогрессирование атрофии СОЖ при наблюдении на протяжении 2 лет. Таким образом, проведение эрадикации H. pylori у пациентов с АИГ – обязательное условие лечения этого заболевания [55].