Классификация
Патология может характеризоваться:
- по быстроте возникновения симптомов: типичная (хроническая) и фульминантная (быстро развивающаяся);
- по течению: рецидивирующая и непрерывная;
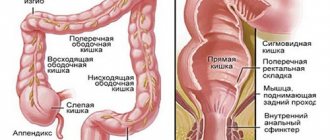
- по локализации: левосторонний с вовлечением в процесс нисходящей ободочной и сигмы, проктит (поражение ректум), тотальный колит с илеорефлюксом, колит с внекишечными проявлениями и осложнениями;
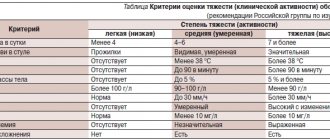
- по тяжести клинических проявлений: легкая, средняя, тяжелая;
- по активности: минимальная, умеренная, резко выраженная.
Патоморфология свидетельствует о поверхностном диффузном патологическом процессе.
Будущее МАТ
В последнее время созданы биспицефичные или поликлональные АТ, воздействующие более чем на одну мишень и значительно увеличивающие эффективность терапии. Так, препарат Абатацепт (Оренсия) для лечения ревматоидного артрита связывается одновременно с CD80 и CD86.
Fc-гибридные белки (фьюжн-белки, Fc-fusion protein) — химерные белки, полученные в результате трансляции гибридного гена («сшитого» из двух генов, изначально кодировавших разные белки). Наибольший коммерческий и клинический успех получили белковые препараты, включающие Fc-фрагмент молекулы антитела (чаще IgG).
Рис.3 Схема строения МАТ и Fc-гибридных белков
Fc-фрагмент обуславливает антителозависимую клеточную цитотоксичность и комплемент зависимую цитотоксичность гибридного белка. Конечным результатом гибридизации является пролонгирование терапевтического действия соединенной с Fc-участком молекулы и повышению клинической эффективности. В России зарегистрировано для применения три подобных вещества: Афлиберцепт, Этанерцепт, Ромиплостим.
Где применяются препараты МАТ?
Препараты на основе МАТ применяются для терапии хронических заболеваний с длительным, прогрессирующим течением. Более половины всех МАТ создано для иммунотерапии рака. Еще одна обширная сфера применения — аутоиммунные заболевания, особенно тяжелые формы, такие как ревматоидный артрит, системная красная волчанка, псориаз, рассеянный склероз. Кроме этого, МАТ используются в аллергологии для лечения резистентных, тяжелых форм бронхиальной астмы, в трансплантологии для профилактики отторжения трансплантата, в терапии некоторых вирусных, хронических воспалительных и орфанных заболеваний (пароксизмальная ночная гемоглобинурия, криопирин-ассоциированные периодические синдромы).
Отличие от болезни Крона
Клиника патологии напоминает еще одно распространенное заболевание, при котором эрозивно-язвенный процесс затрагивает желудочный отдел системы пищеварения и стенки дистального кишечника – это болезнь Крона.
Отличительной дифференциальной чертой между двумя патологиями служит локализация язв и эрозий. Язвенный колит поражает только слизистую толстой ободочной и прямой кишки, а синдром Крона локализуется в любом отделе ЖКТ. Кроме того, язвенный колит ассоциирован с иммунными сдвигами, а болезнь Крона – хроническое воспаление.
Общее между патологиями – это клинические проявления. Помимо этого, исследования в группе монозиготных близнецов показали небольшую вероятность появления определенного признака у обоих близнецов при НЯК (около 10%) в отличие от болезни Крона (до 50%), что напрямую доказывает доминирующее значение внешнего воздействия в возникновении НЯК перед генетическими проблемами.
К удивлению ученых, особенно нестандартно повело себя курение: оно просто блокирует НЯК, но стимулирует болезнь Крона.
Способы получения моноклональных антител
Получение моноклональных антител — это сложный многоступенчатый процесс, который проходит следующие этапы:
- Иммунизация животных. Обычно используются мыши или крысы. Это нужно для того чтобы увеличить количество лимфобластов — клеток, продуцирующих нужные антитела и перевести эти клетки в активное состояние. После выделения из организма эти клетки не могут долго существовать в лабораторных условиях, они погибнут даже на питательных средах с содержанием ростовых факторов. Чтобы это предотвратить, их скрещивают со злокачественными миеломными клетками.
- Подготовка миеломных клеток. Параллельно с иммунизацией животных проводят подготовку опухолевых миеломных клеток. Они, во-первых, обладают способностью синтезировать моноклональные антитела, а во-вторых, обладают неограниченным жизненным потенциалом (они бессмертны и способны к бесконечному воспроизведению). Для того чтобы миеломные клетки не погибли вне организма, их культивируют на специальных средах с использованием факторов роста.
- Гибридизация (слияние) лимфобластов и миеломных клеток для образования гибридомы. Для этого клетки обрабатывают различными антителами, чтобы изменить строение их мембран и спровоцировать образование цитоплазматических контактов. При этом образуются разные типы клеток, имеющих двойной набор хромосом (дикарионы). Это могут быть дикарионы, образованные только лимфоцитами, или только миеломными клетками. Но для производства моноклональных антител нужны именно дикарионы, образованные лимфоцитом и миеломной клеткой — гибридные клетки.
- Отбор гибридных клеток. Для этого используют специальные растворы, которые позволяют выжить только лимфобластным и гибридомным дикарионам. Первые в скором времени погибают, т. к. не обладают возможностью безграничного деления, а гибридомные клетки остаются жизнеспособными.
- Реклонирование гибридомных клонов.
- Определение и отбор гибридом, продуцирующих моноклональные антитела. Обычно для этого используется иммуноферментный анализ.
- Массовое наращивание антител.
- Очистка полученных антител. Степень очистки будет определяться областью применения препарата. Если это диагностика, достаточно 70-95% степени чистоты. Если препарат предполагается использовать для иммунотерапии, требуется более высокая степень чистоты. Для очистки используется аффинная и ионообменная хроматография.
- Удаление оставшихся примесей и обеззараживание полученного препарата от вирусов и бактерий.
В настоящее время идет тенденция отказа в использовании антител животных для лечебных целей. Во-первых, они являются чужеродными агентами для организма и могут спровоцировать аллергические реакции, вплоть до анафилаксии, что напрямую угрожает жизни пациентов. Во-вторых, иммунная система человека, распознавая такие антитела как чужеродные, будет пытаться их инактивировать, что снизит эффективность противоопухолевого лечения. Получить человеческие моноклональные антитела вышеописанным методом не представляется возможным, ввиду следующих проблем:
- Иммунизация человека различными антигенами неэтична.
- Даже если получить иммунизированные лимфоциты человека, будут проблемы на этапе их слияния с клетками миеломы мыши — полученные гибридомы будут нестабильны.
- Клеточные линии миеломы человека, которые можно было бы эффективно использовать в рамках биотехнологий для получения антител, пока получить не удалось.
В этой связи необходимо было искать новые технологии получения антител. Решением проблемы стали гибридные, гуманизированные и одноцепочечные антитела, производство которых подразумевало применение гибридомной технологии, кратко описанной выше, и технологии рекомбинантной ДНК.
- Гибридное или химерное антитело — это антитело, в котором его константный домен заменен на иммуноглобулин человека. Получаются они посредством технологии рекомбинантной ДНК, когда удаляется фрагмент мышиной ДНК, отвечающей за синтез константного домена и меняют его на фрагмент человеческой ДНК. Таким образом, в антителе в качестве константного домена, который обладает иммуногенными и эффекторными свойствами, будет человеческий белок, что позволит организму воспринимать его «за своего», а вариабельный домен, который специфически взаимодействует с антигеном, останется мышиным. Все вместе это позволит сохранить специфичность и уменьшить аллергенность и иммуногенность применяемого препарата.
- Гуманизированное антитело содержит еще меньше мышиного белка за счет только антигенсвязывающих гипервариабельных участков вариабельного домена. Это еще больше снижает вероятность осложнений со стороны иммунной системы.
- Одноцепочечное антитело представляет собой минимальный фрагмент антитела, который еще в состоянии хорошо связаться с антигеном и оказать свое действие. Он не содержит константного домена вообще.
Механизм действия моноклоналных антител
Моноклональные антитела широко используются в лечении заболеваний, у которых в патогенезе замешан иммунный компонент. С их помощью лечат псориаз, аутоиммунные заболевания, ревматоидный артрит, рассеянный склероз. Большие перспективы эти технологии получили и в онкологии в рамках таргетной терапии. При этом, их эффект основан на различных механизмах, которые рассмотрены ниже.
Изменение клеточных сигналов
В качестве примера изменения клеточных сигналов можно привести рецепторы факторов роста. Некоторые злокачественные клетки имеют на своей поверхности большое количество рецепторов к факторам роста, активирующим каскад реакций, направленный на усиление размножения клетки. Чем больше таких рецепторов, тем активнее протекает этот процесс. Если блокировать рецептор с помощью моноклонального антитела, он не сможет связаться с лигандом (фактором роста), и соответственно каскад этих реакций не будет запущен. Клетка не будет так активно размножаться и в конце концов погибнет.
Комплемент-зависимая цитотоксичность
Этот механизм реализуется следующим образом. Антитело связывается с антигеном, находящимся на поверхности злокачественной клетки, что приводит к активации многоэтапной системы комплемента (механизма иммунного ответа). Конечным этапом этих реакций является образование особого белка С 9, который перфорирует клеточную мембрану раковой клетки, что в конечном итоге приводит к ее гибели.
Усиление цитотоксического воздействия иммунных клеток
Моноклональные антитела могут стимулировать иммунные клетки, например, макрофаги. Они будут распознавать клетки злокачественных опухолей и «пожирать» их, тем самым уничтожая их.
Развитие адаптивного иммунитета
Одной из причин, по которой становится возможным образование и развитие злокачественной опухоли в организме, является то, что иммунная система человека не распознает такие клетки как чужеродные. Моноклональные антитела дают возможность иммунитету «познакомиться» с раком и делает его доступным для связывания и последующего уничтожения. Таким образом, организм получает возможность самостоятельно бороться с опухолью.