Что такое Лечение спаек после операции?
На практике же это выглядит так: в местах повреждений серозной оболочки усиленно вырабатываются коллагеновые и эластичные волокна и клетки соединительной ткани. Если в это время какой-нибудь внутренний орган (например, петля кишки) прикасается к участку поврежденной серозы, он поневоле вовлекается в этот процесс. Образуется тяж из соединительной ткани, который ведет от стенки внутренних органов к внутренней поверхности брюшной стенки. Это и называется спайкой.
Спайки могут соединять и внутренние органы друг с другом. Каждый из них также покрывает серозная оболочка. Во время операции не исключены ее микро-надрывы. И эти места микротравм также могут впоследствии стать источником формирования спаек между этим органом и органами прилегающими к нему.
Также на участке соприкосновения и заживления тканей после их рассечения или разрыва может образоваться рубец, при котором обычная ткань заменяется более жесткой и неэластичной соединительной. Рубцы могут быть на коже, а могут быть и на внутренних органах.
Что такое спайки?
Органы брюшной полости и малого таза (матка, маточные трубы, яичники, мочевой пузырь, прямая кишка) снаружи покрыты тонкой блестящей оболочкой — брюшиной. Гладкость брюшины в сочетании с небольшим количеством жидкости в брюшной полости обеспечивает хорошую смещаемость петель кишечника, матки, маточных труб. Поэтому в норме работа кишечника не мешает захвату яйцеклетки маточной трубой[1], а рост матки во время беременности не препятствует нормальной работе кишечника и мочевого пузыря.
Воспаление брюшины — перитонит — очень опасное заболевание. И оно тем опаснее, чем большее пространство в брюшной полости или в малом тазу захватывает. Но в организме существует механизм, ограничивающий распространение перитонита, — образование спаек.
При развитии воспалительного процесса в малом тазу ткани в очаге воспаления становятся отечными, а поверхность брюшины покрывается клейким налетом, содержащим фибрин (белок, составляющий основу кровяного сгустка). Пленка фибрина на поверхности брюшины в очаге воспаления склеивает соседние поверхности друг с другом, в результате чего возникает механическое препятствие для распространения воспалительного процесса. После окончания острого воспалительного процесса в местах склеивания внутренних органов могут образовываться сращения в виде прозрачно-белесых пленок. Эти сращения и называются спайками. Функция спаек — защита организма от распространения гнойно-воспалительного процесса по брюшной полости.
Воспалительный процесс в брюшной полости не всегда приводит к образованию спаек. Если лечение спаек
начато вовремя и проведено правильно, вероятность образования спаек уменьшается. Спайки образуются тогда, когда острый процесс переходит в хронический и процесс заживления растягивается по времени.
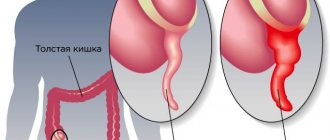
Спайки могут мешать нормальной работе внутренних органов. Нарушение подвижности петель кишечника может приводить к кишечной непроходимости. Спайки, затрагивающие маточные трубы, матку, яичники, нарушают попадание яйцеклетки в маточную трубу, передвижение сперматозоидов по маточной трубе, встречу сперматозоидов и яйцеклетки, продвижение зародыша после зачатия к месту прикрепления в полость матки. В гинекологии спайки могут быть причиной бесплодия и тазовых болей.
Симптомы
Симптоматика при наличии спайки у женщины очень различна, однако, можно выделить несколько общих признаков:
- Синдром хронической тазовой боли — постоянная, порой почти незаметная, тупая боль в области образования спайки. Она возникает из-за натяжения и деформации органов. В некоторых случаях может отдавать в окружающие органы, поясницу и ноги. Боль может усиливаться во время половых актов, физических упражнений и длительных нагрузках, переохлаждении, при переполнении мочевого пузыря.
- Нарушение функции органов — сокращение или исчезновение месячных, отсутствие овуляции, невозможность забеременеть.
- В случаях образования спаек с петлями кишечника — запоры, ощущение вздутия, кишечная непроходимость.
Также стоит отметить, что при наличии спаек у женщины вполне возможно усиление болей во время менструации и овуляции. Но стоит учитывать, что в половине случаев спайки не вызывают никаких симптомов и их обнаруживают лишь при УЗИ органов малого таза или визуальном обследовании.
Спайки, образовавшиеся в результате воспаления
Маточные трубы, матка и яичники могут вовлекаться в спаечный процесс, возникающий при воспалении соседних органов (аппендиците – воспалении червеобразного отростка), а также при поражениях тонкого и толстого кишечника. В этом случае сами половые органы страдают мало: спаечный процесс почти не нарушает их внутреннюю структуру. Если же воспаление возникает внутри половых органов, происходит не только образование спаек, но и повреждение самих половых органов.
Наиболее незащищенной в этом отношении является маточная труба — один из самых нежных и тонко устроенных гладкомышечных органов. Она играет ключевую роль в обеспечении зачатия и поддержке беременности в ее начале.
Сперматозоиды, попадающие во влагалище, фильтруются сквозь слизь шейки матки, проходят через полость матки и попадают в маточную трубу. Перистальтика — движения маточной трубы — помогает сперматозоидам попасть в наружную треть (ампулу) маточной трубы, где происходит процесс зачатия. Во время овуляции – выхода яйцеклетки из яичника — маточная труба «засасывает» зрелую яйцеклетку. Если на момент попадания яйцеклетки в маточную трубу там находятся сперматозоиды, происходит оплодотворение, и образовавшийся зародыш в течение нескольких дней движется к полости матки, где произойдет его погружение в слизистую оболочку матки (имплантация). Доставка зародыша в полость матки обеспечивается движениями маточной трубы и активной работой микроресничек маточной трубы.
Таким образом, маточная труба не только обеспечивает транспортировку половых клеток и зародыша, но и создает среду для оплодотворения и развития эмбриона в течение первых 5—6 дней внутриутробного развития. Изменение состава жидкости, которая вырабатывается в маточной трубе, может погубить зародыш. Местный иммунитет внутри маточной трубы минимален, то есть там почти нет механизмов, обеспечивающих отторжение чужеродных веществ, ведь зародыш наполовину чужероден, маточная труба не отторгает его, а избыточная активность иммунной системы неблагоприятна для развития беременности. Вот почему маточные трубы так легко становятся жертвой так называемой восходящей инфекции (попадающей из влагалища и полости матки). Хирургические и диагностические вмешательства в полости матки (аборты, диагностические выскабливания, гистероскопия[2], эхогистеросальпингография[3]) облегчают попадание инфекции в маточные трубы.
Попав в маточные трубы, инфекция сначала поражает слизистую маточной трубы (эндосальпинкс), затем — мышечный слой (миосальпинкс), и только на последнем этапе в воспалительный процесс вовлекается самый наружный слой маточной трубы (перисальпинкс) и возникают условия для образования спаек. Если лечение спаек
запоздало или недостаточно эффективно, после выздоровления остаются не только спайки, но и необратимые повреждения слизистой оболочки трубы и ее мышечного слоя. Реснички исчезают, а на месте гладкомышечных волокон образуется рубцовая ткань. Маточная труба может превратиться в соединительнотканный мешок (сактосальпинкс), т.е. она утрачивает способность продвигать оплодотворенную яйцеклетку. При таких нарушениях устранение спаек не может восстановить функцию маточной трубы, а наличие очага воспалительного процесса приводит к снижению вероятности наступления беременности даже в трубе с противоположной стороны или с помощью оплодотворения в пробирке. В таких случаях для увеличения шансов наступления беременности с помощью ЭКО, которое может быть проведено после выздоровления, приходится удалять всю трубу целиком. В результате воспаления может произойти склеивание и сращение стенок маточной трубы, что приводит к непроходимости трубы для яйцеклетки и также является показанием для разделения спаек или удаления трубы.
Спайкообразование после удаления матки
Опасность образования спаек после удаления матки высока. Эта проблема возникает почти у каждой прооперированной пациентки. Но негативные последствия спаечной болезни проявляются индивидуально. В тяжелых случаях возникают такие осложнения, как непроходимость кишечника, дисфункция близлежащих органов.
После удаления матки образуются физиологические спайки в виде рубцов. Они не вредят органам, если прекращают свой рост и не превращаются в фиброзные тяжи. Последние же склонны к прорастанию в другие органы, нарушая их кровообращение, а значит и функцию. Избавиться от тяжей можно только повторной операцией.
Спайкообразование в послеоперационный период протекает с симптомами, первый из которых – тянущие боли внизу живота. Они чаще всего носят периодический характер, но интенсивны настолько, что заставляют принимать обезболивающее. У больной может подняться высокая температура (до 40С). Болезненная пальпация шва также указывает на начало спаечных процессов. Наблюдаются затруднения при мочеиспускании и запоры. Но ни один из этих симптомов не может с абсолютной точностью указывать на спаечную болезнь. Окончательный диагноз определяется только после инструментального обследования и сдачи ряда анализов.
Первые 2-3 недели дискомфорт в животе и повышенная температура может быть обусловлены физиологическими факторами послеоперационного периода. Но если они не проходят и дальше, то нужно показаться гинекологу.
Послеоперационные спайки
При хирургических вмешательствах спайки образуются вследствие:
- гипоксии или ишемии тканей – недостаточного снабжения тканей кровью и кислородом;
- высушивания тканей во время операции;
- грубых манипуляций с тканью;
- присутствия инородных тел;
- присутствия крови;
- разделения бывших ранее спаек.
К инородным телам, вызывающим образование спаек, часто относятся частицы талька с перчаток врача, мелкие хлопковые волокна с марли или тампонов, шовный материал. Спайки образуются и при эндометриозе. Во время менструации в брюшную полость через маточные трубы может попадать небольшое количество менструальной крови, содержащей живые клетки слизистой оболочки матки (эндометрия). В норме эти клетки удаляются с помощью собственной иммунной системы, но при наличии каких-либо неполадок они приживаются и образуют функционирующие островки эндометрия, которые менструируют внутрь брюшной полости. Вокруг этих очагов и образуются спайки.
Диагностика
Заподозрить наличие спаек в брюшной полости можно у пациенток, в прошлом перенесших воспалительные заболевания малого таза, хирургические операции на органах малого таза и брюшной полости и у женщин, страдающих эндометриозом. Однако только у половины пациенток с наличием более двух факторов риска развития спаечного процесса в анамнезе спайки обнаруживаются во время лапароскопии (операции, во время которой в передней брюшной стенке делают небольшие отверстия, через которые вводят оптический прибор, позволяющий осмотреть полость, и специальные хирургические инструменты).
Гинекологический осмотр позволяет предположить наличие спаечного процесса в брюшной полости с вероятностью 75%. Непроходимость маточных труб по данным гистеросальпингографии (в матку вводят контрастное вещество, производят рентгенологические снимки) и ультразвуковое исследование с большой степенью достоверности указывает на наличие спаечного процесса, однако проходимость маточных труб не позволяет исключить наличия спаек, серьезно препятствующих наступлению беременности. Обычное ультразвуковое исследование не позволяет достоверно обнаружить наличие спаек малого таза. Очень перспективным в диагностике спаечного процесса на сегодняшний день представляется метод ядерного магнитного резонанса (ЯМР, или магниторезонансная томография, МРТ). С помощью этого метода получают снимки, отражающие «состояние дел» на разных уровнях.
Главным методом диагностики спаечного процесса является метод лапароскопии. Он позволяет не только обнаружить наличие спаек и оценить тяжесть спаечного процесса, но и провести лечение спаек
.
Различают 3 стадии спаечного процесса по данным лапароскопии: I стадия: спайки располагаются вокруг маточной трубы, яичника или в другой области, но не мешают захвату яйцеклетки; II стадия: спайки располагаются между маточной трубой и яичником либо между этими органами и другими структурами и могут мешать захвату яйцеклетки; III стадия: происходит либо перекрут маточной трубы, либо ее закупорка спайками, либо полная блокада захвата яйцеклетки.
Лечение спаек
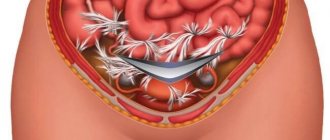
Главным методом лечения спаечного процесса является лапароскопия. С помощью специальных микроманипуляторов производится адгезиолизис — рассечение и удаление спаек. Методы разделения спаек включают в себя лазеротерапию (рассечение спаек при помощи лазера), аквадиссекцию (рассечение спаек с помощью воды, подаваемой под давлением) и электрохирургию (рассечение спаек с помощью электроножа).
Для профилактики образования новых послеоперационных спаек во время лапароскопии могут использоваться следующие методы:
- введение в пространства между анатомическими структурами различных барьерных жидкостей (декстрана, повидина, минеральных масел и пр.);
- окутывание маточных труб и яичников специальными полимерными рассасывающимися пленками.
Кроме того, после проведения лапароскопии в последние годы получила все большее распространение контрольная диагностическая лапароскопия через несколько месяцев после первой лапароскопии.
Как предотвратить возникновение спаек?
Для профилактики и лечения спаек возможно применение ферментных препараты на основе гиалуронидазы. Этот фермент воздействует на «скелет» соединительно-тканных волокон. К сожалению, природная гиалуронидаза, введенная в организм, быстро инактивируется ферментами и ингибиторами плазмы крови , не успевая оказать своего лечебного воздействия.^(3)
Лонгидаза ферментный препарат нового поколения на основе гиалуронидазы—В отличие от ферментных препаратов предыдущего поколения, в его составе гиалуронидаза стабилизирована высокомолекулярным носителем, что позволяет ей оставаться устойчивой к действию ферментов и беспрепятственно оказывать свое лечебное действие. Лонгидаза облегчает движение жидкости в межклеточном пространстве, что приводит к уменьшению отеков, рассасыванию гематом и повышает доступность антибактериальных препаратов к очагу инфекции. Кроме того, снижение вязкости основы соединительной ткани под воздействием препарата увеличивает эластичность спаек, что позволяет уменьшать боли (инструкция к препарату Лонгидаза).
Профилактика
Клеточные и молекулярные механизмы образования спаек в настоящее время довольно хорошо изучены. Поэтому процесс спайкообразования после хирургических операций, в том числе и после лапароскопии, можно резко затормозить с помощью проведения так называемой адъювантной (вспомогательной) терапии. Данная терапия должна начинаться как можно раньше после проведенной операции (в первые дни и часы) и продолжаться несколько недель. Лечения направлено на подавление воспалительной реакции, подавление отложения фибрина в брюшной полости, активацию растворения фибрина.
Адъювантная терапия включает в себя применение следующих препаратов:
- Фибринолитические агенты – вещества, растворяющие фибрин, вокруг которого образуются спайки: ФИБРИНОЛИЗИН, СТРЕПТОКИНАЗА, УРОКИНАЗА, ГИАЛУРОНИДАЗА, ХЕМОТРИПСИН, ТРИПСИН, ТКАНЕВЫЕ АКТИВАТОРЫ ПЛАЗМИНОГЕНА.
- Антикоагулянты – препараты, препятствующие свертыванию крови: препараты ГЕПАРИНА, ОКСАЛАТЫ, ЦИТРАТЫ.
- Антибиотики: ТЕТРАЦИКЛИНЫ, ЦЕФАЛОСПОРИНЫ, СУЛЬФАНИЛАМИДЫ.
- Противовоспалительные средства: кортикостероиды, антигистаминные препараты, нестероидные противовоспалительные препараты, прогестерон, блокаторы кальциевых каналов.
Выбор препаратов и схем лечения зависит от каждого конкретного случая и может быть сделан только лечащим врачом.
Предупреждению послеоперационных спаек посвящены многочисленные экспериментальные, клинические и лабораторные исследования. С учетом этиологических факторов и механизмов формирования послеоперационных спаек для их предупреждения предложены самые разнообразные методы. При этом механизм действия препаратов или применяемых для уменьшения спаечного процесса мер направлен в первую очередь на уменьшение воспаления и экссудации из раневых зон, временное отграничение раневых поверхностей, предотвращение накопления фибрина в брюшной полости, ингибирование пролиферации фибробластов, а также на ферментативную защиту ткани от повреждения при гипоксии [1].
Среди многообразия предлагаемых методов профилактики развития перитонеальных спаек наиболее высокий профилактический эффект дают средства для разобщения раневых поверхностей. Данная группа методов заключается в разделение раневых поверхностей брюшины на срок, необходимый для мезотелизации дефектов (3—8 сут). Противоспаечные барьеры действуют благодаря гидрофлотации, скольжению, механическому разделению поверхностей. Применение противоспаечных барьеров является этиопатогенетическим методом профилактики образования спаек, так как защищает рану от механических повреждений и склеивания ее с соседними органами, оказывает благоприятное воздействие на репаративную регенерацию тканей [2].
На практике к настоящему времени испытано достаточно большое количество различных противоспаечных препаратов. Наиболее широко исследовался раствор декстрана. Препарат декстран-70 апробирован как противоспаечное средство с хорошими экспериментальными и клиническими результатами еще в 80-х годах XX века. Однако при его практическом применении зарегистрированы такие побочные эффекты, как интерстициальный отек, асцит и коагулопатия. По этим причинам использование декстрана как антиспаечного средства не получило одобрения, и его применение в настоящее время весьма ограничено [3].
С противоспаечной целью применялись солевые растворы, которые также создают гидрофлотацию, однако всасываются через поверхность брюшины со скоростью 35 мл/ч, т. е. быстро, и действуют в решающие для формирования спаек только первые 36 ч [4].
Нужно отметить, что в качестве противоспаечного средства апробирован даже мед с хорошими результатами экспериментальных исследований [5].
Наиболее известен как противоспаечный препарат полимер глюкозы — икодекстрин, который является актуальным противоспаечным средством (жидкий барьер) со способностью разделить поврежденные поверхности брюшины и всасываться в течение 3—4 дней, что достаточно для предотвращения раннего формирования спаек. Его 7,5% раствор применяется с целью перитонеального диализа у 4000 больных в год. Известный как препарат Adept, 4% раствор икодекстрина широко применяется как противоспаечное средство в общей хирургии и гинекологии и, по данным ряда авторов, способен уменьшить спайки на 32—52% [6—8].
Полисахариды, выделенные из грибов, дают хорошо известный противовоспалительный эффект, уменьшают спайки в эксперименте, что объясняется модуляцией активатора тканевого плазминогена и активатора плазминогена урокиназного типа [9].
На основе политетрафлуороэтилена, который используется в сосудистых трансплантатах и характеризуется низким тромбообразующим фактором, создан антиспаечный «барьер» Preclude (Gore-Tex Surgical Membrane, W. L. Gore & Associates, Flagstaff, AZ, USA). Этот препарат положительно оценен в одном из исследований и рекомендован для гинекологических операций (The Myomectomy Adhesion Study Group., 1995). Однако Preclude имеет некоторые недостатки, ограничивающие его применение. Они связаны в первую очередь с его гидрофобностью, что приводит к недостаточному прилипанию к тканям. Кроме того, материал не подвержен биодеградации. По этим причинам данный «барьер» должен фиксироваться нитями и остается как инородное тело в брюшной полости навсегда, что естественно повышает риск спайкообразования и развития инфекции в отдаленном послеоперационном периоде [10].
Соединения гиалуронидазы широко применяются как противоспаечные средства. Гиалуронидаза представляет собой гликозаминагликан, в норме обнаруживается в разных тканях, в синовиальной и брюшной жидкостях. Как естественное биологическое соединение организма, имеющее иммунологическую совместимость, оно наиболее удобно в качестве противоспаечного средства. В клинических исследованиях доказана эффективность применения только гиалуронидазы, а также ее соединений с железом, карбоксиметилцеллюлозой (КМЦ). Барьеры, созданные на основе гиалуронидазы кроме противоспаечного дают также противовоспалительный эффект, увеличивают возможности пролиферации мезотелиальных клеток [11, 12]. Из средств, созданных на основании гиалуронидазы, более распространено ее соединение с КМЦ и двумя анионическими полисахаридами, известное под названием Seprafilm («Genzym Corporation», USA). Это биорассасывающаяся мембрана, которая является нетоксичной, неиммуногенной, биологически совместимой. Используется в виде пленки и покрывает травмированные поверхности. Мембрана превращается в гель в течение 24—48 ч, но остается на месте размещения до 7-х суток. Полностью рассасывается к 28-му дню, не требует фиксации швами, эффективна в присутствии крови. Seprafilm значительно уменьшил степень и серьезность послеоперационных спаек в разнообразных экспериментах и в рандомизированных клинических исследованиях в гинекологии, общей хирургии. Препарат получил одобрение на использование в клинике в европейских странах и в Северной Америке [13]. Доказана его эффективность как в экспериментальных, так и клинических исследованиях. Однако Seprafilm довольно дорогой, а воздействие гиалуронидазы может привести к несостоятельности анастомозов, образованию абсцессов, воспалительным реакциям [14]. Остаются еще дискутабельными утверждения о том, что Seprafilm может уменьшить частоту спаечной непроходимости кишечника [15].
Другая разновидность гиалуронидазы — соединение с железом в виде пасты — препарат Intergel («Life Core Biomedical corporation») в настоящее время не применяется, а в литературе о нем имеются отрывочные сведения [16].
Оксидированная регенерированная целлюлоза, известная как противоспаечный барьер Interceed («Ethicon Inc., Somerville», NJ, USA), представляет собой мембрану, которая полностью рассасывается в течение 28 дней. Препарат начал использоваться с конца 80-х годов XX века при гинекологических операциях, экспериментальное и клиническое применение показало уменьшение количества и выраженности послеоперационных спаек. Широкое применение препарата ограничено уменьшением эффективности в присутствии крови или избытка перитонеальной жидкости. Необходимость добиваться тщательного гемостаза перед применением Interceed, как полагают, обусловлена осаждением фибрина между волокнами ткани [17].
КМЦ в экспериментальных работах проявила противоспаечные свойства при применении как в виде монотерапии, так и в сочетании с низкомолекулярным гепарином и активатором тканевого плазминогена. Однако в чистом виде КМЦ в клинике не применяется, т. е. коммерческих препаратов КМЦ для лечения спаек в брюшной полости нет. Несмотря на положительные свойства геля КМЦ, на практике он используется как вспомогательное вещество. На конгрессе хирургов в Атланте в 1999 г. сообщалось, что противоспаечная эффективность КМЦ выше при сочетанном применении с другими противоспаечными препаратами [10, 18].
Недавно появились сообщения о новой мембране Oxiplex («FzioMed, Inc.», San Luis Obispo, CA), которая состоит из КМЦ и оксида полиэтилена. Препарат снижает послеоперационное спайкообразование в эксперименте на кроликах, а также в условиях перитонита у крыс [13].
Когда во время операции повреждается слой сурфактанта брюшины, для поддержания эффекта смазки между органами и брюшной стенкой можно добавить фосфолипиды. В клинических работах с целью профилактики спаечной болезни еще не применялись фосфолипиды, однако в экспериментальных работах применение фосфатидилхолина привело к хорошим результатам как при перитоните, так и без него, без отрицательного влияния на заживление раны или анастомозов [7].
Spraygel, созданный на основе полиэтиленгликоля, представляет гидрогель, который формируется смешиванием двух жидкостей, образующаяся пена прилипает к органам, создает вязкую оболочку, предотвращает соприкосновение поврежденных поверхностей и образование спаек. Spraygel оказался эффективным в экспериментальных работах, с успехом был применен в гинекологической практике [19].
Для профилактики образования спаек применяются также разные виды политетрафлуороэтилена — брюшинная пленка Preclude («WI Core corporation»), хирургическая оболочка Gore-Tex, сетка Dual-Mesh. Однако в настоящее время эти пленки и сетки не имеют широкого практического применения [20].
Несмотря на отсутствие результатов клинических исследований, в экспериментах получены довольно обнадеживающие результаты применения биоактивных полипептидов, как например поли-L-лизин. Сочетание поли-L-лизин—поли-L-глутамат в экспериментах предотвращает образование спаек с брюшиной без влияния на макрофаги, на прочность и герметичность анастомозов. В экспериментах выявлена также способность биоактивных полипептидов уменьшить кровотечение [4, 21].
В экспериментальных работах в качестве противоспаечного барьера применяются также коллагеновая пленка, созданная на основе тромбина желатиновая пленка, полилактинкислотная пленка [22]. Для экспериментальных и клинических исследований новые горизонты открываются внедрением трансплантации мезотелиальных мембран и применением стволовых клеток на участках поврежденного мезотелия [23].
По мнению некоторых авторов, эффективным средством против спаек может служить аллогенная брюшина с сохраненными противоспаечными и противомикробными свойствами. Аллогенную брюшину можно прикрепить к брюшной стенке с помощью медицинского клея Sulfacrilat. В данном случае лапароскопический адгезиолизис и прикрепление пленки с помощью эндовидеохиругической техники значительно уменьшают повреждение тканей, обеспечивают хорошие результаты [24].
Оригинальный подход продемонстрировали авторы, предложившие создать в брюшной полости щелочную среду с помощью фосфат-цитратного буфера с pH 5,6. Они основывались на факте, что одновременно со снижением pH среды активность тромбина тоже резко снижается, а при pH 5,6 последняя стремится к нулю, следовательно, это предотвращает переход фибриногена в фибрин [24].
Таким образом, отдельное применение противоспаечных средств местного и общего влияния в большинстве клинических исследований не привело к удовлетворительным результатам, а некоторые препараты так и не вышли из стадии экспериментальных исследований. Множество нерешенных вопросов осталось в патогенезе спаечной болезни и в области методов лечения, патогенетически обоснованных [25].
В экспериментальных работах нами обнаружено значительное, однако неубедительное уменьшение объема спаек под воздействием метиленового синего, аллопуринола, витамина Е [25].
Таким образом, противоспаечные «барьеры» можно разделить по агрегатному состоянию на пять групп: 1) газы (воздух, кислород, гелий и т. д.); 2) аэрозоли (лекарственные взвеси); 3) жидкости (декстраны, гемодез, физиологический раствор и т. д.); 4) гели (гиалуроновая кислота, КМЦ, фосфотидилхолин, фибриновый клей и т. д.); 5) твердые вещества: А — пленки (Seprafilm, Interceed, Sepracoat); Б — мембраны (Gora-Teflon) [13].
Перспективным методом профилактики образования послеоперационных спаек считается применение барьерных методов из ареактивных, биодеградирующих материалов. Имеющиеся «барьеры» являются твердыми, полутвердыми или жидкими средствами. Многие «барьеры» разжижаются в организме через какое-то время. Биосовместимые абсорбируемые гелевые барьеры безопасны и эффективны. Их легко применять и быстро приспособить к поврежденным тканям без фиксации. Использование барьеров отличается от других методов тем, что они сами не влияют на процесс заживления, а потенциально разделяют противоположные поверхности во время заживления [26].
На основе большого клинико-экспериментального опыта по разработке и применению разнообразных средств для предупреждения образования послеоперационных спаек хирургами и исследователями сформулированы требования к веществам, которые могут быть использованы с этой целью. Идеальный барьер, характеризуясь высокой безопасностью и эффективностью, не должен вызывать воспаления, иммунной реакции, должен сохраняться на протяжении критической фазы ремезотелизации, удерживаться на месте без швов и скрепок, оставаться активным в присутствии крови и быть полностью рассасываемым. Кроме того, он не должен нарушать заживление, провоцировать инфекцию, онкологические процессы и вызывать спайки. Барьерные средства должны использоваться интраперитонеально во время или в конце операции [27].
В настоящее время в обращении имеются следующие барьерные средства:
— Interceed («Johnson a. Johnson/Ethicon corporation») — оксид регенерированной целлюлозы. Имеет форму вязаной ткани с небольшими размерами пористости, не требует подшивания к поврежденным тканям и превращается в гель приблизительно через 8 ч. Материал обычно абсорбируется в течение 4 дней; в случае размещения его несколькими слоями абсорбция происходит в пределах 4 нед. Interceed должен полностью закрыть травмированный участок, при этом требуются тщательный гемостаз и удаление промывной жидкости, иначе эффективность его теряется. В настоящее время он одобрен для употребления только при гинекологических хирургических процедурах [28];
— Фибриновый клей — комбинация высококонцентрированного фибриногена, тромбина, кальция и фактора VIII. Благодаря уплотняющему эффекту фибриновый клей отделяет обнаженные поверхности. Однако использование крови человека для производства клея ограничивает его применение как хирургического лечебного средства;
— Seprafilm («Gemnzyme corporation») — модифицированная гиалуроновая кислота и КМЦ, которая представляет собой биорезорбируемый прозрачный гибкий мембранный барьер и применяется к потенциально адгезиогеничной ткани во время операции перед закрытием брюшной полости. Он хорошо прилегает к влажным тканям, поэтому полный гемостаз необязателен. Seprafilm превращается в гель приблизительно за 24—48 ч после размещения, рассасывается в пределах 28 дней и не требует повторной операции для удаления [28];
— Preclude («Wl Gore corporation») сделан из Gore-Tex — политетрафторэтилена. Он не разжижается и требует удаления путем повторной операции.
— Gore-Tex, по данным C. Farquhar и соавт. [17], превосходит Interceed в предотвращении формирования спаек, но полноценность его ограничена необходимостью наложения швов и в дальнейшем удалении мембраны;
— Flo-Gel («Alliance Pharmaceutical corporation») — гель, состоящий в основном из Poloxamer-407, при температуре ниже температуры тела находится в форме жидкости, а при температуре тела переходит в гель;
— Hyskon («Medison Pharmaceuticalis corporation») — 32% раствор декстрана-70, водорастворимый полимер глюкозы, абсорбируется от 5 до 7 дней;
— Adcon P («Gliatech») — гель, абсорбируемый в организме в пределах 4 нед;
— Repel и Resolve («Life Medical Sciences company») — биорезорбируемая полимерная пленка и вязкий гель;
— Intergel («Life Core Biomedical corporation») — комбинация железа и гиалуроновой кислоты, применяется только при гинекологических операциях, как и Interceed;
— Incert («Anika Therapeutick Inc Woburn MA») — дериват гиалуроновой кислоты;
— Seprocoat («Hal-C Grenzyme corporation») — раствор, применяемый после вскрытия брюшной полости, в ходе операции путем ирригации каждые 30 мин;
— Oxiplex («FzioMed») — оксид полиэтилена и КМЦ в виде пленки, может применяться при лапароскопических операциях, легко скручивается и вводится через 5-миллиметровый троакар, легко расправляется на тканях [15];
— Adhibit («Angiotech Pharmaceuticals») — cамополимeзирующийся жидкий распыляемый гидрогель, идеально подходящий для применения в ходе эндовидеохирургических операций. Гидрогель метаболизируется организмом менее чем за 30 дней и наиболее часто применяется в гинекологической практике при лапароскопических операциях;
— Adept («Shire Pharmaceuticals Ltd») — невискозный раствор 4% икодекстрина, новый полимер раствора глюкозы, используется во время и после вмешательства для орошения и вливания при лапароскопических и лапаротомных операциях. Невязкая жидкость не ослабляет видимость при работе. Эффективный расход — в пределах 500 мл для орошения и 1000 мл для вливаний;
— Мезогель («Линтекс», Россия) — противоспаечный рассасывающийся гель. Действует как искусственный временный «барьер» между поврежденными серозными поверхностями, обеспечивая их эффективное разделение на время заживления, а затем рассасывается. Уменьшение слипания поверхностей органов и тканей способствует сохранению их подвижности и препятствует образованию спаек. По окончании действия гель полностью выводится из организма. При нанесении на здоровые участки тканей гель способствует уменьшению их высушивания за счет образования защитного гидрофильного слоя [26].
Имеющиеся «барьеры» не являются панацеей, поиск новых средств продолжается. K. Treutner и соавт. [26] предлагают направлять научные усилия на поиск жидких субстанций для однократного интраперитонеального применения, которые значительно уменьшат частоту формирования послеоперационных спаек при разумной стоимости, без неблагоприятного действия на свертывающую систему крови и процессы заживления раны.
С вышеозначенных позиций перспективным является препарат Гуардабрида («Hangzhou Singclean Medical Products Co. Ltd.», Китай). Клиническая верификация с участием 30 пациентов продемонстрировала, что Гуардабрида оказывает выраженное профилактическое действие в отношении послеоперационных спаек, не вызывает клинических нежелательных реакций и может быть рекомендована для широкого применения. Механизм действия заключается в его «барьерных» свойствах. Гель действует как временный искусственный барьер между поврежденными поверхностями, обеспечивая их эффективное разделение на время заживления. Уменьшение слипания поверхностей органов и тканей способствует сохранению их подвижности и препятствует образованию спаек. Для применения до окончания операции при соблюдении правила асептики вскрывается наружная упаковка и извлекается шприц. Гель распределяется тонким равномерным слоем на поверхности обрабатываемых органов в местах риска возникновения послеоперационных спаек. Дозировка и количество вводимого геля зависят от области применения и определяется индивидуально лечащим врачом [29].
В заключение следует отметить, что результативность мер по профилактики послеоперационного спаечного процесса зависит от уровня травматичности хирургического пособия, наличия сопутствующего воспалительного процесса, экстрагенитальных очагов инфекции, вида применяемого противоспаечного препарата. Поиски более эффективных противоспаечных компонентов и средств на уровне молекулярной биологии клеток продолжаются [26].
Если лечение спаек не помогает
К сожалению, лапароскопия не может решить всех проблем, связанных со спаечным процессом. Можно освободить внутренние половые органы от спаек, но нельзя восстановить структуру и функцию маточных труб. Поэтому в случае ненаступления беременности в течение нескольких месяцев после проведенной лапароскопии следует подумать о переходе к более радикальным методам лечения бесплодия. Экстракорпоральное оплодотворение[4]
(ЭКО) один из самых известных методов оплодотворения в пробирке.
Для повышения эффективности экстракорпорального оплодотворения (ЭКО) принимают во внимание следующее: 1. Наличие сактосальпинксов (отграниченное скопление жидкости в маточной трубе) резко снижает эффективность метода ЭКО. Сактосальпинксы удаляют с помощью лапароскопии. 2. Перед процедурой экстракорпорального оплодотворения (ЭКО) желательно пройти специальное иммунологическое обследование, позволяющее повысить шансы приживления зародышей.
[1]
Маточная труба – тонкая полая трубка, отходящая от матки, соединяющая полость матки с брюшной полостью. После того, как яйцеклетка выходит из яичника в брюшную полость, она по маточной трубе попадает в полость матки. [2]Гистероскопия — введение в матку специального оптического прибора, который позволяет осмотреть матку изнутри. [3]Гистеросальпингография – введение в матку рентген-контрастного вещества с проведением серии рентгеновских снимков. [4]Экстракорпоральное оплодотворение (ЭКО) — сравнительно молодой метод лечения бесплодия. Впервые он был применён в Англии в 1978 году. Суть экстракорпорального оплодотворения состоит в том, что яйцеклетка оплодотворятся и развивается вне матки и в нее переносится уже эмбрион (состоящий иногда лишь из нескольких клеток) для вынашивания ребенка. Теги: бесплодие