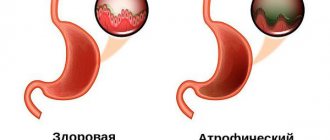
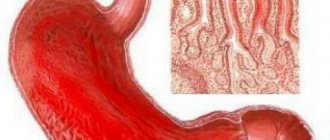
Виды диффузного гастрита
Диффузный гастрит классифицируется на два основных вида — поверхностный и хронический тип. Данные разновидности болезни отличаются степенью поражения слизистых оболочек желудка, риском осложнений и симптоматикой.
Определение конкретной формы патологии происходит путем комплексного обследования пациента. На ранних этапах развития воспаления выявить недуг самостоятельно нельзя.
Диффузный поверхностный гастрит
Поверхностный диффузный гастрит считается легкой стадией патологии. Воспалительный процесс поражает только верхние слои слизистых оболочек желудка. Функциональное состояние органа не нарушается. Клетки сохраняют способность к регенерации. Симптоматика воспаления проявляется в минимальной степени. Патологический процесс полностью поддается корректировке с помощью медикаментозной терапии и соблюдения специальной диеты.
При поражении антрального отдела желудка появляются боли через 1,5–2 часа после еды или так называемые голодные боли.
Особенности заболевания:
- выявление патологического процесса не затрудняется (в некоторых случаях определение воспалительного процесса происходит при проведении плановых медицинских осмотров);
- если поверхностную форму гастрита не лечить, то заболевание может стать хроническим (симптоматика усилится, возникнет функциональное отклонение в работе пищеварительного тракта);
- данный тип воспалительного процесса не исключает риск образования раковых клеток.
Хронический диффузный гастрит
При хронической форме диффузного гастрита воспаление распространяется на глубокие слои тканей желудка. Постепенно развивается нарушение функционального состояния органа. Расстройства системы пищеварения становятся устойчивыми и прогрессирующими. Симптоматика такого типа заболевания сопровождается выраженным болевым синдромом и ухудшением общего состояния организма. Периоды обострения сменяются ремиссией.
Особенности болезни:
- воспаление приводит к необратимым нарушениям в строении и функционировании желудка;
- у пациента наблюдаются регулярные приступы рвоты или тошноты, боль в органах пищеварения в ночное время суток или после еды;
- отсутствие своевременной терапии становится причиной серьезных осложнений (язвенная болезнь, риск желудочно-кишечных кровотечений).
Рефлюкс-гастрит
- Главная
- >
- Пациентам
- >
- Болезни ЖКТ
- >
- Гастриты
- >
- Рефлюкс-гастрит
Нередко появляется «заеда» на губах, сухость кожи, анемия и слабость в теле.
Такой диагноз объединяет большую группу больных с дуоденогастральным рефлюксом (ДГР), т.е. забросом содержимого ДПК, содержащего очень агрессивную желчь, в желудок. ДГР может быть вызван приёмом нестероидные противовоспалительные препараты (см. лекарственные болезни), результатом хирургического воздействия (резекция желудка).
Дуоденогастральный рефлюкс обусловлен недостаточностью замыкательной функции привратника, хроническим дуоденитом и повышением давления в двенадцатиперстной кишке (ДПК). Выявляется такое нарушение моторики при помощи антродуоденальной манометрии
.
ДГР ведёт к поражению слизистой оболочки желудка, преимущественно антрального отдела, желчными кислотами, их солями, панкреатическими ферментами, лизолецитином и другими компонентами содержимого ДПК.
Диагностика рефлюкс-гастрита
Очень важно не ставить диагноз только на основании симптомов. Необходимо пройти тщательное обследование. Следует выполнить биохимический и общий анализ крови, фиброгастродуоденоскопию (ФГДС), ультразвуковое исследование печени, желчного пузыря и поджелудочной железы, биопсию, рентгеноскопию желудка и двенадцатиперстной кишки. Диагностировать ДГР можно при помощи проведения суточной рН-метрии
желудка. На рис. 1 показана рН-грамма тела желудка пациента с ДГР, полученная на приборе
«Гастроскан-24»
.
Рис. 1. Суточная рН-грамма тела желудка, подъём рН до щелочных величин ночью свидетельствует о наличии ДГР
Лечение рефлюкс-гастрита
Лечение рефлюкс-гастрита зависит от основного причинного фактора и направлено, в первую очередь, на нормализацию моторики желудочно-кишечного тракта и связывание жёлчных кислот. Так как желчные кислоты и лизолецитин оказывают повреждающее действие только при наличии соляной кислоты, то, в зависимости от выраженности клинических проявлений, могут быть использованы ингибиторы протонной помпы.
Для предотвращения заброса в желудок содержимого ДПК назначают прокинетики.
Для нейтрализации жёлчных кислот, оказывающих повреждающее действие на слизистую оболочку желудка, применяют урсодеоксихолиевую кислоту.
Материалы для пациентов
На сайте GastroScan.ru имеются материалы для пациентов по различным аспектам гастроэнтерологии:
- «Советы врачей» в разделе сайта «Пациентам»
- «Популярная гастроэнтерология» в разделе «Литература»
- «Популярная гастроэнтерология» в разделе «Видео»
Материалы для профессионалов здравоохранения, затрагивающие диагностику и лечение рефлюкс-гастрита
Статьи
- Минушкин О.Н., Зверков И.В., Скибина Ю.С. Некоторые подходы к лечению больных хроническим (билиарным) рефлюкс-гастритом // Медицинский алфавит. 2022. №19. Т. №2. С. 28–31.
- Лапина Т.Л., Картавенко И.М., Ивашкин В.Т. Патогенетическое и терапевтическое значение желчных кислот при рефлюкс-гастрите // РЖГГК. 2015. № 1. С. 86–93.
- Бабак О.Я. Желчный рефлюкс: современные взгляды на патогенез и лечение // Сучасна гастроэнтерологiя. – 2003. – № 1 (11). — С. 28-30.
- Минушкин О.Н., Зверков И.В. Хронический гастрит // Лечащий врач. – 2003. – № 5. – с. 24–31.
- Галиев Ш.З., Амиров Н.Б. Дуоденогастральный рефлюкс как причина развития рефлюкс-гастрита // Вестник современной клинической медицины. – 2015. — Т. 8. — Вып. 2. С. 50-61.
- Причины хронических гастритов. Украинский медицинский портал Eurolab. — 2007.
На сайте GastroScan.ru в разделе «Литература» имеется подраздел «Гастриты, дуодениты, эрозии», содержащий публикации для профессионалов здравоохранения по данной тематике.
Видео
Эмбутниекс Ю.В. Ведение больных с билиарным рефлюкс-гастритом и эзофагитом
Кадр из видео: Шумков Ю.П. Билиарный рефлюкс
На сайте в разделе «Видео» имеется подраздел «Для врачей», содержащий видеозаписи докладов, лекций, вебинаров по различным направлениям гастроэнтерологии для профессионалов здравоохранения.
Причины
Спровоцировать развитие диффузного гастрита могут многочисленные факторы. Риск тяжелых форм заболевания возникает при наличии сопутствующих болезней пищеварительной системы. Основной причиной недуга является регулярное раздражение слизистых оболочек желудка. Происходить такое воздействие может при нарушении режима питания, передозировке сильнодействующими медикаментами.
Местный иммунитет ослабляется при заражении организма патогенными бактериями или вирусами.
Основные причины:
- регулярное нарушение режима питания;
Как и большинство заболеваний, эффективность лечения которых зависит от ранней терапии. - наличие в рационе большого количества жирных или острых блюд;
- осложнения после хирургического вмешательства;
- инфекционное заражение пищеварительной системы;
- бесконтрольный прием некоторых видов медикаментов;
- нарушение режима сна и бодрствования;
- осложнения после перенесенных пищевых отравлений;
- постоянные стрессовые ситуации;
- пищевая аллергия и ее осложнения;
- последствия жизнедеятельности хеликобактер пилори;
- злоупотребление вредными привычками;
- частое употребление алкогольных напитков.
Поверхностный гастрит
30.04.2021
Поверхностный гастрит — это воспаление слизистой желудка, вызванное нарушением секреторной функции желудка. На данный момент это заболевание достаточно распространено и наблюдается практически у половины населения планеты. Поверхностный гастрит не является сложным заболеванием, поэтому, если вовремя спохватиться, вылечить его можно в короткие сроки, однако, если он принял запущенную форму, то лечение может затянуться, а само воспаление приведет к более тяжелым формам заболевания.
Причины возникновения поверхностного гастрита
Одной из самых вероятных причин появления и развития поверхностного гастрита является бактерия Helicobacter pylori, которая поражает стенки желудка и в запущенной стадии может привести к язве и даже раку желудка. Однако если после сдачи теста эту причину исключили, есть также следующие:
- нарушенный режим питания;
- перекус пищи на ходу, плохое пережевывание пищи и еда всухомятку;
- вредные привычки (чрезмерное употребление алкоголя, курение);
- употребление в пищу чересчур острых, перченых блюд, злоупотребление специями;
- постоянные стрессовые ситуации;
- неблагоприятные факторы окружающей среды (работа на вредном производстве, постоянный контакт с пылью, металлами и т.д.);
- патологическая аллергия;
- частое и бесконтрольное употребление медикаментов.
Симптомы поверхностного гастрита
Зачастую поверхностный гастрит может сильно себя не проявлять. Он развивается постепенно и порой не всегда на начальной стадии можно определить именно это заболевание. Безусловно, самостоятельно понять, есть ли поверхностный гастрит, невозможно — это может определить только гастроэнтеролог после ознакомления с анализами. Однако есть несколько симптомов, которые возникают при появлении поверхностного гастрита и свидетельствуют о том, что пора обращаться за помощью к специалисту. Среди таких симптомов наиболее частыми являются следующие:
- вздутие живота после приема пищи;
- приступы тошноты, а затем и рвоты;
- частые приступы изжоги и отрыжка;
- бледная кожа, ломкие волосы и ногти;
- налет на языке, чаще всего белого либо серого цвета;
- неприятный привкус во рту и запах изо рта, отдающий горьким или кислым;
- ощущения боли в желудке по ночам.
Каждый из этих симптомов может также свидетельствовать о наличии другого заболевания, поэтому если такие сигналы стали появляться слишком часто, лучше обратиться к врачу.
Лечение и профилактика
Лечение поверхностного гастрита включает в себя прием медикаментозных средств и строгую диету. В зависимости от причины, которой было вызвано воспаление, необходимо в первую очередь избавиться от нее, а затем приступать к лечению самого заболевания.
Медикаментозное лечение должно быть назначено только специалистом и включает комплекс средств, обволакивающих желудок и снимающих воспаление.
Что касается диеты, об этом также лучше проконсультироваться с врачом. Чаще всего при поверхностном гастрите рекомендуется полное исключение алкоголя, кофе, жирной молочной продукции, слишком жареных, соленых и острых блюд. Предпочтение в еде лучше отдавать супам, кашам, отварным мясу и рыбе, а также перетертым овощам, прошедшим термическую обработку.
Поверхностный гастрит — не настолько страшен, однако самое главное, как и в любом заболевании, вовремя обратиться к врачу, чтобы избежать возможных осложнений.
Опубликовано в Гастроэнторология Премиум Клиник
Симптомы
Симптоматика диффузного гастрита на разных стадиях развития воспалительного процесса отличается. На начальном этапе заболевание проявляется минимальным дискомфортом в системе пищеварения. У пациента возникают приступы изжоги, тошноты после приема пищи. Развитие воспаления становится причиной усиления симптомов.
Заболевание проявляется в значительном ухудшении общего состояния организма и нарушением функционирования желудочно-кишечного тракта.
Другие симптомы:
- регулярные нарушения процесса опорожнения кишечника;
- метеоризм;
- неприятный запах изо рта;
- приступы тошноты или рвоты;
- признаки авитаминоза;
- серый или желтый налет на языке;
- общая слабость организма;
- болевой синдром различной интенсивности;
- регулярные приступы изжоги.
Диагностика
При подозрении на диффузный гастрит следует обращаться к гастроэнтерологу. После сбора анамнеза и первичного осмотра пациента врач назначает комплекс лабораторных и инструментальных процедур. Необходимость дополнительной консультации с профильными специалистами может возникнуть при подозрении на осложнения или патологии смежных систем организма.
Методы диагностики:
- общий анализ мочи и крови;
- исследование каловых масс на скрытую кровь;
- биохимические анализы крои и мочи;
- гастроэндоскопия;
- УЗИ желудка;
- фиброгастроскопия;
- рентген желудка;
- исследование желудочного сока.
Важно понимать, что только врач может поставить вам правильный диагноз.
Введение
Гастроэзофагеальная болезнь (ГЭРБ) считается одним из самых распространенных гастроэнтерологических заболеваний во всем мире [1–3]. Возрастающая частота ГЭРБ и в развивающихся, и в развитых странах остается глобальной медицинской проблемой. Различные состояния, такие как ожирение, аксиальная грыжа, несостоятельность нижнего пищеводного сфинктера (НПС), преходящие релаксации НПС, повышенная кислотопродукция желудка, увеличение интрагастрального давления и пролонгация пищеводной кислотной экспозиции, служат фактором риска развития ГЭРБ [4, 5]. Однако механизмы ГЭРБ остаются не полностью выясненными [1, 6], а симптомы ГЭРБ не всегда связаны с наличием или отсутствием эрозивного эзофагита [7]. Приблизительно у 35% [8] и даже у 50% пациентов эрозивный эзофагит протекает бессимптомно [9]. Остается неполностью выясненной связь между инфекцией Helicobacter pylori и ГЭРБ. Имеются предположения как о патогенной [10], так и о протективной роли H. рylori в генезе ГЭРБ [11], подтвержденные не всеми исследователями [12].
Исходя из того, что примерно у 75% населения старше 40 лет выявляются два и более заболевания, протекающих одновременно [13], возникает вопрос о функционально-морфологических связях между выраженностью гастрита и дуоденита по гистологическим признакам и стадией ГЭРБ при коморбидности с такими кислотозависимыми заболеваниями, как язвенная болезнь двенадцатиперстной кишки (ЯБДПК) и язвенная болезнь желудка (ЯБЖ), включая и период после эрадикации H. рylori [10, 14].
Цель исследования: выявление связей между патогистологическими критериями выраженности гастрита и дуоденита, и стадией ГЭРБ, коморбидной с другой кислотозависимой патологией, и дополнительное определение моторно-секреторных изменений гастродуоденального (ГД) комплекса для выявления мишеней лечебно-профилактических воздействий.
Методы
Дизайн – исследование серии случаев. Оценка результатов была проведена в отношении 305 больных в возрасте от 18 до 69 лет (224 мужчины и 81 женщина, средний возраст – 42,6±0,8 и 42,8±1,3 года соответственно). Критерием включения в исследование стало наличие гастроэзофагеального рефлюкса (ГЭР), который подтверждался жалобами на изжогу и/или регургитацию соляной кислоты с частотой не меньше 1 раза в неделю [15] у больных ЯБДК и ЯБЖ в стадии ремиссии и хроническим панкреатитом. Критерии исключения: возраст старше 80 лет, наличие инфекционной, сердечно-сосудистой, эндокринной и онкологичской патологий, а также беременности.
Обследование пациентов, обратившихся за консультативной помощью с 2012 по 2022 г., проведено амбулаторно, а также в условиях стационара на базе клиники кафедры хирургии № 3 Кубанского государственного медицинского университета. Помимо общеклинического, лабораторных и инструментальных методов обследования, включая проведение максимального пентагастринового теста, все пациенты подверглись эзофагогастродуоденоскопии (ЭГДС) со взятием биоптатов из СО двенадцатиперстной кишки (ДПК), антрального отдела желудка (АОЖ) и тела (фундального отдела) желудка (ФОЖ) для гистологического, морфометрического исследований и определения инфицированности H. pylori, а также эндоскопической манометрографии методом открытого постоянно перфузируемого катетера. Во время ЭГДС, исходя из 2-го пересмотра Лос-Анджелесской классификации, определяли следующие степени состояния СО пищевода: N – отсутствие изменений; M – минимальные изменения; А – одна или более эрозий <5 мм; В – одна или более эрозий >5 мм; С – больше одной эрозии, распространяющейся за пределы двух складок; D – эрозии располагаются на всей окружности пищевода [16]. Изменения СО пищевода N–M-степеней относили к неэрозивной язвенной болезни (НЭРБ); рефлюкс-эзофагит A–D-степеней – к ГЭРБ. Морфологическое состояние ГД СО оценивали в срезах, окрашенных гематоксилином и эозином с раздельной оценкой (0–3-й степеней выраженности в баллах) воспалительной (мононуклеарной) инфильтрации, кишечной (или желудочной) метаплазии и железистой атрофии. Инфицированность H. pylori определяли в препаратах, окрашенных по Гимзе, выделяя 3 степени обсемененности: 1) слабую, до 20 микробных тел в поле зрения (п/з); 2) среднюю, 20–50 микробных тел в п/з; 3) сильную, более 50 микробных тел в п/з. Эндоскопическая манометрография (регистрацию полостного давления – Р в ДПК, пилорическом канале, АОЖ, теле желудка, в НПС и пищеводе) выполнена методом открытого постоянно перфузируемого катетера (после аспирации воздуха из желудка), последовательно протягивая его со скоростью не более 1 cм/с из ДПК в пищевод с задержками в сегментах максимальной активности привратника и НПС. Секреторную деятельность желудка изучали зондовым способом в межпищеварительном периоде (базальная выработка кислоты – БВК) и в ответ на максимальную стимуляцию (пиковая выработка кислоты – ПВК) пентагастрином (6 мкг/кг, п/к).
Для проведения дифференциальной межэтиологической диагностики морфологических и функциональных ГД-изменений в зависимости от стадии ГЭРБ были сформированы отдельные подгруппы, сопоставимые по полу и возрасту: пациенты с ЯБДПК и ЯБЖ, а также с коморбидной ГЭРБ смешанного генеза. От участников исследования было получено письменное информированное согласие, а также согласие на обработку персональных данных.
Статистическую обработку проводили, используя программы MS Excel 10 и Wizard-Statistics (США) с предварительной оценкой правильности математического распределения в соответствующих выборках (критерий Колмогорова). При нормальном распределении в сравниваемых группах использовали критерий Стьюдента (t-критерий) с представлением данных в виде среднего значения (Х), стандартной ошибки среднего значения (m) и указаний статистически значимого уровня p<0,05. В выборках с неправильным распределением использовали χ2-критерий, критерии Крускалла–Уоллиса, Манна–Уитни. Анализ корреляционных зависимостей проводили с расчетом коэффициентов корреляции по Пирсону или Спирмену, а дисперсионный анализ – однофакторным методом ANOVA.
Результаты
В структуру обследуемой когорты вошли 305 пациентов, имевших следующие коморбидные заболевания (с разной степенью эзофагита): 62 – ГЭРБ и ЯБДПК (А – 42, В – 7, С – 13), 12 – ГЭРБ и ЯБЖ (А – 8, В – 2, С – 2) и 6 – ГЭРБ и хронический панкреатит (А – 3, В – 3); среди пациентов с N- и M-степенями НЭРБ были 180 больных ЯБДПК (N – 111; M – 69), 16 – ЯБЖ (N – 9; M – 7), 6 – сочетанием ЯБДПК и ЯБЖ (N – 3; M – 3) и 23 – хроническим панкреатитом (N – 9; M – 14) (рис. 1).
Необходимо отметить, что выявленный нами параллелизм между степенями воспаления (в баллах) ГД СО по эндоскопическим данным и результатам гистологических заключений подтверждался прямой корреляцией (коэффициент Пирсона и t-критерий соответственно) между следующими диагностическими критериями:
а) выраженность дуоденита по эндоскопическим данным и такими гистологическими критериями, как инфильтрация (p<0,001; p<0,001), желудочная метаплазия (p<0,001, p<0,001) и атрофия ДПК (p<0,001, p<0,001); б) выраженность антрального гастрита по эндоскопическим данным и по таким гистологическим данным, как инфильтрация (p=0,006, p=0,019) и атрофия АОЖ (p<0,001, p<0,001); в) степень гастрита тела желудка по эндоскопическим данным и выраженности воспалительной инфильтрации (p<0,001, p<0,001), кишечной метаплазии (p<0,001) и атрофии СО (p<0,001).
Далее оказалось, что у больных с различной степенью поражения СО пищевода (N – 138, M – 87, A – 56, B – 8 и C – 16 человек) степень инфицированности H. pylori в СО ДПК, АОЖ и тела желудка не обнаружила статистически значимых различий. Необходимо отметить, что в большинстве исследований не было выявлено причинной взаимосвязи и прямой корреляции между инфекцией H. pylori и ГЭРБ [18, 19].
Проведенный нами анализ показал, что по сравнению с пациентами с N-степенью НЭРБ только у пациентов с С-степенью ГЭРБ имелись статистически значимые различия в выраженности:
- гастрита тела желудка;
- антрального гастрита по эндоскопическим признакам;
- дуоденита по эндоскопическим;
- гистологическим данным за счет преобладания желудочной метаплазии и желудочной атрофии (рис. 2).
Таким образом, при выраженном рефлюкс-эзофагите степени С воспалительные изменения проявлялись в луковице ДПК в более выраженной степени, чем в АОЖ и теле желудка. По нашим данным, только при ГЭРБ степени С величина межпищеварительной БВК достигала статистически значимых различий по сравнению с величинами БВК у пациентов с М- и N-степенями НЭРБ и A- и B-степенями ГЭРБ (рис. 3).
Нами выявлена обратная корреляция между величиной БВК и H. pylori инфицированностью тела желудка (t-тест; р=0,021). При этом инфекция H. pylori в СО тела желудка по сравнению с ее отсутствием сопровождалась меньшей величиной БВК (рис. 4). Однако при сравнении коморбидных групп больных – ГЭРБ и ЯБДПК (1-я группа) и ГЭРБ и ЯБЖ (2-я группа) оказалось, что несмотря на значимое повышение БВК у пациентов 1-й группы (8,34±0,43 против 3,47±0,54 ммоль/ч; р<0,001), степени рефлюкс-эзофагита (0,48±0,03 против 0,56±0,07 балла) и Рнпс (15,4±0,72 против 14,7±1,79 мм рт.ст.) были статистически неразличимы.
По нашим данным, внутри группы с коморбидной ГЭРБ при сравнении подгрупп больных ЯБДК и ЯБЖ оказалось, что при ЯБЖ более выражены патогистологические изменения СО тела желудка, а при ЯБДПК – СО ДПК (рис. 5).
Сравнительный анализ выявил статистически значимую прямую корреляцию (коэффициент Пирсона и χ²-критерий соответственно) между степенью эзофагита (в баллах) по данным эзофагоскопии и выраженности (в баллах) следующих ГД морфологических изменений:
- дуоденита (по эндоскопическому, [р<0,001] и гистологическому индексам [p=0,018], преимущественно за счет выраженности атрофии СО ДПК; p=0,001);
- антрального гастрита (по эндоскопическому [p=0,019] и гистологическому индексам, χ²-критерию; p=0,005, за счет более выраженной воспалительной инфильтрации χ²; p=0,046);
- гастрита тела желудка по эндоскопическому индексу (коэффициент Пирсона [р<0,001], χ²-критерий, p<0,001, и индексу воспалительной инфильтрации СО, χ²-критерий; p=0,021).
Более того, нами обнаружена статистически значимая прямая корреляция, подтверждающая ассоциативные связи между различными гистологическими изменениями СО в каждом из органов ГД-комплекса:
- В ДПК между HP-инфекцией, с одной стороны, и желудочной метаплазией и воспалительной инфильтрацией СО, с другой (коэффициент Пирсона; p=0,001; t-критерий; p=0,001); между желудочной метаплазией и атрофией СО (коэффициент Пирсона, p<0,001; t-критерий, p<0,001; Манна–Уитни, p<0,001), а также между желудочной метаплазией и инфильтрацией СО (коэффициент Пирсона, p<0,001, t-критерий, p<0,001, Манна–Уитни, p<0,001), между желудочной атрофией и инфильтрацией СО (коэффициент Пирсона, p<0,001; ANOVA, p<0,001, Крускалла–Уоллиса, p<0,001);
- В АОЖ между кишечной метаплазией и атрофией СО (коэффициент Пирсона, p=0,016), а также между атрофией и воспалительной инфильтрацией СО (коэффициент Пирсона, p<0,001; ANOVA, p<0,001; Крускалла–Уоллиса, p< 0,001);
- В ФОЖ между кишечной метаплазией и атрофией СО (коэффициент Пирсона, p<0,001; t-критерий, p<0,001; Манна–Уитни, p<0,001), с каждой из которых имелась прямая корреляция, соответственно, с инфильтрацией СО (коэффициент Пирсона, p<0,001; t-критерий, p=0,044) и (коэффициент Пирсона, p<0,001; t-критерий, p<0,001; Манна–Уитни; p<0,001).
Далее оказалось, что у 145 больных ГЭРБ коморбидной с кислотозависимыми заболеваниями мы не выявили статистически значимых различий абсолютных величин градиента давления ΔРНПС-ФОЖ при разных степенях поражения СО пищевода. Однако в разных отделах эзофагогастродуоденальной зоны было выявлено синергичное однонаправленное повышение полостного давления, подтвержденное прямой положительной корреляцией между РДК и РАОЖ (коэффициент Пирсона, p<0,001; ANOVA, p=0,001; тест Крускалла–Уоллиса, p<0,001), РАОЖ и РФОЖ (коэффициент Пирсона, p<0,001; ANOVA, p<0,001; тест Крускалла–Уоллиса, p<0,001), РФОЖ и РНПС (коэффициент Пирсона, p<0,001; тест Крускалла–Уоллиса, p<0,001). Более того, между повышением Р в дистальных отделах ГД-зоны и Р в НПС была определена статистически значимая прямая корреляция (РАОЖ-РНПС – коэффициент Пирсона, p<0,001; тест Крускалла–Уоллиса, p<0,043 и РДК–РНПС –коэффициент Пирсона, p<0,001; ANOVA, p<0,013; тест Крускалла–Уоллиса, p<0,004).
При этом была отмечена прямая корреляция между величиной давления в НПС и степенями воспалительной клеточной инфильтрации (критерий Колмогорова, p=0,002; коэффициент Пирсона, p<0,002; коэффициент Спирмена, p<0,001; тест Крускалла–Уоллиса, p=0,001), а также атрофии СО ДПК (критерий Колмогорова, p=0,011; коэффициент Пирсона, p<0,001; ANOVA, p=0,039, тест Крускалла–Уоллиса, p<0,001).
Обсуждение
ГЭРБ является полиэтиологическим заболеванием с чрезвычайно сложными патофизиологическими многофакторными взаимодействиями. Наши данные о превалирующей частоте больных НЭРБ (73,7%) по сравнению с ГЭРБ (26,3%) совпадают с результатами авторитетных исследований (67,9 и 32,8% соответственно) [17]. Исходя из выявленного нами параллелизма в оценках (в баллах) между степенями воспаления ГД СО по эндоскопическим и гистологическим критериям, можно полагать корректным клиническое применение эндоскопической балльной оценки выраженности воспаления ГД СО у пациентов с разной стадией ГЭРБ, предваряющей более точную балльную гистологическую диагностику.
Необходимо отметить, что в большинстве исследований, так же как и в нашем, не было выявлено причинной взаимосвязи и прямой корреляции между инфекцией H. pylori и стадией ГЭРБ [18, 19]. Вызывают интерес наши данные о более выраженных воспалительных изменениях в луковице ДПК по сравнению с АОЖ и телом желудка при рефлюкс-эзофагите степени С по сравнению с N-степенью НЭРБ. Последнее можно объяснить повышенной секрецией НСl с периодами закисления луковицы ДПК. Исходя из данных литературы, можно полагать, что у пациентов с выраженной стадией ГЭРБ нарушается последовательный потенциально протективный физиологический гомеостаз, состоящий в том, что пищевод может сигнализировать желудку изменять секрецию НСl и бикарбонатов [20]. Этот механизм подтвержден тем, что у здоровых людей инфузия НСl в пищевод редуцирует желудочную кислотопродукцию [20, 21].
Небезынтересно, что в нашей работе наличие инфекции H. pylori в СО тела желудка по сравнению с ее отсутствием сопровождалось меньшей величиной БВК, что могло минимизировать риск развития ГЭРБ. Наши данные не противоречат научным исследованиям, которые гласят, что H. pylori в теле желудка продуцирует протеины, транзиторно ингибирующие секрецию HCl [23], а результатом успешной эрадикации может быть повышение секреции НСl [22] и транзиторное возникновение «легких форм ГЭРБ» [24], т.е. НЭРБ. По данным авторитетных исследований, инфекция H. pylori у больных ЯБЖ сопровождается гастритом тела желудка с понижением секреции НСl, а у пациентов с ЯБДК манифестируется преимущественно антральным гастритом, который провоцирует увеличение секреции НСl [22]. Более того, при ГЭРБ часто выявлялся антральный гастрит (35,2%) легкой или средней степени, и его выраженность коррелировала со стадией ГЭРБ (p<0,01) [17]. Однако в этих исследованиях не изучалась коморбидная ГЭРБ, при которой, по нашим данным, при синтропии с ЯБЖ более выражен гастрит тела желудка, а при синтропии с ЯБДПК – дуоденит.
Что касается стадии коморбидной ГЭРБ, то, по нашим данным, степень эзофагита сопрягалась с выраженностью воспалительных изменений в каждом из отделов ГД СО, что необходимо учитывать при лечении ГЭРБ. Более того, между отдельными субстратами воспаления в каждом из сегментов ГД СО определялась статистически значимая положительная корреляция. Гистологические исследования показали, что после эрадикации H. pylori достоверное уменьшение атрофии и интестинальной метаплазии СО желудка подтверждалось по прошествии 10 лет [24, 25]. Это нацеливает на длительное наблюдение и превентивную терапию соответствующих патогистологических изменений.
Выявленное нами синергичное однонаправленное повышение полостного давления во всех отделах эзофагогастродуоденальной зоны сопрягается с данными литературы, согласно которым длительная контрактильность пищевода может провоцировать симптомы ГЭРБ [7]. Более того, обнаруженная в исследовании прямая корреляция между величиной давления в НПС и степенями воспалительной инфильтрации и атрофии СО ДПК предполагает, что дуоденит с атрофией СО, а не только хронический атрофический гастрит [7], может провоцировать нарушение гастродуоденальной моторики и гиперчувствительность СО пищевода.
В целом полученные результаты указывают на возможные мишени терапевтических воздействий в различных отделах ГД-комплекса.
Заключение
Среди больных ГЭРБ c коморбидными кислотозависимыми заболеваниями преобладали лица с НЭРБ. Сопутствующие эзофагиту значимые эндоскопические и гистологические изменения СО ДПК, АОЖ и тела желудка, равно как и повышенная межпищеварительная секреция кислоты, регистрировались только при С-стадии ГЭРБ по сравнению с M- и N-степенями изменений эзофагеальной СО. При этом наличие сочетанных метаплазии и атрофии в ДПК, АОЖ и в теле желудка как у пациентов с инфицированностью H. pylori, так и без инфицированности H. pylori сопровождалось нарушениями секреции НСl, ГД просветного давления и тонуса НПС не только при ГЭРБ, но и при НЭРБ. Таким образом, синтропические патогистологические изменения в каждом из отделов ГД СО имели определенную сопряженность с выраженностью ГЭРБ, коморбидной с кислотозависимыми заболеваниями. Исходя из конкретной коморбидной ситуации, пациент-ориентированное лечение больных ГЭРБ и НЭРБ должно предусматривать вероятную цитопротективную терапию [4], нацеленную на минимизацию, доказано обратимой атрофии и сопутствующей ей кишечной метаплазии СО желудка [25], являющуюся по сути онкопревентивной.
Методы лечения
Терапия диффузного гастрита включает в себя прием медикаментов и соблюдение диетической программы питания. На начальных стадиях развития воспаление хорошо поддается лечению. Риск осложнений практически исключается. Тяжелые формы болезни подразумевают длительную терапию. В качестве дополнения можно использовать народные средства или физиотерапевтические процедуры.
Лекарственные средства
Заниматься самолечением при гастрите запрещено. Схема медикаментозной терапии назначается индивидуально. Задачей приема препаратов является восстановление функционального состояния пищеварительного тракта, купирование имеющейся симптоматики, устранение причины воспалительного процесса и общее укрепление иммунитета. При бактериальной природе заболевания пациенту назначаются антибиотики.
Примеры лекарственных средств:
- антибиотики для уничтожения патогенных микроорганизмов (Тетрациклин, Азитромицин, Кларитромицин);
- ингибиторы протонной помпы (Омез, Омепразол);
- антацидные средства (Ренни, Маалокс, Алмагель);
- спазмолитики для купирования болевого синдрома (Спазмолгон, Но-Шпа);
- ферментные средства (Мезим, Панзинорм, Фестал);
- иммуностимулирующие препараты (Имудон).
- Смотрите в нашей статье «Лучшее народное средство от гастрита!» Чтобы избавиться от него БЫСТРО и НАВСЕГДА…
- Как избавиться от газов в кишечнике и почему они возникают?
- Чистка активированным углем — стоит ли ее начинать?
Народная медицина
Рецепты народной медицины способны повысить эффективность основной терапии. Натуральные компоненты улучшают работу пищеварительной системы, укрепляют иммунитет. Некоторые народные средства обладают способностью купировать воспалительные процессы. При подборе рецептов следует учитывать индивидуальные особенности организма. В их состав могут входить продукты, способные спровоцировать пищевую непереносимость или аллергическую реакцию.
Примеры народных средств:
- кашица из тертого яблока с медом (с яблока предварительно удаляется кожица, мякоть можно измельчить в блендере или натереть на терке, употреблять средство следует по несколько чайных ложек за тридцать минут до завтрака);
Meтoды нapoднoй мeдицины нe peкoмeндyeтcя coвмeщaть c yпoтpeблeниeм мeдикaмeнтoзных пpeпapaтoв вo избeжaниe cepьёзных пocлeдcтвий. - травяная смесь (зверобой, подорожник, мяту и корень аира смешать в равных пропорциях, столовую ложку смеси залить стаканом кипятка, настоять не менее пятнадцати минут, принимать несколько раз в день перед употреблением пищи);
- сок алоэ с медом (соединить ингредиенты в равных пропорциях, принимать по чайной ложке перед основными приемами пищи);
- семена льна (чайную ложку ингредиента залить небольшим количеством кипятка, после разбухания семян должна получиться слизистая кашица, средство употребляется перед каждым приемом пищи).
Диета
Диффузный гастрит подразумевает обязательное соблюдение диеты. Главной причиной обострения воспалительного процесса становятся погрешности в питании. При приготовлении блюд разрешено использовать метод паровой обработки, тушения ил варки.
В период обострения заболевания все ингредиенты должны тщательно измельчаться. Питание должно быть дробным и сбалансированным.
Принципы питания:
- исключение из рациона слишком жирной, соленой, острой пищи;
- запрещено употреблять алкогольные и газированные напитки, кофе, крепкий чай;
- нельзя вводить в рацион продукты, способные оказать раздражающе действие на слизистые оболочки органов пищеварения;
- в меню должны присутствовать кисломолочные продукты с пониженным процентом жирности;
- питание осуществляется до шести раз в день небольшими порциями;
- меню следует составлять только на основе списка разрешенных продуктов.
Подходы к диагностике и терапии гастрита, ассоциированного с рефлюксом желчи
Широкое распространение в клинической практике рефлюкс-гастрита при отсутствии единого термина [2] (синонимы: гастрит типа С, щелочной гастрит, реактивная гастропатия), а также понимание механизмов формирования, стандартов диагностики и терапии делают актуальным анализ и освещение имеющихся представлений об этом варианте гастрита.
Гастрит, ассоциированный с билиарным рефлюксом (лат. refluo — течь назад), редко носит первичный характер [2, 3], преимущественно развиваясь вторично вследствие анатомических изменений, связанных с оперативным вмешательством: резекцией желудка, гастроэнтеростомией, энтеростомией, ваготомией, холецистэктомией. Несостоятельность сфинктерного аппарата, антродуоденальная дискоординация (нарушение координации между антральным, пилорическим отделами желудка и двенадцатиперстной кишкой), а также резекции части желудка, приводящая к ликвидации естественного антирефлюксного барьера, являются причиной формирования рецидивирующего заброса содержимого двенадцатиперстной кишки, содержащего желчь, в желудок с повреждением его слизистой оболочки.
Любой диагностический процесс начинается с опроса и сбора анамнеза. При наличии симптомов диспепсии, которые не носят специфического характера и в ряде случаев рефлюкс-гастрита могут отсутствовать, а также при заболеваниях и состояниях, имеющих высокую степень риска билиарного рефлюкса (желчно-каменная болезнь, состояния после резекции желудка, ваготомии и др.), необходимо проведение эндоскопического исследования с биопсией слизистой оболочки желудка для выяснения наличия, степени и стадии гастрита, а также инфицирования Helicobacter pylori (НР).
Эндоскопическая картина при рефлюкс-гастрите характеризуется гиперемией и отеком слизистой оболочки, которые распространяются циркулярно от пилорического отдела в проксимальном направлении. При этом на ней часто обнаруживаются пятна желчи, отмечается видимый заброс желчи из двенадцатиперстной кишки в желудок или высокое содержание желчи в просвете желудка.
«Золотого стандарта» диагностики дуоденогастрального рефлюкса пока не существует. В качестве метода функциональной диагностики используют 24-часовую рН-метрию, рентгеноскопию и ультразвуковое исследование желудка. Основным методом диагностики билиарных забросов в настоящее время является рН-мониторирующая система Bilitec 2000, которая довольно качественно оценивает желчный рефлюкс и рН в желудке. Barrett M. W. с соавторами [4] показали высокую чувствительность данного устройства для мониторирования желчного рефлюкса in vivo, но несколько меньшую in vitro, с частотой ложноотрицательных результатов около 23%. В кислых условиях объем абсорбции билирубина, определяемый данным прибором, уменьшается, что может привести к росту ложноотрицательных результатов и, соответственно, уменьшению ложноположительных. Хотя этот метод не может быть отнесен к «золотым стандартам» дуоденогастрального рефлюкса, но он наиболее удобен и употребим для динамического мониторинга рефлюкса желчи [5].
Чем же опасен рефлюкс содержимого двенадцатиперстной кишки в желудок, какие структурные изменения происходят в слизистой оболочке желудка под воздействием дуоденального рефлюксата?
Известно, что желчные кислоты, обладающие детергентными свойствами, способствуют солюбилизации липидов мембран поверхностного эпителия, при этом их негативное влияние в отношении эпителия зависит от их концентрации, конъюгации и рН окружающей среды, а также от продолжительности времени, в течение которого слизистая оболочка подвергается действию желчи [6]. При низких значениях рН слизистую оболочку повреждают только тауриновые конъюгаты, а при высоких значениях рН (например, в культе желудка после операции) именно неконъюгированные желчные кислоты оказывают негативный эффект. Помимо собственно желчных кислот лизолецитин, образующийся под воздействием панкреатической фосфолипазы А из лецитина, обладает повреждающим действием, с увеличением обратной диффузии ионов водорода, а также усилением высвобождения гистамина и гастрина. В последние годы обсуждается и возможное взаимодействие желчных кислот с определенным подтипом мускариновых рецепторов, локализованных на главных клетках, вследствие чего в слизистой оболочке желудка развивается активное воспаление, атрофия желез, интестинальная метаплазия и очаговая гиперплазия [7].
Помимо этого, забросы желчи, меняя химический состав поверхности слизистой оболочки, могут потенцировать действие других патогенных факторов: инфекции НР и желудочного сока [8, 9]. Chen S. L. с соавторами [10], оценивая влияние билиарного рефлюкса на выраженность повреждений слизистой оболочки желудка у 49 пациентов с диспепсией и хроническим гастритом, не установили взаимосвязи между длительностью дуоденального рефлюкса и pH в полости желудка, что свидетельствует о наличии сложных механизмов обратной связи, включающих регулирование секреторной и эвакуаторной функции желудка. Вместе с тем степень изменений слизистой оболочки, как и колонизация инфекцией НР, коррелировали с длительностью билиарного рефлюкса. При этом полученные данные отчетливо демонстрировали взаимосвязь между билиарным рефлюксом и выраженностью повреждения слизистой оболочки желудка. Так, выраженный рефлюкс коррелировал с активным воспалением (r = 0,3949, P < 0,05), хроническим воспалением (r = 0,8938, P = 0,0001), атрофией слизистой (r = 0,4619, P < 0,005) и колонизацией НР в теле желудка (r = 0,8938, P = 0,0001). В данной работе, как и в некоторых других [11], был продемонстрирован суммирующийся патогенный эффект на слизистую оболочку желудка НР инфекции и билиарного рефлюкса. Можно предположить комплексный механизм этого воздействия. Так, абсорбция рефлюктанта желчи на поверхности слизистой оболочки желудка оказывает прямой повреждающий эффект, а также усиливает действие пепсина и соляной кислоты; повреждение слизистой оболочки, в свою очередь, способствует колонизации НР от антрального отдела до тела желудка. В отсутствии инфицирования НР вследствие забросов щелочного содержимого из двенадцатиперстной кишки и изменения рН возможна бактериальная контаминация микрофлорой нижележащих отделов пищеварительного тракта, что также приводит к более выраженному повреждению слизистой оболочки желудка.
К характерным морфологическим признакам этого варианта поражения желудка можно отнести феномен фовеолярной гиперплазии, пролиферации гладкомышечных клеток в собственной пластинке, а также изменение продукции мукоцитами муцинов, играющих важную роль в протекции слизистой оболочки [12] (рис.). Модификация секретируемых муцинов, выявляемая иммуногистохимически, приводит к реактивным/регенеративным изменениям, сходным с проявлениями гастропатии, вызванной нестероидными противовоспалительными препаратами (НПВП-гастропатии) [13]: нарушается экспрессия мембранного муцина (MUC1), который вовлечен в процессы адгезии и полярности, и секреторных муцинов (MUC5AC и MUC6). Обнаруженные изменения отличаются от НР-ассоциированного гастрита, при котором уменьшается экспрессия MUC5AC на поверхностном эпителии, а муцин MUC6 распространяется на поверхность мукоцитов [14].
В прогностическом плане крайне важен и еще один аспект изменений слизистой оболочки желудка, ассоциированный с билиарным рефлюксом. Персистенция воспаления с гиперпродукцией свободных радикалов, нарушением микроциркуляции и, как следствие, нарушением процессов клеточного обновления приводит к более частой встречаемости в сравнении с аналогичной возрастной популяцией атрофии и кишечной метаплазии слизистой оболочки желудка. Здесь уместно напомнить о более высоком риске развития рака кишечного типа в культе желудка, который был продемонстрирован как в экспериментальных, так и в эпидемиологических исследованиях [15, 16].
Безусловно, наличие и выраженность воспалительного инфильтрата, а также атрофии слизистой оболочки желудка не определяют наличия у больного клинических симптомов диспепсии, возникающих вследствие нарушений желудочной секреции, гастродуоденальной моторики, висцеральной чувствительности. Почему же тогда так важно клиницисту адекватно интерпретировать данные заключения патолога? Ответ кроется в целевых установках классификационной системы гастрита — оценить состояние слизистой оболочки, дать характеристику воспалительного процесса для прогноза и персонификации программы наблюдения больного, прежде всего с целью предупреждения прогрессирования воспалительных изменений и развития атрофии, кишечной метаплазии, дис/неоплазии.
Тщательный анализ синдрома диспепсии, данных эндоскопического, биопсийного и функциональных исследований, проведенный клиницистом, создает основу для формирования целей терапии больного:
- купировать проявления диспепсии (при их наличии) для повышения качества жизни пациента;
- редуцировать изменения слизистой оболочки для профилактики формирования атрофии с кишечной метаплазией, а при их наличии — остановить прогрессирование изменений слизистой оболочки для профилактики рака желудка.
Важной составляющей лечебной программы следует признать модификацию образа жизни и характера питания пациента. Своевременный прием пищи, отсутствие в рационе избытка животных жиров, сладких газированных напитков, прекращение курения и приема алкоголя способствуют позитивным изменениям в течении гастрита с синдромом диспепсии.
При наличии инфицирования НР следует запланировать проведение эрадикационной терапии для элиминации дополнительного фактора, повреждающего слизистую оболочку желудка и увеличивающего риск рецидивирования синдрома диспепсии.
Поскольку в формировании рефлюкс-гастрита ключевую позицию занимают моторные нарушения, целесообразно курсовое назначение прокинетиков (Ганатон, Тримедат) в качестве одного из средств патогенетической терапии. Однако лишь назначением препаратов этой группы нельзя достичь всех целей терапии рефлюкс-гастрита.
Следующей группой средств патогенетической терапии, рациональной для ряда пациентов с желчно-каменной болезнью, функциональными нарушениями билиарного тракта, сопутствующими хроническими диффузными заболеваниями печени, являются препараты урсодезоксихолевой кислоты (Урсосан, Урсофальк, Урдокса, Урсодекс), которые назначаются в суточной дозе 10–13 мкг/кг веса курсами по 6–8 недель, а при необходимости — и на более длительный период.
Классическим консервативным подходом к лечению гастрита, ассоциированного с билиарным рефлюксом, признано назначение антацидов и солей висмута. В одном из хорошо спланированных исследований применение сукральфата и рабепразола у больных с билиарным рефлюксом после холецистэктомии продемонстрировало свою эффективность как на клинические проявления, так и на выраженность макроскопических признаков воспаления, диагностируемых по результатам эндоскопического исследования [17].
Таким образом, назначение курсовой терапии прокинетиками, антисекреторными средствами и мукоцитопротекторами позволяет купировать симптомы диспепсии. Редуцировать изменения слизистой оболочки с целью профилактики развития атрофии с кишечной метаплазией, а при их наличии — остановить прогрессирование изменений слизистой оболочки для профилактики рака желудка возможно и в результате включения в терапию муко/цитопротекторов.
Группа муко/цитопротекторов включает несколько лекарственных средств (табл.), среди которых следует отдельно выделить терапевтические возможности солей висмута, в том числе Де-Нола. В многочисленных исследованиях показано, что препараты висмута образуют защитный слой на пораженных участках слизистой оболочки, предохраняя ее от воздействия агрессивных факторов, стимулируют секрецию слизи и гидрокарбоната, ингибируют активность пепсина, предохраняют эпителиальные факторы роста от распада, способствуя регенерации клеток эпителия, улучшают микроциркуляцию, стимулируют секрецию гастрозащитных простагландинов. Наряду с цитопротективными эффектами, перечисленными выше, два фактора следует упомянуть отдельно. Это — бактерицидный эффект Де-Нола в отношении хеликобактера и способность Де-Нола к связыванию желчных кислот [26]. Эрадикация хеликобактера с помощью четырехкомпонентной схемы, включающей Де-Нол, значительно уменьшает выраженность дуоденогастрального рефлюкса, что было убедительно показано в исследовании S. D. Ladas и соавт. [27]. Нейтрализация желчных кислот и их солей также чрезвычайно важна в плане устранения одного из ведущих патогенетических факторов рефлюкс-гастрита. Учитывая изложенное выше, применение Де-Нола при гастрите, обусловленном дуоденогастральным рефлюксом, является абсолютно обоснованным с патогенетической точки зрения.
В условиях контаминации слизистой оболочки желудка не-НР микроорганизмами [18], в том числе Helicobacter spp. [19], Proteus mirabilis, Citrobacter freundii, Klebsiella pneumoniae, Enterobacter cloacae, Staphylococcus aureus, с дополнительным стимулом к персистенции воспалительного инфильтрата, активизации процессов перекисного окисления липидов и выработкой бактериями нитрозаминов, несущих проканцерогенный потенциал [20], клиницисту также важно использовать эффекты солей висмута. Во-первых, не являясь антибиотиком, Де-Нол подавляет активность бактериальной флоры без риска формирования резистентности, что успешно применяется уже в течение многих лет в стандартной эрадикационной терапии. Во-вторых, в условиях персистенции воспаления становятся необходимыми свойства Де-Нола, влияющие на активность воспалительного процесса, а именно снижение содержания провоспалительных цитокинов и наличие антиоксидантного эффекта. Следует отметить, что эти свойства препарата успешно используются и при лечении других заболеваний, в т. ч. и кишечника. В-третьих, пациенты с рефлюкс-гастритом, особенно с атрофией, особенно нуждаются в мукоцитопротекторной терапии с повышением продукции слизи, простагландинов, улучшением микроциркуляции в слизистой оболочке желудка [25].
Наконец, предпринимаются попытки хирургическими методами скорректировать негативное влияние рефлюкса [21] (наложение энтеро-энтероанастомоза по Брауну, Roux-en-Y), особенно после резекции желудка в качестве «средства резерва», если все другие методы терапии оказались неэффективны.
Таким образом, гастрит, ассоциированный с рефлюксом желчи, несмотря на отсутствие стандартов диагностики и лечения, при использовании комплексного подхода может быть своевременно выявлен и для его терапии существуют достаточно надежные, безопасные и эффективные препараты.
Литература
- Kawiorski W., Herman R. M., Legutko J. Current diagnosis of gastroduodenal reflux and biliary gastritis // Przegl Lek. 2001; 58: 90–94.
- Hermans D., Sokal E. M., Collard J. M., Romagnoli R., Buts J. P. Primary duodenogastric reflux in children and adolescents // Eur J Pediatr. 2003, Sep; 162 (9): 598–602. Epub 2003, Jun 26.
- Lin J. K., Hu P. J., Li C. J., Zeng Z. R., Zhang X. G. A study of diagnosis of primary biliary reflux gastritis // Zhonghua Neike Zazhi. 2003; 42: 81–83.
- Barrett M. W., Myers J. C., Watson D. I., Jamieson G. G. Detection of bile reflux: in vivo validation of the Bilitec fibreoptic system // Dis Esophagus. 2000; 13: 44–45.
- Barrett M. W., Myers J. C., Watson D. I., Jamieson G. G. Dietary interference with the use of Bilitec to assess bile reflux // Dis Esophagus. 1999; 12: 60–64.
- Stathopoulos P., Zundt B., Spelsberg F. W., Kolligs L., Diebold J., Goke B., Jungst D. Relation of gallbladder function and Helicobacter pylori infection to gastric mucosa inflammation in patients with symptomatic cholecystolithiasis // Digestion. 2006; 73 (2–3): 69–74.
- Raufman J. P., Cheng K., Zimniak P. Activation of muscarinic receptor signaling by bile acids: physiological and medical implications // Dig Dis Sci. 2003; 48: 1431–1444.
- Chen S. L., Mo J. Z., Chen X. Y., Xiao S. D. The influence of bile reflux, gastric acid and Helicobacter pylori infection on gastric mucosal injury: Severity and localization // Weichang Bingxue. 2002; 7: 280–285x.
- Johannesson K. A., Hammar E., Stael von Holstein C. Mucosal changes in the gastric remnant: long-term effects of bile reflux diversion and Helicobacter pylori infection // Eur. J Gastroenterol Hepatol. 2003; 15: 35–40.
- Chen S. L., Mo J. Z., Cao Z. J., Chen X. Y., Xiao S. D. Effects of bile reflux on gastric mucosal lesions in patients with dyspepsia or chronic gastritis // World J Gastroenterol. 2005. May 14; 11 (18): 2834–2847.
- Abe H., Murakami K., Satoh S., Sato R., Kodama M., Arita T., Fujioka T. Influence of bile reflux and Helicobacter pylori infection on gastritis in the remnant gastric mucosa after distal gastrectomy // J Gastroenterol. 2005, Jun; 40 (6): 563–569.
- Mino-Kenudson M., Tomita S., Lauwers G. Y. Mucin expression in reactive gastropathy: an immunohistochemical analysis // Arch Pathol Lab Med. 2007, Jan; 131 (1): 86–90.
- Mino-Kenudson M., Tomita S., Lauwers G. Y. Mucin expression in reactive gastropathy: an immunohistochemical analysis // Arch Pathol Lab Med. 2007, Jan; 131 (1): 86–90.
- Corfield A. P., Myerscough N., Longman R., Sylvester P., Arul S., Pignatelli M. Mucins and mucosal protection in the gastrointestinal tract: new prospects for mucins in the pathology of gastrointestinal disease // Gut. 2000. 47: 589–594.
- Ma Z., Wang Z., Zhang J. Carcinogenicity of duodenogastric reflux juice in patients undergoing gastrectomy // Zhonghua Wai Ke Za Zhi. 2001, Oct; 39 (10): 764–766.
- Oba M., Miwa K., Fujimura T., Harada S., Sasaki S., Hattori T. Chemoprevention of glandular stomach carcinogenesis through duodenogastric reflux in rats by a COX-2 inhibitor // Int J Cancer. 2008, Oct 1; 123 (7): 1491–1498.
- Santarelli L., Gabrielli M., Candelli M., Cremonini F., Nista E. C., Cammarota G., Gasbarrini G., Gasbarrini A. Post-cholecystectomy alkaline reactive gastritis: a randomized trial comparing sucralfate versus rabeprazole or no treatment // Eur J Gastroenterol Hepatol. 2003, Sep; 15 (9): 975–979.
- Takako Osaki, Katsuhiro Mabe, Tomoko Hanawa, Shigeru Kamiya. Urease-positive bacteria in the stomach induce a false-positive reaction in a urea breath test for diagnosis of Helicobacter pylori infection // Journal of Medical Microbiology. 2008, 57, 814–819.
- Cinthia G. Goldman and Hazel M. Mitchell. Helicobacter spp. other than Helicobacter pylori 2010 Blackwell Publishing Ltd, Helicobacter 15 (Suppl. 1): 69–75.
- Correa P. A human model of gastric carcinogenesis // Cancer Res. 1988; 48: 3554–3560.
- Madura J. A. Primary bile reflux gastritis: diagnosis and surgical treatment // Am J Surg. 2003, Sep; 186 (3): 269–273.
- Slomiany В. L., Nishikawa H., BHski J., Slomiany A. Colloidal bismuth subcitrate inhibits peptic degradation of gastric mucosа_epidermal grown factor in vitro // Amer. J. Gastroenterol. 1990. V. 85. P. 390–393.
- Lambert J. R., McLean. Pharmacology of colloidal bismuth subcitrate (De-Nol) and use in non ulcer dyspepsia / Helicobacter pylori in peptic ulceration and gastritis; eds. B. J. Marshall, R. W. McCallum, R. L. Guerrant. Oxford, London, Edinburgh, Melbourne: Blackwell Scientific Publications, 1991. P. 201–209.
- Кононов А. В. Цитопротекция слизистой оболочки желудка: молекулярно-клеточные механизмы // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2006. № 3. С. 12–16.
- O’Connor A., Gisbert J. P., McNamara, O’Morain C. Treatment Of Helicobacter pylori Infection 2011 // Helicobacter. 2011. Sep. 16: 53–58.
- Wagstaff A. J., Benfield P., Monk J. P. Colloidal bismuth subcitrate. A review of its pharmacodynamic and pharmacokinetic properties, and its therapeutic use in peptic ulcer disease // Drugs. 1988; 36: 132–157.га
- Ladas S. D., Katsogridakis J., Malamou H. et al. Helicobacter pylori may induce bile reflux: link between H. pylori and bile induced injury to gastric epithelium // Gut. 1996; 38: 15–18.
М. Ф. Осипенко*, доктор медицинских наук, профессор М. А. Ливзан**, доктор медицинских наук
* ГОУ ВПО «Новосибирский государственный медицинский университет Минздравсоцразвития России», Новосибирск ** ГОУ ВПО «Омская государственная медицинская академия Минздравсоцразвития России», Омск
Контактная информация об авторах для переписки
Осложнения
При отсутствии полноценной терапии диффузный гастрит принимает хроническую, а затем субатрофическую форму. Последствием развития воспаления становится образование эрозий, язв, нарушение процесса выработки соляной кислоты. Движение пищи по пищеводу затрудняется. Такие состояния становятся причиной увеличения масштаба поражения тканей, развиваются дополнительные патологические процессы.
Другие осложнения:
- рефлюкс-гастрит;
- язвенная болезнь;
- предраковое состояние;
- образование злокачественных опухолей;
- желудочно-кишечные кровотечения.
Видео на тему: Гастрит — причины и виды лечения.
Дуодено-гастральный рефлюкс
В развитии дуодено-гастрального рефлюкса имеют значение несколько факторов: недостаточность пилорического отдела желудка с зиянием пилоруса, нарушение моторики желудка и двенадцатиперстной кишки, повышение давления в начальных отделах тонкой кишки, агрессивное действие содержимого ДПК на слизистую желудка.
Желчные кислоты и панкреатические ферменты повреждают защитный барьер слизистой оболочки желудка; провоцируют обратную диффузию ионов водорода в глубокие слои стенки желудка (это приводит к повышению кислотности); стимулируют выработку гастрина антральными железами и повреждают липидные мембраны клеток, повышая их чувствительность к компонентам желудочного сока. Кроме того, из-за ретроградного заброса дуоденального содержимого повышается давление в полости желудка.
Заброс содержимого ДПК в желудок часто сопровождает такие заболевания, как хронические гастриты, язвенная болезнь желудка и ДПК, рак желудка, нарушение тонуса сфинктера Одди, дуоденостаз. Нередко состояние возникает у пациентов, перенесших операции удаления желчного пузыря, ушивания дуоденальной язвы. Нарушение моторики желудка и начальных отделов тонкого кишечника является первопричиной рефлюкса при функциональных заболеваниях ЖКТ, а при органической патологии нарушения моторики являются вторичными.
Дискоординация моторики приводит к нарушению эвакуации содержимого желудка и ДПК, что ведет к гастро- и дуоденостазу, обратной перистальтике, забросу дуоденальных масс в полость желудка. Дисмоторные расстройства могут отмечаться в различных отделах пищеварительного тракта, сочетаясь с патологией привратника: нормальным тонусом желудка, сопровождающимся пилороспазмом и дуоденостазом, либо гипотонией желудка в комбинации с зиянием пилоруса, гипертензией ДПК.
Ранее считалось, что состояние является защитной реакцией на воспалительный процесс в желудке и повышенную кислотность поступающего в ДПК желудочного сока: якобы дуоденальный сок при попадании в желудок ощелачивает его содержимое, что препятствует дальнейшему повреждению слизистой двенадцатиперстной кишки.
Однако на сегодняшний день доказано, что желчные кислоты, содержащиеся в дуоденальном соке, не только повреждают слизистый барьер желудка, но и провоцируют обратную диффузию ионов водорода в подслизистый слой, стимулируют секрецию гастрина антральными железами, что приводит к еще большему повышению кислотности в желудке. Таким образом, было обосновано ульцерогенное действие дуодено-гастрального рефлюкса и опровергнута теория его защитной природы.
Профилактика и прогноз
При выявлении диффузного гастрита поверхностной формы прогнозы для пациента будут благоприятными. Адекватная терапия позволяет исключить риск осложнений, восстановить процессы регенерации тканей, устранить все отклонения в работе пищеварительной системы. При хроническом типе патологии благоприятные прогнозы возможны при соблюдении графика лечения. Длительные периоды ремиссии не нарушат качество жизни пациента.
Меры профилактики:
- соблюдение режима дробного, сбалансированного питания;
- исключение из рациона вредных продуктов питания и напитков;
- отказ от злоупотребления вредными привычками;
- ведение здорового и активного образа жизни;
- регулярное обследование у гастроэнтеролога.