БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ
КАФЕДРА ФАКУЛЬТЕТСКОЙ ТЕРАПИИ
Зав. кафедрой д.м.н., профессор Г.Х.Мирсаева
Преподаватель: д.м.н. профессор Галиева Гузель Ахметовна
Клинический диагноз:
Хронический неатрофический (эрозивный) антральный гастрит, ассоциированный с НР (++) стадия обострения.
Осложнения: нет
Сопутствующие заболевания: нет
Куратор – обучающийся 4 курса
Л-413а группы лечебного факультета
Худжаев Акмал Бойназарович
Время курации с 17 марта по 24 марта 2022 года
Жалобы больного
Основная жалоба:
— На ноющие боли в области эпигастрия и левого подреберья, возникающие после приема пищи (при нарушении режима диеты) в любое время суток, без иррадиации, сопровождающиеся позывами к акту дефекации. Побочные:
— На чувство тяжести и дискомфорта в верхней трети живота, изжогу, отрыжку с кислым привкусом в разное время суток.
— На эпизодические подъемы артериального давления с максимальными цифрами до 160/100 мм. рт. ст. (адаптирована к 140/80), сопровождающиеся головной болью, мельканием мушек перед глазами.
-На частые затяжные приступы сердцебиения, сопровождающиеся слабостью, одышкой, головокружением, дискомфортом в левой половине грудной клетки.
— На чувство остановки сердца и перебои в области сердца.
— На периодические ноющие, давящие боли за грудиной, сопровождающиеся чувством нехватки воздуха, возникающие при физической нагрузке, купирующиеся приемом нитроглицерина.
— На периодические ноющие боли в тазобедренном суставе, возникающие в покое и при физической нагрузке в любое время суток, без иррадиации.
Введение
Эффективная курация больного хроническим атрофическим гастритом в реальной клинической практике представляет собой сложную задачу для клинициста. Прежде всего это связано с тем, что структурные изменения слизистой оболочки желудка не определяют наличие, выраженность и тип синдрома диспепсии, а значит, у клинициста нет надежных клиническим стигм, позволяющих уже на этапе осмотра заподозрить наличие атрофии слизистой оболочки желудка. Еще одной трудностью следует признать необходимость междисциплинарной кооперации с эндоскопистом и морфологом — именно от них зависит сама возможность постановки диагноза «хронический атрофический гастрит (ХАГ)». Наконец, выбор наиболее эффективной стратегии ведения пациента определяет как риск формирования рака желудка, так и вероятность его выявления на ранних стадиях.
Настоящая публикация подготовлена с целью систематизации имеющихся данных о современных подходах к курации больного ХАГ.
Хронический атрофический гастрит представляет собой конечную стадию воспалительного процесса, ключевой характеристикой которого является убыль желез с замещением их фиброзной тканью или кишечной метаплазией. Эти характеристики выделяют структурные изменения слизистой оболочки желудка в каскаде неблагоприятных событий от воспаления к раку и делают крайне актуальным выявление ХАГ в аспекте канцеропревенции. Гистопатологический каскад канцерогенеза желудка, также называемый каскадом P. Correa, по имени патолога, впервые описавшего его еще в 1975 г., представляет собой ступенчатый процесс: от нормального эпителия желудка до хронического неатрофического гастрита, хронического атрофического гастрита, кишечной метаплазии, дисплазии и рака [1]. Следует отметить, что сам процесс изменений от нормальной слизистой оболочки к воспалению и раку относится к общебиологическим и не зависит от причинного фактора (например, инфекционный или аутоиммунный гастрит). Это означает, что клиницисту крайне важно не только установить этиологический фактор и при возможности (в случае инфекции Helicobacter pylori
) устранить его, но и определить индивидуальный риск формирования рака. Сегодня можно с уверенностью говорить о том, что существует так называемая «точка невозврата» в виде ХАГ с кишечной метаплазией, когда даже при устранении этиологического фактора сохраняется риск прогрессирования воспалительных изменений слизистой оболочки желудка с нарушением процессов клеточного обновления, что в итоге делает наиболее эффективной стратегию проведения профилактических мероприятий до формирования атрофии (рис. 1) [2].
Подходы к диагностике хронического атрофического гастрита
Существует два основных методологических подхода для диагностики ХАГ, а именно серологические исследования с использованием маркеров функции желудка (пепсиноген I, соотношение пепсиногена I и пепсиногена II, дополнительно гастрин-17 стимулированный и базальный, антитела IgG к H. pylori
) или инвазивные исследования, требующие гистологического анализа биоптатов, взятых в ходе эзофагогастродуоденоскопии, что является «золотым стандартом» для установления диагноза. В соответствии с отечественными клиническими рекомендациями всем пациентам с клиническими проявлениями синдрома диспепсии необходимо проведение эндоскопического исследования верхних отделов пищеварительного тракта с последующей морфологической оценкой гастробиоптатов [3].
Поэтому уже на этапе первичного контакта с пациентом важно выяснить, имеется ли у него синдром диспепсии, и если да, то уточнить его характер, оценить сопутствующие клинические проявления, а также исключить наличие симптомов тревоги. Следует отметить, что появление симптомов диспепсии и их выраженность не зависят от характера и степени структурных изменений слизистой оболочки желудка. Вместе с тем при аутоиммунном генезе воспалительных изменений в клинической картине можно выявить определенные клинико-лабораторные стигмы, позволяющие включить пациента в когорту лиц высокого риска развития атрофии слизистой оболочки желудка (рис. 2) [4].
Разрушение париетальных клеток при хроническом аутоиммунном гастрите приводит к подавлению секреции соляной кислоты, что может привести к развитию разнообразных клинических проявлений, в том числе отражающих дефицит железа и витамина В12. Так, дефицит витамина В12, обусловленный снижением выработки внутреннего фактора, определяет формирование мегалобластной анемии, снижение числа тромбоцитов и развитие периферической нейропатии. Также в связи со снижением уровня цианокобаламина увеличивается содержание гомоцистеина — фактора риска сердечно-сосудистых заболеваний. Кроме того, гипо- и ахлоргидрия сопровождается повышением в сыворотке крови уровня гастрина — гормона, стимулирующего пролиферацию и гиперплазию энтерохромаффиноподобных клеток, что, в свою очередь, считается предвестником нейроэндокринных опухолей слизистой оболочки желудка [4].
Безусловно, наличие таких симптомов тревоги, как анемия, а также возраст 45 лет и старше, отягощенный наследственный анамнез по раку желудка, должны насторожить клинициста в отношении активного выявления атрофических изменений слизистой оболочки желудка.
Таким образом, когорту лиц с высокой вероятностью выявления ХАГ составляют пациенты с сочетанием синдрома диспепсии с признаками дефицита цианокобаламина и/или симптомами тревоги.
Эндоскопическое исследование играет ключевую роль в диагностике ХАГ, поскольку именно от действий врача-эндоскописта и адекватности забора гастробиоптатов зависит последующая морфологическая оценка поражения слизистой оболочки желудка и верификация диагноза.
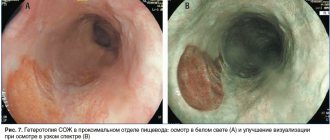
Согласно литературным данным чувствительность и специфичность обычной эндоскопии в белом свете для диагностики атрофии слизистой оболочки желудка составляют 53–59%, эндоскопии в белом свете высокой четкости с увеличением — 70–74%, тогда как для узкоспектральной эндоскопии с увеличением данные показатели достигают 95–98,5% [5]. Следует отметить, что по своей информативности в отношении выявления атрофии слизистой оболочки желудка любой эндоскопический метод превосходит серологические тесты. Узкоспектральная эндоскопия (NBI — narrow band imaging) позволяет провести детальный осмотр слизистой оболочки желудка, значительно повышая эффективность диагностики предраковых изменений и облегчая эндоскописту выбор подозрительных на кишечную метаплазию или дисплазию участков для взятия гастробиоптатов. Показано, что вероятность выявления кишечной метаплазии при так называемой прицельной или картографической биопсии, выполненной во время узкоспектральной эндоскопии, в несколько раз выше, чем при биопсии, проведенной во время обычной эндоскопии в белом свете [6]. Однако, несмотря на все преимущества, узкоспектральная эндоскопия не подходит для популяционного скрининга аденокарциномы желудка, поскольку данный метод является дорогостоящим, а также считается достаточно субъективным диагностическим инструментом, что требует наличия значительного профессионального опыта врача-эндоскописта.
Морфологическая оценка изменений слизистой оболочки желудка по системе Operative Link for Gastritis Assessment of Atrophic Gastritis (OLGA), предложенной международной группой экспертов в 2008 г., позволяет стратифицировать риск развития рака желудка. В данной системе определяются интегральные показатели степени и стадии хронического гастрита, где под степенью понимается выраженность инфильтрации собственной пластинки слизистой оболочки желудка воспалительными клетками (лимфоцитами, плазматическими клетками и нейтрофильными лейкоцитами), под стадией — наличие атрофических изменений [7]. Кишечная метаплазия является стигмой атрофии и определяется как замена железистого эпителия желудка кишечным эпителием. По распространенности выделяют ограниченную кишечную метаплазию, если патологический процесс находится в одной анатомической области желудка, и распространенную — если вовлечены две области. Гистологически кишечная метаплазия подразделяется на полную и неполную. Полная (I тип) кишечная метаплазия схожа с эпителием тонкой кишки, неполная (II тип) — с толстокишечным эпителием.
Стадия атрофических изменений и степень воспаления не определяют наличие и выраженность клинических симптомов при хроническом гастрите, при этом данные гистологического исследования необходимы для прогноза и выбора тактики ведения пациента. Необходимо подчеркнуть, что с нарастанием стадии атрофии увеличивается вероятность развития рака желудка кишечного типа. У пациентов с III–IV стадией хронического гастрита риск рака желудка возрастает в 5–6 раз. Более высокий риск развития аденокарциномы желудка характерен для неполной и/или распространенной кишечной метаплазии [8, 9]. Так, 5-летняя вероятность развития аденокарциномы желудка при отсутствии кишечной метаплазии составляет 1,5%, у пациентов с кишечной метаплазией в антральном отделе — 5,3%, а в случае распространения кишечной метаплазии из антрального отдела на тело желудка — 9,8% [10].
В соответствии с протоколом забора биопсийного материала, оценка степени и стадии хронического гастрита по системе OLGA подразумевает взятие 5 фрагментов: по одному по малой кривизне из тела желудка, по большой кривизне из тела желудка, из угла желудка, по малой кривизне из антрального отдела желудка, по большой кривизне из антрального отдела желудка.
Анамнез жизни
Родилась во Владимировской области, в 1938 году, в срок, вторым ребёнком в семье. Вскармливалась грудью. Ходить и говорить начала в срок. Условия жизни в детстве – нормальные. Развиваться и учиться начала нормально, без отставаний. Посетила в течение жизни следующие учреждения: детсад → школа → институт → работа.
Средний уровень бюджета семьи. Жилищно-коммунальные условия удовлетворительные. Питается нормально, любит горячее, жареное, солёное, перчёное, чай и кофе, овощи и фрукты. Зарядку не делает, физическими упражнениями не занимается. Личную гигиену соблюдает.
Вредные привычки
Алкоголь принимает «по праздникам» в малых количествах. Не курит. Крепким кофе, чаем не злоупотребляет.
Перенесенные заболевания
Болела в детстве корью, ветряной оспой.
В 8 лет проводилась аппендэктомия. Осложнение – аппендицит с гнойным перитонитом.
В 2006 году проводилась полипэктомия.
Гинекологический анамнез
5 беременностей, 2 родов, 3 аборта.
Менопауза с 50 лет.
Гинекологические операции и заболевания отрицает.
Последний осмотр гинеколога в 2006 году. Патологии не обнаружено.
Аллергологический анамнез
Непереносимости лекарственных препаратов, вакцин, сывороток не испытывает. Аллергия на мёд – проявляется кожным зудом.
Аутоиммунный гастрит
Данное заболевание представляет собой воспалительный процесс хронического типа, затрагивающий слизистые структуры желудка. Подобное состояние проистекает из-за сбоев в работе иммунной системы, при которых в организме начинают вырабатываться антитела к собственным клеткам желудка.
Подобная патология встречается крайне редко – по статистике, от нее страдают лишь 10% всех людей, больных различными формами гастрита.