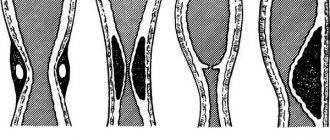
Причины
Основными причинами стеноза пищевода являются такие факторы:
- эмбриональный порок развития пищевода;
- заболевание любого органа пищеварительной системы;
- рубцующиеся язвы, в частности, провоцируют возникновение рубцового стеноза пищевода;
- токсикоз при беременности;
- анорексия;
- булимия;
- тяжелые инфекционные заболевания;
- туберкулез;
- скарлатина;
- сифилис;
- травмы пищевода;
- лучевая терапия;
- возникновение доброкачественных опухолей;
- рак пищевода;
- сдавливание пищевода увеличенными лимфоузлами, опухолями и т.д.
Профилактические мероприятия
Врачи озвучивают следующие рекомендации:
- Должное и правильное лечение заболеваний, которые могут привести к образованию колец Шацкого
- Не допускать контакта с агрессивными жидкостями – кислотами, щелочами, прочими опасными соединениями
- После хирургического вмешательства или бужирование пищевода проводить рентгенологическое обследование регулярно. Показана следующая периодичность – через 30 дней после операции, через 90 дней и в дальнейшем 1 раз в 6 месяцев.
Симптомы стеноза пищевода
Симптомы стеноза пищевода выглядят так:
- частые срыгивания новорожденного;
- обильное слюноотделение у ребенка;
- выделение слизи из носа у новорожденного;
- расстройство функции глотания (дисфагия) у ребенка;
- загрудинная боль у взрослого;
- рвота;
- приступы кашля или удушья;
- обильные срыгивания после каждого приема пищи;
- боли в области пищевода;
- аспирационная пневмония;
- опухоли в области стриктуры;
- спонтанные или травматические разрывы пищевода.
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу
. Легче предупредить болезнь, чем бороться с последствиями.
Послеоперационный период, правила для пациентов
Одноразовый объем пищи — 150 — 200 мл.
В течение 5 дней после вмешательства запрещено питание и питье через ротовое отверстие. Питательные смеси подают через назальный зонд.
Дополнительно показано внутривенное питание. Пациентам вводят раствор глюкозы, хлорида натрия, плазмы крови.
На 6 сутки разрешается принимать жидкости – сладкий чай, отвары лекарственных трав, кефир. Одноразовый объем пищи не должен превышать 150–200 мл. С 8 дня объемы питания должны быть увеличены. Больным не рекомендуется употреблять сладости, жирное молоко, газированную воду, овощи и фрукты в сыром виде. Показана протертая, нежирная и неострая пища.
Блюда не должны раздражать пищевод и желудок.
Диагностика
Диагностика стеноза пищевода предполагает принятие таких мер:
- осмотр у гастроэнтеролога
; - осмотр новорожденного у педиатра
; - эндоскопическое обследование системы пищеварения;
- рентгенографическое обследование
системы пищеварения; - эзофагоскопия;
- эндоскопическая биопсия для выявления язвенных и опухолевых образований.
Главная задача специалиста при диагностике стеноза пищевода – исключить фарингит, наличие инородных тел в пищеводе или дивертикулы пищевода, которые сходи по симптоматике с описываемым заболеванием.
Отражение заболевания на картине лабораторных данных и ЭКГ
В общем анализе крови может наблюдаться анемия (нормохромная либо гипохромная). Это связано с обеднением поступлений в организм различных питательных и ценных веществ, особенно железа. Повышается количество эритроцитов в момент, когда проходит многократная рвота, организм обезвоживается. Обезвоживание также приводит к сгущению крови. От этого повышается гемоглобин, может увеличиваться СОЭ.
В биохимическом анализе крови снижено содержание белка и альбумина. При рвоте, происходящей многократно, также проявляются признаки обезвоживания. Речь идет об электролитных нарушениях: гипонатриемии, гипохлоремии, гипокалиемии, гипокальциемии. Иногда уменьшается количество железа. Гипохлоремия приводит к увеличению уровня мочевины в крови.
По результатам ЭКГ наблюдаются изменения в миокарде диффузного характера: снижается амплитуда зубца Т в нескольких отведениях. Если нарушен электролитный состав крови, то это отразится на ЭКГ соответствующим образом. Если наличествует гипоркальциемия, будет наблюдаться удлинение электрической систолы желудочков — интервала Q-T, иногда укорочение интервала P-Q и уменьшение амплитуды зубца Т.
Гипокалиемия дает уменьшающуюся амплитуду зубца Т или показывает формирование двухфазного (±) или отрицательного несимметричного зубца Т. Также может наблюдаться увеличение амплитуды зубца U. Иногда происходит удлинение электрической систолы желудочков — интервала Q-T; горизонтально смещается сегмент ST ниже изолинии.
Система пищеварения, как она работает? Смотрите видеоматериал:
Лечение стеноза пищевода
Лечение стеноза пищевода предполагает следующие манипуляции:
- регулярное посещение гастроэнтеролога
; - щадящая диета, включающая в себя употребление жидкой и полужидкой пищи;
- прием антацидных, вяжущих средств;
- бужирование;
- баллонная дилатация;
- эндоскопическое рассечение электрохирургическими инструментами при лечении рубцового стеноза пищевода;
- эндопротезирование пищевода с помощью установки в его просвет саморасширяющегося стента;
- резекция участка сужения;
- эзофагопластика (замещению резецированного участка желудочным или кишечными трансплантатами);
- гастростомия, направленная на осуществление энтерального питания.
История развития паллиативного лечения онкологических больных с опухолевыми стриктурами пищевода насчитывает более 50 лет. Для устранения дисфагии вначале пытались использовать различные цилиндрические конструкции: из серебряной проволоки, латекса, специально обработанных клыков животных, каучука, полиэтилена, поливинилхлорида, кремнийорганических соединений и др. В 70-80-е годы на первое место выходят методы реканализации пораженного опухолью пищевода: баллонная дилатация, бужирование, электрокоагуляция, аргонно-направленная коагуляция, Nd:YAG-лазерная деструкция, брахитерапия, инъекция в опухоль этанола и др.. С начала 80-х годов прошлого столетия при стенозирующем раке пищевода успешно используется метод фотодинамической терапии (ФДТ).
В данной работе представляем 15-летний опыт эндоскопического лечения больных со злокачественными стриктурами пищевода в клинике Московского научно-исследовательского онкологического института им. П.А.Герцена.
Основной причиной развития злокачественной стриктуры пищевода является первичный местно-распространенный рак пищевода, который в структуре онкологических заболеваний занимает 16-е место. Ежегодно в России выявляется 7700 – 7800 больных раком пищевода, при этом ранние стадии диагностируются только у 5% больных (В.М.Кухаренко, 2000). Наиболее часто заболевание диагностируется после 50 лет. Доля больных с запущенной стадией рака пищевода составляет 60-70%.
Для инкурабельных больных с распространенными формами стенозирующего рака пищевода, осложненными дисфагией и/или формированием пищеводно-бронхиальной фистулы, долгие годы основным методом паллиативной помощи являлась гастростомия. Однако этот метод значительно ухудшает качество жизни, является дополнительной психологической травмой, лишает больных возможности естественного приема пищи. В последнее время широкое распространение получают различные варианты эндоскопической реканализации просвета пищевода и протезирования, позволяющие устранить дисфагию и восстановить естественный способ питания.
Показаниями для реканализации и протезирования пищевода являются:
- стенозирующий рак пищевода или кардии с дисфагией II-IV степени (подготовительный этап к химиолучевому или хирургическому лечению, а у инкурабельных больных – как самостоятельный метод паллиативного лечения, альтернативный гастростомии);
- рак пищевода или рак легкого с формированием пищеводно-трахеального или пищеводно-бронхиального свища;
- злокачественные опухоли и метастатическое поражение органов средостения с вторичным поражением и стенозом пищевода;
- рецидив рака желудка (после гастрэктомии) с развитием злокачественной стриктуры в зоне пищеводно-кишечного анастамоза.
Методы эндоскопической хирургии и протезирования
Пациенты с неоперабельными стенозирующими формами рака пищевода в большинстве случаев страдают различными сопутствующими заболеваниями, тяжесть которых нарастает на фоне нарушения питания и обезвоживания организма. В связи с этим подготовка больных к эндоскопическому лечению должна включать коррекцию нарушений функций сердечно-сосудистой системы, водно-электролитного баланса, белкового и энергетического дефицита с использованием парентерального питания.
До и во время проведения эндоскопического вмешательства на пищеводе, в зависимости от его сложности и длительности, кроме местной анестезии, целесообразно усиливать анестезирующий эффект комбинацией малых доз гипнотиков и анальгетиков (диприван и др.) в субнаркотических дозах. В послеоперационном периоде в течение 2-3 суток для купирования болевого синдрома показано использование анальгетических препаратов.
Эндоскопическое лечение стенозирующего рака пищевода Для реканализации просвета при стенозирующем раке пищевода мы применяем антеградную и ретроградную электрокоагуляцию, аргонно-направленную коагуляцию и лазерную деструкцию опухоли. В последние годы преимущество остается за электрокоагуляцией.
Антеградный способ реканализации применяется при опухолях протяженностью до 5 см с частичной обтурацией просвета пищевода. В этих случаях деструкцию опухоли производят в направлении от проксимального к дистальному краю. У таких пациентов, с экзофитной формой роста опухоли, поражающей одну стенку (не более 1/2 просвета) пищевода, отдается предпочтение электрорезекции и Nd:YAG-лазерной деструкции.
При ретроградном способе реканализации пищевода электрокоагуляция осуществляется с помощью электрозонда, «горячих» щипцов или аргонно-направленной каогуляции. Операцию начинают с дистального края опухоли с постепенным перемещением в проксимальном направлении. При невозможности проведения электрозонда или световода к дистальному краю опухоли перед проведением сеанса деструкции опухоли выполняют бужирование: с помощью эндоскопа проводят за опухоль струну-направитель, после извлечения эндоскопа по струне в суженный участок пищевода последовательно вводят бужи с увеличением их диаметра. После извлечения бужей выполняют дополнительную электролазерную деструкцию опухоли. Мы считаем предварительное бужирование пищевода обязательной процедурой перед использованием Nd:YAG-лазерной деструкции.
ФДТ при стенозирующем раке пищевода используют как самостоятельно, так и после предварительной электролазерной деструкции экзофитного компонента опухоли и уменьшения степени стеноза. В качестве фотосенсибилизаторов применяют фотогем (2,5-3,0 мг/кг), фотосенс (0,5 мг/кг), радахлорин (1,2 мг/кг). Диффузор для лазерного облучения при ФДТ проводят через суженный участок пищевода и помещают у дистального края опухоли. После этого производят последовательное облучение светом определенной длины волны (для фотогема – 630 нм; фотосенса – 670 нм; радахлорина – 662 нм) зоны опухолевого поражения пищевода на всем протяжении за счет перемещения световода в проксимальном направлении. Расчет энергии, световой дозы, количества позиций и время облучения выполняют индивидуально в каждом случае в зависимости от типа фотосенсибилизатора, характера роста опухоли, степени стеноза и др.
Эндопротезирование пищевода осуществляют с целью предотвращения рестенозирования после первого этапа реканализации.
В первые годы (1987-1994) освоения метода эндоскопической хирургии пищевода в нашем институте использовали протезы (Россия), изготовленные из медицинской силиконовой резины с фиксирующим устройством и конусообразной воронкой на проксимальном конце. Однако они имеют ряд недостатков: фиксированный диаметр, недостаточная эластичность, сложная методика установки в пищевод, выраженный и длительный послеоперационный болевой синдром.
В настоящее время мы отдаем предпочтение саморасправляющимся эндопротезам (Z-стентам) (81 больной), которую мы применяем с 1999 г. По 2 стента в просвет пищевода установлено у 5 пациентов. У 14 из 81 пациента перед стентированием в качестве подготовительного этапа использовали только бужирование или баллонную дилатацию. В остальных в 83% случаях применяли один из способов электролазерной или фотодинамической реканализации просвета пищевода. После установки стента и стабилизации общего состояния больного у 30 больных была проведена многокурсовая ФДТ с световым воздействием на опухоль пищевода через прозрачную полиэтиленовую стенку стента. Средняя продолжительность жизни больных после одно- или многократной реканализации составила 8 мес.
После реканализации и установления пищеводного стента больной с первого дня мог принимать практически любую пищу. У всех пациентов отмечены улучшение общего состояния, стабилизация и восстановление нормальной массы тела. Продолжительность жизни больных после реканализации и протезирования пищевода составила: до 1 года – у 44 больных, от 1 года до 2 лет – у 23, от 2 до 3 лет – у 14. Максимальная продолжительность жизни больного с протезированием пищевода – 20 мес.
Из осложнений, связанных с реканализацией и стентированием пищевода, во всех случаях отмечалась боль за грудиной разной интенсивности в первые 7-15 дней после установки стента. Интенсивность боли зависела от протяженности и степени исходного стеноза пищевода. После полного расправления стента в течение 5-7 дней болевой синдром полностью исчезал или значительно ослабевал, приема сильнодействующих обезболивающих средств не требовалось.У 2 больных во время реканализации и установки стента произошла частичная перфорация стенки пищевода. На место перфорации был установлен стент, назначено консервативное лечение. При дальнейшем наблюдении не зарегистрировано признаков медиастинита или других осложнений.
Миграция стента в желудок (при раке кардии) и тонкую кишку (при рецидиве рака желудка после гастрэктомии) наблюдалась у 4 пациентов в сроки от 2 нед до 4 мес. У 2 пациентов выполнена повторная установка стента, у 2 – стент удален и продолжено паллиативное лечение в виде многокурсовой реканализации просвета пищевода. У 2 больных произошла миграция стента в проксимальном направлении. В 1 случае потребовались извлечение стента и его повторная установка. У 5 больных через 6-18 месяцев произошло «обрастание» опухолью стента по проксимальному (4) и дистальному (1) краю с развитием дисфагии. У 2 больных в зону стеноза был установлен второй стент, остальным 2 больным проведены электрокоагуляция и ФДТ.
У больных с местно-распространенным раком пищевода при невозможности эндопротезирования мы использовали методику многокурсовой эндоскопической реканализации с интервалом в 1-1,5 мес. Максимальное количество эндоскопических операций – 46 за 3 года лечения.
Таким образом, расширение сферы применения оперативной эндоскопии при раке пищевода как для паллиативного, так и для радикального лечения (при ранней опухолевой патологии у соматически инкурабельных больных), следует считать оправданным. Для повышения эффективности терапии у инкурабельных больных со злокачественными стриктурами пищевода перспективно сочетание оперативной эндоскопии, ФДТ и протезирования.
Материал взят из журнала «Вместе против рака», #4, 2004.