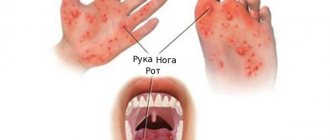
Ротовирусная инфекция представляет собой острую форму патологии, при которой происходит поражение желудочно-кишечного тракта с развитием яркой клинической картины. Симптомы выражаются диспепсическими расстройствами, интоксикацией и обезвоживанием. Состояние является распространенным, встречается у взрослых и детей.
Как может заразиться ребенок
Существуют определенные условия, при которых ребенок может заболеть этой инфекцией. Возникновению заболевания будет способствовать:
- Нерегулярное и неполноценное питание ребенка;
- Низкие гигиенические и санитарные условия, в которых проживает ребенок и его семья;
- Употребление ребенком в пищу некачественных или несвежих продуктов;
- Наличие заболеваний желудка и кишечника;
- Наличие иммунодефицитных состояний (ребенок часто болеет простудными заболеваниями или часто получает лечение антибиотиками)
Источником инфекции при ротавирусном заболевании является человек, который уже болеет этим заболеванием. Он опасен для окружающих начиная с появления первых симптомов и до конца болезни (5-7 дней).
Эта инфекция передается через систему пищеварения. Ребенок может заразиться во время купания в водоеме, где в воде есть ротавирус. Заражение может произойти через грязные руки, посуду, полотенца, салфетки, игрушки и другие предметы, если ими пользовался больной человек. Заболевание у малыша может возникнуть и при употреблении продуктов, в которые попал ротавирус – чаще всего это различные молочные продукты.
Ротавирусная инфекция чаще возникает в осенний или весенний периоды. Этим заболеванием человек может переболеть несколько раз в течение жизни.
От момента заражения до появления у ребенка рвоты, болей в животе или поноса проходит от нескольких часов до нескольких дней.
Расшифровка анализов ребенка врачами-педиатрами онлайн
стоимость услуги: 500 рублей
Заказать
Педиатр расшифрует анализы в режиме онлайн звонка в приложении Zoom или WhatsApp.
- подробное пояснение врача педиатра.
- альтернативное мнение компетентного специалиста по расшифровке анализов.
- возможность задать вопросы врачу, касающиеся результатов анализов.
Как передается вирус
Основной путь передачи ротавирусной инфекции – фекально-оральный. Чаще всего он проникает в организм вместе с зараженными продуктами питания или сырой водой. Вирус хорошо переносит низкие температуры, на протяжении длительного периода времени может сохранять свою жизнеспособность в холодильнике.
Также возможно заражение воздушно-капельным путем. Как и классический, кишечный грипп сопровождается воспалением респираторного тракта. Во время чихания и кашля вирусные частицы вместе с мельчайшими капельками слизи распространяются по воздуху и заражают восприимчивых к заболеванию окружающих людей.
Наверх к содержанию
Симптомы
Нередко случаи заболевания остаются неустановленными, поскольку воспринимаются как обычные расстройства кишечника, проходят самостоятельно, либо при соблюдении режима питания, и не влекут за собой обращение к врачу с обязательной сдачей анализов для выявления возбудителя. Однако в некоторых случаях эта болезнь может приводить к тяжёлым осложнениям у детей из-за больших потерь жидкости.
В начале заболевания у ребенка может появляется:
- Заложенность носа;
- Насморк;
- Кашель;
- Увеличенные подчелюстные или другие группы лимфатические узлы.
При развитии заболевания:
- Боли в животе. Так как вирус поражает кишечник почти на всем его протяжении, то и боли могут быть по всему животу или в разных его отделах.
- Метеоризм. Так как в это время клетки кишечника выделяют в просвет много жидкости, то появляется бульканье и урчание в животе. Пораженный кишечник не может правильно и своевременно переваривать пищу и усваивать ее.
- У малыша появляется рвота. Она может быть 1-2 раза или чаще. Рвота продолжается один-два дня;
- Частый жидкий стул, который может быть в виде желтой воды. Этот симптом появляется одновременно со рвотой, или немного попозже. Жидкий, частый стул у ребенка может продолжаться от нескольких дней до недели. В течение одного дня стул может быть несколько раз, а в тяжелых случаях – больше пятнадцати раз. Это вызвано тем, что пораженные клетки кишечника выделяют много воды.
- Температура тела повышается. Этот симптом у ребенка может держаться один или несколько дней. В эти дни отмечается вялость, снижение аппетита и настроения.
- Бледность кожи;
- Вялость;
- У грудного ребенка можно обнаружить западение большого родничка, глазных яблок. Все это будет следствием обезвоживания у ребенка;
- При тяжелой ротавирусной инфекции у ребенка могут быть судороги.
Диагностика
Чтобы врач мог поставить диагноз «ротавирусная инфекция» необходимо провести исследование кала на наличие в нем частичек генома вируса (этот метод называется «полимеразная цепная реакция»). Кроме того, проводят другие различные исследования крови, мочи и кала. Это позволяет раньше обнаружить инфекцию и предупредить осложнения у ребенка.
В бытовых условиях поставить диагноз этой инфекции заболевшему члену семьи очень сложно. Поэтому консультация врача необходима в любом случае, как бы ни был человек уверен в этом диагнозе и методах его лечения. Существует большое количество инфекционных и неинфекционных заболеваний, протекающих с похожими на ротавирусную инфекцию симптомами.
Например неинфекционные заболевания печени, желудка, кишечника, поджелудочной железы родители могут принять за проявление ротавирусной инфекции. При них заболевший ребенок жалуется на появление тошноты, рвоты, болей в животе после определённой (жирной, острой, жареной) пищи, или указывает на то, что все проявления беспокоят только с одной стороны тела и начались после сильного эмоционального стресса.
Похожие признаки заболевания – могут быть при отравлении лекарственными препаратами или ядовитыми растениями (чаще этим страдают именно дети, если они остаются одни дома и могут добраться до домашней аптечки, или гуляют без присмотра и могут попробовать разные ягоды).
Подробнее о пищевых отравлениях у детей читайте в нашей статье «Рекомендации педиатра при пищевом отравлении у ребенка».
Онлайн консультация Врача-педиатра Текутьевой Ольги Николаевны
Запись онлайн
В рамках консультации вы сможете озвучить свою проблему, врач уточнит ситуацию, расшифрует анализы, ответит на ваши вопросы и даст необходимые рекомендации.
Лечение
Ротавирусная инфекция у разных детей протекает по-разному – в легкой, среднетяжелой и в тяжелой форме. Если рвота и жидкий стул у ребенка не очень частые, то тогда говорят о легкой форме ротавирусной инфекции. Чем чаще будут у малыша рвота и понос, тем больше его организм потеряет жидкости и микроэлементов, тем тяжелее протекает это заболевание. Потеря воды со стулом и рвотой у ребенка приводит к обезвоживанию. Если при частой рвоте и жидком стуле не пытаться понемногу поить больного ребенка, то это может привести к тяжелым последствиям обезвоживания.
Лечение ротавирусной инфекции нужно начинать как можно раньше. К сожалению, сейчас не существует препарата, который бы уничтожал непосредственно ротавирус. Основное лечение – это восстановление потерь жидкости, которая уходит из организма со рвотой и стулом. Ребенку проводят оральную регидратацию – отпаивают в дробном режиме. Лучше всего потери жидкости будут восстанавливать растворы, в которых есть соли натрия, калия и глюкоза.
Где можно заразиться ротавирусом
Как правило, заражение происходит в местах большого скопления народа: в детских садах, школах, офисах, общественном транспорте и пр. Заболевание может проявляться единичными случаями или эпидемическими вспышками, чаще всего случающимися в холодное время года.
Источником распространения инфекции является больной манифестной формой кишечного гриппа (клинически выраженной болезни) или вирусоноситель. Заболевание передается только от человека к человеку.
Наверх к содержанию
Что могут сделать родители до прихода врача
Еще до прихода врача родители должны начинать давать больному ребенку пить. Это можно попробовать делать различными способами. Кто-то из малышей неплохо пьет во время болезни с помощью ложки. Кому-то придется потихоньку вливать жидкость в рот из шприца. Главное, не торопиться и делать это равномерно и регулярно — по 5-20 мл через несколько минут. Если у малыша сохраняется тошнота или рвота, надо сделать промежутки времени между отпаиванием чуть больше, но не прекращать предлагать больному пить. Кроме солевых растворов, полезно поить компотом из сухофруктов, отваром ромашки.
Чтобы снизить проявление симптомов заболевания, используют сорбенты и препараты, содержащие пробиотики. Сорбенты обеспечивают связывание и выведение из организма возбудителя. Для этого могут использоваться угольные, волокнистые, минеральные или синтетические сорбенты, которые эффективно сорбируют и выводят из организма продукты разложения пищи, образующиеся при ферментативной недостаточности, способствуют ускорению регенерации эпителия, снижению метеоризма и болевого синдрома, а также не оказывают влияния на состав нормальной флоры кишечника.
В некоторых ситуациях в лечении могут использоваться ферменты, если у ребенка нарушается переваривание пищи из-за сильного поражения кишечника и поджелудочной железы.
Кроме лекарственных препаратов, важно уделить внимание диете во время заболевания. Чтобы у ребенка не возникала тошнота, еду ему надо давать в небольшом количестве и почаще. Примерно на месяц из питания стоит исключить молочные продукты, свежие овощи, фрукты, макароны, хлебобулочные изделия, сдобную выпечку, конфеты, жареную пищу.
Продукты питания подаются больному в отварном, тушеном или запеченном без корочки виде. Такая пища у ребенка должна быть примерно в течение месяца, а затем потихоньку можно расширять рацион.
Если поторопиться и не соблюдать диету, то выздоровление будет замедляться. Могут возникнуть осложнения и развиваться хронические болезни печени, желудка, кишечника или поджелудочной железы.
Профилактика ротавирусной инфекции
Чтобы не допустить возникновение заболевания, необходимо соблюдать несложные и привычные всем повседневные правила – мыть руки перед едой, при возвращении домой с прогулки, после общения с больным человеком. К этим же правилам надо приучать с самого маленького возраста каждого ребенка. Если в семье кто-то заболел ротавирусной инфекцией или другим инфекционным заболеванием, то у больного должна быть отдельная посуда, полотенце, постельное белье и предметы обихода, которые следует ежедневно замачивать в дезинфицирующих растворах и тщательно мыть горячей водой или кипятить.
Самым эффективным способом профилактики любого инфекционного заболевания, в том числе ротавирусной инфекции является вакцинация, которая может проводиться детям в возрасте от 1,5 до 8 мес. Вакцинация проходит в три этапа с промежутком не менее четырех недель между каждой прививкой. Она представляет собой закапывание в рот малыша капель вакцины. Главное, чтобы в этот момент ребенок был здоров. Тогда, после правильно проведенной вакцинации, ваш малыш будет защищен от очень неприятной ротавирусной инфекции.
Даже после перенесенной ротавирусной инфекции, существует шанс еще раз заболеть этим заболеванием, так как организм не всегда вырабатывает стойкий иммунитет к заболеванию. Поэтому родителям важно всегда соблюдать гигиенические правила и не забывать о вакцинации ребенка.
Алгоритм терапии острых кишечных инфекций у детей
В общей структуре инфекционных заболеваний острые кишечные инфекции (ОКИ) составляют более 40% от всех госпитализированных больных, а в структуре инфекционной заболеваемости занимают второе место после острых респираторных вирусных инфекций (ОРВИ) и гриппа, представляя серьезную проблему педиатрической практики.
По данным периодических отчетов Роспотребнадзора об инфекционных и паразитарных заболеваниях, зарегистрированных в Российской Федерации, в первом полугодии 2015 г. показатель заболеваемости на 100 тыс. населения ОКИ установленной этиологии составил 98,3 человека, а для детского населения — 511,8. Для ОКИ неустановленной этиологии этот показатель за первые 6 месяцев 2015 г. был 170,0, а для детей — 556,6 на 100 тыс. населения. Высокие показатели заболеваемости (от 13,06 до 44,98 на 100 тыс. населения) зарегистрированы в Ненецком, Ханты-Мансийском, Ямало-Ненецком автономных округах, в Томской, Тамбовской, Липецкой, Иркутской, Новосибирской, Амурской, Оренбургской, Кемеровской, Калининградской областях, республиках Коми, Мордовия, Саха [1].
Алгоритм выбора терапевтической тактики при ОКИ начинается с установления этиопатогенетической группы диареи. Наиболее оптимальным является определение этиологии заболевания с использованием методов экспресс-диагностики (например, тесты для диагностики вирусных ОКИ SD BIOLINE Ротавирус, RIDA Quick Ротавирус R-Biopharm AG, Cito Test Rota и другие), позволяющих в кратчайшие сроки установить возбудителя и выбрать дальнейший алгоритм терапии.
К сожалению, в рутинной клинической практике этиология ОКИ в большинстве случаев остается не установленной и терапевтическая тактика определяется на основании этиопатогенетической группы диареи, диагностика которой осуществляется на основании клинических и эпидемиологических данных. Так, водянистые диареи в большинстве случаев обусловлены вирусными агентами и требуют назначения в качестве этиотропной терапии противовирусных препаратов, инвазивные — бактериальными, что подразумевает антибактериальную терапию при наличии соответствующих показаний.
Клиническая дифференциальная диагностика ОКИ основывается на клинических особенностях ведущих синдромов (табл. 1).
Эпидемиологические данные об этиологической структуре ОКИ в настоящее время характеризуются преобладанием вирусных агентов над бактериальными и наличием сочетанных форм у 26,0 ± 1,6% пациентов вирусно-бактериальной и вирусно-вирусной этиологии.
Среди вирусных агентов у детей при первичном инфицировании первое место занимает ротавирусная инфекция (87,6 ± 1,4% среди кишечных моноинфекций вирусной этиологии), среди бактериальных — сальмонеллы, и, как следствие, наиболее частой формой сочетанных форм является сочетанная форма ротавирусной инфекции и сальмонеллеза (9,2% ± 1,1% в общей структуре расшифрованных ОКИ). Среди вирусных ОКИ наиболее значимыми этиологическими факторами являются ротавирусная и норовирусная инфекции, что и определяет данное сочетание как наиболее частое не только при одновременном заражении двумя вирусными агентами, но и при заражении большим числом возбудителей (4,8 ± 0,8% в общей структуре расшифрованных ОКИ).
Оценка эпидемиологического анамнеза заболевания осуществляется по следующей схеме (табл. 2). Он необходим врачу для предположения об этиологии заболевания. Так, пищевой и водный пути передачи более характерны для бактериальных ОКИ, контактно-бытовой — для вирусных агентов. В осенне-зимний период отмечается подъем заболеваемости вирусными ОКИ, в летний — бактериальными.
При проведении клинико-эпидемиологиечского анализа у пациента необходимо учитывать возрастную структуру ОКИ. Для детей во все возрастные периоды достоверно чаще регистрируется ротавирусная инфекция, при этом на ее долю пациентов до 3 лет приходится 83% всех пациентов с установленной ротавирусной инфекцией (р < 0,01) (рис.). Для норовирусной инфекции характерно наибольшее количество пациентов в возрасте от 3 до 7 лет — 43,6 ± 6,7%.
По форме тяжести ОКИ подразделяются на легкую, среднюю и тяжелую. Установление формы тяжести заболевания осуществляется путем интегрального анализа клинических данных:
1) распространенность поражения желудочно-кишечного тракта (ЖКТ) и других органов; 2) интенсивность проявления основных клинических симптомов заболевания; 3) интенсивность проявления основных жалоб пациента [2] (табл. 3).
Установление формы тяжести можно проводить визуально: чем больше пунктов отмечено в блоке 1 и чем больше суммарное количество баллов в блоках 2 и 3, тем более тяжелая форма заболевания отмечается у больного.
Однако более предпочтительным является расчет интегрального индекса клинических симптомов, который осуществляется по формуле:
где показатель А — сумма положительных значений для каждого пункта блока 1; В и С — сумма положительных значений для каждого пункта блоков 2 и 3 соответственно.
Значения данного показателя в пределах от 1% до 35% относятся к легкой форме заболевания, от 36% до 70% — к среднетяжелой, а 71% и более — к тяжелой форме заболевания.
Тяжесть острой кишечной инфекции у детей во многом определяется в зависимости от объема потери жидкости пациентом, при этом особую значимость приобретает правильность оценки степени дегидратации у ребенка, больного ОКИ.
Для диагностики обезвоживания «золотым» стандартом является оценка динамики массы тела пациента. Так, эксикозу I степени соответствует потеря до 5% массы тела, что составляет до 50 мл/кг жидкости, эксикозу II степени — потеря 6–10% массы тела (60–100 мл/кг), эксикозу III степени — потеря более 10% массы тела (110–150 мл/кг). Обезвоживание, характеризующееся потерей массы тела более 20%, не совместимо с жизнью [3].
Однако для педиатрической практики применение метода оценки потери массы тела не всегда является приемлемым. В таком случае на первое место выходит клиническая оценка симптомов дегидратации.
За рубежом довольно широко используется шкала признаков M. H. Gorelick [4]:
- изменение общего состояния (вида) пациента;
- наличие слез;
- капиллярная реперфузия > 2 секунд;
- запавшие глаза;
- снижение диуреза;
- состояние (сухость, тургор) кожи и слизистых;
- основные гемодинамические показатели (частота и наполнение пульса);
- нарушения дыхания.
Оценка формы обезвоживания по данной шкале подразумевает подсчет числа признаков, имеющихся у больного:
- легкое (< 5%) обезвоживание ≤ 2 признаков;
- умеренное (6–9%) обезвоживание 3–5 признаков;
- сильное (> 10%) обезвоживание — 6–7 признаков.
Однако значимость каждого из симптомов обезвоживания в клинической практике может быть не всегда достаточно высокой, особенно при эксикозе I степени (табл. 4).
Схема рекомендованного клинико-лабораторного обследования при ОКИ представлена в табл. 5.
Терапевтическая тактика при ОКИ у конкретного пациента базируется на знании или предположении (на основании клинических особенностей, данные эпидемиологического анамнеза) об этиологии заболевания: бактериальная или вирусная инфекция. Кроме того, необходимо учитывать возраст пациентов, особенности его преморбидного фона и период заболевания.
Схема терапевтической тактики при ОКИ в зависимости от типа диареи и периода заболевания приведена в табл. 6.
Этиотропная терапия является ключевым звеном и имеет три основных направления:
- устранение возбудителя инфекции (антибактериальные, противовирусные, противопаразитарные препараты, бактериофаги);
- связывание возбудителя (специфические антитела и сыворотки, сорбенты);
- выведение (сорбенты) [3, 7].
Всем пациентам вне зависимости от этиологии и формы тяжести заболевания в качестве одного из важных аспектов этиотропной терапии должны быть назначены сорбенты (угольные, синтетические, минеральные, волокнистые). В настоящее время на российской фармацевтическом рынке присутствует достаточно большое количество препаратов, обладающих сорбционными свойствами в различной степени [8]. Назначение энтеросорбентов показано в как можно более ранние сроки болезни — до идентификации возбудителя, что позволяет добиваться «обрывающего» действия на течение ОКИ. Применение энтеросорбентов в поздние сроки заболевания (после 5–7 дня), особенно при инвазивных ОКИ, меньше влияет на диарейный синдром, но оказывает выраженное дезинтоксикационное и энтеропротективное действие. К важным положительным моментам использования энтеросорбентов следует относить и отсутствие влияния этих препаратов на состав облигатной микробиоты кишечника. Курс лечения энтеросорбентами обычно составляет 5–7 дней. Критерий ранней отмены препаратов — стойкая нормализация стула или его задержка в течение 2 суток [7].
Противовирусные препараты рекомендованы при вирусных ОКИ. Противовирусные препараты, рекомендованные при ОКИ и доказавшие свою эффективность в клинических исследованиях: аффинно очищенные антитела к гамма-интерферону человека, интерферон альфа-2b в сочетании с таурином, умифеновир [9–12].
Вопросы антибактериальной терапии ОКИ для практикующего врача остаются одними из самых насущных. К сожалению, большая часть докторов подходит к вопросу назначения антибиотиков шаблонно, без учета этиологии заболевания, рекомендуя их даже при вирусных ОКИ, и без знания данных о чувствительности и резистентности основных бактериальных возбудителей.
Показания к назначению антибактериальных лекарственных средств подразделяются на абсолютные, основные и дополнительные (табл. 7) [7, 13].
Абсолютные показания к назначению антибактериальной терапии имеют абсолютную силу — антибактериальная терапия показана всем пациентам, у которых они установлены. Наличие основных показаний в сочетании с одним из пунктов дополнительных является показанием к назначению антибактериальной терапии. Наличие только дополнительных показаний не является показанием к назначению антибактериальной терапии.
Антибактериальные средства, рекомендованные при ОКИ, подразделяются на два типа: кишечные антисептики и препараты, предназначенные для системного действия. Первая группа может быть рекомендована для назначения в амбулаторно-поликлинической практике, где наиболее оправданной тактикой стартовой терапии ОКИ является использование нитрофуранов (нифуроксазид, нифурантел). Хинолоны (налидиксовая кислота, ципрофлоксацин) хорошо себя зарекомендовали в терапии сальмонеллезов. Цефалоспорины рекомендованы для системной антибактериальной терапии при среднетяжелых и тяжелых ОКИ в условиях стационара. Возможно назначение тетрациклинов, метронидазола, аминогликозидов, хлорамфеникола.
В случае установления диагноза кампилобактериоза наиболее оптимальными для стартовой этиотропной терапии являются макролиды (эритромицин, азитромицин, кларитромицин).
Длительность курса антибактериальной терапии в острой фазе локализованных ОКИ определяется клинической ситуацией и, как правило, составляет не менее 5–7 суток. Показания к смене препарата общепринятые — клиническая неэффективность лекарственного средства в течение 3 суток [7, 14].
Следует подчеркнуть, что в последние годы большинство возбудителей инвазивных ОКИ имеют резистентность к фуразолидону. Сальмонеллы сохраняют высокую чувствительность к фторхинолонам (например, ципрофлоксацин — 96,7% штаммов чувствительны, однако к пефлоксацину 23,3% умеренно устойчивы и 17,2% устойчивы), однако их применение в педиатрической практике ограничено; налидиксовой кислоте (53,1%), амикацину (61,1%), нетилмицину (63,9%), некоторым цефалоспоринам II (цефокситин, цефуроксим) — 86,7–57,9%, III (цефтриаксон, цефотаксим, цефтазидим) — 84,4%, 85,0%, 81,7% и IV поколения (цефепим) — 91,3% чувствительных штаммов.
Обязательным компонентом антибактериальной терапии с момента ее назначения и в периоде реконвалесценции является назначение пробиотиков.
Среди патогенетических методов терапии наиболее важными остаются средства регидратации (оральной, парентеральной), препараты, влияющие на процессы дегидратации (желатина танат), и пробиотики.
Оральная регидратация — необходимый компонент терапии, входящий в перечень терапевтических мероприятий, рекомендованных Всемирной организацией здравоохранения, и назначается всем пациентам с ОКИ. Для оральной регидратации наиболее оправдано использование готовых форм растворов, сбалансированных по электролитному составу и осмолярности (75 мэкв/л натрия и 75 мэкв/л глюкозы и осмолярностью 245 мосм/л).
Оральная регидратация проводится в два этапа.
1-й этап — первичная регидратация представляет собой восполнение потерь, произошедших до момента обращения за медицинской помощью, и рассчитывается на 6 ч. Назначается суммарное количество жидкости 50–80 мл/кг за 6 ч.
2-й этап — поддерживающая регидратация, задачей которой является восполнение текущих потерь жидкости при ОКИ. В сутки назначается 80–100 мл/кг жидкости. Длительность второго этапа оральной регидратации продолжается до момента выздоровления или появления показаний для парентеральной коррекции обезвоживания.
Необходимо учитывать, что коррекция обезвоживания невозможна без использования бессолевых растворов, среди которых предпочтение следует отдать питьевой воде (не минеральной!), возможно использование пектинсодержащих отваров (яблочный компот без сахара, морковно-рисовый отвар). Соотношение глюкозосолевых растворов и питьевой воды должно быть 1:1 при водянистой диарее, 2:1 при выраженной рвоте, 1:2 при инвазивных диареях [3, 15].
Тяжелые формы ОКИ, отсутствие эффекта от оральной регидратации или наличие обильной рвоты, отеков, развитие функциональной (острой) почечной недостаточности являются показаниями для проведения парентеральной регидратации, которая может быть осуществлена с использованием одного из современных отечественных растворов — 1,5% раствора меглюмина натрия сукцинат, доказавшего свою эффективность в интенсивной терапии данных состояний [16].
Использование противодиарейных средств (лоперамид) при ОКИ патогенетически не оправдано, т. к. механизм действия данных препаратов подразумевает снижение моторики ЖКТ (усиление моторики является защитной реакцией организма при остром инфекционном поражении кишечника) и может способствовать усугублению интоксикационного синдрома при ОКИ.
ОКИ любых форм тяжести являются причиной значительных изменений микробиоценоза ЖКТ — например, при дизентерии Зонне у 67,8–85,1% пациентов, при сальмонеллезе — у 95,1%, иерсиниозе — у 94,9%, ротавирусной инфекции — у 37,2–62,8% больных [17–20].
Пробиотики должны назначаться в составе комплексной стартовой терапии вне зависимости от этиологии заболевания в как можно более ранние сроки. Данные препараты показаны также всем пациентам в периоде реконвалесценции с целью восстановления параметров микробиоценоза. Их применение при ОКИ у детей является не только патогенетически обоснованным, но и относится к самому высокому уровню доказательности А — в соответствии с принципами доказательной медицины [21].
Современный взгляд на терапию пробиотиками подразумевает штамм-специфичный подход, который имеет в виду установление в клинических исследованиях терапевтических эффектов, характерных для определенных генетически сертифицированных штаммов и дальнейшее их использование с учетом штамм-специфичных свойств пробиотиков в различных клинических ситуациях [22].
Применительно к острым кишечным инфекциям у детей рабочая группа Европейского общества педиатров?гастроэнтерологов, гепатологов и нутрициологов (European Society for Paediatric Gastroenterology, Hepatology and Nutrition, ESPGHAN) в 2014 г. на основе анализа опубликованных систематических обзоров и результатов рандомизированных клинических исследований, в том числе плацебо-контролируемых, опубликовала меморандум, в котором рекомендовала (несмотря на низкий уровень доказательной базы по мнению экспертов) в терапии острых кишечных инфекций несколько пробиотических штаммов: Lactobacillus GG, Saccharomyces boulardii, Lactobacillus reuteri штамм DSM 17938 (исходный штамм ATCC 55730), а также к этой группе пробиотиков был отнесен термически инактивированный штамм Lactobacillus acidophilus LB, который формально к пробиотикам как живым микроорганизмам с заданными полезными свойствами отнесен быть не может, однако он показал свою эффективность при острых инфекционных гастроэнтеритах [23].
В настоящее время пробиотические штаммы Bifidobacterium lactis BB-12, Escherichia coli Nissle 1917, Lactobacillus acidophilus, Bacillus clausii относят к группе микроорганизмов, для которых данных об эффективности их применения в остром периоде ОКИ недостаточно. Однако уже проведенные ранее исследования показали наличие клинически значимых положительных свойств, эффективность и безопасность их применения при ОКИ, постинфекционном синдроме избыточного бактериального роста и профилактике нарушений микробиоценоза ЖКТ на фоне антибактериальной терапии. Таким образом, спектр штаммов, которые могут быть рекомендованы в терапии ОКИ, требует дальнейшего изучения.
В этой связи наиболее перспективными пробиотическими штаммами являются микроорганизмы, характеризующиеся высокой способностью к адгезии, устойчивостью к действию агрессивных сред ЖКТ человека (соляная кислота, желчь) и относящиеся к категории донорских.
Среди таких пробиотических штаммов можно выделить микроорганизмы рода Bifidobacterium. Бифидобактерии относятся к доминирующему виду в микробиоценозе ЖКТ человека — их удельный вес в составе микробиоценозов составляет от 85% до 98%. Для этого рода характерна высокая способность к адгезии, ведущая роль в обеспечении колонизационной резистентности организма, регуляции обмена жиров, белков и минералов, синтезе биологически активных веществ, в том числе витаминов. Наиболее изученными являются штаммы Bifidobacterium longum и Bifidobacterium animalis lactis.
Одной из линеек пробиотических препаратов, которые могут быть рекомендованы для комплексной терапии ОКИ у детей, являются пробиотические средства Бифиформ.
В состав Бифиформ Бэби входят Bifidobacterium BB-12 1 × 108 КОЕ и Streptococcus thermophilus TH-4 1 × 107 КОЕ.
Доклинические исследования Bifidobacterium lactis BB-12, который является компонентом естественной биопленки кишечника здоровых людей, продемонстрировали его способность к высокоуровневой адгезии к поверхностям с муцином (использовались поликарбонатные луночные планшеты), без муцина и пленкам клеточных культур (Caco-2, HT29?MTX) [14], в том числе на фоне ротавирусной инфекции и после нее [24, 25].
Для данного штамма показана антагонистическая активность к целому спектру патогенных возбудителей (Bacillus cereus, Clostridium difficile, Clostridium perfringens Type A, Escherichia coli, Listeria monocytogenes, Pseudomonas aeruginosa, Salmonella enterica subsp enterica serovar Typhimurium, Salmonella enterica subsp. enterica serovar Typhi, Shigella flexneri, Shigella sonnei, Campylobacter jejuni и Candida albicans) [26, 27], что делает его использование предпочтительным при ОКИ бактериальной этиологии.
Bifidobacterium lactis BB-12 устойчив к действию агрессивных сред организма человека — соляной кислоты и желчи, за счет синтеза рН-зависимой АТФ-азы, регулирующей кислотно-основной баланс внутри бактерии [28] и наличия гидролазы солей желчных кислот, позволяющей бактерии сохранять активность в присутствии желчи [29].
Особого внимания заслуживают пациенты, которые нуждаются в терапии антибактериальными лекарственными средствами. Вызванные течением инфекционного процесса изменения микробиоты ЖКТ могут усугубляться под действием антибиотиков. Поэтому данная категория пациентов нуждается во включении в состав комплексной терапии ОКИ пробиотических лекарственных средств, направленных на поддержание микробиоценоза. Bifidobacterium lactis BB-12 обладает резистентностью к таким антибиотикам, как гентамицин, стрептомицин, полимиксин В, налидиксовая кислота, канамицин, неомицин, циклосерин, тетрациклин, что делает его штаммом выбора при назначении пациентам данных антибактериальных средств, например при острых кишечных инфекциях (сальмонеллез, шигеллез) [30].
Проведенные плацебо-контролируемые исследования показали, что помимо терапевтических свойств, штамму Bifidobacterium lactis BB-12 присущи и профилактические. В частности, применение его снижает риск развития инфекций ЖКТ, в том числе ротавирусной, связанных с оказанием медицинской помощи [31, 32].
Следует отметить, что высокий профиль безопасности данного штамма был утвержден регуляторными органами в Европе — в 2008 г. Европейское агентство по безопасности продуктов питания (European Food Safety Authority, EFSA) присвоило ему статус Qualified Presumption of Safety (безусловной безопасности) — и в США, где признан Управлением по контролю за пищевыми продуктами и лекарственными средствами (Food and Drug Administration, FDA) безопасным (Generally Regarded As Safe (GRAS)).
Streptococcus thermophilus, входящий в состав Бифиформ Бэби, в исследованиях демонстрировал антагонистическое действие в отношении возбудителей ОКИ, в частности, была показана его эффективность в профилактике диареи путешественника.
Для данного штамма были показаны симбиотические отношения с Lactobacillus bulgariсus.
Бифиформ Бэби предназначен для детей с первых дней жизни и до 2 лет. Суточная доза (отметка на пипетке соответствует 1 дозе) составляет 0,5 г ~ 0,5 мл. Применяется 1 раз в день во время приема пищи. Наиболее оптимальным является использование его при проведении антибактериальной терапии ОКИ, в периоде реконвалесценции, а также с профилактической целью (например, при выезде с ребенком на отдых, посещении общественных мероприятий, бассейна).
Капсулы Бифиформ включают в состав Bifidobacterium longum, также являющийся донорским штаммом и характеризующийся выраженной антагонистической активностью в отношении патогенных и условно-патогенных микроорганизмов. Включение в препарат апатогенного Enterococcus faecium, не относящегося к не рекомендованным для применения в педиатрической практике [23], а в норме колонизирующего тонкий кишечник, позволяет оказывать положительное воздействие на состояние и пищеварительные функции не только толстого, но и тонкого кишечника, особенно при наличии бродильной диспепсии и явлений метеоризма.
Препарат показан детям старше 2 лет. При острой диарее препарат принимают по 1 капсуле 4 раза в день до нормализации стула. Затем прием препарата необходимо продолжить в дозе 2–3 капсулы в сутки до полного исчезновения симптомов. Для нормализации микробиоты кишечника и поддержки иммунной системы препарат назначают в дозе 2–3 капсулы в сутки 10–21 день. Детям с 2 лет по 1 капсуле 2–3 раза в день.
Симптоматическая терапия включает терапию лихорадочных состояний. Жаропонижающие средства показаны не всем пациентам, т. к. повышение температуры является адаптационной реакцией организма на инфекцию, создающей оптимальные условия для иммунной перестройки организма. Назначение данной категории лекарственных средств показано всем больным при гипертермии, а при наличии тяжелой сопутствующей патологии — при лихорадке более 38,5 °С.
Развитие вторичной панкреатической недостаточности, обострения хронической патологии поджелудочной железы нередко наблюдается в периоде репарации и реконвалесценции ОКИ. Следует обратить внимание, что при норовирусной инфекции поражение поджелудочной железы отмечается чаще, чем при ОКИ другой этиологии. В таких случаях показано назначение ферментных препаратов, предпочтительно в минимикросферической форме. Следует учесть, что в остром периоде ОКИ ферментные препараты не показаны. Наиболее оптимальным сроком их назначения при наличии показаний является 5–6 сутки, критерием назначения является появление аппетита у пациента.
Для купирования упорной рвоты можно использовать прокинетики и противорвотные препараты: метоклопрамид, домперидон, прометазин, 0,25% новокаин — 1 ложку (чайную, десертную, столовую по возрасту) [3, 7].
Критерии оценки эффективности лечения:
- клинические (купирование интоксикационного синдрома, нормализация температуры, купирование рвоты, диареи и др. симптомов);
- клинико-лабораторные (стойкая нормализация гемограммы, копроцитограммы, отрицательные результаты при бактериологическом и ПЦР-обследовании).
В связи с тем, что санация от возбудителя, полная репарация кишечника и восстановление его нарушенных функций наступают значительно позже, чем исчезают клинические проявления болезни, целесообразно проводить динамическое наблюдение за пациентами, перенесшими ОКИ.
Таким образом, острые кишечные инфекции требуют от врача особых подходов к диагностике, тактике ведения и терапии. При курации пациентов с острыми кишечными инфекциями следует учесть, что даже легкие формы приводят к существенным изменениям микробиоты ЖКТ у детей, что требует использования пробиотических препаратов не только в остром периоде заболевания, но и в периоде реконвалесценции.
Литература
- Сведения об инфекционных и паразитарных заболеваниях (Форма 1) за январь–июнь 2015. www.rospotrebnadzor.ru (https://www.rospotrebnadzor.ru/activities/statistical-materials/statictic_details.php? ELEMENT_ID=3919). Вход 10.08.2015.
- Горелов А. В., Плоскирева А. А. и др. Заявка № 2012156024 на изобретение «Способ оценки тяжести острых кишечных инфекций у детей», 2014.
- Горелов А. В., Милютина Л. Н., Усенко Д. В. Тактика комплексной терапии острых кишечных инфекций у детей // Вопросы современной педиатрии. 2003; 2: 82–85.
- Gorelick M. H., Shaw K. N., Murphy K. O. Vaildity and reliability of clinical signs in the diagnosis of dehydration in children // Pediatrics. 1997; 99 (5), E6.
- Kimberly Pringle at al. Comparing the accuracy of the three popular clinical dehydration scales in children with diarrhea // Int J Emerg Med. 2011; 4: 58. Published online 2011 Sep 9.
- Adam C. Levine at al. Prediction of Severe Disease in Children with Diarrhea in a Resource-Limited Setting // PLoS One. 2013; 8 (12): e82386. Published online 2013 Dec 3.
- Горелов А. В., Милютина Л. Н., Усенко Д. В. Клинические рекомендации по диагностике и лечению острых кишечных инфекций у детей. М., 2006. 49 с.
- Щербаков П. Л., Петухов В. А. Сравнительная эффективность энтеросорбентов при диарее у детей // Вопросы современной педиатрии. 2005; 4 (4): 86–90.
- Горелов А. В., Плоскирева А. А., Тхакушинова Н. Х. Клинико-вирусологическая оценка эффективности индуктора интерферона, содержащего антитела к гамма-интерферону в релиз-активной форме, в терапии острых вирусных кишечных инфекций // Инфекционные болезни. 2012; 10 (3): 3.
- Левин Д. Ю., Кадура А. А. Эффективность использования препарата арбидол при ротавирусной инфекции у детей // Бюллетень медицинских интернет-конференций. 2013; 3 (2): 188.
- Литяева Л. А., Ковалева О. В., Якубович И. С. Особенности острых кишечных инфекций у детей в Оренбургской области // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2013; 6: 39–42.
- Горелов А. В., Феклисова Л. В., Плоскирева А. А. и др. Новые возможности в терапии острых кишечных инфекций у детей // Инфекционные болезни. 2012; 10 (1); 42–49.
- Guarino A., Albano F., Ashkenazi S., Gendrel D., Hoekstra J. H., Shamir R., Szajewska H. European Society for Paediatric Gastroenterology, Hepatology and Nutrition/European Society for Paediatric Infectious Diseases Evidence-based Guidelines for the Management of Acute Gastroenteritis in Children in Europe // J Pediat Gastroenterol Nutr. 2008. Vol. 46, Suppl. 2, 81–122.
- Каджаева Э. Н., Усенко Д. В., Горелов А. В., Ардатская М. Д. Современные нитрофураны в лечении кишечных инфекций у детей // Фарматека. 2007; 13: 79–82.
- Малеев В. В., Горелов А. В., Усенко Д. В., Кулешов К. И. Актуальные проблемы, итоги и перспективы изучения острых кишечных инфекций // Эпидемиология и инфекционные болезни. 2014. № 1. С. 4.
- Плоскирева А. А., Горелов А. В., Жучкова С. Н. и др. Современные подходы к интенсивной терапии острых кишечных инфекций у детей // Инфекционные болезни. 2012; 10 (1): 50–55.
- Железова Л. И. Клинико-лабораторные особенности микроэкологических нарушений слизистой толстой кишки при острых кишечных инфекциях у детей. 2006.
- Крамарь Л. В., Родионова Н. В., Арова А. А. Микроэкологические особенности кишечного биоценоза детей первого года жизни при острых кишечных инфекциях // Фундаментальные исследования. 2014. № 2. С. 90–93.
- Битиева Р. Л. Оценка новых подходов к диагностике и терапии ротавирусной инфекции у детей. Автореф. дис. … канд. мед. наук. М., 2007.
- Allen S. J., Martinez E. G., Gregorio G. V. et al. Probiotics for treating acute infectious diarrhoea // Cochrane Database Syst Rev. 2010; CD003048.
- Кligler B., Cohrssen A. Probiotics // Am Fam Physician. 2008 Nov 1; 78 (9): 1073–1078.
- Szajewska H. Advances and limitations of evidence-based medicine — impact for probiotics // Ann Nutr Metab 2010; 57 (suppl): 6–9. Rijkers G. T., Bengmark S., Enck P. et al. Guidance for substantiating the evidence for beneficial effects of probiotics: current status and recommendations for future research // J Nutr. 2010; 140: S671–S676.
- Szajewska H., Guarino A., Hojsak I., Indrio F., Kolacek S., Shamir R., Vandenplas Y., Weizman Z. Use of probiotics for management of acute gastroenteritis: a position paper by the ESPGHAN Working Group for Probiotics and Prebiotics // J Pediatr Gastroenterol Nutr. 2014 Apr; 58 (4): 531–539.
- Laparra J. M., Sanz Y. Comparison of in vitro models to study bacterial adhesion to the intestinal epithelium // Lett Appl Microbiol. 2009 Dec; 49 (6): 695–701.
- Juntunen M., Kirjavainen P. V., Ouwehand A. C., Salminen S. J., Isolauri E. Adherence of probiotic bacteria to human intestinal mucus in healthy infants and during rotavirus infection // Clin Diagn Lab Immunol. 2001 Mar; 8 (2): 293–296.
- Martins F. S., Silva A. A., Vieira A. T., Barbosa F. H., Arantes R. M., Teixeira M. M., Nicoli J. R. Comparative study of Bifidobacterium animalis, Escherichia coli, Lactobacillus casei and Saccharomyces boulardii probiotic properties // Arch. Microbiol. 2009, 191, 623–630.
- Collado M. C., Meriluoto J., Salminen S. Role of commercial probiotic strains against human pathogen adhesion to intestinal mucus // Lett. Appl. Microbiol. 2007, 45, 454–460.
- Matsumoto M., Ohishi H., Benno Y. H+-ATPase activity in Bifidobacterium with special reference to acid tolerance // Int J Food Microbiol. 2004 May 15; 93 (1): 109–13.
- Garrigues C., Stuer-Lauridsen B., Johansen E. Characterisation of Bifidobacterium animalissubsp. lactis BB-12 and other probiotic bacteria using genomics, transcriptomics and proteomics // Aust. J. Dairy Technol. 2005, 60, 84–92.
- Amund O. D., Ouoba L. I., Sutherland J. P., Ghoddusi H. B. Assessing the effects of exposure to environmental stress on some functional properties of Bifidobacteriumanimalis ssp. Lactis // Benef Microbes. 2014 Dec; 5 (4): 461–469.
- Saavedra J. M., Bauman N. A., Oung I., Perman J. A., Yolken R. H. Feeding of Bifidobacterium bifidum and Streptococcus thermophilus to infants in hospital for prevention of diarrhoea and shedding of rotavirus // Lancet. 1994, 344, 1046–1049.
- Chatterjee S., Kar P., Das T., Ray S., Ganguly S., Rajendiran C., Mitra M. Randomised placebo-controlled double blind multicentric trial on efficacy and safety of Lactobacillus acidophilus LA-5® and Bifidobacterium BB-12® for prevention of antibiotic-associated diarrhoea // JAPI. 2013, 61, 708–712.
А. А. Плоскирева1, кандидат медицинских наук А. В. Горелов, доктор медицинских наук, профессор
ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Москва
1 Контактная информация