Синдром раздраженного кишечника у детей: основные причины и подходы к терапии
В развитие заболевания имеют значение личностные и психологические аспекты, генетическая предрасположенность, факторы питания, изменение висцеральной гиперчувствительности, нарушения моторной активности и нейроэндокринной системы (ось «головной мозг — кишечник»), повышение проницаемости кишки, нарушение состава кишечной микробиоты. Качественные и количественные изменения микрофлоры оказывают влияние на функцию кишечника, выступая в качестве причины нарушений его двигательной активности, чувствительности и нейроиммунных взаимоотношений, включая нарушение экспрессии рецепторов слизистой оболочки и изменения функции гипоталамо-гипофизарно-надпочечниковой системы. В педиатрической практике возможности использования медикаментозных препаратов значительно ограничены возрастом пациентов. В терапии предпочтение необходимо отдавать селективным препаратам, влияющим на висцеральную чувствительность и пробиотикам с доказанной эффективностью и безопасностью штаммов.
Сведения об авторах:
Захарова Ирина Николаевна – д.м.н., профессор, заведующая кафедрой педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России;; e-mail: [email protected]
Сугян Нарине Григорьевна – кандидат медицинских наук, доцент кафедры педиатрии педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России;
Бережная Ирина Владимировна — кандидат медицинских наук, доцент кафедры педиатрии педиатрии им. Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России.
Ключевые слова: дети, синдром раздраженной кишки, прокинетики, тримебутин, необутин, пробиотики, максилак.
Синдром раздраженного кишечника (СРК) является самым распространенным функциональным заболеванием кишечника у взрослых, представляя значимую социальную проблему с негативным влиянием на качество жизни. В большинстве стран мира частота встречаемости СРК составляет в среднем около 20%, варьируя от 9 до 48%. Мало информации о распространенности СРК у детей, например, в США по данным разных авторов частота составляет от 1,2 до 2,9% [1]. Оценить распространенность СРК в популяции трудно, т. к. статистические данные значимо различаются даже в разных регионах одной страны. Эпидемиологические показатели, обобщенные по данным опросников в разных странах мира, показывают, что чифры колеблются от 10 до 25%. По данным мета-анализа, суммарная распространенность заболевания оказалась около 11,2% (95% ДИ, 9,8–12,8) с различием в регионах земного шара: от самой низкой в Южной Азии (7%) до самой высокой в Южной Америке (21%). Показано, что первые несколько месяцев после установки диагноза «СРК» больные переносят до 4 атак с выраженной болью в животе. В дальнейшем у 30–40% увеличиваются светлые промежутки между обострениями. Примерно у половины пациентов с СРК (45%) развиваются хронические заболевания верхних отделов ЖКТ (диспепсия, хронический гастрит, ГЭРБ и др.) через несколько лет течения СРК.
Функциональные нарушения ЖКТ одна из самых загадочных проблем современной медицины, так как, несмотря на огромный спектр диагностических процедур, до конца понять этиологию и патогенез не представляется возможным. Уже около 30 лет мы используем клинические рекомендации, известные под названием Римские критерии. В 2016 году вышла новая редакция клинических рекомендаций функциональных нарушений ЖКТ – Рим IV, в которые входят разделы функциональных гастроинтестинальных расстройств ФГИР) у взрослых, детей и подростков. Появившаяся доказательная база в течение последних 10 лет обеспечила основу для рекомендаций «Рим IV пересмотра». При некоторых расстройствах органов пищеварения комитет использовал клинический опыт и консенсус членов комитета, все еще не имея достоверных научных данных, для этих разделов. В научной литературе можно встретить разные интерпретации перевода «functional gastrointestinal disorders» — функциональные гастроинтестинальные расстройства (ФГИР), функциональные расстройства органов пищеварения (ФРОП) и другие. ФРОП более полно отражает проблему, так как консенсус охватывает функциональные нарушения верхних и нижних отделов ЖКТ и расстройства билиарного тракта.
В критериях Рима III подчеркивалось, что для установления функциональных нарушений нужно исключить органическое заболевание. В Римских критериях IV пересмотра фраза «нет доказательств в пользу воспалительного, анатомического, метаболического или неопластического процесса, объясняющего симптомы у субъекта» был удален из диагностических критериев [2]. Вместо этого добавлено «после соответствующего медицинского обследования, симптомы не могут быть отнесены к другому заболеванию». Это изменение позволяет выборочное обследование для подтверждения положительного диагноза ФРОП. Также отмечено, что ФРОП могут сосуществовать с другими органическими и хроническими воспалительными заболеваниями [3]. Точно так же у одного пациента могут быть разные ФРОП. В последней версии рекомендаций международного консенсуса Римские критерии-IV (Rome-IV), опубликованной в 2016 г., функциональные кишечные расстройства рассматриваются как спектр кишечных симптомов в 6 категориях, которые определяются как расстройства взаимодействия «кишка — головной мозг» («ЖКТ — ЦНС (центральная нервная система») (disorders of gut-brain interaction) [4].
В новую редакцию Римских критериев IV (2016) включены новые расстройства, это функциональная тошнота и функциональная рвота. Изменена формулировка «боль в животе, связанная с функциональными желудочно-кишечными расстройствами» на «функциональные абдоминальные болевые расстройства». В эту группу внесен новый термин — функциональная абдоминальная боль (иным образом «FAP-NOS») для описания детей абдоминальной болью, диагностические критерии которых недостаточны для включения под определенное расстройство, например, СРК, функциональная диспепсия или абдоминальная мигрень.
Термин «дискомфорт» в новой редакции Римских критериях IV изъят из определения, поскольку сложно проводить грань между дискомфортом и абдоминальной болью у детей. Кроме того, как диагностический критерий, отсутствуют такие жалобы, как вздутие, растяжение или другие ощущения пациента [5].
В основе ФРОП лежат комбинированные физиологические и морфологические отклонения, связанные с висцеральной гиперчувствительностью, нарушениями моторики ЖКТ, защитного слизистого барьера, иммунной функции и состава кишечной микробиоты, а также расстройствами со стороны ЦНС.
В развитии ФРОП у детей в раннем возрасте немаловажную роль играют такие факторы, как морфофункциональная незрелость, недостаточная активность панкреатических и гастроинтестинальных ферментов, нарушение микробиоценоза, недостаточность мукозального иммунитета. В более старшем возрасте висцеральная гиперчувствительность обусловлена совокупностью факторов: социальными взаимоотношениями, стрессом, переутомлением, нарушением режима дня, отдыха.
В основе развития СРК лежит взаимодействие двух основных патогенетических механизмов: психосоциального воздействия и нарушения моторной функции толстой кишки, что проявляется повышением висцеральной чувствительности и нарушением двигательной функции кишки (таблица 1).
Таблица 1. Диагностические критерии СРК для детей (признаки должны присутствовать не менее 2 месяцев) [1].
| Должны присутствовать следующие симптомы: | |
| 1. Абдоминальная боль не менее 4 дней в месяц, ассоциированная с 1 или более из следующих симптомов: | а. связано с дефекацией; б. ассоциирована изменением частоты опорожнения; c. ассоциирована с изменением формы (внешнего вида) стула. |
| 2. При СРК с запором боль не проходит после опорожнения (если боль проходит после опорожнения, то у ребенка функциональный запор, а не СРК). | |
| 3. После соответствующей оценки симптомы не могут быть отнесены под другое заболевание. | |
Боль может быть различной интенсивности, локализуется, как правило, внизу живота, хотя может отмечаться и в других его отделах. Она часто усиливается при погрешностях в диете, психоэмоциональной нагрузке, переживаниях, также при физической нагрузке. Важно отметить, что абдоминальная боль исчезает в ночное время, когда ребенок спит.
Если боль проходит после опорожнения, то в этом случае, скорее всего, у ребенка имеет место функциональный запор, а не СРК с запором. Установлено, что у 75% детей, страдающих запором, присутствует абдоминальная боль, что подпадает под критерии СРК. Но и пациенты с СРК длительно наблюдаются с диагнозом функциональный запор не получая эффективной медицинской помощи. Комитет рекомендует пациентам с запором и абдоминальной болью на начальном этапе проводить лечение только от запора. Если боль в животе проходит после лечения запора, то у пациента функциональный запор. Если боль не проходит, вероятно, у ребенка имеет место СРК с запором. Аналогично, в случае возможного СРК с диареей. На первом этапе нужно исключить кишечную инфекцию с рецидивирующим, хроническим течением, целиакию, мальабсорбцию углеводов и реже воспалительное заболевание кишечника. Важно обратить внимание на тревожные сигналы («симптомы тревоги», «красные флаги»), при наличии которых нужно исключить органическую патологию органов ЖКТ. Указывается, что чем больше присутствует тревожных симптомов, тем выше вероятность органического заболевания (Таблица 2). Определение фекального кальпротектина все чаще используется как неинвазивный скрининг для исключения воспалительного заболевания кишечника (ВЗК) [6].
Таблица 2. Симптомы тревоги у пациентов с ФРОП.
| Семейный анамнез воспалительного заболевания кишечника, целиакии или язвенная болезнь; |
| Постоянная боль в правом верхнем или правом нижнем квадранте; |
| Дисфагия, одинофагия; |
| Рецидивирующая рвота; |
| Кровотечения из органов желудочно-кишечного тракта; |
| Ночная диарея; |
| Артрит; |
| Периректальные поражения; |
| Немотивированное похудание, потеря веса, недостаточность питания; |
| Задержка полового созревания; |
| Необъяснимая лихорадка; |
У детей, как и у взрослых, СРК можно разделить на разные типы, отражающие преобладающий характер стула (СРК с запор, СРК с диареей, СРК с запором и диарея и неуточненный СРК) и эти типы теперь включены в Рим IV [7].
Таблица 3. Функциональные расстройства органов пищеварения: нарушение взаимодействия ЖКТ и ЦНС по данным Римских критериев IV (коды Рим IV и МКБ-10).
| С. Кишечные расстройства | ||
| С.1 Синдром раздраженного кишечника (СРК) | СРК с преобладанием запора (СРК-3) СРК с преобладанием диареи (СРК-Д) СРК смешанного типа (СРК-См) Неклассифицируемый СРК (СРК-Н) | |
| Формулировка | Коды Рим IV | МКБ-10 |
| Функциональный запор | С.2 | K59.0 запор K58.2 Синдром раздраженного кишечника с преобладанием запоров |
| Функциональный понос | С.3 | K59.1 Функциональная диарея K58.1 Синдром раздраженного кишечника с преобладанием диареи |
| Функциональное абдоминальное вздутие/растяжение | С.4 | R14 Метеоризм и родственные состояния K59.9 Функциональное нарушение кишечника неуточненное K58.8 Другой или неуточненный синдром раздраженного кишечника |
| Неспецифическое функциональное кишечное расстройство | С.5 | K59.2 Неврогенная возбудимость кишечника, не классифицированная в других рубриках K58.3 Синдром раздраженного кишечника со смешанными проявлениями |
| Опиоид-индуцированный запор | С.6 | K59.0 Запор |
Сложность этио-патогенеза заболевания у детей объясняется совокупностью факторов: личностные психологические аспекты, генетическая предрасположенность, факторы питания, развитие висцеральной гиперчувствительности, нарушения моторной активности, изменения в нейроэндокринной системе (ось «головной мозг — кишечник»), повышение проницаемости кишечника, нарушение состава кишечной микробиоты.
В научных исследованиях показано, что висцеральная гиперчувствительность может быть связана с детским психологическим стрессом (тревога, депрессия, импульсивность, гнев) [8].
У детей с СРК могут наблюдаться повышенный уровень стресса, беспокойства, депрессии и эмоциональных проблем, о которых они сообщают сами [9]. Тяжелые заболевания, требующие медицинского инвазивного вмешательства в раннем возрасте (например, операция) связаны с более высоким риском развития ФРОП у детей, включая СРК [10].
Патофизиология СРК включает воздействие внешних раздражающих факторов (стресс, высокая эмоциональная нагрузка, недостаток сна и т. д.), что возбуждает ЦНС, вегетативный ответ, с воздействием на нейроэндокринную систему кишечника, включая гипоталамо-гипофизарно-надпочечниковую (кортизол) систему. Это нарушает двигательную активность кишечника, усиливает спазм гладкой мускулатуры, нарушает пассаж кишечного содержимого. С другой стороны, изменения двигательной активности кишечника приводят к перевозбуждению внутрикишечных нервных волокон, клеток Кахаля, усиливая спазм гладких мышц, изменяется микробиота, что влияет на среду и синтез КЖК. Таким образом, возникает порочный круг (таблица 4).
Таблица 4. Патофизиология развития СРК: связь «головной мозг – кишка» [11].
| Нарушение функционирования оси «головной мозг – кишка» | ||
| Кортикотропин-релизинг-фактор (CRF) | Активация энтеральной нервной системы | Изменение микробиоты |
| Активирует CRF-1 рецепторы → усиление моторики при стрессе Провоспалительная активность → увеличение синтеза ИЛ-1 и ИЛ-2 Усиление ответа на эндотоксины Повышение уровня кортизола и адреналина Повышение сенситивности кишечных нервов | Избыточное высвобождение Нейротрансмиттеров → нарушение перистальтики Повышенная дегрануляция тучных клеток → нарушение серотонинового сигнального каскада Дисбаланс синтеза провоспалительных и воспалительных медиаторов Повышение проницаемости кишечного барьера | Нарушение местного иммунитета Экспрессия синтеза нейротрансмиттеров (серотонин, ГАМК, гистамин, ацетилхолин, мелатонин и др.) Нарушение слизистого барьера и микробной биопленки Модуляция кишечной чувствительности афферентных волокон |
Часто СРК развивается после перенесенной острой кишечной инфекции, отмечено повышение содержания провоспалительных цитокинов в слизистой оболочке ЖКТ и развивается постинфекционный СРК [12]. Систематический обзор, опубликованный в 2015 году, показал частоту регистрации постинфекционной функциональной диспепсии и СРК в популяции, включая детей 10,0% (ФД, n = 976; ОГЭ, n = 9737) и 13,1% (СРК, n = 1128; ОГЭ, n = 8624), соответственно. Так же указано длительное сохранение расстройств, установлено, что через 1 год после перенесенного о. гастроэнтерита постинфекционная функциональная диспепсия сохранилась у 13,5 % пациентов (n = 380; ОГЭ n = 2807) и синдром раздраженной кишки у 38,9% детей (n = 86 ; ОГЭ n = 221) [13].
В другом исследовании указана роль паразитарной инфекции (Balantidiumcoli, Strongyloidesstercoralis, Ascarislumbricoides, Necatoramericanus, Ancylostomaduodenale, Taeniasolium, Taeniasaginataи Hymenolepisnana) в развитии постинфекционных ФРОП, в частности в развитии СРК (OР составил: 1,69), функционального запора (Oр: 4,13) [14].
Роли кишечной микробиоты в патофизиологии СРК в настоящее время посвящено большое количество экспериментальных и клинических исследований. Были продемонстрированы изменения в микробиоме кишечника, хотя неясно, являются ли эти изменения причиной или результатом СРК и его симптомов [15].
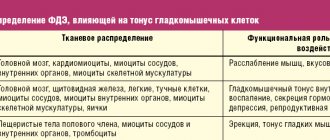
Установлено, что качественные и количественные изменения микрофлоры оказывают влияние на функцию кишечника, выступая в качестве причины нарушений его двигательной активности, чувствительности и нейроиммунных взаимоотношений, включая нарушение экспрессии рецепторов слизистой оболочки и изменения функции гипоталамо-гипофизарно-надпочечниковой системы. Известно, что кишечная микрофлора утилизирует нерастворимые углеводы и выделяются метаболиты, среди них важное значение имеют короткоцепочечные жирные кислоты (уксусная, пропионовая и масляная кислоты). Именно эти короткоцепочечные жирные кислоты (КЦЖК) в разных отделах толстой кишки оказывают противоположное влияние на моторную ее активность, через стимуляцию определенных рецепторов, вырабатывающих биологически активные вещества. В проксимальных отделах толстой кишки КЦЖК стимулируют рецепторы L-клеток, которые вырабатывают регуляторный полипептид PYY, замедляющий двигательную активность не только толстой, но и тонкой кишки. А в дистальных отделах КЦЖК стимулируют рецепторы Ecl-клеток, вырабатывающих гистамин, который, действуя на 5-HT 4-рецепторы афферентных волокон блуждающего нерва, инициирует рефлекторное ускорение моторики. Среди КЦЖК, важное значение для колоноцитов имеет масляная кислота (бутират), которая является важнейшим энергетическим источником для колоноцитов, синтеза липидов мембран, защитного барьера и проницаемости слизистой оболочки толстой кишки, подавления окислительного стресса, воспаления, колоректального канцерогенеза, восстановления водно-электролитного баланса. Кроме этого, масляная кислота (бутират) оказывает регулирующее влияние на кишечную моторику [16].S.A.Vanhoutvin с соавт. изучали влияние масляной кислоты (бутирата) на висцеральную гиперчувствительность у здоровых добровольцев. Участникам исследования ректально вводили масляную кислоту. Результаты исследования показали, что введение масляной кислоты повышало порог болевой чувствительности и снижало боль и дискомфорт, вызванные раздуванием ректального баллона, что оценивалось по аналоговой шкале. При этом отмечено, что введение бутирата имело дозозависимый эффект, чем выше была доза бутирата, тем больше снижалась висцеральная чувствительность [17].
Применение одного из штаммов Bifidobacterium bifidum у пациентов с симптомами СРК приводило к значимому снижению таких симптомов как боль/дискомфорт в животе, метеоризм, нарушение пищеварения у 57% пациентов по сравнению с 21% в группе плацебо [19].
В метаанализе проводилась оценка результатов 24 клинических исследований с участием 2001 пациентов с СРК. Результаты анализа показали достоверное уменьшение симптомов боли и общих симптомов у пациентов при применении мультиштаммовых пробиотиков. Мультиштаммовые пробиотики оценивались в 12 РКИ с участием 1197 пациентов со значительным влиянием на симптом абдоминальной боли (ОР = 0,81; 95% ДИ 0,67–0,98, р
По данным исследований, проведенных у пациентов с СРК, с применением различных пробиотиков и их комбинаций установлено, что:
- L. rhamnosus LGG., L. Rhamnosus, B. animalis B. lactis – способствуют стабилизации кишечной микрофлоры [20, 21].
- S.thermophillus, L. acidophilus, B. longum – приводят к оптимизации слизистого барьера кишечника [21];
- L. rhamnosus LGG., L. Rhamnosus, B. animalis, B. lactis ; L. acidophilus, B. Bifidum – способствуют снижению абдоминальной симптоматики [22];
- B. longum, L. Acidophilus, L. lactis, S. thermophilus, L. plantarum – повышают показатель качества жизни пациентов [23, 24];
- L. Acidophilus, L. lactis, S.thermophillus (Drouault-Holowacz S et al. A double blind randomized controlled trial of a probiotic combination in 100 patients with irritable bowel syndrome. Gastroenterol Clin Biol 2008), B. bifidum [25, 26] – помогают устранить вздутие живота [25].
Результаты систематического обзора (Simrén М. 2014) подтверждают роль синбиотических комплексов, — сочетание мульти штаммовых пробиотиков и пребиотиков в комплексной терапии проявлений СРК (54).
Один из мультиштаммовых пробиотиков является Максилак, в состав которого входят бифидобактерии (Bifidobacteriumlongum, Bifidobacteriumbreve, Bifidobacteriumbifidum) и лактобактерии (Lactobacillusacidophilus, Lactobacillusrhamnosus, Lactobacilluscasei, Lactobacillusplantarum, Lactobacilluslactis), Streptococcusthermophilus 108 КОЕ, а также пребиотический компонент фруктоолигосахарид. Инновационная капсула DRcaps™, в свою очередь, нейтрализует негативное воздействие кислого содержимого желудка, солей желчных кислот и пищеварительных ферментов.
Ведущую роль в структуре абдоминального болевого синдрома наиболее часто играет спастическая висцеральная боль, в основе которой лежит непроизвольное сокращение гладких мышц кишечника, не сопровождающееся их немедленным расслаблением. Селективные миотропные спазмолитики имеют возрастные ограничения у детей. По клинической эффективности тримебутин сопоставим с такими спазмолитиками, как пинаверия бромид и мебеверин в терапии боли в животе при СРК у взрослых [27].
Механизм действия тримебутина заключается в стимуляции периферических опиоидных (энкефалиновых) рецепторов (μ-, k-, δ-) на протяжении всего ЖКТ. Связывание с k-рецепторами приводит к снижению мышечной активности, а связывание с μ- и δ-рецепторами вызывает ее стимуляцию. При этом препарат не оказывает влияние на другие рецепторы. Тримебутин оказывает прямое действие на гладкомышечные клетки через рецепторы миоцитов и ганглиев энтеральной нервной системы, имитируя действие энкефалинов [28]. На российском фармацевтическом рынке присутствует дженерик препарата тримебутина: Необутин® (выпускается в таблетированной форме в дозировках 100 и 200 мг), который разрешен детям с 3-х лет. Препарат оказывает нормализирующее влияние на моторную функцию желудочно-кишечного тракта: в зависимости от исходного состояния ЖКТ он оказывает стимулирующее или расслабляющее воздействие на ЖКТ. Кроме того, тримебутин оказывая влияние на Na+ и Ca2+-каналов, обеспечивает анестезирующее действие и прямой спазмолитический эффект, таким образом опосредованно нормализует моторику ЖКТ и висцеральную гиперчувствительность.
Проведена сравнительная оценка эффективности терапии препаратами, координирующими моторику кишечника (тримебутин) как монотерапии, так и в комбинации с пробиотиками у детей в возрасте 5-17 лет с симптомами СРК. В первой группе (n=15) проводилась терапия тримебутином в возрастной дозировке курсом 1 месяц, во второй группе (n=15) проводилась комбинированная терапия тримебутин + пробиотики. Авторы определяли уровень фекального кальпротектина (белка, отражающего выраженность воспалительного процесса), как показателя воспаления в кишечнике. Уровень кальпротектина у пациентов с СРК был исходно повышен у 27,3% детей, средний уровень показателя превышал нормальные показатели в 2 раза.
Полученные результаты показали высокую эффективность тримебутина (у 82% детей) при монотерапии, и наилучший результат (до 98%) при комбинации тримебутина с пробиотиком. В группе плацебо купирование абдоминальной боли наблюдалось у 22 % детей. Нормализация стула у 99% детей второй группы и 15% группы плацебо [29].
В другом исследовании оценивали распространенность СРК у детей и эффективность тримебутина в коррекции клинической симптоматики. Были включены 345 детей и подростков от 4-18 лет. Распространенность СРК в соответствии с критериями Рима III у детей и подростков составила 22,6%, причем преобладающим подтипом был СРК с запором. 78 детей и подростков с нормальными лабораторными показателями и установленным диагнозом СРК были рандомизированы на две группы: 39 пациентов получали тримебутин 300 мг в сутки три недели, 39 пациентов не получали медикаментозного лечения. Клиническое улучшение наблюдалось у 94,9% пациентов, принимавших тримебутин против 20,5% в группе, не применявшей медикаментозное лечение (P
Таким образом, применение синбиотических комплексов, содержащих мультиштаммовый состав пробиотических штаммов лакто- и бифидобактерий, оказывающих позитивное влияние на качественный и количественный состав микрофлоры ЖКТ, и тримебутина малеата, способного оказывать прямое нормализующее действие на моторную функцию желудочно-кишечного тракта, имеет основание для включения в комплексную терапию синдрома раздраженного кишечника у детей.
Узнать больше
Список литературы
- Van Tilburg MAL, Walker L, Palsson O, et al. Prevalence of child/adolescent functional gastrointestinal disorders in a national U.S. community sample. Gastroenterology 2014;144(Suppl 1):S143–S144.
- Dhroove G, Chogle A, Saps M. A million-dollar work-up for abdominal pain: is it worth it? J Pediatr Gastroenterol Nutr 2010;51:579–583.
- Faure C, Giguere L. Functional gastrointestinal disorders and visceral hypersensitivity in children and adolescents suffering from Crohn’s disease. Inflamm Bowel Dis 2008;14:1569–1574.
- Drossman D. A., Hasler W. L. Rome IV — Functional GI disorders: disorders of Gut- Brain interaction // Gastroenterology. 2016. Vol. 150 (6). P.1262–1279.
- Jeffrey S. Hyams, Carlo Di Lorenzo, Miguel Saps, Robert J. Shulman, Annamaria Staiano, Miranda van Tilburg. Childhood Functional Gastrointestinal Disorders: Child/ Adolescent // Gastroenterology 2016;150:1456–1468.
- Henderson P, Casey A, Lawrence SJ, et al. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease. Am J Gastroenterol 2012;107:941–949.
- Rajindrajith S, Devanarayana NM. Subtypes and symptomatology of irritable bowel syndrome in children and adolescents: a school-based survey using Rome III criteria. J Neurogastroenterol Motil 2012;18:298–304.
- Iovino P, Tremolaterra F, Boccia G, et al. Irritable bowel syndrome in childhood: visceral hypersensitivity and psychosocial aspects. Neurogastroenterol Motil 2009;21. 940-e74.
- Waters AM, Schilpzand E, Bell C, et al. Functional gastrointestinal symptoms in children with anxiety disorders. J Abnorm Child Psychol 2013;41:151–163.
- Bonilla S, Saps M. Early life events predispose the onset of childhood functional gastrointestinal disorders. Rev Gastroenterol Mex 2013;78:82–91.
- Захарова И.Н., Бережная И.В., Холодова И.Н., Зайденварг Г.Е. Боли в животе у ребенка: тактика педиатра. Учебное пособие для врачей. – М.: ФГБОУ ДПО РМАНПО. –2020. – 128 с.
- Saps M, Pensabene L, Turco R, et al. Rotavirus gastroenteritis: precursor of functional gastrointestinal disorders? J Pediatr Gastroenterol Nutr 2009;49:580–583.
- S. Futagami 1, T Itoh, C Sakamoto. Systematic review with meta‐analysis: post‐infectious functional dyspepsia// Aliment Pharmacol Ther . 2015 Jan;41(2):177-88. doi: 10.1111/apt.13006.
- Blitz J, Riddle MS and Porter CK (2018) The Risk of Chronic Gastrointestinal Disorders Follow in Acute Infection with Intestinal Parasites. Front. Microbiol. 9:17. doi: 10.3389/fmicb.2018.00017.
- Rajilic-Stojanovic M, Biagi E, Heilig HG, et al. Global and deep molecular analysis of microbiota signatures in fecal samples from patients with irritable bowel syndrome. Gastroenterology 2011;141:1792–1801.
- Hamer HM. Review article: the role of butyrate on colonic function. Aliment Pharmacol Ther. 2008;27:104-19.
- Vahoutvin SA, Troost FJ, Kilkens TO. The effects of butyrate enemas on visceral perception in healthy volunteers. Neurogastroenterol Motil. 2009;21(9):952-76.
- S. Guglielmetti, D. Mora, M. Gschwender & K. Popp. Randomised clinical trial: Bifidobacterium bifidum MIMBb75 significantly alleviates irritable bowel syndrome and improves quality of life –– a double-blind, placebo-controlled study. Aliment Pharmacol Ther 2011.
- Alexander C. Ford, MBChB, MD et al. Efficacy of Prebiotics, Probiotics, and Synbiotics in Irritable Bowel Syndrome and Chronic Idiopathic Constipation: Systematic Review and Meta-analysis. Am J Gastroenterol 2014; 109:1547–1561; doi: 10.1038/ajg.2014.202.
- Michael J Fox et al. Can probiotic yogurt prevent diarrhoea in children on antibiotics? A doubleblind, randomised, placebo-controlled study. BMJ Open 2015.
- Ki Cha B et al. The effect of a multispecies probiotic mixture on the symptoms and fecal microbiota in diarrhea-dominant irritable bowel syndrome: a randomized, double-blind, placebo-controlled trial. J Clin Gastroenterol 2012; 46.
- Williams EA, Stimpson J, et al. Clinical trial: a multistrain probiotic preparation significantly reduces symptoms of irritable bowel syndrome in a double-blind placebo controlled study. Aliment Pharmacol Ther 2009.
- Drouault-Holowacz S et al. A double blind randomized controlled trial of a probiotic combination in 100 patients with irritable bowel syndrome. Gastroenterol Clin Biol 2008);
- Simrén M, Ohman L, Olsson J, Svensson U, Ohlson K, Posserud I, Strid H. Clinical trial: the effects of a fermented milk containing three probiotic bacteria in patients with irritable bowel syndrome — a randomized, double-blind, controlled study. Aliment Pharmacol, Ther 2010.
- А Randomized Clinical Trial of Synbiotics in Irritable Bowel Syndrome: Dose-Dependent Effects on Gastrointestinal Symptoms and Fatigue Sang-Hoon Lee, Doo-Yeoun Cho at al, The Korean Academy of Family Medicine. Received: May 16, 2022,
- L. plantarum (Ducrotté P, Sawant P, Jayanthi V. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome. World J Gastroenterol 2012; 18.
- Rahman M. Z., Ahmed D. S., Mahmuduzzaman M. et al. Comparative efficacy and safety of trimebutine versus mebeverine in the treatment of irritable bowel syndrome // Mymensingh Med J. 2014; 23 (1): 105–113.
- Трухан Д. И., Багишева Н. В., Голошубина В. В., Гришечкина И. А. Тримебутин в лечении гастроинтестинальных функциональных расстройств // Международный журнал прикладных и фундаментальных исследований. 2016; 11 (6): 1072–1076.
- Типикина М.Ю., Корниенко Е.А.. Патогенетически обоснованная стратегия терапии синдрома раздраженного кишечника у детей. Вопросы детской диетологии. 2014; 12(1): 22-27.
- Gülcan S Karabulut. The Incidence of Irritable Bowel Syndrome in Children Using the Rome III Criteria and the Effect of Trimebutine Treatment. J Neurogastroenterol Motil. 2013;19(1): 90-3. doi: 10.5056.
Газета «Новости медицины и фармации» Гастроэнтерология (294) 2009 (тематический номер)
В клинической практике врача-гастроэнтеролога часто встречаются нарушения функции кишечника функционального характера. Функциональные расстройства кишечника (ФРК) включают группу гетерогенных клинических состояний, которые проявляются симптомами со стороны среднего и нижнего отделов желудочно-кишечного тракта и не сопровождаются какими-либо структурными, системными либо метаболическими изменениями. Несмотря на отсутствие органической основы, функциональные заболевания снижают качество жизни пациентов и наносят большой экономический ущерб обществу как по прямым показателям затрат на медицинское обслуживание и лечение, так и по непрямым показателям, включающим компенсацию временной нетрудоспособности [3, 4]. У большинства практических врачей диагностика функциональных расстройств кишечника вызывает озабоченность из-за новой терминологии, недостаточно четкого понимания их сущности [7]. В 2006 году экспертами Международной группы по изучению функциональных заболеваний органов пищеварения рассмотрены и уточнены определение, классификация, критерии диагностики и рекомендации по лечению функциональных расстройств кишечника, что нашло отражение в материалах III Римского консенсуса [1, 4]. В классификацию функциональной патологии желудочно-кишечного тракта (ЖКТ) включены следующие рубрики кишечных расстройств:
Функциональные кишечные расстройства (III Римский консенсус)
С1. Синдром раздраженного кишечника. С2. Функциональное вздутие живота. С3. Функциональный запор. С4. Функциональная диарея. С5. Неспецифическое функциональное расстройство кишечника.
В МКБ-10 функциональные заболевания кишечника соответствует шифрам К58–59.
Рубрики функциональных кишечных расстройств (МКБ-10):
К58. Синдром раздраженного кишечника. К58.0. Синдром раздраженного кишечника с диареей. К58.9. Синдром раздраженного кишечника без диареи. К59. Другие функциональные кишечные нарушения. К59.0. Запор. К59.1. Функциональная диарея. К59.2. Неврогенная возбудимость кишечника, не классифицированная в других рубриках.
Ведущая роль в диагностике функциональных заболеваний кишечника отводится анализу клинических проявлений. Весьма сложным аспектом диагностики в клинической практике представляется разграничение сходных по симптоматике функциональных состояний: функциональной диареи и синдрома раздраженного кишечника (СРК) с диареей, функционального запора и СРК с запором, неспецифического функционального расстройства кишечника с неспецифическим СРК. В материалах III Римского консенсуса представлены критерии диагностики, позволяющие отграничить эти клинические состояния. Знание характерных симптомов и критериев диагностики каждого из функциональных расстройств необходимо для установления его вида, проведения дифференциального диагноза, обоснования программы лечения больных. Диагностика функциональных заболеваний осуществляется при отсутствии структурной патологии, которая также может обусловливать имеющиеся у пациента симптомы, поэтому важное место в верификации диагноза имеет проведение лабораторных исследований, эндоскопического и рентгенологического исследований кишечника, позволяющих исключить органическую причину изменений [1, 2, 4, 7].
Наиболее распространенным среди функциональных заболеваний желудочно-кишечного тракта является СРК. В странах Западной Европы СРК выявляется у 10–20 % населения [4, 6]. Показатели распространенности СРК в Украине, вероятнее всего, близки к таковым в странах Европы. СРК встречается преимущественно в молодом возрасте, причем чаще у женщин. Среди клинических подтипов СРК чаще других встречается смешанный СРК [6]. Эпидемиологические данные о распространенности функционального запора вариабельны, что связано с различными представлениями врачей и пациентов о функциональном запоре. В целом запором страдает почти 27 % взрослого населения, на долю функционального запора приходится предположительно около 3 %. Так же затруднительно охарактеризовать распространенность функционального вздутия живота и функциональной диареи. Известно, что около 2 % визитов к врачу общей практики вызвано диареей, в том числе СРК с диареей и функциональной диареей [4, 6].
Синдром раздраженного кишечника
занимает ключевое место среди функциональных заболеваний кишечника и всего желудочно-кишечного тракта. Под СРК понимают функциональное расстройство, при котором наблюдаются боль и неприятные ощущения в животе, особенностью которых является взаимосвязь с изменением частоты и характера стула или другими признаками нарушения опорожнения кишечника. Большинство пациентов с СРК отмечают уменьшение болевых ощущений и дискомфорта после дефекации.
В III Римском консенсусе по данным факторного анализа выделены группы клинических симптомов, которые послужили основой формирования четырех клинических подгрупп СРК. В клинической практике наиболее приемлемо для применения классифицировать подгруппы СРК на основе формы стула. Консистенцию стула оценивают по Бристольской шкале классификации кала (табл. 1).
Разделение СРК по преобладающей форме стула
1. СРК с преобладанием запора — твердый или комковатый стул ≥ 25 % и жидкий или водянистый стул < 25 % дефекаций. 2. СРК с преобладанием диареи — жидкий или водянистый стул ≥ 25 % и твердый или комковатый стул < 25 % дефекаций. 3. Смешанный СРК — твердый или комковатый стул ≥ 25 % и жидкий или водянистый стул ≥ 25 % дефекаций. 4. Неспецифический СРК — нарушения стула, не соответствующие критериям 1–3.
Классификацию можно применять при условии, что пациент не принимает антидиарейных или слабительных средств.
Известно, что СРК является многофакторным расстройством, основой которого является нарушение взаимодействия в системе «мозг — кишечник — мозг». К нарушению данного взаимодействия могут привести стрессы, изменение способа жизни и питания, кишечные инфекции. Больные СРК имеют определенный тип личности, склонны к астено-невротическим состояниям, депрессиям, фобиям. Данные расстройства, в свою очередь, приводят к нарушениям регуляции на межнейронном уровне в стенке толстой кишки, дискоординации моторики, повышению висцеральной чувствительности рецепторов кишечника к нейромедиаторам, снижению порога болевой чувствительности.
Функциональный запор
— это функциональное заболевание кишечника неизвестной этиологии, которое проявляется персистирующей затрудненной, нечастой дефекацией или ощущением неполного опорожнения кишечника. В основе функционального запора лежат нарушения кишечного транзита, акта дефекации либо их сочетание.
Функциональная диарея
— это хронический или рецидивирующий синдром, характеризующийся неоформленным или жидким стулом без боли и неприятных ощущений в животе. Чаще функциональная диарея является клиническим вариантом СРК, но если остальные диагностические критерии отсутствуют, то хроническая функциональная диарея рассматривается как самостоятельное заболевание. Этиология и патогенез функциональной диареи до конца не изучены, но установлено, что у таких пациентов отмечается усиление пропульсивной моторики кишечника, которое приводит к уменьшению времени транзита кишечного содержимого. Дополнительную роль могут играть и расстройства всасывания короткоцепочечных жирных кислот в результате быстрого транзита содержимого по тонкой кишке с последующим нарушением абсорбции воды и электролитов в толстой кишке.
Функциональное вздутие живота
, согласно III Римским критериям, — это рецидивирующее чувство распирания в животе, которое может не сопровождаться видимым увеличением живота и не сочетается с другими фукциональными расстройствами желудочно-кишечного тракта. Рецидивирующее чувство распирания в животе или видимое вздутие живота наблюдается не менее 3 дней в месяц на протяжении последних 3 месяцев с появлением симптомов 6 месяцев назад.
Соответствие критериям для всех ФРК должно соблюдаться в течение не менее последних 3 месяцев с началом проявлений не менее 6 месяцев перед диагностикой.
Как следует из табл. 2, для всех клинических подгрупп СРК свойственно наличие болевых ощущений в животе либо дискомфорта, который не описывается как боль, в то время как для других ФРК данные симптомы не характерны. Болевой синдром характеризуется многообразием проявлений: от диффузных тупых болей до острых, спазматических; от постоянных до пароксизмов болей в животе. Длительность болевых эпизодов — от нескольких минут до нескольких часов. Помимо основных диагностических критериев, у больного СРК могут наблюдаться головная боль, боль в спине, учащение мочеиспускания, дизурия, никтурия, дисменорея. Почти у 40–70 % больных с СРК выявляются изменения психической сферы в виде тревожных и депрессивных расстройств. В III Римском консенсусе подчеркивается, что при обследовании пациента, предъявляющего жалобы, характерные для функционального расстройства желудочного тракта, характер общения с пациентом должен во всем, даже в сборе анамнеза, включать психотерапевтический компонент.
Рекомендации III Римского консенсуса по установлению контакта с больным:
1. Собирайте анамнез внимательно, обстоятельно, глубоко, интересуясь пациентом. 2. Проводите обследование тщательно, учитывайте его стоимость и эффективность. 3. Установите, насколько больной знаком с природой своего заболевания и что считает причиной заболевания. 4. Проведите исчерпывающее объяснение природы расстройств пациента так, чтобы он мог их воспринять. 5. Определите, какое улучшение ожидает пациент получить в результате лечения, и объясните его возможности. 6. Если возможно, оцените связь факторов стресса с симптомами. 7. Установите твердые ограничения в отношении приема наркотических обезболивающих лекарств. 8. Вовлекайте больного в процесс лечения, предложив некоторые методы лечения для рассмотрения. 9. Давайте рекомендации, согласованные с интересами больного. Например, «антидепрессанты могут быть использованы для лечения депрессии, но в малых дозах эти лекарства могут применяться и для уменьшения боли». 10. Устанавливайте прочную длительную связь с семейным (участковым) врачом.
В процессе диагностики ФРК следует проанализировать клиническую картину и убедиться, что жалобы пациента, скорее всего, связаны с нарушением функции кишечника. Необходимо исключить симптомы тревоги (необъяснимое снижение массы тела, повторяющаяся рвота, прогрессирующая дисфагия, кровотечения из ЖКТ). К сожалению, появление симптомов тревоги обычно свидетельствует о далеко зашедшем процессе.
Для всех функциональных расстройств кишечника свойственно длительное течение. Поэтому установить диагноз любого из ФРК возможно лишь при условии появления клинических симптомов не менее 6 месяцев назад. Если за этот период не выявлено иной причины нарушения функции кишечника, то это позволяет врачу предположить его функциональный характер.
Объем лабораторных и инструментальных исследований зависит от возраста пациента, тяжести и длительности симптоматики, тревожных симптомов и семейного анамнеза болезней органов пищеварения. Эндоскопическое исследование кишечника, радиологические исследования назначаются при необходимости исключить воспаление, опухоль и меланоз толстой кишки, связанный с длительным приемом слабительных препаратов. В особенности это относится к пациентам старше 50 лет с коротким анамнезом заболевания.
В зависимости от эпидемиологической обстановки целесообразно исследование кала на яйца глистов, цисты лямблий.
В ряде случаев необходимо определение антител к глиадину для исключения целиакии.
Таким образом, предлагаемые III Римским консенсусом диагностические рекомендации открывают перспективы для более точного разграничения функциональных расстройств кишечника, установления клинической подгруппы СРК. Более точное определение патофизиологических вариантов СРК предполагает разработку новых лекарственных препаратов. Вероятно, именно в этом состоит основное позитивное значение III Римского консенсуса. Знание критериев диагностики нередко позволяет установить диагноз функционального расстройства и избежать лишних диагностических процедур. Вместе с тем следует помнить о необходимости проведения дополнительных диагностических мероприятий при изменении клинической симптоматики, для исключения воспалительных и опухолевых заболеваний.
Функциональные нарушения верхних отделов пищеварительного тракта у детей
Особенностью функциональных нарушений желудочно-кишечного тракта (ЖКТ) является отсутствие явного морфологического субстрата патологического процесса. Согласно широко распространенному определению функциональных нарушений по D. A. Drossman (1994) и близкой к нему формулировке, представленной в «Римских критериях II», международном консенсусе по функциональным заболеваниям органов пищеварения (1999 г.), к ним относится «разнообразная комбинация гастроинтестинальных симптомов без структурных или биохимических нарушений» [1, 2]. При этом изменения, лежащие в основе функциональных нарушений, происходят вне пораженного органа и связаны с регуляцией (нервной или гуморальной) нарушенной функции. Такое объяснение представляется наиболее приемлемым как с теоретических, так и с практических позиций.
Жалобы, связанные с нарушением моторики ЖКТ, могут быть обусловлены изменениями на уровне пораженного органа («органическая» патология), могут быть нарушением регуляции этих органов со стороны нервной системы, но также могут быть сгенерированы независимо от состояния органа, в связи с особенностью психоэмоциональной организации пациента. При этом возникает возможность генерации симптома нижележащим органом без участия вышележащего или генерации нисходящего стимула на сегментарном уровне в ответ на патологический восходящий импульс, например при гиперреактивности рецепторов. Любой симптом (жалоба) становится таковым из разрозненной нервной импульсации только на уровне психической деятельности, и если истинная соматическая жалоба определяется поражением того или иного внутреннего органа, а различные отделы нервной системы выполняют функции связующего звена и первичной обработки данных, передавая последние на уровень психики или в обратном направлении, то генератором соматоподобных жалоб может стать сама нервная система и ее высшие отделы. При этом психический уровень является абсолютно самодостаточным, и здесь могут «зарождаться» жалобы, не имеющие своего «прообраза» на соматическом уровне, но не отличимые от истинных соматических симптомов. Дифференцирование первичного уровня симптома (жалобы) имеет принципиальное значение для правильной постановки диагноза и выбора оптимального плана лечения [3].
Несмотря на то, что «Римские критерии II» указывают на стабильный и благоприятный характер течения функциональных нарушений, практика показывает, что возможна их эволюция в органическую патологию. Например, заболевания, сопровождающиеся гастроэзофагеальным рефлюксом (ГЭР), могут эволюционировать в гастроэзофагеальную рефлюксную болезнь (ГЭРБ), функциональная диспепсия — в гастрит, а синдром раздраженного кишечника — в колит. Таким образом, отношение к функциональным заболеваниям должно быть достаточно серьезным, а меры лечения — адекватными.
Последняя классификация функциональных нарушений органов пищеварения у детей в нашей стране была принята в 2004 г. на XI Конгрессе детских гастроэнтерологов России (Москва) в рамках «Рабочего протокола диагностики и лечения функциональных нарушений органов пищеварения у детей». Основой для данного документа послужила классификация, предложенная педиатрической группой экспертов, работавших в рамках проекта «Римские критерии II». Согласно этой классификации функциональные нарушения с преимущественным вовлечением верхних отделов пищеварительного тракта вошли в две категории: функциональные расстройства, проявляющиеся рвотой, к которым относятся регургитация, руминация, циклическая (функциональная) рвота и аэрофагия, и функциональные расстройства, проявляющиеся абдоминальной болью (функциональная диспепсия).
Диагноз функциональных заболеваний ставится на основании клинических данных (в том числе тщательно собранного анамнеза) и результатов дополнительного лабораторного и инструментального обследования. Основная сложность диагностики функциональных нарушений заключается в необходимости исключить всю возможную органическую патологию. Лишь после этого можно с уверенностью говорить о функциональном характере заболевания.
Симптоматика при функциональных нарушениях многообразна, но жалобы должны иметь место на протяжении длительного периода времени (согласно «Римским критериям II», 12 последних месяцев и более (необязательно непрерывно!).
Говоря о клинических и лабораторных симптомах, следует отметить так называемые «симптомы тревоги», при наличии которых развитие функциональных нарушений представляется маловероятным и требуется серьезное обследование для выявления их причины. К «симптомам тревоги» относятся: лихорадка, немотивированное похудание, дисфагия, рвота кровью, кровь в кале, анемия, лейкоцитоз, увеличение СОЭ. Так как функциональные нарушения практически всегда связаны с теми или иными нарушениями со стороны нервной системы, в комплекс обследования всегда следует включать консультации невропатолога, психолога, психоневролога.
Исходя из представлений о патогенезе функциональных нарушений, основными направлениями их лечения следует считать:
- устранение причины, которая привела к их развитию, коррекцию психоневрологического статуса, ликвидацию провоцирующих факторов, терапию сопутствующих заболеваний, усугубляющих течение функциональных нарушений;
- коррекцию нарушенной моторики органов пищеварения;
- коррекцию изменений, вызванных нарушением моторики.
В основе функциональных нарушений, проявляющихся срыгиваниями и рвотой, лежат ГЭР, ретроградное перемещение, затекание или заброс желудочного и/или кишечного содержимого в пищевод. ГЭР в ряде классификаций, в том числе и МКБ-10 (XI, К21) нередко рассматривается как самостоятельная нозологическая единица, хотя, по существу, ГЭР является нормальным физиологическим процессом, наблюдающимся и у здоровых лиц, а патологический ГЭР представляет собой патогенетический механизм, лежащий в основе ряда заболеваний. Кроме того, патологический ГЭР может быть связан не только с нарушением регуляторных механизмов, т. е. выступать в качестве чисто функционального феномена. В ряде случаев он также развивается на фоне органических процессов, например аномалий пищевода, желудка, двенадцатиперстной кишки. В этом случае ГЭР рассматривается как проявление указанных заболеваний или их осложнение.
Для диагностики ГЭР наиболее информативна суточная внутрижелудочная рН-метрия, которая позволяет определить общее число эпизодов рефлюкса в течение суток, а также их продолжительность. В норме рН в пищеводе составляет 5,5–7,0, а достоверным критерием ГЭР считается снижение рН ниже 4. Критерием патологического ГЭР является частота эпизодов рефлюкса более 50 в сутки и суммарная продолжительность рефлюксов в течение суток, превышающая 4,5% от всего периода наблюдения.
В основе любого ГЭР лежит снижение тонуса нижнего пищеводного сфинктера (или невозможность его смыкания при ряде органических заболеваний) и повышение внутрижелудочного давления. Снижение рН желудочного содержимого играет вспомогательную роль и имеет большее значение для повреждения слизистой оболочки пищевода. Развитие воспалительного процесса в пищеводе (рефлюкс-эзофагит) или возникновение связанных с функциональным ГЭР внепищеводных патологических процессов (поражение дыхательных путей, полости рта и зубов в результате высокого заброса желудочного содержимого, а также патологических рефлексов — в результате раздражения слизистой оболочки пищевода) знаменует формирование ГЭРБ и переход от функциональной патологии к органической. Дальнейшая эволюция ГЭР через ГЭРБ может включать метаплазию слизистой оболочки пищевода на фоне длительного персистирующего воспаления с формированием пищевода Барретта, в свою очередь чреватого развитием рака пищевода. Представленная гипотетическая цепочка событий полностью отвергает отношение к функциональным заболеваниям как к транзиторным и не имеющим серьезных последствий состояниям.
Одним из наиболее частых заболеваний рассматриваемой группы является регургитация (срыгивание) (МКБ-10, XVIII, R11) — обратный заброс пищевого химуса вскоре после проглатывания съеденной пищи. У детей первых месяцев жизни регургитация может расцениваться как физиологическое состояние, если имеет редкий, необильный характер и возникает не позже, чем через час после кормления. Наоборот, в этом возрасте она считается патологической, если наблюдается более двух раз в сутки, возникает через час и позднее после еды и носит обильный характер. К развитию срыгиваний у детей первых месяцев жизни предрасполагают особенности строения верхних отделов пищеварительного тракта и незрелость нейрогуморальной регуляции сфинктерного аппарата и моторики ЖКТ. Часто срыгивания обусловлены неадекватным вскармливанием (аэрофагия, перекорм, нарушение режима вскармливания, неадекватный подбор смесей и др.), а также перинатальным поражением центральной нервной системы.
К регургитации в ряде случаев приводит наличие пилороспазма (МКБ-10, XVIII, R19) — затрудненное опорожнение желудка вследствие спазма мускулатуры привратника. С первых дней жизни при пилороспазме отмечаются срыгивания, по мере нарастания объема питания появляется рвота, «отсроченная», створоженным кислым содержимым без примеси желчи, не превышающая объем съеденной пищи. Ребенок, несмотря на рвоту, прибавляет в весе, хотя и недостаточно, при несвоевременно начатом лечении может развиться гипотрофия. Рентгенологически патология не определяется, хотя при осмотре через 2 ч может отмечаться задержка эвакуации контрастной массы. При эндоскопическом обследовании обнаруживается сомкнутый в виде щели привратник, через который всегда можно пройти эндоскопом, что исключает органические причины пилородуоденальной непроходимости.
Руминация (МКБ-10, XVIII, R19) представляет собой повторяющиеся периодически приступы сокращения мышц брюшного пресса, диафрагмы и языка, приводящие к забросу желудочного содержимого в ротовую полость, где оно вновь пережевывается и проглатывается. Характерно начало в возрасте 3–8 мес и отсутствие эффекта от изменения характера питания, вскармливания через соску или гастростому. Признаки дискомфорта отсутствуют. Может служить симптомом депривации или признаком тяжелого органического поражения центральной нервной системы.
Циклическая (функциональная) рвота (МКБ-10, XVIII, R11) — остро возникающие приступы тошноты и рвоты продолжительностью от нескольких часов до нескольких дней, перемежающиеся с бессимптомными периодами, длительность которых составляет несколько недель или месяцев. Может наблюдаться хроническое течение, причем симптомы отмечаются в течение не менее 3 мес (или с перерывами суммарно 3 мес в течение года). Встречается в основном у детей старше 3 лет и требует тщательного неврологического обследования.
Аэрофагия — заглатывание воздуха, приводящее к повторной отрыжке и метеоризму, наблюдающееся на протяжении 12 мес и более (необязательно непрерывно) на протяжении последнего года. Умеренная аэрофагия нередко отмечается у детей первых месяцев жизни в связи с незрелостью нервной регуляции процесса глотания. В большей степени аэрофагия выражена у недоношенных и детей, незрелых к моменту рождения. Аэрофагию провоцируют разговоры во время еды, привычка торопиться при приеме пищи, употребление жевательной резинки, а также газированных напитков. Упорная аэрофагия у детей старше 1 года жизни требует исключения неврологической патологии [4].
Лечение перечисленных заболеваний проводится в соответствии с общими принципами терапии функциональных нарушений и предусматривает прежде всего устранение первопричины, что нередко требует привлечения невропатолога, психолога или психоневролога.
Коррекция нарушенной моторики при ГЭР включает режимные, диетологические и медикаментозные воздействия.
Больным с ГЭР рекомендуется спать с поднятым не менее чем на 15 см головным концом кровати, избегать ношения тесной одежды и тугих поясов, физических упражнений, связанных с перенапряжением мышц брюшного пресса, глубоких наклонов, длительного пребывания в согнутом положении, поднятия тяжестей весом более 8–10 кг.
Также следует ограничить или снизить содержание животных жиров, повысить содержание белка в рационе, избегать употребления раздражающих продуктов, газированных напитков, уменьшить разовый объем приема пищи (можно увеличить частоту). Кроме того, не следует есть перед сном. Больным с ожирением рекомендуется снизить вес.
У детей первых месяцев жизни, находящихся на искусственном вскармливании, следует применять специальные антирефлюксные смеси, особенностью которых является изменение соотношения казеина и сывороточных белков в сторону казеина, а также включение в их состав загустителей (чаще всего камеди из плодов рожкового дерева, Е410).
По возможности следует избегать приема препаратов, снижающих тонус нижнего пищеводного сфинктера, в том числе седативных, снотворных, транквилизаторов, теофиллина, холинолитиков, b-адреномиметиков. Необходимо также отказаться от курения.
Медикаментозная терапия включает применение прокинетиков (домперидон), а также антисекреторных препаратов, повышающих рН рефлюксата и в определенной степени тонус нижнего пищеводного сфинктера (блокаторы Н2-гистаминовых рецепторов и блокаторы протонного насоса).
Действие домперидона (мотониум, мотилиум), так же как и метоклопрамида (церукал), связано с антагонизмом к дофаминовым рецепторам ЖКТ и, как следствие, с усилением холинергической стимуляции, приводящей к повышению тонуса сфинктеров и ускорению моторики. В отличие от домперидона метоклопрамид хорошо проникает через гематоэнцефалический барьер и способен вызывать серьезные побочные эффекты (экстрапирамидные расстройства, чувство сонливости, усталости, беспокойство, а также галакторею, связанную с повышением в крови уровня пролактина), что заставляет избегать его применения в педиатрической практике. Домперидон назначается в дозе 2,5 мг на 10 кг массы тела 3 раза в день в течение 1–2 мес. Побочные эффекты (головная боль, общая утомляемость) встречаются редко (0,5–1,8% больных).
Применение мотониума у детей с ГЭР функционального происхождения уменьшает, согласно данным внутрипищеводной рН-метрии, частоту эпизодов рефлюкса на 68%. Клиническое улучшение (уменьшение выраженности изжоги) при этом наблюдается не менее чем у 70% детей, хотя успех лечения во многом зависит от характера патологического процесса.
Применение антисекреторных препаратов показано лишь при тяжелых формах ГЭР, не поддающихся устранению другими путями, у детей старшего возраста и у взрослых пациентов. Эффективность препаратов этой группы при ГЭР связана в первую очередь со снижением желудочной секреции, повышением рН желудочного содержимого, забрасываемого в пищевод, и уменьшением раздражающего действия рефлюксата на слизистую оболочку пищевода.
В настоящее время существуют два подхода к выбору терапевтической тактики при ГЭР. В первом случае (так называемая «step-up» терапия) лечение начинают с организации режима и питания пациента, а при отсутствии эффекта назначают прокинетики и далее антисекреторные препараты. Если врач пользуется альтернативной («step-down») схемой лечения, терапия начинается с полного комплекса средств, который в дальнейшем на фоне улучшения показателей сокращается.
Содержание термина «диспепсия» в последние десятилетия претерпело значительную эволюцию. Традиционно под диспепсией в отечественной медицине подразумевали алиментарную диспепсию, что наиболее точно соответствует переводу данного термина («нарушение переваривания») и под которым понимается несоответствие возможностей пищеварительных ферментов объему и/или составу принимаемой пищи. Термин «алиментарная диспепсия» наиболее часто использовался в педиатрической практике применительно к детям первого года жизни, однако он подходит для описания состояния пациентов любого возраста.
В конце XX в. в отечественной литературе появилось новое, пришедшее из западных публикаций определение диспепсии.
Синдром диспепсии, в соответствии с определением Комитета по функциональным заболеваниям Всемирного конгресса гастроэнтерологов (1991 г.), представляет собой комплекс расстройств, включающих боль или дискомфорт в эпигастрии, чувство переполнения в подложечной области после еды, раннее насыщение, тошноту, рвоту, отрыжку, изжогу. В дальнейшем, в 1999 г. диспепсию с изжогой отнесли к гастроэзофагеальной рефлюксной болезни, а боли или дискомфорт в животе, сочетающиеся с нарушениями дефекации, — к синдрому раздраженного кишечника.
Термин «синдром диспепсии» используют на начальных этапах обследования или в случаях, если невозможно проведение углубленного диагностического процесса. При дальнейшем обследовании диагноз может быть расшифрован как органическая диспепсия, т. е. поставлен диагноз гастрита, язвенной болезни и т. д., или как диспепсия функциональная, относящаяся к функциональным нарушениям. По существу, в настоящее время под функциональной диспепсией понимают те случаи диспепсии, когда при тщательном гастроэнтерологическом обследовании ее причину установить не удается. В основе функциональной диспепсии лежат двигательные расстройства желудка и двенадцатиперстной кишки, возникающие в результате нарушения нервной и/или гуморальной регуляции, в том числе обусловленные висцеральной гиперчувствительностью.
Функциональная диспепсия (МКБ-10, XI, К30) — симптомокомплекс, выделяемый у детей старше 1 года и включающий в себя боли, дискомфорт или чувство переполнения в подложечной области (необязательно связанные с приемом пищи или физическими упражнениями), раннее насыщение, вздутие живота, тошноту, срыгивание, непереносимость жирной пищи и другие симптомы, наблюдающиеся не менее 12 нед в течение последних 12 мес, если при этом в процессе обследования не удается выявить какое-либо органическое заболевание. Важно также отсутствие связи симптомов с дефекацией или изменением частоты и характера стула.
Выделяют следующие варианты функциональной диспепсии: язвенноподобный (локализованные боли в эпигастрии, «голодные» боли, проходящие после приема пищи, антацидов или антисекреторных препаратов), дискинетический (дискомфорт в верхних отделах живота, усиливающийся при приеме пищи) и неспецифический (жалобы трудно отнести к определенному варианту).
Обязательным компонентом терапии функциональной диспепсии является нормализация вегетативного статуса и психоэмоционального состояния, консультация психоневролога, психолога.
Диета при функциональной диспепсии в большой степени определяется индивидуальной переносимостью продуктов. Также исключаются все продукты, способные вызвать боли в эпигастрии, изжогу, отрыжку: жирные блюда, копченые колбасы, крепкие мясные, рыбные и грибные бульоны, щи, борщи, ржаной хлеб, свежая выпечка, блины, газированные напитки, кофе, редис, острые приправы. Больным разрешается употребление белого хлеба, лучше вчерашнего, сухарей из белого хлеба, сухого несдобного печенья, вегетарианских супов и супов на некрепких бульонах, супов-пюре, отварного мяса, паровых котлет, фрикаделек (говядина, курица, кролик, индейка), отварной рыбы, каш (манной, рисовой, гречневой, овсяной) с добавлением молока, макаронных изделий, яиц всмятку, паровых омлетов, молока цельного и сгущенного, творога, кефира, йогуртов, неострого сыра, киселя, желе, компотов из сладких сортов ягод и фруктов, отварных овощей (свеклы, картофеля, кабачков, тыквы, цветной капусты), сырой тертой моркови, сладких груш без кожуры, бананов, печеных яблок. Принимать пищу рекомендуется 4–5 раз в день [4].
Антацидные и антисекреторные препараты показаны при язвенноподобном варианте функциональной диспепсии. Антацидные препараты могут назначаться, если их прием уменьшает выраженность клинических проявлений. Антисекреторные препараты при необходимости назначаются с учетом характера желудочной секреции.
Прокинетики назначаются в первую очередь пациентам с преобладанием таких симптомов, как чувство переполнения, быстрого насыщения после еды, вздутие живота (дискинетический вариант диспепсии). Препаратом выбора при дискинетическом варианте функциональной диспепсии является домперидон, назначаемый в дозе 2,5 мг на 10 кг массы тела 3 раза в день в течение 1–2 мес. Применение отечественного препарата мотониум у детей с функциональной диспепсией уменьшает в большинстве случаев выраженность дискомфорта в эпигастральной области, чувство тяжести и тошноты, а также у большого числа больных уменьшает или устраняет болевую симптоматику.
Спазмолитические препараты назначаются при спастических состояниях: миотропные спазмолитики — мебеверина гидрохлорид (дюспаталин) применяется у детей с 12 лет по 200 мг 2 раза в день за 20 мин до еды; новая форма выпуска 200 мг в микрогранулах, заключенных в капсулу, обеспечивает не только наибольшую эффективность препарата, но также пролонгированность действия во времени и на протяжении всего ЖКТ; папаверин (детям, в зависимости от возраста, по 0,005–0,06 г 2 раза в сутки), дротаверин (но-шпа, спазмол) — детям до 6 лет внутрь по 0,01–0,02 г 1–2 раза в сутки, детям 6–12 лет по 0,02 г 1–2 раза в сутки.
Важное значение имеет учет вегетативного статуса пациента и назначение соответствующих препаратов, в частности холинолитических при ваготонии.
В настоящее время диагностику и лечение при синдроме диспепсии разделяют на два этапа. На первом этапе врач, опираясь на клинические данные (в том числе исключая симптомы «тревоги») и результаты скринингового обследования (общий анализ крови, копрологическое исследование, исследование кала на скрытую кровь, ультрасонография), может с высокой степенью вероятности предположить функциональный характер заболевания и назначить лечение сроком на 2–4 нед. Отсутствие эффекта от проводимой терапии рассматривается как сигнал тревоги и служит показанием к тщательному гастроэнтерологическому обследованию в условиях консультативного центра или специализированного стационара. Такой подход является оправданным не только с медицинской, но и с экономической точки зрения [5].
Комплексное, своевременное и адекватное лечение функциональных нарушений органов пищеварения у детей является важным фактором предупреждения развития у маленьких пациентов более серьезных патологических состояний.
Литература
- Drossman D. A. The Functional Gastrointestinal Disorders. Diagnosis, Pathophysiology, and treatment. A Multinational Consensus. Little, brown and Company. Boston/ New York/ Toronto/ London. 1994; 370.
- Drossman D. A. The Functional Gastrointestinal Disorders and the Rome II process//Gut. 1999; 45; 2: II1-II5.
- Антропов Ю. Ф., Бельмер С. В. Соматизация психических расстройств в детском возрасте. М., 2005.
- Бельмер С. В., Гасилина Т. В., Хавкин А. И., Эйберман А. С. Функциональные нарушения органов пищеварения у детей. М., 2005. 36 с.
- Печкуров Д. В., Щербаков П. Л., Канганова Т. И. Синдром диспепсии у детей: современные подходы к диагностике и лечению: Информационно-методические материалы для педиатров, гастроэнтерологов и семейных врачей. Самара, 2005. 20 с.
С. В. Бельмер, доктор медицинских наук, профессор Т. В. Гасилина, кандидат медицинских наук А. И. Хавкин, доктор медицинских наук, профессор А. П. Пономарева РГМУ, Москва