Под синдромом короткой кишки (СКК) подразумевается нарушение процессов всасывания в кишечнике. Он возникает вследствие ранее проведенного оперативного вмешательства. Проблема короткого кишечника может также иметь врожденный характер. При недостаточном размере кишки возникают трудности с перевариванием пищи, тревожат другие неприятные симптомы. Клиническая картина вызвана острой нехваткой значительной всасывательной поверхности кишки.
Степень распространенности патологии кишки, возникающей на фоне резекции, зависит от критериев синдрома. По статистике, СКК диагностируется достаточно редко – в 1,4 случая на миллион. В основном проявление клинических признаков наблюдается у людей с размером кишки менее 1 м.
Причины синдрома короткой кишки
В редких случаях синдром короткой кишки имеет врожденный характер и диагностируется у детей в раннем возрасте. Зачастую короткий размер кишки, который впоследствии негативно сказывается на самочувствии пациента, связан с массивной резекцией при пороках развития органа пищеварительной системы. Среди других причин патологии кишки:
- некротический энтероколит;
- гастрошизис с заворотом кишок;
- интестинальные атрезии протяжного или множественного типа, характеризующиеся незавершенным формированием части тонкой кишки;
- спаечная непроходимость;
- тромбоз кровеносных сосудов кишки;
- злокачественные или доброкачественные новообразования кишки, удалявшиеся хирургическим путем;
- ранения и механические повреждения кишок.
В зависимости от вида резекции, синдром короткого кишечника может быть различной степени, что влияет на интенсивность и разнообразие клинических симптомов. Наиболее тяжелый случай – полное хирургическое удаление тонкой и толстой кишки. Также возможен вариант, при котором орган удаляется частично, с сохранением илеоцекального клапана, расположенного между тонкой и толстой кишками.
Физиология тонкого кишечника
Внутренний орган представляет собой часть пищеварительной системы, включает три сегмента – двенадцатиперстная, тощая и подвздошная кишки. Основные функции тонкого кишечника:
- всасывание питательных компонентов;
- обеспечение перистальтики;
- образование пищеварительных соков.
В начальные отделы кишки поступают питательные вещества, там поглощаются вода и полезные микроэлементы. Дистальные отделы кишки отвечают за всасывание солей желчных кислот и витамина В12.
Длина тонкой кишки варьируется в зависимости от возраста. Так, у новорожденных она достигает 2,5 м, а у взрослых людей – от 3,5 до 6 м. За счет наличия в кишке множества складок орган имеет большую всасывающую поверхность. Илеоцекальный клапан, расположенный в области соединения толстой и тонкой кишок, служит своеобразным барьером, препятствуя попаданию микроорганизмов из одного органа в другой.
Клиническая картина при синдроме короткой кишки связана именно с дисфункцией тонкого кишечника. Интенсивность симптомов зависит от места повреждения кишки и длины дефекта. При резекции орган не только становится коротким, но и существенно сокращается площадь всасывательной поверхности, что провоцирует ускорение продвижения содержимого и сокращение времени его соприкосновения со слизистой оболочкой кишки. Данные факторы и способствуют проявлению симптоматики синдрома короткого кишечника.
Принципы ведения пациентов с синдромом короткого кишечника
Баранская Е.К., Шульпекова Ю.О.
Синдром короткого кишечника представляет собой комплекс симптомов, который развивается после обширных резекций тонкой кишки. Подобные операции проводятся по поводу болезни Крона, ишемии кишечника, лучевого энтерита, заворота тонкой кишки, десмоидных опухолей, травм и др. Распространенность синдрома короткого кишечника оценивать затруднительно, так как его проявления существенно варьируют по тяжести и не все случаи регистрируются медицинской статистикой. По некоторым оценкам, в европейских странах, распространенность тяжелых форм составляет 1,8-2 на 1 млн населения [5].
Длина тонкой кишки варьирует от 275 до 850 см, у женщин она короче, чем у мужчин. В физиологических условиях у здоровых лиц общая площадь активно функционирующей абсорбционной и секретирующей поверхности слизистой тонкой кишки колоссальна и соизмерима с площадью корта для большого тенниса (500 м2), а площадь слизистой толстой кишки примерно соответствует площади поверхности стола для настольного тенниса (4 м2). Значительное снижение функции кишечника вследствие резекции ведет к развитию специфического синдрома короткой кишки и кишечной недостаточности.
Синдром короткого кишечника в особенности тяжело протекает у пациентов, перенесших резекцию с сохранением менее 2 м тонкой кишки.
Исходя из объема резекции можно выделить три основных типа клинико-анатомических изменений [8,13,16].
- Резекция тонкой кишки при сохранении хотя бы части подвздошной кишки, илеоцекального клапана и толстой кишки. Такие пациенты в меньшей степени подвержены тяжелым расстройствам пищеварения и редко нуждаются в длительном искусственном питании.
- Резекция тонкой кишки с наложением тощекишечно-толстокишечного анастомоза. Больные с тощекишечно-толстокишечным анастомозом первое время после операции чувствуют себя удовлетворительно, хотя отмечаются признаки стеатореи. В последующие месяцы постепенно проявляется трофологическая недостаточность. Однако со временем возможна функциональная адаптация со снижением потребности в пищевых веществах. Употребление объемов пищи, обычных для здоровых людей, сопровождается появлением диареи. При сохранении менее 50 см тонкой кишки может возникнуть необходимость в поддерживающем парентеральном питании.
- Резекция тонкой кишки и колэктомия с наложением тощекишечной стомы (еюностомы). Для этого варианта характерна диарея с развитием дегидратации, электролитных расстройств (гипомагниемия, гипокальциемия, гипонатриемия) и трофологической недостаточности уже в ближайшее время после операции. Диарея нарастает после приема пищи или жидкости. Со временем не отмечается сколько-нибудь значимой физиологической адаптации кишечника. При еюностоме часто необходим постоянный прием изотонических растворов натрия и глюкозы внутрь, прием антидиарейных препаратов, в ряде случаев — парентеральное питание и введение плазмазаменителей.
Понятие кишечной недостаточности. Синдром кишечной недостаточности (КН) подразумевает нарушения переваривания и всасывания, приводящие к необходимости дополнительного назначения специального питания и/или водно-электролитной поддержки [11]. В отсутствие адекватного лечения при КН развиваются трофологическая недостаточность и/или дегидратация. Тяжесть КН наиболее точно позволяют определять малодоступные на практике методы расчета баланса энергии. Исходя из потребностей лечения КН классифицируется как легкая, средней тяжести и тяжелая.
- Легкая: необходимость подбора специальной диеты с повышенным содержанием нутриентов и/или перорального приема глюкозо-солевых растворов.
- Средней тяжести: необходимость назначения специального энтерального питания и перорального приема глюкозо-солевых растворов.
- Тяжелая: необходимость проведения парентерального питания и введения глюкозо-солевых растворов.
Как правило, признаки КН развиваются при длине сохранившегося отрезка тонкой кишки менее 2 м. Резекция с сохранением менее 40-50 см рассматривается как наиболее прогностически неблагоприятная в отношении развития самых тяжелых форм КН.
КН может быть острой и хронической, что определяется причинами ее развития. Острая КН, как правило, служит проявлением инфекционного или лучевого энтерита, кишечного илеуса, кишечных фистул. Хроническая КН развивается вследствие хирургических вмешательств (резекции тонкой кишки с формированием анастомозов и стом), а также наблюдается при болезни Крона с поражением тонкой кишки, лучевом энтерите, грубых нарушений моторики.
Патофизиологические изменения после резекции тонкой кишки
Ускорение пассажа по кишечнику. При резекции подвздошной и толстой кишки вследствие нарушения естественного запирательного механизма существенно нарастает скорость опорожнения желудка и пассажа по тонкой кишке. Это опосредовано низким уровнем продукции YY-пептида и глюкагоноподобного пептида-2, которые в норме секретируются клетками слизистой оболочки подвздошной и толстой кишки и играют важную роль в регуляции аппетита и моторики.
Потеря натрия и воды. В физиологических условиях пассивная секреция в тощей кишке способствует достижению изотонического равновесия между содержимым кишечника и плазмой. Большая часть жидкости должна реабсорбироваться в тощей кишке, поэтому при резекции и наложении еюностомы могут наблюдаться существенные потери воды и электролитов. Если длина тощей кишки проксимальнее стомы составляет менее 1 м, потеря жидкости через стому может превышать выпитое количество. Если же пациент употребляет внутрь гипотонический раствор (с содержанием натрия менее 90 ммоль/л), происходит дополнительная потеря натрия вследствие его диффузии из плазмы в просвет кишечника по градиенту концентрации.
Гиперсекреция желудочного сока. В первые 2 нед. после резекции тонкой кишки отмечается гиперсекреция желудочного сока [20].
Нарушение функции всасывания и магниево-кальциевого обмена. После резекции более 60-100 см терминального участка подвздошной кишки развивается мальабсорбция жиров, витамина В12 и желчных кислот, не компенсируемая нарастанием их синтеза в печени. Неабсорбированные желчные кислоты поступают в толстую кишку, где стимулируют секрецию воды и электролитов. Неабсорбированные жирные кислоты связывают ионы магния. Одновременно вследствие вторичного гиперальдостеронизма возрастает потеря магния с мочой. Гипомагниемия сопровождается снижением активности паратгормона, угнетением выработки D-1,25-диоксихолекальциферола, захвата кальция в почечных канальцах и кишечнике.
Адаптивные процессы после резекции. При синдроме короткой кишки нередко развивается компенсаторная гиперфагия. В кишечнике наблюдается увеличение площади абсорбирующей поверхности — структурная адаптация, — а также замедление транзита — функциональная адаптация.
У пациентов с тощекишечно-толстокишечным анастомозом со временем возможно замедление опорожнения желудка и пассажа по тонкой кишке на фоне повышения активности YY-пептида и глюкагоноподобного пептида — 2 в крови; постепенно возрастает интенсивность всасывания нутриентов, воды, натрия и кальция.
У пациентов с еюностомой не развивается сколько-нибудь значимой адаптации [7].
Клиническая оценка при синдроме короткого кишечника заключается, прежде всего, в характеристике трофологического статуса и водно-электролитного обмена, включающего анализ содержания натрия, магния и кальция.
Трофологическая недостаточность проявляется в снижении массы тела более чем на 10%, показателя индекса массы тела (ИМТ) <18,5 кг/м2, окружности мышц плеча <19 см у женщин и <22 см у мужчин.
При еюностоме крайне важное значение имеет оценка степени гидратации, содержания натрия и магния в крови, контроль массы тела и объема выделений через еюностому. Признаки дегидратации и дефицита натрия — как правило, жажда и артериальная гипотензия, вплоть до развития преренальной анурии. Для выраженного дефицита натрия характерно снижение его концентрации в моче <10 ммоль/л.
Для долговременного прогноза и выбора тактики лечения необходимо уточнить длину сохранившегося участка кишечника от дуодено-еюнальной связки, что возможно во время хирургического вмешательства или при рентгенографии с контрастом.
Общие принципы ведения пациентов. Цель лечения пациентов с синдромом короткой кишки — обеспечить потребности организма в воде, электролитах и питательных веществах, при этом, по возможности, отдавая предпочтение оральному/энтеральному питанию перед парентеральным. Ведение пациентов командой специалистов позволяет предотвратить быстрое развитие дегидратации, снизить риск осложнений, связанных с КН и искусственным питанием (в частности, нарушений функции печени, септических осложнений), и повысить качество жизни пациентов.
При наиболее тяжелых формах (еюностома с отрезком сохранившейся части тощей кишки менее 50 см) жизненно необходимо обеспечить полное парентеральное питание и регидратацию. При относительно длинном сохранившемся отрезке тонкой кишки и сохранении пассажа по толстой кишке (тонко-толстокишечный анастомоз) режим питания и приема жидкости приближается к естественному.
Особенности ведения пациентов с тощекишечно-толстокишечный анастомозом
Особенности питания. В ближайшие 6 мес. после операции, учитывая наклонность к желудочной гиперсекреции, следует назначить антисекреторные средства. При приеме пищи через рот следует учитывать, что 50% энергии и более может не усваиваться из-за нарушений всасывания, поэтому энергетическая ценность пищи должна быть повышена; показано кормление в ночные часы. При недостаточном эффекте следует присоединить парентеральное питание в течение нескольких недель, месяцев [3].
Поступление длинноцепочечных жирных кислот в толстую кишку провоцирует ускорение транзита, снижение всасывания воды и тем самым усугубляет диарею. Жирные кислоты угнетают деятельность бактерий, ферментирующих углеводы, и связывают кальций, цинк и магний. Последнее способствует нарастанию диареи, всасыванию окасалатов и повышению риска уролитиаза. При подборе диеты следует отдавать предпочтение включению триглицеридов со средней и короткой длиной цепи, способных всасываться как в тонкой, так и в толстой кишке, например продуктов на основе кокосового и пальмового масел, питательных смесей «Пептамен», «Клинутрен» [22]. Углеводы в диете таких пациентов должны быть представлены преимущественно полисахаридами (в составе киселей, каш и супов из гречневой, овсяной, перловой, пшенной, кукурузной круп, картофельного пюре, заварного несладкого и нежирного крема). Прием большого количество моно- и олигосахаридов несет риск лактатацидоза в результате гиперпродукции молочной кислоты тонкокишечными лактобациллами и микрофлорой толстой кишки при pH кала выше 6,5 [6].
При сохраненной толстой кишке существенные нарушения водно-электролитного баланса наблюдаются редко. В случае снижения содержания натрия в течение дня рекомендуется принимать внутрь изотонический глюкозо-солевой раствор в количестве, определяемом степенью дегидратации (обычная физиологическая потребность составляет около 30 мл/кг массы).
В большинстве случаев бывает необходимым поддерживающее лечение витамином В12, препаратами селена. У некоторых больных возникает необходимость возмещения дефицита цинка, эссенциальных жирных кислот, жирорастворимых витаминов А, Е, D, К.
Лечение диареи. Диарея при синдроме короткого кишечника носит преимущественно характер осмотической и отчасти гиперсекреторной и гиперкинетической, обусловленной нарушением секреции гастро-интестинальных гормонов. При уменьшении объема потребляемой через рот пищи диарея регрессирует, и в ряде случаев может потребоваться временное парентеральное питание. Принципы медикаментозного лечения диареи сходны с таковыми при еюностомии: назначение лоперамида в дозе 2-8 мг за полчаса до приема пищи, кодеина фосфата в дозе 30-60 мг перед едой. Если резецированы 100 см и более терминальной части подвздошной кишки и в развитие диареи вносит вклад мальабсорбция желчных кислот, целесообразно назначение холестирамина.
У пациентов с тонко-толстокишечным анастомозом зафиксированы эпизоды спутанности сознания, причинами которых могут послужить снижение содержания магния (<0,2 ммоль/л), дефицит тиамина (синдром Вернике — Корсакова, основными проявлениями которого служат грубые нарушения памяти, расстройства координации в сочетании с полинейропатией), лактатацидоз и гипераммониемия вследствие дефицита цитруллина. Лечение заключается в коррекции дефицита магния, назначении тиамина, промежуточного продукта цикла синтеза мочевины — аргинина, антибиотиков широкого спектра; в отдельных случаях показано временное парентеральное питание [21].
Снижение риска желчнокаменной и мочекаменной болезни. Частота образования кальциево-билирубиновых желчных камней после операций на кишечнике достигает 45%. Вероятная причина холелитиаза у этих больных — снижение активности (отсутствие) энтерогепатической циркуляции билирубина и стаз желчи в желчном пузыре и желчевыводящих протоках. Профилактика включает предпочтительно энтеральное питание, введение холецистокинина, назначение урсодеоксихолевой кислоты, подавление избыточного роста кишечных бактерий. Некоторые хирурги при масштабной резекции тонкой кишки предпочитают проводить профилактическую холецистэктомию.
Риск формирования оксалатных мочевых камней и нефрокальциноза после резекции тонкой кишки достигает 25%. Для профилактики уролитиаза следует не допускать развития дегидратации, исключать продукты, богатые оксалатами, обогащать рацион триглицеридами со средней длиной цепи и кальцием (питание по типу диеты № 5).
Особенности ведения пациентов с еюностомой. В отличие от пациентов с тонко-толстокишечным анастомозом, при еюностомии наблюдается выраженная потеря жидкости и электролитов, но отсутствуют проблемы, связанные с выраженной бактериальной ферментацией в толстой кишке.
При ведении пациентов с еюностомой необходимо контролировать объем отделяемого через стому содержимого кишечника за сутки. Большой объем отделяемого может указывать на наличие нераспознанных инфекционных осложнений, частичной/преходящей обструкции кишечника, активного энтерита (например, клостридиального).
Коррекция дефицита воды и электролитов. Потери через стому нарастают после приема жидкости и пищи, причем каждый литр отделяемого содержит ≈100 ммоль натрия. Если длина оставшейся части тощей кишки более 50 см, потеря калия является относительно небольшой ( ≈15 ммоль/л). Снижение калия может наблюдаться вследствие гиперальдостеронизма — вторично по отношению к потере натрия; гипокалиемия может быть также следствием гипомагниемии, ведущей к нарушению работы транспортных систем, контролирующих экскрецию калия [12]. При гипокалиемии возникает риск нарушений сердечного ритма.
Распространенной ошибкой служит рекомендация принимать внутрь большие объемы гипотоничной жидкости для коррекции водно-электролитного обмена; это ведет к повышению объема потерь через стому. Такой же эффект наблюдается при приеме гипертонических растворов глюкозы, напитков с сахарозаменителями, чая, кофе, алкоголя, фруктовых соков.
Для пациентов с еюностомой оптимальным является прием регидратационных изотонических растворов с концентрацией натрия ≈90 ммоль/л (так как концентрация натрия в отделяемом из еюностомы составляет ≈100 ммоль/л). Состав растворов для регидратации в расчете на 1 л простой воды, рекомендованный ВОЗ, включает: натрия хлорида 60 ммоль (3,5 г); натрия бикарбоната (или цитрата) 30 ммоль (2,5 г или 2,9 г, соответственно); глюкозы 110 ммоль (20 г). Альтернативный состав: натрия хлорида 120 ммоль (7 г), глюкозы 44 ммоль (8 г). Примеры готовых растворов для пероральной регидратации, в целом соответствующих составу, рекомендованному ВОЗ — Регидрон, Оралит.
Объем принимаемой внутрь гипотонической жидкости не должен превышать 500 мл/сут. Рекомендуется раздельный прием твердой и жидкой пищи (с интервалом не менее получаса).
При большом объеме отделяемого из еюностомы (более 2 л) целесообразно на 2-3 дня исключить полностью употребление пищи и жидкости внутрь, что обычно ведет к уменьшению объема потерь. Внутривенно вводят изотонический раствор в объеме 2-4 л/сут. Количество суточной мочи должно составлять не менее 800 мл, а концентрация натрия в моче — не менее 20 ммоль/л. Для поддержания нормального уровня калия в крови основное значение имеет коррекции баланса натрия и магния.
При объеме отделяемого 1,5-2 л/сут. рекомендуют пить глюкозо-солевой раствор, а при приеме гипотоничной жидкости — подсаливание пищи (примерно 7 г, ≈2/3 чайной ложки поваренной соли в сутки). При пограничном объеме отделяемого (1-1,5 л/сут.) можно рекомендовать питье обычной жидкости в объеме менее 1 л и подсаливание пищи.
Адекватная регидратация, позволяющая предотвратить развитие вторичного гиперальдостеронизма, — важнейший шаг в профилактике и коррекции гипомагниемии. Соли магния плохо абсорбируются из желудочно-кишечного тракта и могут вызвать усугубление диареи. При назначении внутрь предпочтение отдается оксиду магния в желатиновых капсулах на ночь, когда отмечается наиболее медленный кишечный транзит. Следует избегать избыточного содержание жира в пище. При недостаточной компенсации гипомагниемии добавляют 1-a-гидроксихолекальциферол в постепенно увеличивающейся дозе (0,25-9,0 мкг/сут.). При необходимости назначения магния сульфата парентерально он вводится вместе с раствором хлорида натрия.
Коррекция белково-энергетической недостаточности при еюностоме подразумевает подбор диеты, содержащей жиры в виде триглицеридов, углеводы — в виде полисахаридов, что предотвращает повышение осмолярности пищи. Желательно, чтобы концентрация натрия хлорида в пище составляла 90-120 ммоль/л. Назначение элементарной диеты (содержащей питательные вещества в легко ассимилируемой форме — в виде аминокислот, олигопептидов, глюкозы, микроэлементов, декстринов, витаминов) не имеет преимуществ, наоборот, она способствуют повышению осмолярности пищи и содержит мало натрия.
Лекарственные средства, подавляющие кишечную моторику и секрецию. При недостаточной эффективности перечисленных мер прибегают к лекарственным средствам, снижающим объем отделяемого за счет угнетения моторики и/или секреции.
В программу лечения диареи при синдроме короткого кишечника и кишечных стомах входят агонисты периферических опиоидных рецепторов кишечника (лоперамид, кодеина фосфат, дифеноксилат). Препараты этого класса замедляют пассаж содержимого по кишечнику за счет угнетения пропульсивных и стимуляции сегментарных сокращений. Соответственно, возрастает степень абсорбции воды и электролитов. Агонисты опиоидных рецепторов также непосредственно снижают секрецию воды и электролитов и повышают тонус илеоцекального и анального сфинктеров.
Исследования показали, что лоперамид и кодеина фосфат за счет подавления моторики кишечника снижают объем отделяемого из илеостомы на 20-30% [14].
В одном из исследований прием лоперамида в дозе 4 мг 4 раза/сут. оказался более эффективным, чем кодеина фосфат в дозе 60 мг 4 раза/сут., в уменьшении объема отделяемого через стому и потери натрия. Эффект от совместного назначения лоперамида и кодеина может быть более выраженным.
По мнению британских экспертов, применение лоперамида при синдроме короткого кишечника более предпочтительно, поскольку он не обладает центральным седативным эффектом и, как показали специальные исследования, не вызывает мальабсорбцию жиров [14].
Лоперамид обладает низкой системной абсорбцией при приеме внутрь, не проникает через гемато-энцефалический барьер, поэтому риск центральных побочных эффектов препарата, включая наркотическое действие, минимален.
Как указывается в «Рекомендациях Британского общества гастроэнтерологов» (2006), при синдроме короткой кишки препарат целесообразно принимать за час до еды в дозе 2-8 мг, средняя доза составляет
16 мг/сут. (в 4 приема). Учитывая частое нарушение энтеро-гепатической циркуляции лекарственных препаратов после резекции кишечника, может потребоваться повышение дозы лоперамида до 12-24 мг на однократный прием [14]. Повышение дозы необходимо проводить под наблюдением врача!
Проведен ряд рандомизированных плацебо-контролируемых исследований, убедительно доказывающих эффективность и высокую безопасность лоперамида (Имодиума) в лечении диареи у больных, перенесших операции на кишечнике с наложением различного типа анастомозов и стом [9,10,15,17,18].
Применение комбинации дифеноксилата и атропина ограничено вследствие побочных эффектов, связанных с антихолинергическим действием атропина.
В случаях, если отмечается выделение из еюностомы таблеток или капсул в неизмененном виде, их содержимое следует предварительно смешивать с пищей или водой. У такой категории пациентов идеальным вариантом терапии являются таблетки для рассасывания — уникальная лекарственная форма лоперамида (Имодиум). Они моментально (за 2-3 с!) растворяются на языке и обладают приятным мятным вкусом.
При явлениях гиперсекреции — когда объем отделяемого превышает 2-3 л/сут. — показано назначение антисекреторных средств: Н2-блокаторов, ингибиторов протонной помпы, октреотида, препаратов соматостатина/октреотида пролонгированного действия. При длине тощей кишки менее 50 см омепразол следует назначать внутривенно.
При сохраненной подвздошной кишке хороший эффект в купировании диареи могут оказывать препараты минералокортикоидов (флюдрокортизон, альдостерон) или гидрокортизон.
Альтернативные методы лечения. Накапливаются данные об эффективности применения факторов роста слизистой оболочки и гормонов-регуляторов (в частности, глюкагоноподобного пептида-2) в стимуляции адаптивных процессов после резекции кишечника.
Введение в рацион жирных кислот с короткой цепью стимулирует адаптацию тонкой кишки и значительно увеличивает всасывание аминокислот [2]. Парентеральное назначение глутамина и аргинина, подкожное введение гормона роста также ускоряет процесс адаптации [4,19].
Трансплантация кишечника — хирургический метод лечения, который показан пациентам с тяжелой КН, не поддающейся коррекции с помощью консервативной терапии (в частности, с очень коротким отрезком тощей кишки — менее 50 см, с грубыми нарушениями моторики), а также пациентам с опасными осложнениями парентерального питания (рецидивирующая инфекция, прогрессирующее поражение печени и др.). Трансплантация также показана при необходимости обширной резекции кишечника. В мире проведено более 1200 таких операций. В некоторых случаях требуется пересадка комплекса «печень — тонкая кишка» и даже мультивисцеральная трансплантация (с желудком и поджелудочной железой).
Пересадка кишечника представляет существенные трудности из-за высокой частоты развития септических осложнений и низкой выживаемости пациентов. Осложнения обусловлены временной потерей защитных функций развитой иммунной системы собственной слизистой кишки и наличием нестерильной среды внутри просвета трансплантируемой кишки. Иммуносупрессивная терапия включает схемы на основе такролимуса и антилимфоцитарную индукционную терапию. Сегодня трансплантация кишечника ассоциируется с выживаемостью в течение года 80% больных, в течение 5 лет — 50% пациентов, причем в большинстве случаев без парентерального питания. Качество жизни сравнимо с таковым при неосложненной КН.
Предложены альтернативные хирургические методы, позволяющие замедлить перистальтику, в частности реверсия короткого сегмента тонкой кишки, суть которой заключается в «повороте» участка кишечника, который начинает сокращаться в ретроградном направлении.
Литература 1. Ивашкин В.T., Шептулин А.А., Склянская О.А. Синдром диареи. M., 2002. 164 с. 2. Нечаев В. М., Ивашкин В. Т., Мягкова Л. П. Синдром короткой кишки. https://www.gastrosite.ru/articles. 3. American Gastroenterological Association medical position statement. Short bowel syndrome and intestinal transplantation. Gastroenterology 2003; 124: 1105-10. 4. Bustos D., Pons S., Pernas J.C. et al. Fecal lactate and short bowel syndrome // Dig. Dis. Sci. — 1994. — Vol. 39, N 11. — P. 2315-2319. 5. Cagir B. Short-Bowel Syndrome. // Название сайта: URL: https://emedicine.medscape.com/article/193391-overview (4 апр., 2010). 6. Caldarini M.I., Pons S., D’Agostino D. et al. Abnormal fecal flora in a patient with short bowel syndrome. An in vitro study on effect of pH on D-lactic acid production // Dig. Dis. Sci. — 1996. — Vol. 41, N 8. — P. 1649-1652. 7. Goodlad RA., Nightingale JMD., Playford RJ. Intestinal adaptation. In: Nightingale JMD., eds. Intestinal failure. Greenwich: Greenwich Medical Media Limited, 2001. 8. Gouttebel MC., Saint-Aubert B., Astre C. , et al. Total parenteral nutrition needs in different types of short bowel syndrome. Dig Dis Sci 1986; 31: 718-23/ 9. King R.F.G.J., Hill G.H. Effect of loperomide and codeine phosphate on ileostomy output. // Clinical Research Reviews — 1981, 1 (Suppl.1), 207-213. 10. Levitt MD, Jenner DC, Maher MJ. High dose loperamide suppositories: a novel approach for improving clinical function after restorative proctocolectomy. // Aust N Z J Surg. 1995 Dec;65(12):881-3. 11. Nightingale JMD. Introduction. Definition and classification of intestinal failure. In Nightingale JMD, eds. Intestinal failure. Greenwich: Greenwich Medical Media Limited, 2001. 12. Nightingale JMD., Lennard-Jones JE., Walker ER., et al. Jejunal efflux short bowel syndrome. Lancet 1990; 336: 765-8. 13. Nightingale JMD., Lennard-Jones JE, Gerthner DJ, et al. Colonic preservation reduces the need for parenteral therapy, increases the incidence of renal stones but does not change the high prevalence of gallstones in patients with a short bowel. Gut 1992; 33:1493-7. 14. Nightingale J, Woodward JM; Small Bowel and Nutrition Committee of the British Society of Gastroenterology. Guidelines for management of patients with a short bowel. // Gut. 2006 Aug;55 Suppl 4:iv1-12. 15. Shee C.D., Pounder R.E. Loperamide, diphenoxylate, and codeine phosphate in chronic diarrhea. // Br Med J. 1980 Feb 23;280(6213):524. 16. Simons BE., Jordan GL. Massive bowel resection. Am J Surg 1969; 118: 953-9. 17. Tytgat GN, Huibregtse K. Loperamide and ileostomy output -placebo-controled double-blind crossover study. // Br Med J. 1975 Jun 21;2(5972):667. 18. Tytgat GN, Huibregtse K, Dagevos J, van den Ende A. Effect of loperamide on fecal output and composition in well-established ileostomy and ileorectal anastomosis. // Am J Dig Dis. 1977 Aug;22(8):669-76. 19. Wilmore D.W., Lacey J.M., Soultanakis R.P. et al. Factors predicting a successful outcome after pharmacologic bowel compensation // Ann. Surg. — 1997. — Vol. 226, N 3. — P. 288-292. 20. Windsor CWO., Fejfar J., Woodward DAK. Gastric secretion after massive small bowel resection. Gut 1969; 10: 779-86. 21. Yokoyama K., Ogura Y., Kawabata M., et al. Hyperammonemia in a patient with short bowel syndrome and a chronic renal failure. Nephron 1996; 72: 693-5. 22. Zurier RB., Campbell RG., Hashim SA., et al. Use of medium-chain triglyceride in management of patients with massive resection of the small intestine. N Engl J Med 1966; 274: 490-3.
Симптомы патологического процесса
После резекции кишки человек на протяжении нескольких недель или месяцев может столкнуться со следующими признаками, которые характерны для первой стадии синдрома короткого кишечника:
- частый жидкий стул;
- обезвоживание организма вследствие диареи;
- нарушения метаболизма;
- слабость и частая сонливость;
- уменьшение массы тела;
- психические и неврологические расстройства.
После восстановления вследствие частичной или полной резекции кишки следует период субкомпенсации, для которого характерна нормализация стула, обмена веществ. Продолжительность второго периода синдрома короткой кишки – около года.
После операции и восстановления организм приспосабливается к новой кишке. Длительность данного этапа зависит от состояния пациента с синдромом короткого кишечника, возраста, масштаба хирургического вмешательства и прочих факторов.
Наиболее неблагоприятна последняя стадия синдрома короткой кишки, при которой у пациента наблюдаются изнуряющая диарея (около 15 походов в туалет за сутки), стремительное снижение веса, стойкое нарушение метаболизма, анемия и психические расстройства.
Синдром избыточного бактериального роста
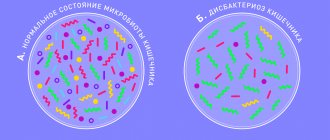
Синдром избыточного бактериального роста (СИБР) – патологическое состояние, которое характеризуется повышением количества бактерий в тонкой кишке с развитием диарейного синдрома и нарушением всасывания некоторых питательных веществ.
Это состояние/заболевание в отечественной литературе нередко называют частным случаем дисбактериоза/дисбиоза кишечника.
Распространенность СИБР
Распространенность данного синдрома в мире остается неизвестной. В литературе чаще всего проводится оценка встречаемости СИБР при различных заболеваниях желудочно-кишечного тракта (ЖКТ) и других органов. В частности, известно, что СИБР отмечается у 38% пациентов с синдромом раздраженного кишечника и у 50-60% больных циррозом печени. Нередко данный патологический синдром выявляется у лиц, страдающих воспалительными заболеваниями кишечника, системными болезнями соединительной ткани (например, склеродермия), эндокринными патологиями (сахарный диабет) и т.д.
Причины и механизмы развития СИБР
В норме различные отделы пищеварительной трубки имеют разный видовой и количественный состав заселяющих их микроорганизмов. Так, например, в желудке и верхних отделах тонкой кишки микробный состав довольно беден, ограничиваясь небольшим (103-104 колониеобразующих единиц (КОЕ) в миллилитре аспирата) количеством бактерий, среди которых преобладают лактобактерии, энтерококки и некоторые другие аэробные бактерии.
В конечных отделах тонкой кишки, прежде всего в терминальном отделе подвздошной кишки, растет число и разнообразие микроорганизмов. В этой переходной зоне между тонкой и толстой кишкой количество микроорганизмов увеличивается до 107-109 КОЕ/мл. Основные бактерии, выявляемые в этом регионе, представлены лакто- и бифидобактериями, стрептококками, бактероидами и т.д.
Наконец, толстая кишка – место «проживания» анаэробных бактерий, которым для жизнедеятельности не требуется кислород (бактероиды, бифидобактерии, энтерококки и клостридии, лактобациллы, кишечные палочки, стрептококки, стафилококки и т.д.). Количество микроорганизмов в этом отделе кишечника максимально и может достигать 1012 КОЕ/мл.
Количественный и качественный микробный состав в разных отделах ЖКТ поддерживается несколькими механизмами. Это и кислая среда желудка, и бактерицидное действие желчи в тонкой кишке, а также сохранная моторика желудка и кишечника. Очень важной является нормальная двигательная и замыкательная функция сфинктеров ЖКТ, таких как пилорический сфинктер (клапан между желудком и 12-перстной кишкой) и илеоцекальный клапан (между подвздошной и толстой кишкой).
Нарушение этой регуляции приводит к тому, что увеличивается количество микроорганизмов в тонкой кишке, и это приводит к различным расстройствам пищеварения. Данное состояние и называется СИБР или синдром избыточного бактериального роста в тонкой кишке.
Основные причины развития СИБР:
- Состояния, приводящие к снижение продукции соляной кислоты в желудке – гипо- и ахлоргидрия на фоне атрофического или аутоиммунного гастритов, вследствие применения препаратов из группы H2-гистаминоблокаторов и ингибиторов протонной помпы;
- Нарушение моторики желудка и/или тонкой кишки – нередко наблюдается при сахарном диабете, циррозе печени, хронической почечной недостаточности, склеродермии, полимиозите, целиакии, болезни Крона и т.д.;
- Анатомические нарушения – последствия оперативных вмешательств (резекция желудка, илеоцекального клапана и др.), дивертикулы тонкой кишки, стриктуры тонкой кишки любого происхождения и т.д.;
- Применение антибиотиков, нестероидных противовоспалительных препаратов, цитостатиков, стероидных гормонов, трициклических антидепрессантов, опиатов и т.д.;
- Иммунные нарушения, включая дефицит секреторного иммуноглобулина А;
- Хронический панкреатит с внешнесекреторной недостаточностью поджелудочной железы;
- Хроническое злоупотребление алкоголем;
- Пожилой и старческий возраст – увеличивают риск возникновения СИБР.
Следствием увеличения количества тонкокишечных микроорганизмов является:
- снижение содержания и активности внутрипросветных и пристеночных ферментов за счет их разрушения бактериями;
- недостаточное расщепление питательных веществ, нарушение их всасывания и увеличение жидкой части кишечного содержимого с развитием диареи;
- преждевременная деконъюгация желчных кислот в начальных отделах тонкой кишки с развитием химического повреждения слизистой тонкой кишки и диареей.
Из-за нарушения всасывания в тонкой кишке развивается дефицит некоторых микро- и макроэлементов, а также витаминов (например, витамина В12).
Симптомы СИБР
- Вздутие живота и/или повышенное газообразование – наиболее частый симптом;
- Послабление стула – от кашицеобразного 1-2 раза в сутки до жидкого несколько раз в день;
- Запоры – встречаются редко, но не исключают диагноза СИБР;
- Слабые боли в животе (часто на фоне повышенного газообразования) – обычно локализуются в околопупочной области;
- Ощущение «переливания» или урчания в животе;
- Снижение массы тела – возможно при выраженном и длительном СИБР;
- Различные жалобы, обусловленные дефицитом микро-, макроэлементов и витаминов.
Диагностика СИБР
Типичная клиническая картина заболевания и анамнез (например, указание на применение антибиотиков) позволяют заподозрить диагноз СИБР. Подтверждением служат результаты дополнительные тесты.
В связи с тем, что СИБР связан с увеличением количества бактерий в тонкой кишке, использование традиционного в нашей стране анализа кала на дисбиоз/дисбактероз для диагностики этого синдрома не имеет ценности. При исследовании бактериального состава кала этим методом оцениваются образцы каловых масс из толстой кишки. Анализ включает в себя определение лишь 20 разновидностей бактерий, тогда как в кишечнике человека их выделено более 1000.
В научных целях и крупных медицинских центрах для диагностики используется жидкое содержимое (аспират) 12-перстной кишки. Этот аспират может быть посеян на специальные среды для выявления аэробных и анаэробных бактерий и определения количества КОЕ. Альтернативой является метод полимеразной цепной реакции (ПЦР), которым также определяется количество (реже качественный состав) тонкокишечных бактерий и других микроорганизмов.
По самым современным рекомендациям при увеличении количества микроорганизмов в аспирате из тонкой кишки более чем 103 КОЕ/мл высока вероятность СИБР. Увы, предложенные методы исследования дорогостоящие и не могут быть использованы с рутинной практике.
Если с количественными характеристиками СИБР все более-менее ясно, то качественные изменения бактериального состава тонкой кишки при этом состоянии остаются малоизученными. Существует лишь небольшое количество работ при некоторых заболеваниях (например, при синдроме раздраженного кишечника), где выявлены определенные изменения соотношений одних групп бактерий к другим. Клиническое значение таких изменений до сих пор неясно.
В настоящее время большинство рекомендаций предлагает использовать для диагностики СИБР водородный дыхательный тест с лактулозой или глюкозой. В норме водород продуцируется только кишечными бактериями при переработке некоторых углеводов. Образовавшийся водород всасывается в кровоток, достигает легких и может быть определен специальным анализатором в выдыхаемом воздухе. В ходе теста оценивается изменение концентрации водорода после употребления внутрь раствора углевода. В качестве тестового субстрата чаще всего используется невсасываемый углевод лактулоза, реже применяется глюкоза.
У части лиц симптомы СИБР могут быть вызваны избыточным ростом метанпродуцирующих микроорганизмов, и в этом случае возможно использование метанового дыхательного теста.
Существуют и другие дыхательные тесты, однако они малодоступны в рутинной практике.
Лечение СИБР
В настоящее время СИБР рассматривается как вторичное состояние, которое возникает как следствие имеющегося «фонового» заболевания или внешнего воздействия (в т.ч. лекарственной терапии). Поэтому во всех рекомендациях по лечению СИБР на первом месте стоит лечение основного заболевания для предотвращения повторного появления жалоб.
Одним из главных методов лечения СИБР – так называемая «санация» кишечника путем назначения антибиотиков. Предпочтение отдается невсасываемым антибиотикам (например, рифаксимину) и другим антибактериальным препаратам, доказавшим свою эффективность.
Диетотерапия с ограничением продуктов, богатых ферментируемыми углеводами (так называемая диета lowFODMAP) может быть эффективна у некоторых пациентов.
Назначение пре- и пробиотиков в качестве дополнительных средств коррекции СИБР может уменьшить часть симптомов – вздутие живота, дискомфорт в животе. Однако эти препараты редко бывают эффективны в качестве единственной терапии.
Также в лечении СИБР нередко используются дополнительные лекарственные средства, такие как полиферментные препараты, регуляторы кишечной моторики, сорбенты и т.д.
Прогноз СИБР
В большинстве случаев СИБР протекает благоприятно. При устранении причинного фактора, вызвавшего СИБР, в случае правильно подобранной терапии происходит полное излечение пациента. Однако при сохранении условий для развития СИБР (хроническое заболевание, перенесенное хирургическое вмешательство и др.) возможны рецидивы симптомов, требующие повторных курсов лечения.
Как проводится диагностика?
При подозрении на синдром короткого кишечника необходимо незамедлительно обратиться к гастроэнтерологу. Специалист опрашивает пациента, уточняя, как давно проводилась резекция кишки, интересуется сложностью течения заболевания и проводит внешний осмотр больного. При синдроме короткого кишечника важна комплексная диагностика, включающая следующие процедуры:
- Забор мочи и крови для общего и биохимического анализа. При патологии кишки в результате обнаруживаются анемия, воспалительные процессы, нехватка витаминов и низкий уровень белка.
- Рентгенография тонкой кишки с применением пассажа бария.
- Выполнение копрограммы с целью выявить частицы пищи и жира, которые не переварились кишкой.
- Исследование кишки посредством ультразвука.
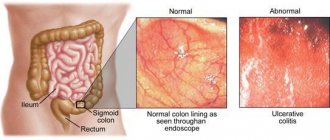
- Гастродуоденоскопия для осмотра слизистой оболочки кишки.
- Измерение уровня pH кишечного секрета, поскольку у пациентов с синдромом увеличивается содержание соляной кислоты в кишке.
- Колоноскопия, позволяющая оценить состояние кишок и заметить патологические процессы или изменения во внутренних органах.
При синдроме короткого кишечника врач обязательно пальпирует живот пациента для обнаружения вздутия и болезненности. Комплексная диагностика дает возможность не только оценить состояние кишки, но и выявить симптомы сопутствующих острых или хронических заболеваний.
Публикации в СМИ
Демпинг-синдром — патологическое состояние, возникающее после резекции желудка (особенно по модификации Билльрот-II), гастрэктомии, ваготомии, пилоропластики вследствие быстрого поступления желудочного содержимого в тонкую кишку.
Статистические данные. Частота после селективной проксимальной ваготомии — у 0,9% оперированных больных; после стволовой ваготомии с пилоропластикой — 10–22% случаев; у женщин после резекции желудка — до 100%.
Классификация • По времени возникновения •• Ранний демпинг-синдром (признаки появляются в течение 30 мин после еды) •• Поздний (гипогликемический) демпинг-синдром (через 2 ч после еды) • По степени тяжести •• Лёгкая степень (демпинг-реакция возникает только после молочных и сладких блюд): незначительная слабость, учащение пульса на 10–15 в минуту; продолжительность приступа — до 30 мин; дефицит массы тела — не более 5 кг; трудоспособность сохранена •• Средняя степень (демпинг-реакция возникает при приёме любой пищи, на высоте реакции больной вынужден ложиться): учащение пульса на 20–30 в минуту; АД с тенденцией к повышению систолического компонента; длительность приступа — до 1 ч; дефицит массы тела — до 10 кг; трудоспособность снижена •• Тяжёлая степень (демпинг-реакция развивается при приёме любой пищи): больные принимают пищу лёжа и находятся в горизонтальном положении до 2–3 ч после еды; учащение пульса более чем на 30 в минуту; АД лабильное, иногда брадикардия, артериальная гипотензия, коллапс; дефицит массы тела — более 10 кг; трудоспособность утрачена.
Факторы риска: дренирующие операции, резекция желудка.
Патогенез • Быстрое поступление в верхний отдел тонкой кишки пищи, имеющей высокую осмолярность, приводит к перемещению в просвет внеклеточной жидкости, растяжению стенки кишки и выделению биологически активных веществ: гистамина, серотонина, брадикинина. В результате: вазодилатация, уменьшение ОЦК, усиление перистальтики кишечника • Другая форма демпинг-синдрома (реактивная гипогликемия) связана с резким увеличением содержания глюкозы после приёма пищи. Быстрое увеличение концентрации глюкозы в крови стимулирует выделение инсулина. Однако к этому времени (примерно через 2 ч после еды) принятая пища уже утилизирована, и запоздалое действие инсулина вызывает клинические признаки гипогликемии. На фоне гипогликемии изменяется содержание электролитов, особенно калия, в сыворотке крови.
Клинические проявления • Приступы слабости во время еды или через 15–20 мин после неё • Сонливость, головокружение, шум в ушах, дрожание конечностей • Чувство дискомфорта в животе, боль • Метеоризм • Тошнота • Диарея • Сердцебиение • Повышенное потоотделение • Снижение массы тела • Преходящая эритема • Спутанное сознание и обморочное состояние • Тяжесть проявлений демпинг-синдрома уменьшается в положении лёжа. Напротив, пища, богатая углеводами, усиливает симптоматику.
Методы исследования • Провокационная проба. Демпинг-синдром может быть спровоцирован приёмом 150 мл 50% р-ра глюкозы или сахара. При этом больной не должен ложиться • Рентгеноскопия желудка: выявляют мгновенное опорожнение желудка от контрастной массы • Анализ крови: послеобеденная гипогликемия, признаки анемии, гипоальбуминемия • Препарат, влияющий на результаты, — инсулин; заболевание, влияющее на результат: СД.
Дифференциальная диагностика • Частичная кишечная непроходимость • Желудочно-ободочный свищ • Хронический энтерит • Спру • Болезнь Крона • Инсулинома • Секреторная недостаточность поджелудочной железы • Нейроэндокринные опухоли (карциноид).
ЛЕЧЕНИЕ
Консервативное лечение • Диета. Назначают диету №1, содержащую 130 г белков, 100 г жиров, 350–400 г углеводов (30 г сахара). Возможно полное исключение сахара с заменой на ксилит или сорбит. Для снижения скорости эвакуации пищи из культи желудка готовят вязкие и желеобразные блюда. Целесообразен раздельный приём плотной и жидкой пищи. Приём пищи — не менее 6 р/день. После еды желательно лежать около 30 мин • Для уменьшения реакции на быстрое поступление пищи в тонкую кишку перед едой назначают прокаин, анестезин, антигистаминные препараты • Октреотид по 200–400 мг/сут п/к в равных дозах каждые 8 ч • Заместительная терапия: желудочный сок, соляная кислота, панзинорм форте, панкреатин, панкреатин+жёлчи компоненты+гемицеллюлаза, витамины • Другие методы •• Антихолинергические средства (например, атропин, платифиллин) обычно малоэффективны •• При нарушениях питания — переливание крови и кровезаменителей •• Психотерапия.
Хирургическое лечение • Показания к операции: демпинг-синдром тяжёлой степени в случае неэффективности лечебного питания и длительного комплексного медикаментозного лечения • Оперативное вмешательство заключается в редуоденизации с гастродуоденопластикой. Тонкокишечный трансплантат замедляет опорожнение культи желудка, включение двенадцатиперстной кишки улучшает пищеварение и у ряда больных может уменьшить интенсивность демпинг-реакции.
Осложнения • Гипогликемия • Нарушения питания • Электролитные нарушения, включая гипокалиемию • Анемия.
Сопутствующая патология • Пептические язвы • Реактивная гипогликемия • Спаечная болезнь брюшины • Хронический панкреатит • Хронический энтерит • Дискинезия желчевыводящих путей.
Профилактика: широкое применение органосохраняющих операций (например, селективной проксимальной ваготомии) при лечении язвенной болезни двенадцатиперстной кишки. В случае необходимости резекции желудка следует стремиться к наложению прямого гастродуоденоанастомоза.
Синонимы • Постгастрорезекционный синдром • Болезнь оперированного желудка • Агастральная астения • Синдром «малого желудка» • Синдром сбрасывания
МКБ-10 • K91.1 Синдромы оперированного желудка